腹腔镜超声联合CT三维重建引导腹腔镜肝切除术
王丹璞,赫 嵘,贾 哲,王米雪,何 楠,张 萌,张 瑶*
(1.首都医科大学附属北京地坛医院普外科,2.超声科,3.放射科,北京 100015)
对于早、中期原发性肝细胞癌(hepatocellular carcinoma, HCC),手术切除是主要治疗手段之一;腹腔镜肝切除术(laparoscopic hepatectomy, LH)的安全性及有效性均已获广泛认可[1-3],但术中无法准确定位肝脏肿瘤和肝内管道,需要详细的术前规划、术中辅助标识和引导。CT三维重建可直观显示肝内血管的走行和肿瘤与血管的空间位置关系,有助于分析门静脉、肝静脉流域,指导制定手术方案[4]。腹腔镜超声(laparoscopic ultrasound, LUS)可弥补腹腔镜手术触觉缺失的不足,准确定位肝脏肿瘤及肝内血管[5]。本研究观察LUS联合CT三维重建引导LH的价值。
1 资料与方法
1.1 研究对象 回顾性分析2016年1月—2021年12月78例于首都医科大学附属北京地坛医院接受LH的HCC患者,男55例、女23例,年龄22~70岁,平均(50.5±9.5)岁;根据术前是否接受CT三维重建及LUS将其分为观察组(n=46)和对照组(n=32):观察组男35例、女11例,年龄29~70岁、平均(51.4±8.9)岁,对照组男20例、女12例,年龄22~66岁、平均(49.4±10.2)岁。纳入标准:①术后病理证实HCC;②肝功能为Child-Pugh分级A或B级;③全程于腹腔镜下进行手术;④中国肝癌分期(China liver cancer staging, CNLC)[6]ⅠA期;⑤资料完整。排除标准:①继发性肝恶性肿瘤;②伴其他恶性肿瘤或既往其他恶性肿瘤史;③严重感染;④凝血功能障碍;⑤严重心、肺、肾或代谢性疾病。本研究获医院伦理委员会批准[京地伦科字【2020】第(016)-02号];检查前患者均签署知情同意书。
1.2 CT三维重建 采用Philips 256排Brilliance螺旋iCT机。嘱患者仰卧,先行肝胆胰平扫,范围自膈顶至肾脏下缘;之后经静脉注入80 ml碘海醇对比剂,分别延迟20~25 s及50~55 s行动脉期及门静脉期扫描;参数:管电压120 kV,管电流250 mAs,0.625×64排探测器,层厚1.0 mm,层间隔1.0 mm,螺距0.984。球管旋转时间0.5 s/rot。将CT图像以DICOM格式导入IPS(Intelligent Precise Service,深圳旭东数字医学影像技术有限公司)系统进行数据分割,以体绘制交互分割算法、区域自生长法和面绘制法行自动化三维重建;基于重建图像评估肿瘤位置、大小及毗邻关系等,并分析门静脉流域,评估拟剩余肝体积。见图1A。
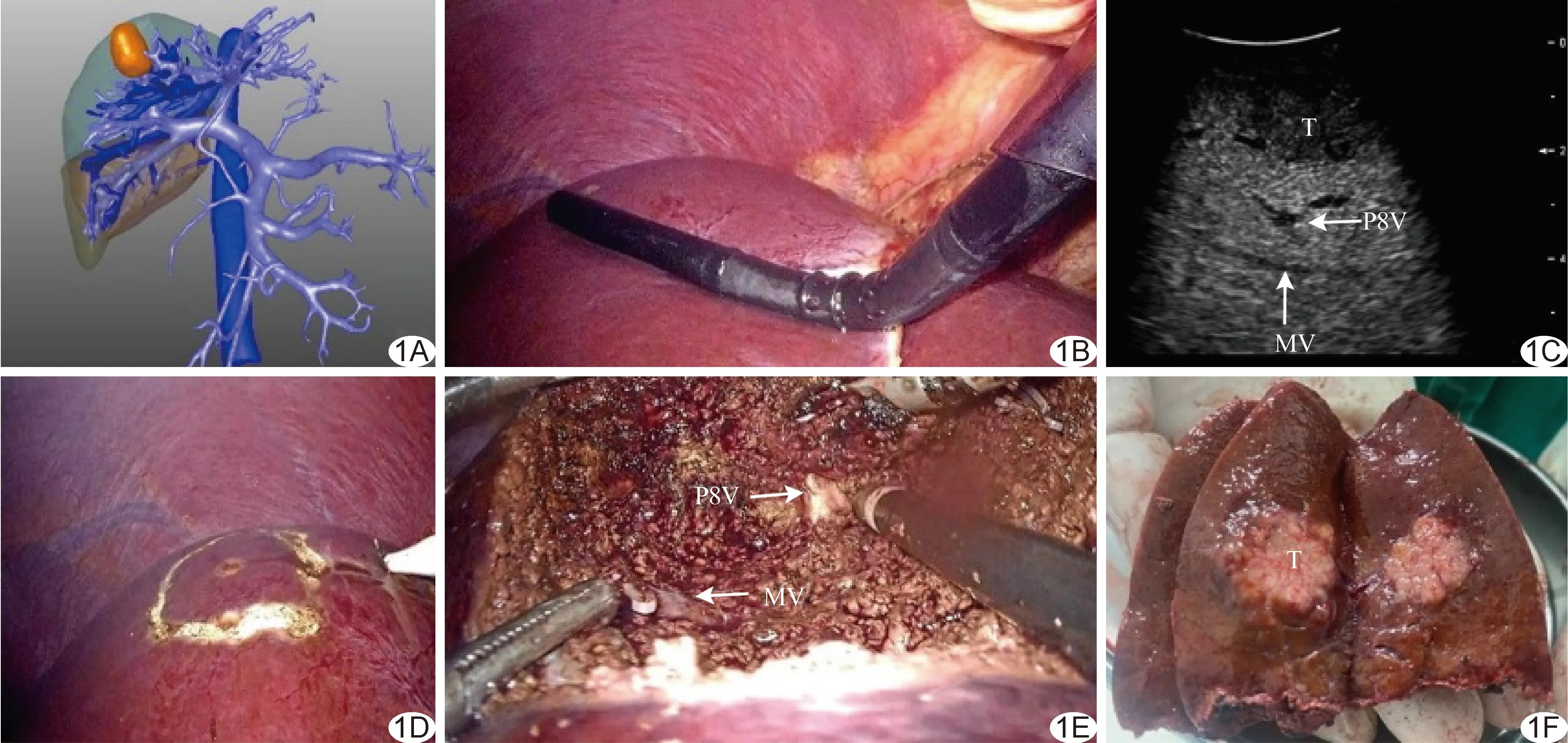
图1 患者男,55岁,HCC A.术前CT三维重建图示肝脏肿瘤主要位于Ⅷ段,显示肝蒂腹侧支及肝中静脉清晰; B.以LUS扫查肝脏; C.LUS清晰显示肝脏肿瘤、肝蒂腹侧支及肝中静脉; D.LUS引导下于肝脏表面标记肿瘤及血管走行; E.术中于断肝平面见肝蒂腹侧支和肝中静脉; F.术后大体标本示肿瘤切除范围与术前规划一致 (T:肿瘤;P8V:肝蒂腹侧支;MV:肝中静脉)
1.3 LH 采用Hitachi Aloka Noblus超声仪、频率7.5 MHz UST-547探头。嘱患者仰卧,常规消毒、铺巾后,经12 mm戳卡将探头探入腹腔,先于肝表面扫查全肝,观察肿瘤大小、位置、数目及毗邻关系等,明确有无术前检查未发现的瘤灶;采用(4±1)孔法,根据拟切除范围适当离断肝周韧带后,以间歇性全肝入肝血流Pringle法或经Laennec入路半肝、肝段阻断法[7]阻断血流。以LUS于肝表面标记肿瘤范围、预离断肝蒂投影及肝静脉走行等,划定切除线,并与术前CT三维重建进行对比;之后以超声刀离断肝实质,分离目标肝蒂并经LUS确认后离断。完成切除后止血、放置引流管,将标本放入标本袋并经戳孔取出。LH过程中随时监测切面及切缘。见图1B~1F。
记录手术时间、术中出血量、肿瘤切缘(以肝切面与肿瘤边缘最短距离≥1 cm为宽切缘,<1 cm为窄切缘)、肝切除方式(解剖性肝切除:按照肝脏Couinaud分段进行手术,根据病情行单肝段切除或多肝段切除;非解剖肝切除:按照完整切除肿瘤原则进行手术)。
1.4 术后随访 术后1个月检测肝功能及血清甲胎蛋白(alpha-fetoprotein, AFP)等,复查腹部增强CT或MRI评估肿瘤有无残留及复发;之后每6个月复查AFP、腹部增强CT或MRI,发现肿瘤复发时,根据情况予以手术切除、射频消融(radiofrequency ablation, RFA)或TACE及靶向治疗等。随访截至2023年7月31日或患者死亡。
记录术后并发症(参考Clavien-Dindo分级)、术后住院时间、术后病理学检查结果、无瘤生存期(手术当天至随访发现肿瘤复发)和总体生存期(手术当天至患者死亡或随访截止日)。
1.5 统计学分析 采用SPSS 26.0统计分析软件。以±s表示正态分布的计量资料,组间行t检验;以中位数(上下四分位数)表示非正态分布者,行Mann-WhitneyU检验。采用χ2检验或Fisher精确概率法比较计数资料。以Kaplan-Meier法和log-rank检验进行生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 组间临床资料差异均无统计学意义(P均>0.05),见表1。
2.2 手术及转归 2组均顺利完成手术,围手术期无死亡病例。组间肿瘤主体所在肝段、切除方式、肿瘤切缘、手术时间、术中出血量、术后住院时间及术后并发症分级差异均有统计学意义(P均<0.05),见表2。观察组术后并发症发生率为17.39%(8/46),包括胸腔积液2例、切口感染2例、腹腔积液2例、腹腔感染2例;对照组并发症包括胸腔积液5例、腹腔积液3例、切口感染2例、肺部感染2例、腹腔感染2例,发生率(14/32,43.75%)明显高于观察组(χ2=6.475,P=0.011),后均经积极处理好转并出院。
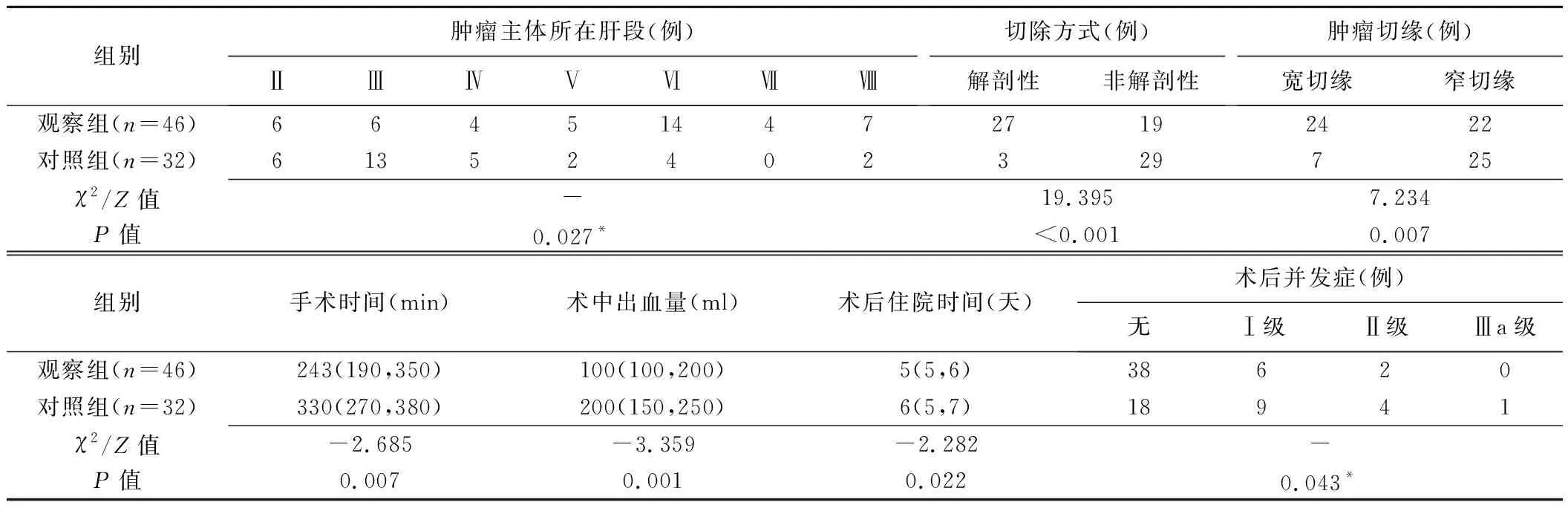
表2 接受与未接受术前CT三维重建及LUS引导下LH的HCC患者手术情况
2.3 生存分析 观察组随访22~91个月,中位随访时间63个月;对照组随访19~91个月,中位随访时间67个月。随访期间观察组死亡15例,死因包括肝衰竭14例、心肌梗死1例;对照组死亡14例,死因包括肝衰竭12例、心脏衰竭1例、肺部感染及呼吸衰竭1例。观察组术后1、3和5年无瘤生存率分别为93.50%、79.60%和68.40%,对照组分别90.20%、58.80%和38.40%,观察组整体无瘤生存率高于对照组(χ2=4.210,P=0.040);观察组术后1、3和5年总体生存率分别为97.80%、93.10%和77.70%,对照组分别为96.80%、86.40%和70.70%,组间总体生存率差异无统计学意义(χ2=1.320,P=0.251)。见图2。
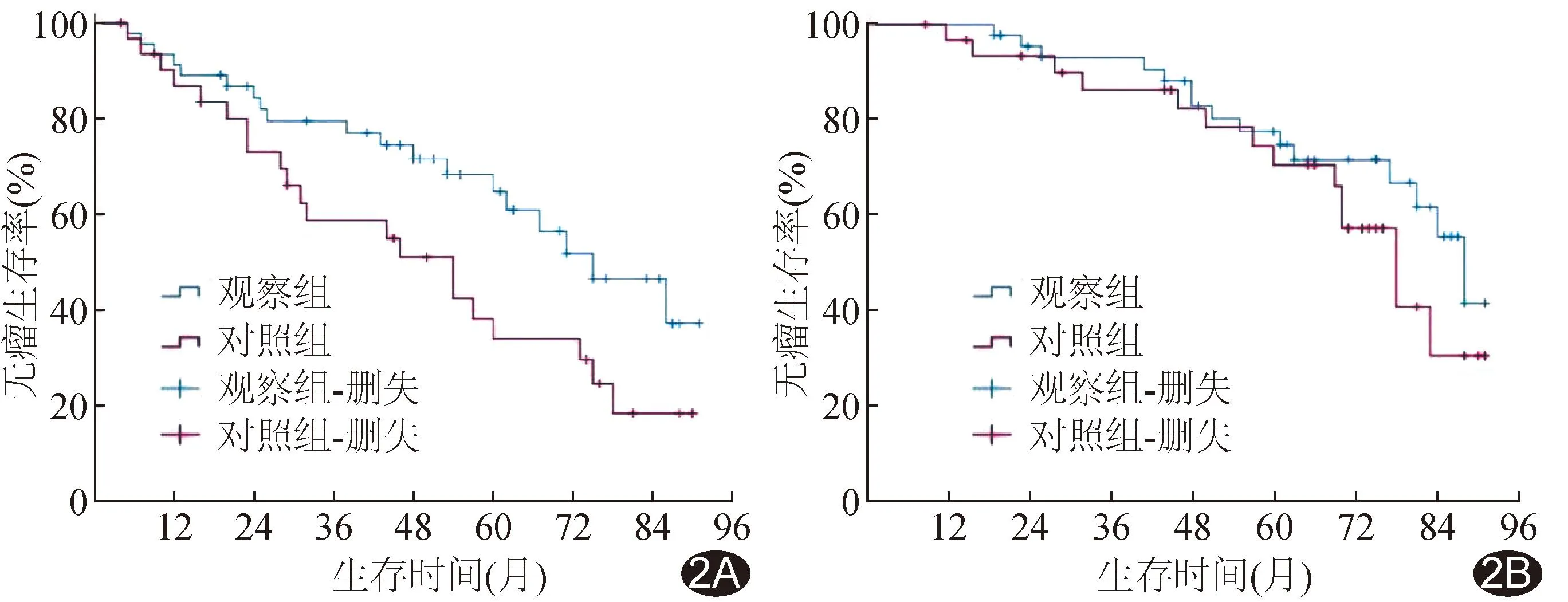
图2 LH后HCC患者生存曲线 A.无瘤生存率; B.总体生存率
3 讨论
LH具有切口小、出血量少、术后恢复快及并发症发生率低等优点,且疗效与开腹肝切除术相当,其治疗HCC的安全性及有效性已得到证实[8-9]。肝脏内部结构缺乏明显解剖标志,且LH存在触觉缺失和视野暴露受限等不足,术中难以保证肝脏切面正确且切缘足够。LUS将超声与腹腔镜技术相结合,可避免腹壁和肠内气体的干扰而为提供清晰的术中图像,能够弥补LH的不足[10-11]。
以往主要基于二维超声、CT和MRI等诊断HCC并指导治疗,无法完全模拟真实三维空间结构,术前规划难以与术中实际准确吻合[12]。三维重建CT图像可清晰显示肝脏三维结构,为术前精准评估病灶、制定手术规划提供充足信息,近年已广泛用于临床[13-14]。
已有研究[15-16]表明三维可视化技术联合LUS可减少LH损伤、缩短术后恢复时间。本研究观察组手术时间、术中出血量、术后住院时间、术后并发症分级及发生率均优于对照组;与上述研究相符。既往研究[17]发现,解剖性肝切除的出血量和损伤率均低于非解剖性肝切除。本研究观察组肿瘤位于肝Ⅶ段和Ⅷ段(即切除困难段)、接受解剖性肝切除患者占比均高于对照组,分析原因,主要在于观察组基于CT三维重建进行术前规划,可直观显示肿瘤位置及肝内血管走行,且利用LUS能更有效地寻找拟离断肝蒂、肝静脉,更好地实施解剖性肝切除,故虽观察组位于切除困难段肿瘤占比高于对照组,所需手术时间、术中出血量及并发生发生率亦低于对照组。
肿瘤微血管侵犯是HCC术后复发和转移的独立危险因素[18];存在微血管侵犯时,肿瘤切缘≥1 cm者术后无瘤生存率高于切缘<1 cm者[3,19-20]。本研究观察组肿瘤宽切缘占比明显高于对照组,且术后1、3及5年无瘤生存率均高于对照组,表明CT三维重建联合LUS有助于实现根治性切除、提高无瘤生存率。
综上所述,LUS联合CT三维重建用于引导LH可降低术中损伤和并发症发生率、提高无瘤生存率。但本研究为单中心小样本回顾性分析,有待后续深入观察。
利益冲突:全体作者声明无利益冲突。
作者贡献:王丹璞查阅文献、研究实施、数据分析、撰写及修改文章;赫嵘图像处理和分析;贾哲、王米雪和张萌数据分析;何楠图像处理;张瑶指导。

