鸡蛋中氟虫腈及其代谢物残留分析方法
郭宏斌,彭侃霖,吴金玲,杨舒娴,林玲,叶剑芝,刘元靖*,王晓芳
(1.中国热带农业科学院农产品加工研究所,农业农村部农产品加工质量安全风险评估实验室(湛江),广东湛江 524001;2.云南农业大学热带作物学院,云南普洱 665000)
氟虫腈及其主要代谢物(氟甲腈、氟虫腈砜与氟虫腈亚砜)属于苯基吡唑类杀虫剂的一种[1-2],具有接触毒性、胃毒性和一定的内吸作用,该类药物具有慢性神经毒性作用[3],其中氟虫腈被定为C 类致癌物质[4-5]。有研究表明,氟虫腈在正常使用条件下,其代谢产物也有毒性,甚至有的远高于母体[6-8]。
生产中,经常使用氟虫腈灭杀蛋鸡养殖过程中的蚜虫和蝇类[9]。鉴于氟虫腈及其代谢物的高风险及其高破坏性,氟虫腈在鸡蛋中的残留也已引起世界各国的重视,各国均制定了严格的限量标准[10-11]。
Li 等[12]采用液相色谱串联质谱法测定食品中的农药残留,分析方法不仅耗时长,对复杂基质鸡蛋提取效率低。美国食品药物管理局(Food and Drug Administration,FDA)[13]在开展鸡蛋样品农残检测中必须通过净化和脱溶剂处理,才能用气相色谱仪分析,以获得较宽的农药检测谱[14-18]。超临界流体抽提(supercritical fluid extraction,SFE)法在鸡蛋检测中可以免去后续的净化过程,具有选择性强的优势[19],但极性范围窄,超临界流体抽提法仅适用于检测鸡蛋食品中游离的胆固醇[20]。
本研究以鸡蛋为研究对象,采用中性氧化铝柱进行净化,其成本显著低于常规的C18 固相萃取柱、弗洛里矽硅土固相萃取柱,样品前处理流程简洁,以期建立一种高效、灵敏、可靠的鸡蛋中氟虫腈及其代谢物残留的分析方法。
1 材料与方法
1.1 材料
1.1.1 试剂
乙酸乙酯、正己烷、氧化铝、丙酮等(均为分析纯):广州化学试剂厂;水为超纯水;正己烷、乙腈、甲酸、甲醇、乙酸铵(均为色谱纯):美国赛默飞世尔科技公司;弗洛里矽硅土固相萃取柱:美国Agilent 有限公司;氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜4 种农药标准溶液:天津环境保护科学研究所,纯度大于98%。
鸡蛋:市售。
1.1.2 仪器设备
UNIVERAL 32R 离心机:日本Hettich 公司;Waters TQS 超高效液相色谱串联质谱仪:美国沃特世公司;R-200 旋转蒸发仪:上海申生;N-EVAP 氮吹仪:美国Organomation 公司;中性氧化铝柱:农业农村部农产品加工质量安全风险评估实验室(湛江)自制。
1.1.3 仪器条件
超高效液相色谱(ultra-high performance liquid chromatography,UPLC)色谱柱:Waters C18 柱(50 mm×2.1 mm×1.7 μm);流动相:流动相A 为乙腈,流动相B 为5 mmol/L 的乙酸铵溶液;流速0.3 mL/min;柱温40 ℃;进样量1 μL。梯度洗脱比例及流速见表1。
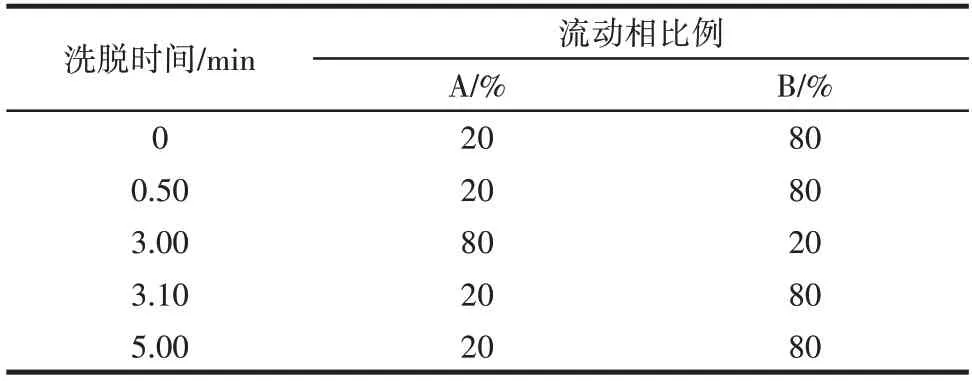
表1 梯度洗脱比例及流速Table 1 Mobile phase gradient and flow rate
质谱条件为电喷雾离子源(electrospray ionization,ESI),负离子模式;离子源温度:110 ℃;毛细管电压:4.0 kV;脱溶剂气温度350 ℃;锥孔反吹气流量50 L/h;脱溶剂气流量:800 L/h;锥孔电压:40 V;扫描方式:多反应监测(multiple reaction monitoring,MRM)。每种农药优化的去簇电压和碰撞能量等质谱参数见表2。
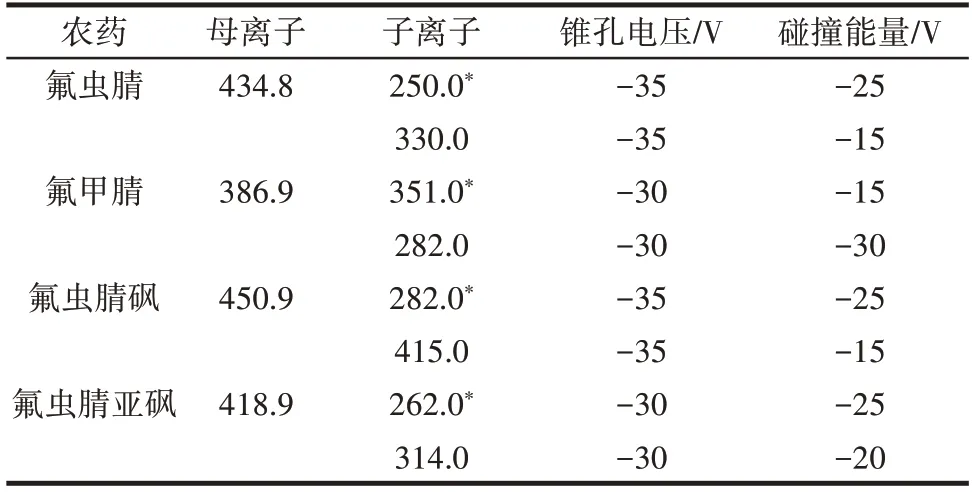
表2 氟虫腈及其代谢物特征离子质谱条件Table 2 UPLC-MS/MS parameters for fipronil and its metabolites
1.2 方法
1.2.1 样品制备
按照NY/T 1897—2010《动物及动物产品兽药残留监控抽样规范》的要求,将采集的鸡蛋样品打碎,使用打蛋器进行充分混合和均匀浆化,混匀后的样品将被存放在聚乙烯瓶中,并在-18 ℃的低温条件下进行冷冻保存。
1.2.2 样品提取
准确称取经步骤1.2.1 匀浆的鸡蛋样品2 g,置于50 mL 聚丙烯离心管中,加入2 g 无水硫酸钠,加入5 mL 乙腈作为粗提取液,均质1 min 后,振荡10 min,在4 ℃,以8 000 r/min 离心,提取上清液于鸡心瓶中,得提取液;沉淀物用5 mL 乙腈重复提取1 次,合并两次提取液,将2mL 异丙醇加入到溶液中,使用旋转蒸发仪在50 ℃下进行浓缩,直至溶液接近干燥,得到浓缩液。接着,加入2.0 mL 的甲醇与二氯甲烷混合溶液(体积比为1∶99),将残渣溶解,并充分混匀。得待净化溶液。
1.2.3 样品净化
将中性氧化铝柱首先使用5 mL 的甲醇进行预淋洗,接着用5 mL 的甲醇与二氯甲烷混合溶液(体积比为1∶99)进行活化。净化后,利用15 mL 刻度离心管收集洗脱液。随后,用5 mL 的甲醇与二氯甲烷混合溶液(体积比为1∶99)冲洗烧杯,并再次洗脱固相萃取柱,此步骤需重复一次。将含有10 mL 洗脱液的刻度离心管放置在氮吹仪上,于50 ℃水浴温度下使用氮气进行吹干处理,再使用乙腈与超纯水的混合溶液(体积比为1∶1)将其定容至1.0 mL。在旋涡混合器上进行充分混合后,通过0.22 μm 有机滤膜进行过滤,最终供超高效液相色谱串联质谱仪进行分析测定。
1.2.4 标准溶液配制
1.2.4.1 氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜4 种混合储备液
分别吸取体积为1.00 mL、浓度为100 μg/mL 氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜标准溶液至容量瓶,用甲醇溶解并定容至10.0 mL。此溶液每毫升相当于含氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜10.00 μg。
1.2.4.2 混合标准工作液
分别准确吸取氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜4 种混合储备液,将其稀释成氟虫腈及其代谢物含量分别为0.001、0.002、0.005、0.010、0.020、0.050 μg/mL的混合标准工作液。
1.3 回收率实验
在筛选出的空白鸡蛋液中,添加相应浓度的氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜4 种混合工作液,进行不同提取溶剂以及不同固相萃取条件下的回收试验。
式中:R为回收率,%;C0为添加待测物的浓度,μg/kg;C1为实际测出待测物浓度,μg/kg;C2为空白基质待测物浓度,μg/kg。
1.4 数据统计
采用SPSS 软件,对提取鸡蛋中氟虫腈及其代谢物的6 个平行样回收率的平均值数据进行方差分析。
2 结果与分析
2.1 预处理方法的优化
2.1.1 样品提取的优化
由于氟虫腈及其代谢物的分子结构中有较多数量的极性原子,为了实现鸡蛋中氟虫腈及其代谢物的有效提取,比较了乙腈、乙酸乙酯、正己烷、甲醇和酸化乙酸乙酯(pH2.5)不同提取溶剂的提取效果,并研究了它们对氟虫腈及其代谢物的净化效果和回收率的影响,结果见表3。
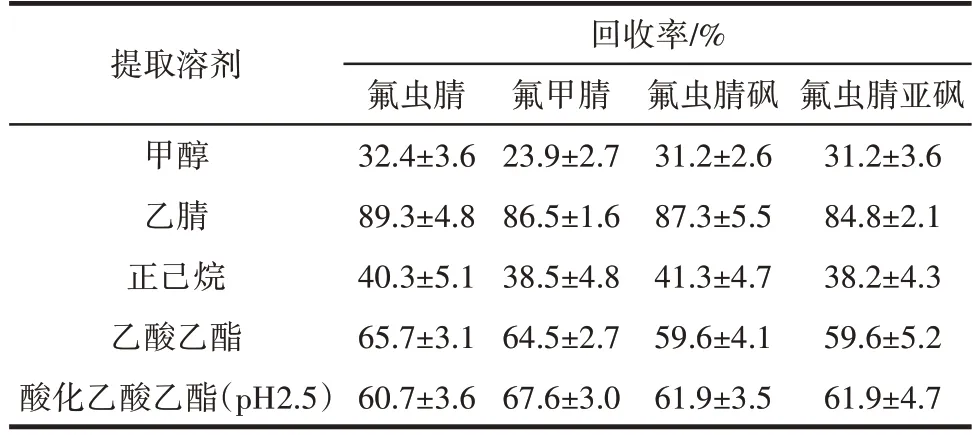
表3 不同溶剂提取鸡蛋样品中的氟虫腈及其代谢物回收率Table 3 Recovery of fipronil and its metabolites from egg samples using various solvents
表3 结果表明,甲醇、乙酸乙酯、正己烷与酸性环境(pH2.5)中的乙酸乙酯作为提取溶剂时,鸡蛋样品中的氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜回收率较低,难以满足残留检测要求;当选用乙腈作为鸡蛋中氟虫腈及其代谢物的提取溶剂时,回收率在84.8%~89.3% 之间;因此,本文选择乙腈作为提取溶剂,能够有效提取鸡蛋中的氟虫腈及其代谢物。
2.1.2 固相萃取柱的选择
为有效减少杂质对农药的干扰,比较了3 种不同类型的固相萃取柱,包括中性氧化铝柱、C18 固相萃取柱与弗洛里矽硅土固相萃取柱。通过氟虫腈及其代谢物标准溶液过柱试验,结果见表4。
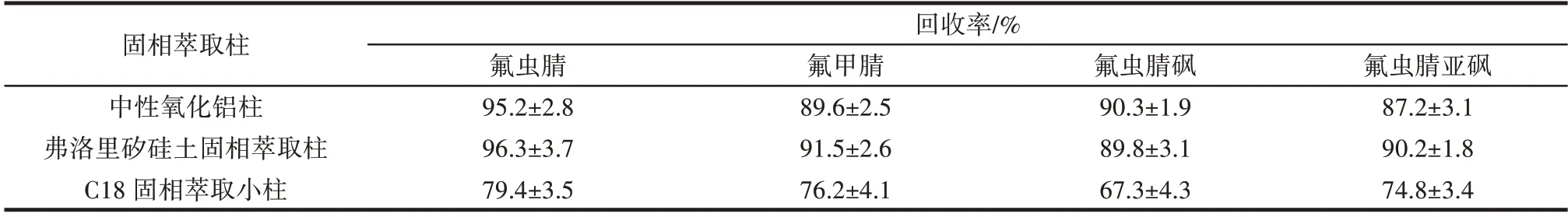
表4 不同固相萃取柱过柱试验提取鸡蛋样品中的氟虫腈及其代谢物回收率Table 4 Recovery of fipronil and its metabolites in egg samples extracted by different solid phase extraction columns
表4 结果表明,中性氧化铝柱与弗洛里矽硅土固相萃取柱的回收率达到87.2%~96.3%,而C18 固相萃取小柱的回收率仅达70%左右。由于自中性氧化铝柱填料为普通的试剂中性氧化铝,价格方面远低于C18 填料与弗洛里矽硅土,成本更有优势,故本方法选择中性氧化铝柱固相萃取小柱作为净化小柱。
样品中添加氟虫腈及其代谢物试验结果也证明,选用中性氧化铝柱后试验的准确度与精密度参数均符合要求,且在氟虫腈组分保留时间周围没有杂质峰的干扰,完全适用于本方法。
2.1.3 色谱条件的优化
分别选择乙腈-5 mmol/L 乙酸铵溶液、乙腈-0.1%甲酸水、甲醇-5 mmol/L 乙酸铵溶液和甲醇-0.1% 甲酸水作为流动相,对样品进行分离试验。
试验表明,当乙腈-5 mmol/L 乙酸铵溶液的比例采用表1 的条件时,氟虫腈及其代谢物的峰形对称、尖锐,且与样品本底分离良好,乙腈-5 mmol/L 乙酸铵溶液分离体系优于其他体系,所以选择乙腈-5 mmol/L 乙酸铵溶液作为分离氟虫腈及其代谢物的流动相。
2.2 空白试验
称取鸡蛋(不添加氟虫腈及其代谢物)10.0 g,按照1.2 所述的方法,对样品进行前处理和净化过柱后,进行定容处理。随后,使用超高效液相色谱串联质谱仪进行检测,所得的检测图谱如图1所示。
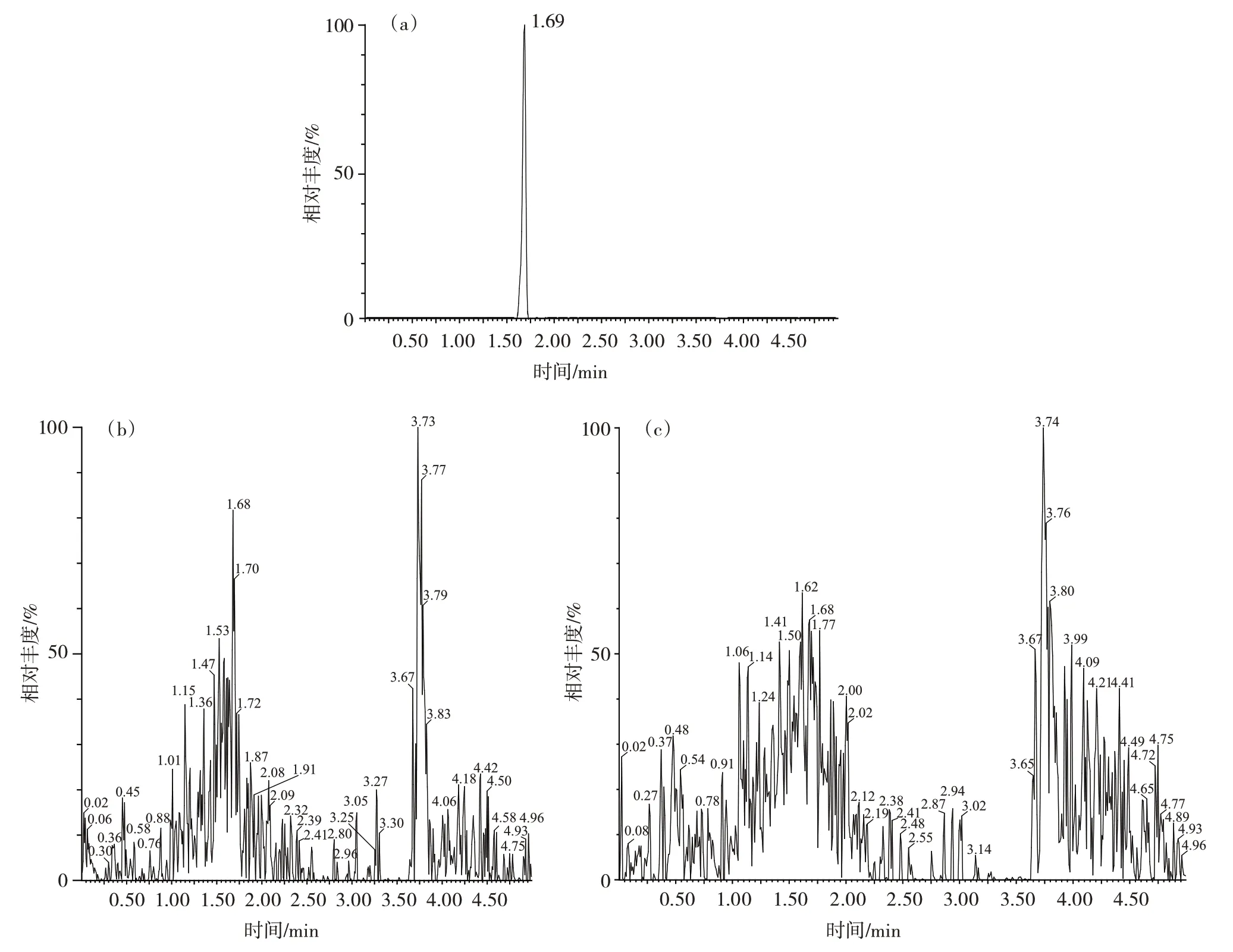
图1 氟虫腈及其代谢物标准品总离子流图Fig.1 Total ion chromatogram of fipronil and its metabolite standards
由图1 可知,在氟虫腈及其代谢物对照品的出峰保留时间范围为1.64~1.70 min 时,未出现任何干扰峰。这一结果表明,鸡蛋样品中并未含有氟虫腈及其代谢物,不影响氟虫腈及其代谢物的检测。
2.3 方法的评价
2.3.1 回收率与精密度
称取2.0 g 的空白鸡蛋样品(精确至0.01 g),添加适量的氟虫腈及其代谢物标准工作液,以实现加标水平分别为0.005、0.010 mg/kg 和0.020 mg/kg。随后对样品按照1.2 方法开展检测,每个添加水平重复5 次,计算鸡蛋样品中4 种氟虫腈及其代谢物的残留量、回收率和相对标准偏差(relative standard deviation,RSD),结果见表5。
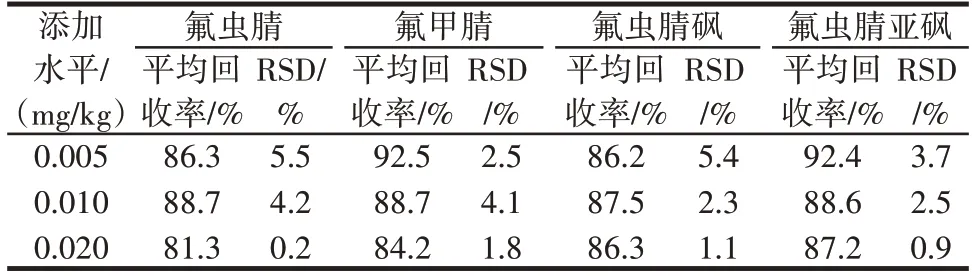
表5 鸡蛋样品中不同添加水平中的氟虫腈及其代谢物回收率Table 5 Recovery of fipronil and its metabolites in egg samples with different additions
由表5 可知,4 种氟虫腈及其代谢物的回收率在81.3%~92.5%之间,相对标准偏差低于5.5%。典型空白鸡蛋样品添加氟虫腈及其代谢物的超高效液相色谱串联质谱图见图2。
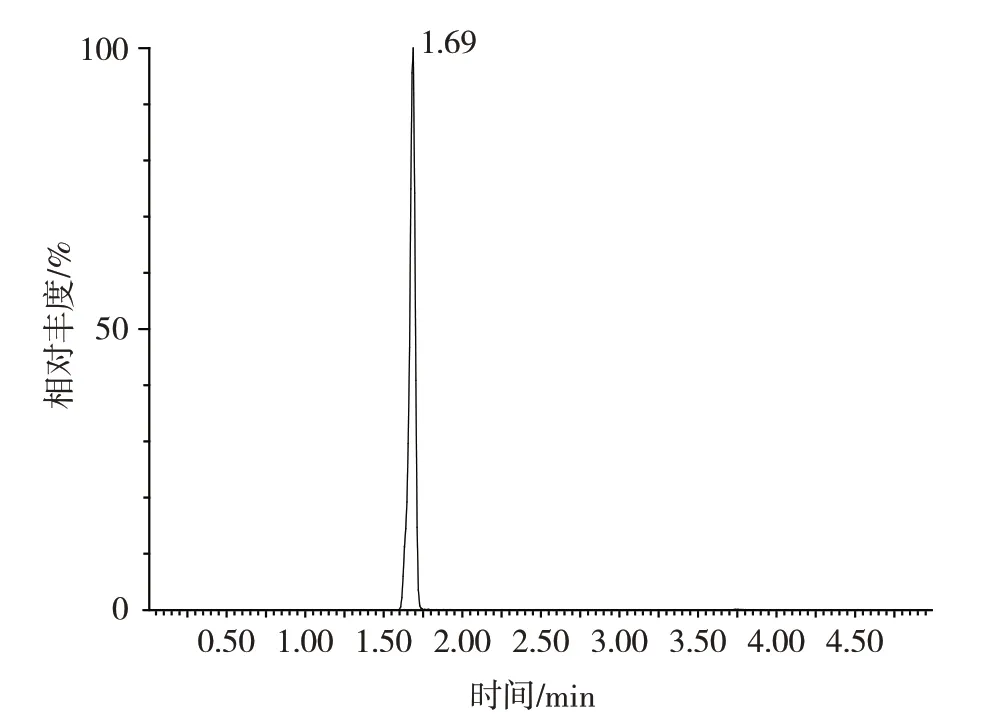
图2 空白鸡蛋加入氟虫腈及其代谢物总离子流图Fig.2 Total ion chromatogram of add fiproni and its metabolites to blank eggs
由2 可知,该色谱峰形分离度好,周边无杂质峰干扰。
2.3.2 方法线性与检出限
针对4 种农药制备不同浓度梯度的基质标准溶液(浓度分别为 0.001、0.002、0.005、0.010、0.020、0.050 μg/mL),并对其进行了进样分析。以溶液的质量浓度为横坐标,相应的峰面积为纵坐标,绘制了标准曲线,得出了4 种农药的回归系数,具体数据见表6。
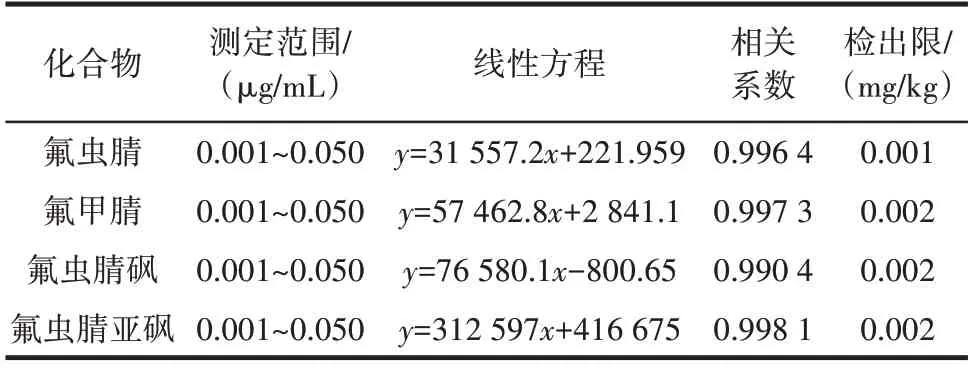
表6 方法的线性范围及标准曲线的回归方程Table 6 Linear range and linear equation of the method
由表6 可知,在浓度范围为0.001~0.050 μg/mL内,这4 种农药的相关系数均大于0.990 4,显示出良好的线性关系。根据3 倍信噪比来计算出方法的检出限,氟虫腈的检出限为0.001 mg/kg,而氟甲腈、氟虫腈砜和氟虫腈亚砜的检出限均为0.002 mg/kg,与GB 2763—2021《食品安全国家标准食品中农药最大残留限量》规定的鸡蛋中氟虫腈残留限量0.02 mg/kg 相比,所开发方法中检出限能够满足检测要求。
3 讨论与结论
本研究建立了快速、高效、成本低的一种超高效液相色谱串联质谱检测方法,适用于鸡蛋中氟虫腈及其代谢物药物残留的分析。对比胡贝贞等[21]采用液相色谱一串联质谱法测定茶叶中氟虫腈的含量;安琼等[22]采用气相色谱法测定禽蛋中有机氯农药含量;本研究对鸡蛋中氟虫腈及其代谢物的药物残留进行了全面、详细的分析,采用了超高效液相色谱串联质谱法同时测定氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜,样品前处理成本低,方法检出限满足要求,加标回收率范围为81.3%~92.5%,相对标准偏差均低于5.5%。这表明该方法可应用于鸡蛋样品中4 种农药的高灵敏度检测,结果具有准确性和可靠性。

