骆驼骨髓蛋白的提取工艺优化及功能特性
古丽米热·阿巴拜克日,帕尔哈提·柔孜,*,刘源,陈艳萍,排则丽耶·阿不都热依木,图尼古丽·艾麦提,则拉莱·司玛依,邓杰
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.上海交通大学农业与生物学院,上海 200240)
畜禽骨骼作为一种高营养的传统食物,据传统中药学记载具有强筋壮骨、延年益寿、滋补等作用[1]。现代药理学研究表明,动物骨骼提取物具有抗氧化、抗菌、免疫调节、降血压、保护骨健康等功效[2-3],其可能与动物骨骼中的优质蛋白、矿物质和脂肪等活性成分有关[4]。胶原蛋白独特的生物相容性和生物可降解性在食品、美容、农业等领域得到了广泛的应用[5],目前已从羊、猪、牛、牦牛、鹿、驴等禽畜骨中制备了胶原蛋白和胶原肽,开发了骨肽片、骨胶原蛋白肽、骨肽注射液、冻干粉、蛋白胶囊等产品[6-9],同时开发了多种骨汤呈味产品[10-11],骨类资源的开发日益增多。骆驼随产业趋势逐渐由役用转向食用,但骆驼的可利用部分除了驼奶和肉以外,骆驼骨资源的开发利用较其它骨资源相比未能得到关注,针对其骨髓营养化学成分研究更为鲜见。
随着我国的畜禽业规模和肉类需求越来越庞大,骆驼养殖规模逐渐扩大,2021年全国存栏数约有60 万峰左右,新疆已成为养殖骆驼最多的地区之一,占全国总量的47.69%[12]。同年,新疆的骆驼存栏数19.6 万峰,畜产品产量1.32 万t[13],按动物体重比例,骨骼的质量约占体重的20%~30%,待开发的骨类蛋白资源较为丰富。目前国内外已有部分关于动物胶原蛋白提取及功能特性的研究,如猪骨中蛋白提取率可达28.45%,酶解后羟自由基清除能力较强,在pH 值为5,浓度为2.5 mg/mL 时,其酶解物具有较高的乳化稳定性[14-16];羊骨的蛋白质含量占总质量的20.97%,羊骨多肽具有较好的抗氧化活性[17-18];牛骨胶原蛋白肽提取率为12.45%,且分子量越小抗氧化能力越强[19],牦牛骨的两种胶原蛋白肽对DPPH·、ABTS+·、·OH 和·O2-均有较好的清除活性,可用于抗氧化产品开发[20]。随着食品加工技术的进步,越来越多的学者关注动物骨类蛋白与相关产品在理化性质上的应用,乌日古莫乐[21]发现牛骨蛋白在pH 值为8 时,理化性质表现最佳;宋乐[22]前期分析驼掌胶原蛋白的理化性质,表明等电点在pH7 附近,远离等电点时具有较高的乳化性及乳化稳定性,持油性为(6.22±0.44)g/g。
从骆驼骨髓中提取胶原蛋白和评价其功能特性及活性是有效利用骆驼骨资源的途径之一,促进解决动物肉副产品的有效利用问题,同时也能丰富蛋白资源。
本文以骆驼骨髓为原料,蛋白含量为评价指标,在单因素试验的基础上利用响应面法对骆驼骨髓蛋白(camel bone marrow protein,CBMP)的提取条件进行优化,得出最佳提取工艺,并探究其功能特性和抗氧化活性,旨在为动物骨髓中蛋白资源的高值化开发和利用提供参考。
1 材料与方法
1.1 试验材料
骆驼骨:市售,经新疆农业大学食品科学与药学学院巴吐尔·阿不力克木教授鉴定为新疆双峰骆驼骨,凭证标本保存于新疆农业大学生物大分子实验室。
1.2 试剂
牛血清蛋白E-BC-K318-M:武汉伊莱瑞特生物科技股份有限公司;考马斯亮蓝G-250:上海蓝季科技发展有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH):上海麦克林生化科技公司;十二烷基硫酸钠:生工生物工程(上海)股份有限公司;花生油:益海嘉里金龙鱼粮油食品股份有限公司;石油醚、无水乙醇、氢氧化钠、三氯化铁、三氯乙酸、磷酸、铁氰化钾、磷酸氢二钠、磷酸二氢钠(均为分析纯):天津市致远化学试剂有限公司。
1.3 主要仪器
电子天平(FA1004):常州市幸运电子设备有限公司;集热式恒温加热磁力搅拌器(DF-101S):上海兴创科学仪器设备有限公司;冷藏冷冻箱(BCD-208JDE):浙江星星冷链集成股份有限公司;紫外可见分光光度计(T6 新世纪):北京普析通用仪器有限责任公司;旋转蒸发仪(RE-52):上海亚荣生化仪器有限公司;离心机(SF-TDL-40D):上海菲恰尔分析仪器股份有限公司;高速分散器(XHF-DY):宁波新芝生物有限公司。
1.4 试验方法
1.4.1 样品预处理
取出冷冻的骆驼骨,将骨髓与骨质分开,初步洗净,除去骨髓中的残留碎片和多余的肉渣并洗去血迹,将所得的骆驼骨髓冷冻至-20 ℃下硬化,再放置于捣药罐中按照1∶6(g/mL)的固液比加入液氮进行冷冻粉碎,保存在-40 ℃冰箱,备用。
1.4.2 CBMP 的提取
参照文献[23]并略作修改,取30 g 骆驼骨髓粉末,按1∶20(g/mL)固液比加入蒸馏水,搅拌,充分混合,45 ℃下磁力搅拌回流提取2 h,重复3 次,用分液漏斗分离油水层,收集并混合下层提取液,用石油醚萃取脱脂,滤过,再适当浓缩,透析(截留量为3 000 Da)48 h,真空冷冻干燥,得到CBMP 粉末。根据公式(1)计算CBMP 提取率。
式中:C为CBMP 提取率,%;M为水提蛋白粉末质量,g;m为骆驼骨髓粉末质量,g;n为骆驼骨髓粉末油含量,%。
1.4.3 蛋白含量测定
标准曲线的绘制[24]:将1 mL 不同浓度的(0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)牛血清蛋白质溶液分别加入到3 mL 考马斯亮蓝溶液,避光静置反应5 min。在595 nm 处测吸光度,以蛋白浓度为横坐标,吸光度为纵坐标绘制标准曲线,回归方程:Y=1.010 8X+0.694 2(R2=0.999 7)。取浓度为1 mg/mL 的蛋白提取液,按照上述步骤测定其蛋白含量。
1.4.4 单因素试验
以蛋白含量为指标,分别以提取温度、料液比、时间、提取次数为影响因素设计单因素试验。通过单因素试验考察各因素对CBMP 含量的影响,从而得到合适的自变量水平,进行Box-Behnken 试验设计,单因素试验水平见表1。

表1 单因素试验水平Table 1 Factor levels in single factor experiments
1.4.5 Box-Behnken 法优化CBMP 提取工艺
利用Design-Expert 设定四因素三水平试验,对试验数据进行回归性分析,拟合响应值与各因素的数学回归模型。因素及水平见表2。

表2 响应面优化试验水平Table 2 Factors and levels of response surface design
1.4.6 CBMP 功能特性的测定
1.4.6.1 蛋白溶解性
准确称取CBMP 样品10 mg 于离心管中,加入盐酸(0.5 mol/L)或氢氧化钠(0.5 mol/L)分别配制pH 值为2、4、6、8、10 的10 mL 溶液,漩涡混合6 min,3 500 r/min 离心25 min,测定其蛋白含量[25],按公式(2)计算蛋白溶解性。
式中:S为CBMP 溶解性,%;M1为悬浮液中加入的蛋白含量,%;M2为离心后上清液蛋白含量,%。
1.4.6.2 蛋白乳化性和乳化稳定性
参照文献[26]测定CBMP 的乳化性(emulsification,EAI)与乳化稳定性(emulsion stability,ESI),准确称取CBMP 样品10 mg 于烧杯中,加入盐酸(0.5 mol/L)或氢氧化钠(0.5 mol/L)分别配制pH 值为2、4、6、8、10 的10 mL 溶液,再加5 mL 花生油,10 000 r/min 高速均质2 min。分别在0 min(A0)和静置10 min(A10)时从烧杯低部取50 μL 乳浊液与5 mL 十二烷基硫酸钠(1%)溶液混合均匀,在500 nm 处测定吸光度。用以下公式计算乳化性(A,m2/g)和乳化稳定性(S,%)。
式中:W为样品稀释倍数;C为蛋白质浓度,mg/mL;Φ为光程,设定为0.01;θ为乳状液的油体积分数,0.25。
1.4.6.3 蛋白持水性
准确称取10 mg CBMP 记为m0,将CBMP 放入离心管中记质量为m1,加入盐酸(0.5 mol/L)或氢氧化钠(0.5 mol/L)分别配制pH 值为2、4、6、8、10 的10 mL 溶液,漩涡混合6 min 并于30 ℃恒温箱恒温30 min,4 000 r/min 离心30 min,除去上层清液,称重记为m2[27],持水性(W,g/g)计算公式如下。
1.4.6.4 蛋白持油性
准确称取10 mg CBMP 记为m0,将CBMP 放入离心管中记质量为m1,加入10 mL 花生油,再漩涡混合5 min,直到样品被油饱和,静置30 min,4 000 r/min 离心20 min,将上清液的油去掉,称离心管质量记为m2[28],持油性(O,g/g)计算公式如下。
1.4.7 CBMP 抗氧化活性的测定
1.4.7.1 DPPH·清除能力
将不同浓度的(0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)CBMP 溶液各准确吸取2 mL 于具塞试管中分别加入2 mL 已配制好的DPPH 溶液(0.2 mmol/L)摇匀,37 ℃恒温30 min,于517 nm 处测定吸光度。空白组由等量蒸馏水代替,以抗坏血酸为阳性对照[29]。CBMP 对DPPH·的清除率按下式计算。
式中:T1为DPPH·清除率,%;A0为空白组吸光度;A1为样品组吸光度;A2为对照品组吸光度。
1.4.7.2 ·OH 清除能力
将不同浓度的(0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)CBMP 溶液各1 mL 于试管中,分别加入各1 mL 配制好的FeSO4·7H2O 溶液(6 mmol/L)、水杨酸-乙醇溶液(6 mmol/L)和H2O2(0.1%)溶液,反应30 min,于510 nm 处测吸光度[30]。CBMP 对·OH 清除率计算公式如下。
式中:T2为·OH 清除率,%;A0为空白组吸光度;A1为样品组吸光度;A2为对照品组吸光度。
1.4.7.3 总还原能力
准确吸取不同浓度的(0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)CBMP 溶液0.8 mL 于具塞试管中,分别加入0.2 mol/L 的pH 值为6.6 的磷酸盐缓冲液(phosphate buffered saline,PBS)0.4 mL,再加入1%的铁氰化钾0.4 mL,在50 ℃水浴20 min,冷却,加10% 的C2HCl3O2水溶液0.4 mL,再加入蒸馏水1.6 mL 和0.1%的FeCl3水溶液0.4 mL,室温放置10 min,700 nm 处测吸光度[31]。
1.5 数据处理与统计分析
每个样品至少重复测定3 次,取平均值,采用SPSS 16.0、Origin 9.0、Design-Expert 8.0.6 进行数据处理和分析。
2 结果与分析
2.1 单因素试验
各因素对CBMP 含量的影响如图1所示。

图1 各因素对CBMP 含量的影响Fig.1 Effects of various factors on the content of camel bone marrow protein(CBMP)
由图1A 可知,当提取温度达到45 ℃时,CBMP 含量达到最高值(P<0.05),为(34.65±0.23)%。然而,继续升高温度可能导致蛋白的变性,从而导致蛋白含量降低[32-33]。因此,选择40、45、50 ℃3 个水平进行响应面研究。
由图1B 可知,当料液比为1∶20(g/mL)时,CBMP含量达到最高值(P<0.05),为(34.35±0.31)%,进一步升高溶剂量,CBMP 含量逐渐减小。当溶剂量较少时,提取溶液的黏度高,分子扩散速率较低,影响蛋白的溶出;随着溶剂的增加,溶液逐渐稀释,蛋白溶解量增加,蛋白含量升高;然而,溶剂量过多导致蛋白含量的降低,这可能是由于太多的溶剂使溶液分散太多,使蛋白损失增加,蛋白含量降低[34]。因此,选择1∶15、1∶20、1∶25(g/mL)3 个水平进行响应面研究。
由图1C 可知,当提取时间为120 min 时,CBMP含量达到最大值(P<0.05),为(35.13±0.05)%。提取时间较短,蛋白和其他成分分离程度小,导致蛋白含量降低;然而提取时间延长,可能引起蛋白和非蛋白成分的沉淀,从而降低蛋白的含量。因此,选择90、120、150 min 3 个水平进行响应面研究。
由图1D 可知,当提取次数为2 次时CBMP 含量达到最大(P<0.05),为(35.14±0.18)%。此后,随着提取次数的增加,蛋白含量逐步降低,这原因可能是提取次数过多,可能会导致非蛋白类杂质与蛋白一起溶出,因此蛋白含量降低。因此,选择1、2、3 次3 个水平进行响应面研究。
2.2 响应面法提取条件的优化
2.2.1 响应面试验设计与结果
根据中心复合试验设计原理和单因素试验结果,选择了对CBMP 含量影响显著的4 个因素(提取温度、料液比、提取时间和提取次数)设计四因素三水平的响应面试验,结果如表3所示。
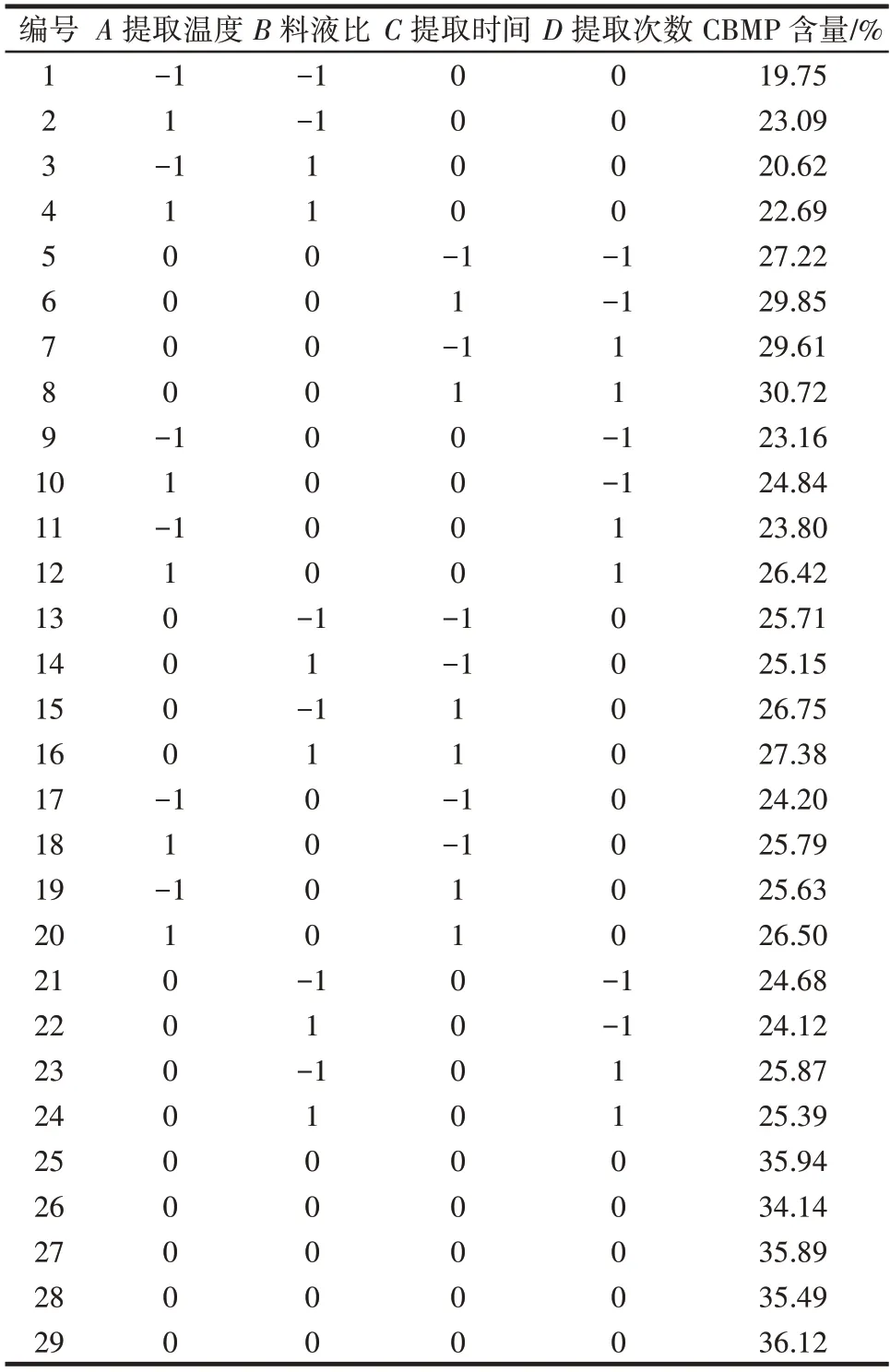
表3 响应面分析试验结果Table 3 Results of response surface test
采用Design-Expert 8.0.6 软件,分别以提取温度、料液比、提取时间、提取次数为变量,经多元回归分析,得到CBMP 提取工艺含量(Y)对4 个因素(A、B、C、D)的二次回归模型:Y=35.32+1.01A-0.042B+0.76C+0.66D-0.32AB-0.18AC+0.24AD+0.30BC+0.020BD-0.38CD-7.22A2-6.63B2-2.47C2-3.57D2。
以CBMP 含量为响应值对数据进行分析,方差分析结果见表4。
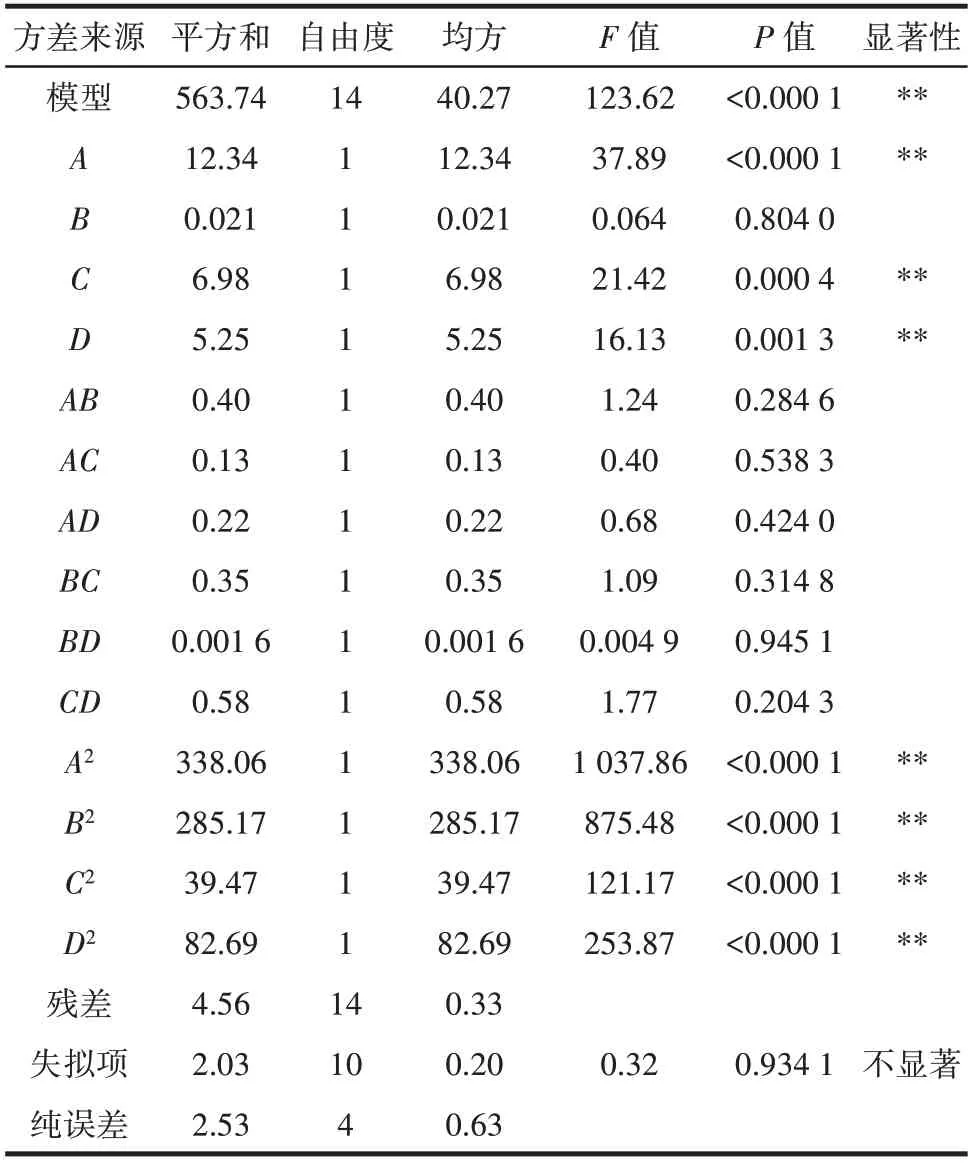
表4 回归模型方差分析Table 4 Analysis of variance of regression equation
回归模型方差分析表明,A、C、D、A2、B2、C2、D2对CBMP 含量的线性效应极显著(P<0.01);B、AB、AC、AD、BC、BD、CD均不显著(P>0.05);该模型极显著(P<0.000 1),失拟项不显著(P>0.05),R2=0.992 0,说明实际试验与该模型拟合度良好,证明响应面法优化CBMP 提取工艺是可行的。F值的大小反映因素对试验指标(因变量)的重要程度,结果为FA>FC>FD>FB。
2.2.2 各因素交互作用对CBMP 含量的影响
利用Design-Expert 8.0 软件对工艺参数组合进行优化,等高线的形状与疏密程度反映因素相互作用的强度,椭圆形且曲线密集对响应值有显著影响,而圆形和曲线稀疏对响应值没有显著影响。各因素交互作用对CBMP 含量的影响如图2~图5所示。

图2 提取温度与料液比的交互作用Fig.2 Interaction between extraction temperature and solid-liquid ratio
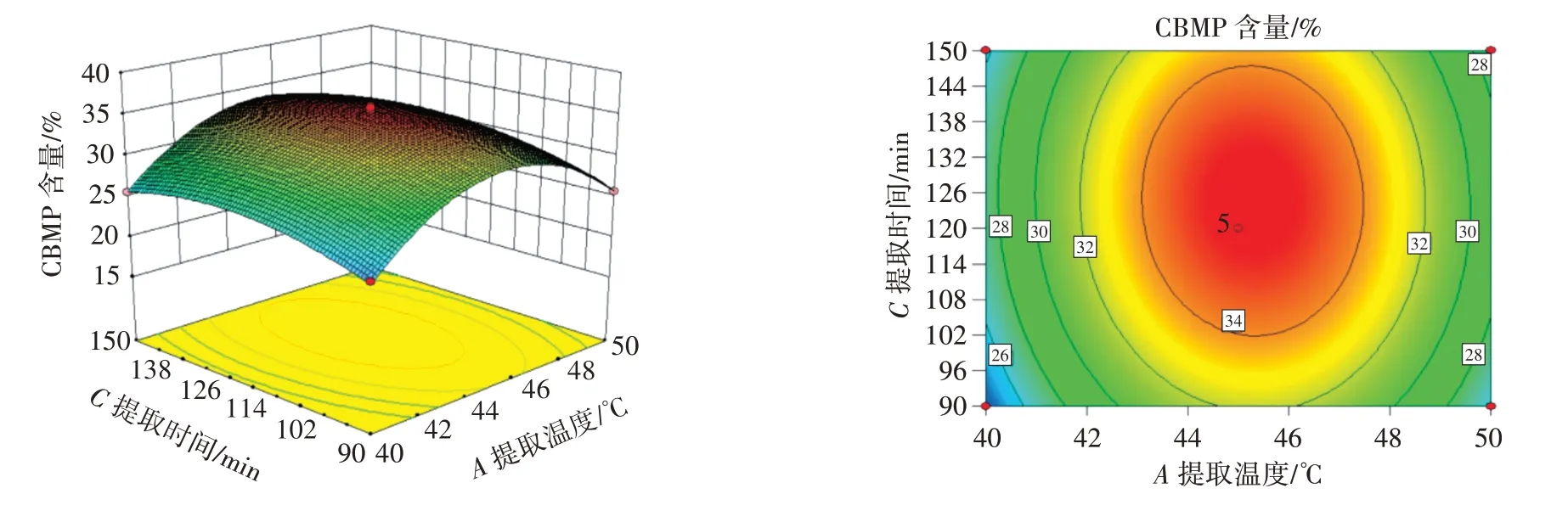
图3 提取温度与提取时间的交互作用Fig.3 Interaction between extraction temperature and extraction time
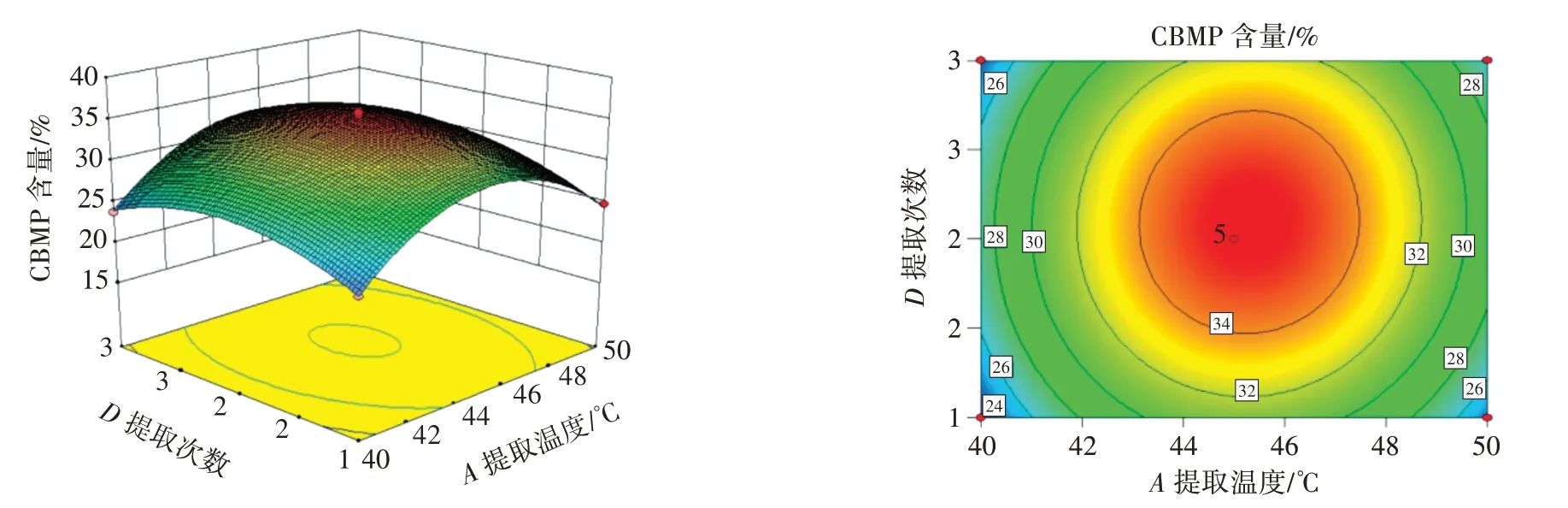
图4 提取温度与提取次数的交互作用Fig.4 Interaction between extraction temperature and extraction times
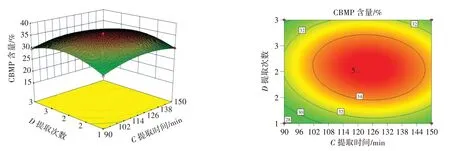
图5 提取时间与提取次数的交互作用Fig.5 Interaction between extraction time and extraction times
由图2~图5 可知,提取温度、料液比、提取时间、提取次数两两交互作用的等高线接近椭圆,说明交互作用明显。
2.2.3 提取工艺条件的确定和验证
优化得到的CBMP 提取的最优提取条件为提取温度45.35 ℃、料液比1∶19.99(g/mL),提取时间124.36 min、提取次数2.09,最佳CBMP 含量为35.4357%。考虑到实际运用时的可操作性,将提取工艺参数修正为提取温度45℃、料液比1∶20(g/mL)、提取时间120 min、提取2 次。采用修正参数进行3 次平行试验,CBMP 含量为(36.56±0.24)%,提取率为(18.26±1.23)%。
2.3 CBMP 功能特性分析
2.3.1 溶解性
溶解性是蛋白质十分重要的功能性质,pH 值对CBMP 溶解性的影响如图6所示。
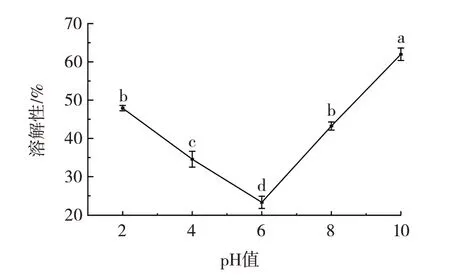
图6 pH 值对CBMP 溶解性的影响Fig.6 Effect of pH on the solubility of camel bone marrow protein(CBMP)
由图6 可知,CBMP 在较低或较高的pH 值时,溶解性较好,当pH 值为6 时溶解性最低(P<0.05),为(23.29±1.58)%,这是由于等电点处在pH6 左右。蛋白质在等电点附近时分子间会聚集而发生沉降,导致溶解度降低[35],这与杨恒[28]研究中鸡肺胶原蛋白在等电点附近溶解度最小,偏离等电点溶解度增大的结果一致。
2.3.2 乳化性及乳化稳定性
pH 值对CBMP 乳化性及乳化稳定性的影响如图7所示。
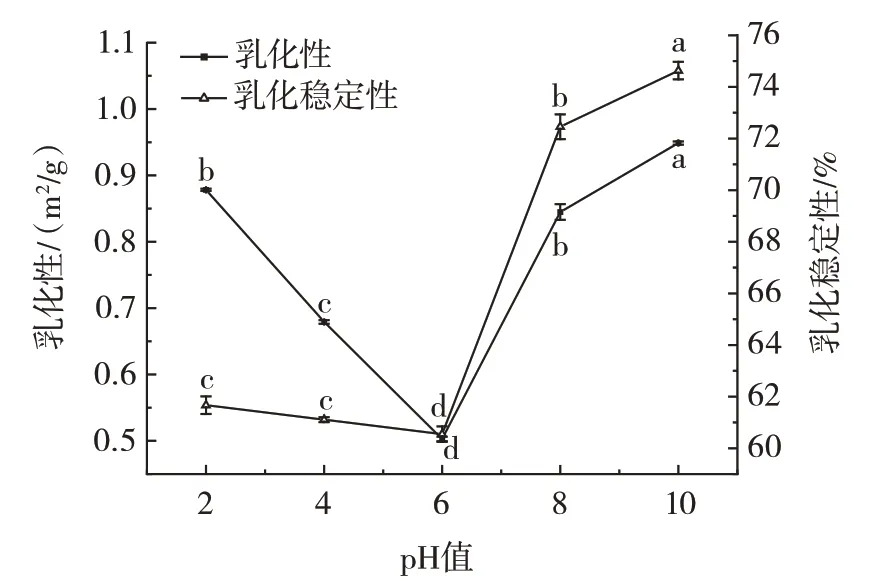
图7 pH 值对CBMP 乳化性及乳化稳定性的影响Fig.7 Effects of pH on the emulsibility and emulsification stability of camel bone marrow protein(CBMP)
CBMP 的乳化性及乳化稳定性随pH 的增加先降后升,pH 值为6 时最低(P<0.05),为(0.50±0.03)m2/g、(60.55±0.29)%,和溶解性表现出相似的曲线图,在等电点附近乳化性及乳化稳定性较差。碱性条件下CBMP 的乳化性及乳化稳定性表现较佳[36]。
2.3.3 持水性
pH 值对CBMP 持水性的影响如图8所示。
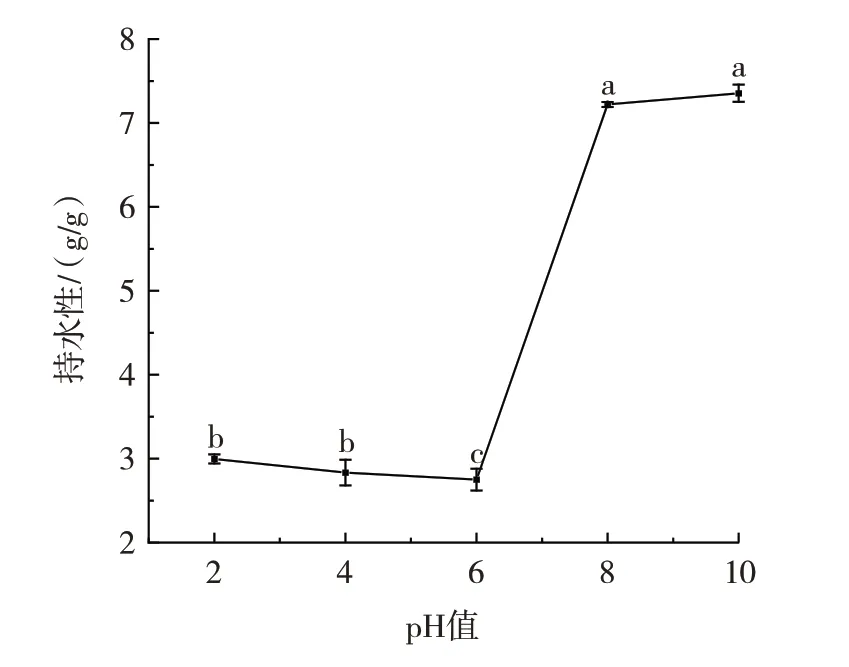
图8 pH 值对CBMP 持水性的影响Fig.8 Effect of pH on the water-holding capacity of camel bone marrow protein(CBMP)
当pH 值为6 时CBMP 的持水性最弱(P<0.05),为(2.78±0.05)g/g,这是由于在等电点附近,蛋白间的相互作用较大,结合水的能力较小,在pH 值为8~10 时CBMP 的持水性得到了改善,是因为电离后蛋白间的相互作用变小,结合水的能力增大,表现为持水性增强[37]。
2.3.4 持油性
蛋白质的吸油性在肉制品、乳制品以及饼干等食品配方及加工中起着非常重要的作用[38],CBMP 的吸油性为(7.56±0.73)g/g,比驼掌蛋白高1.34 g/g[22]。
2.4 CBMP 抗氧化活性的分析
2.4.1 DPPH·清除能力
DPPH 法普遍应用于食品和生物试样的抗氧化能力,能与氧化剂产生的质子结合在一起,在最大吸收波长下的吸光度减少[39]。维生素C 与CBMP 对DPPH·清除能力的测定结果如图9所示。
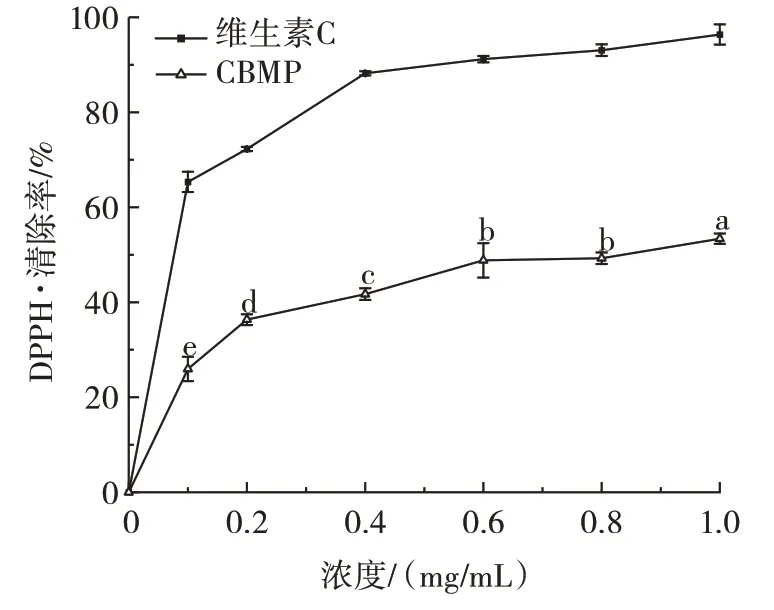
图9 CBMP 对DPPH·清除率的影响Fig.9 DPPH·scavenging rate of camel bone marrow protein(CBMP)
由图9 可知,在测定范围内维生素C 与CBMP 随着浓度的增加,其清除能力逐渐增强,呈量效关系。不同浓度的对照组维生素C 的DPPH·清除率均高于CBMP。在浓度为1 mg/mL 时,CBMP 的DPPH·清除率最高(P<0.05),为(53.39±1.09)%,其半抑制浓度IC50是0.75 mg/mL。
2.4.2 ·OH 清除能力
·OH 是体内产生的活性氧,能带给细胞很大的伤害,因此清除羟自由基是很有必要的[40],维生素C 与CBMP 对·OH 清除能力的测定结果如图10所示。
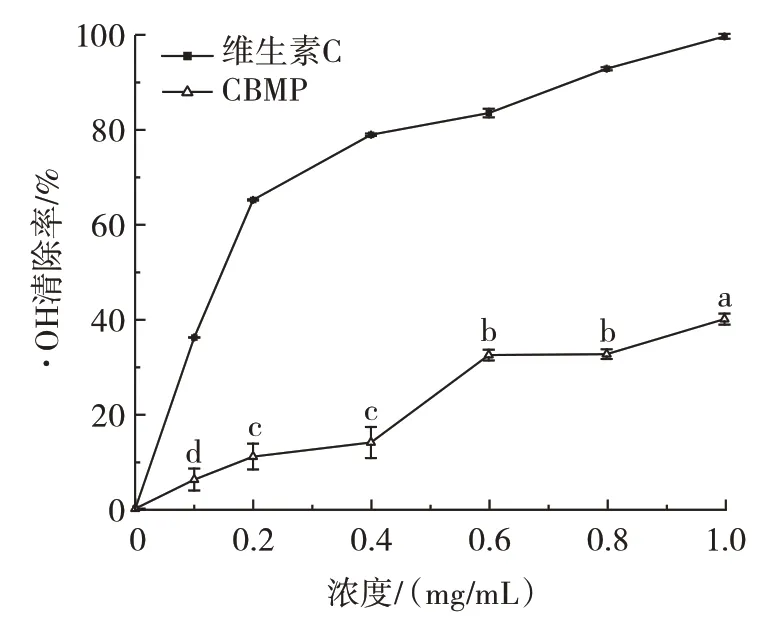
图10 CBMP 对·OH 清除率的影响Fig.10 ·OH scavenging rate of camel bone marrow protein(CBMP)
由图10 可知,维生素C 与CBMP 对·OH 具有较强的清除能力,且在0~1.0 mg/mL 范围内,清除率均伴随浓度的升高而逐渐增加,具有浓度依赖性。不同浓度的对照组维生素C 的·OH 清除率均高于CBMP。在浓度为1 mg/mL 时,·OH 清除能力最高(P<0.05),为(40.02±1.17)%,其半抑制浓度IC50是1.46 mg/mL。
2.4.3 总还原能力
蛋白的总还原能力与抗氧化活性之间具有显著的相关性[41],维生素C 与CBMP 对总还原能力的测定结果如图11所示。
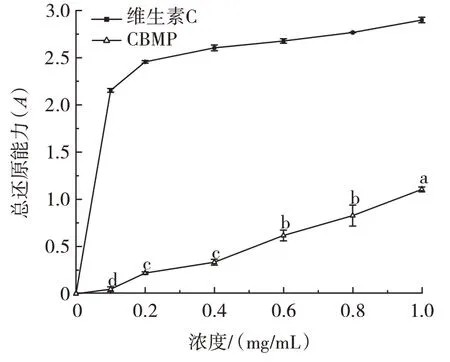
图11 CBMP 对总还原能力的影响Fig.11 Total reducing capacity of camel bone marrow protein(CBMP)
由图11 可知,在浓度0~1.0 mg/mL 范围内总还原能力强弱与维生素C 和CBMP 的浓度呈剂量关系,随着浓度的增加,总还原能力逐渐增强。不同浓度的对照组维生素C 的总还原能力均高于CBMP。在浓度为1.0 mg/mL 时,达到最大(P<0.05),为1.11±0.03,表明CBMP 的还原能力较强。
3 结论
通过响应面法优化CBMP 提取工艺,得出提取温度45 ℃、料液比1∶20(g/mL)、提取时间120 min、提取次数为2 时,CBMP 含量达到(36.56±0.24)%,提取率为(18.26±1.23)%。在最优条件下得到的CBMP 具有较好的功能特性及较强的抗氧化活性,pH 值为6 时溶解性、乳化性及乳化稳定性、持水性最低,分别为(23.29±1.58)%、(0.50±0.03)m2/g、(60.55±0.29)%、(2.78±0.05)g/g,表明等电点在pH6 附近,持油性比驼掌蛋白高,达(7.56±0.73)g/g,碱性条件下CBMP 的功能特性较好。CBMP 对DPPH·、·OH 清除能力IC50值分别为0.75、1.46 mg/mL,浓度为1.0 mg/mL 时,总还原能力为1.11±0.03,表明抗氧化活性较强。本研究为CBMP 的综合利用提供理论基础,对动物骨新资源产品的开发具有现实意义。

