黑青稞γ-氨基丁酸提取工艺优化及体外降血糖活性
孙康娜,丁红艳,李岩,院珍珍,2*,韩丽娟,叶英
(1.青海大学农牧学院,青海西宁 810016;2.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016)
青稞(HordeumvulgareLinn.var.nudumHook.f.)属禾本科大麦属,因其籽粒裸露、内外颖壳分离,所以又被称为裸大麦[1]。它作为青藏高原最具民族特色的农作物,具有“三高两低”即高蛋白、高纤维、高维生素、低脂肪、低糖的特性,是一种营养价值较高的农作物[2]。
近年来国内外在青稞的营养价值、活性成分等方面开展了研究,进一步推动了青稞产业的发展。γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种非蛋白质、功能性氨基酸,是主要存在于微生物和动植物体内的天然活性成分[3]。它是动物中枢神经系统中主要的抑制性神经递质之一[4]。GABA 在健康和糖尿病动物个体水平口服都具有促进胰岛素分泌和降低空腹血糖的功能[5]。GABA 生理功能较多,不仅能抗应激、解毒、抗癌[6]、治疗帕金森、促进乙醇代谢、调节生殖功能[7],还是大脑中最重要的抑制性神经递质,在癫痫的发生和发展中起着重要作用[8],兼具镇静、抗焦虑或抗惊厥作用[9],可以改善色素沉着过度障碍[10],在治疗重度抑郁症方面也具有积极作用[11]。此外,GABA 能通过离子型GABA(A)受体和代谢性GABA(B)受体影响多种胰岛细胞类型的活性[12],在干酪乳杆菌对葡聚糖硫酸钠(dextran sulphate sodium,DSS)诱导的小鼠结肠炎的有益作用中起关键作用[13]。在植物中GABA 也具有积极作用,叶面施用GABA 或GABA 的代谢工程产物可以降低作物生产中农药污染风险[14];外源GABA 通过增强GABA 分流和次生细胞壁生物合成,提高苹果幼苗对长期干旱胁迫的抵抗力[15];GABA 能有效缓解苹果幼苗中的镉(Cd)毒性[16];外源GABA 对紫花苜蓿幼苗耐碱胁迫有正向作用[17]。
国内外学者在富含GABA 原料的选择、高产GABA 微生物的分离鉴定等方面取得显著的进展,目前已有学者研究不同因素对青稞中GABA 含量的影响,通过分析提取时间、提取温度、料液比、pH 值、青稞种类等因素对GABA 含量的影响,得到最优提取工艺,使GABA 含量达到更高[18]。从米糠中提取GABA 所需的条件是用水作为提取介质,在50 ℃的温度下搅拌米糠4 h,该方法可为提取GABA 提供良好的条件[19]。
α-淀粉酶抑制剂可以抑制餐后血糖升高和胰岛素的分泌[20]。α-葡萄糖苷酶抑制剂具有抑制肠道细菌、保持血糖平衡等作用[21],α-葡萄糖苷酶和α-淀粉酶抑制剂可抑制糖原、淀粉等物质水解成葡萄糖,延缓糖原、淀粉等物质在小肠中被吸收,能有效降低餐后血糖水平[22]。故可以通过α-葡萄糖苷酶和α-淀粉酶抑制率测定降血糖活性。
本试验研究提取温度、提取时间、液料比对黑青稞中GABA 含量的影响,在单因素试验的基础上,进行响应面试验探究最优提取工艺参数,并进行体外降血糖活性研究,以期为推进高原健康食品发展提供理论依据。
1 材料与方法
1.1 材料与试剂
黑青稞粉:青海汉和生物科技股份有限公司;γ-氨基丁酸标准品:上海源叶生物科技有限公司;四硼酸钠(分析纯):上海仪电科学仪器股份有限公司;苯酚、次氯酸钠、可溶性淀粉溶液(均为分析纯):天津市致远化学试剂有限公司;3,5-二硝基水杨酸(分析纯):上海展云化工有限公司;4-硝基苯基-α-D-吡喃葡萄糖苷(分析纯):索莱宝生物科技有限公司;α-淀粉酶(酶活力50 U/mg):合肥博美生物有限公司;α-葡萄糖苷酶(酶活力70 万U/mL):上海吉至生化科技有限公司。
1.2 仪器与设备
电热恒温水浴锅(HH-6 型):上海比朗仪器有限公司;恒温振荡器(THZ-82 型):常州国华电器有限公司;台式高速离心机(H/T16MN 型):湖南赫西仪器装备有限公司;紫外可见分光光度计(UN-2600 型):日本岛津公司;涡旋振荡器(Xw-80A 型):海门市其林贝尔仪器制造有限公司;全波长酶标仪(MULTISKAN Sky 型):北京平利洋经贸有限公司。
1.3 方法
1.3.1 GABA 标准曲线的绘制
参考刘元等[3]的方法,并稍作修改,称取一定量的GABA 标准品用去离子水配制成1 mol/L 的GABA 标准溶液,准确吸取0.05、0.10、0.15、0.20、0.25 mL 于10 mL 带盖离心管中,分别加蒸馏水0.95、0.90、0.85、0.80、0.75 mL 使每个离心管中的溶液达到1 mL,得到不同浓度的GABA 标准液,从配好的标准液中取1.0 mL 到另一个带盖离心管中,在离心管中先加入硼酸盐缓冲液(pH9.18)0.4 mL,然后加入6% 苯酚溶液1 mL,再加入5.25% 次氯酸钠溶液1.5 mL,将其充分混匀后马上放入水浴锅中沸水浴10 min,然后取出冰浴5 min,之后加入60% 乙醇溶液2 mL,在645 nm 处测定溶液的吸光值。
1.3.2 单因素试验
考察不同提取温度、提取时间、液料比对GABA含量的影响,并确定各因素的最佳水平。
1.3.2.1 提取温度对黑青稞中GABA 含量的影响
参考赵大伟等[23]的方法,并稍作修改,称取(500±5)mg 黑青稞粉放置于10 mL 带盖离心管中,在每管中加5 mL 蒸馏水,固定液料比为10∶1(mL/g),将试管放入振荡器,设置转速为2 000 r/min,时间为90 min,分别在40、50、60、70、80℃条件下进行振荡处理。振荡结束后,离心10 min(6 000 r/min),取1 mL 上清液于另一离心管中,待测。
1.3.2.2 提取时间对黑青稞中GABA 含量的影响
参考赵大伟等[23]的方法,并稍作修改,称取(500±5)mg 黑青稞粉放置于10 mL 带盖离心管中,每个离心管加5 mL 蒸馏水,固定液料比为10∶1(mL/g),将试管放入振荡器,设置转速为2 000 r/min,固定温度为60 ℃,在30、60、90、120、150 min 条件下进行振荡处理。振荡结束后,离心10 min(6 000 r/min),取1 mL 上清液于另一离心管中,待测。
1.3.2.3 液料比对黑青稞中GABA 含量的影响
参考赵大伟等[23]的方法,并稍作修改,称取(500±5)mg 黑青稞粉放置于10 mL 带盖离心管中,固定时间为90 min、温度为60 ℃,设置液料比分别为2∶1、3∶1、4∶1、5∶1、6∶1(mL/g),将试管放入振荡器,设置转速为2 000 r/min,振荡结束后,离心10 min(6 000 r/min),取1 mL 上清液于另一离心管中,待测。
1.3.3 响应面试验
在单因素试验结果的基础上,以提取温度(A)、提取时间(B)、液料比(C)为自变量,以GABA 含量(Y)为响应值,利用Box-Behnken 中心设计法则[24],确定黑青稞中GABA 提取的最佳工艺条件,并进行验证试验以检验结果的可靠性。
通过单因素试验结果确定响应面因素水平设计如表1所示。
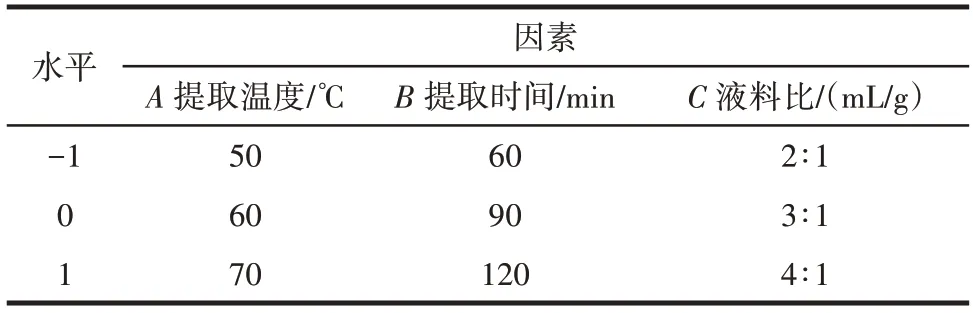
表1 响应面试验因素水平设计Table 1 Factors and levels of response surface methodology
1.3.4 体外降血糖活性测定
1.3.4.1 黑青稞中GABA 对α-淀粉酶的抑制活性试验参考张燕丽[21]的方法,并稍作修改,根据响应面试验的最佳条件提取GABA,取150 μL 未处理青稞粉溶液和富集GABA 溶液并添加0.5 mg/mL 的α-淀粉酶液150 μL,充分混匀后,放入水浴锅在37 ℃条件下孵育10 min,然后将250 μL 的1% 可溶性淀粉溶液加入到混合液中,并在37 ℃条件下继续孵育10 min,加入500 μL 的3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)停止反应,在沸水浴中反应5 min。冷却后取200 μL 于96 孔板中,使用酶标仪在540 nm 处测吸光值,每组重复测定3 次,取平均值。α-淀粉酶抑制率(X,%)按公式(1)计算。
式中:a为含葡萄糖苷酶溶液与待测样本时所检出的吸光值;b为含有待测样本但不包括葡萄糖苷酶的溶液所测得的吸光值;c为含葡萄糖苷酶溶液但不含待测样本所测得的吸光值。
1.3.4.2 黑青稞中GABA 对α-葡萄糖苷酶的抑制活性试验
参考张燕丽[21]的方法,并稍作修改,根据响应面试验的最佳条件提取GABA,取0.05 mol/L(pH6.8)磷酸盐缓冲液600 μL,加入20 mol/L 的4-硝基苯基-α-D-吡咯葡萄糖苷溶液300 μL 与40 μL 未处理青稞粉溶液和富集GABA 溶液,将其放置于37 ℃水浴条件下孵育10 min,然后加入0.2 U/mL 的α-葡萄糖苷酶溶液52 μL,室温条件下放置10 min 后再加入0.1 mol/L 的Na2CO31.65 mL 终止反应,在405 nm 的条件下测定终止液吸光值。反应体系中采用0.05 mol/L(pH6.8)磷酸盐缓冲液(phosphate buffer solution,PBS)作为溶液及待测样品的空白对照。每个样品做3 个平行,并设置空白对照,取平均值。α-葡萄糖苷酶抑制率(Y,%)按公式(2)计算。
式中:a为含葡萄糖苷酶溶液与待测样本时所检出的吸光值;b为含有待测样本但不包括葡萄糖苷酶的溶液所测得的吸光值;c为含葡萄糖苷酶溶液但不含该样本时所测得的吸光值;d为不包括葡萄糖苷酶的溶液与待测样本时所检出的吸光值。
1.4 数据处理
同一处理的样品组做3 组平行,使用Excel 2016、Origin 2021 软件进行数据处理、分析及作图,响应面试验结果利用Design-Expert 8.0.6 软件进行处理。
2 结果与分析
2.1 GABA 含量分析标准曲线
在室温条件下,测定处理过的GABA 标准溶液在645 nm 处的吸光值,结果见图1。
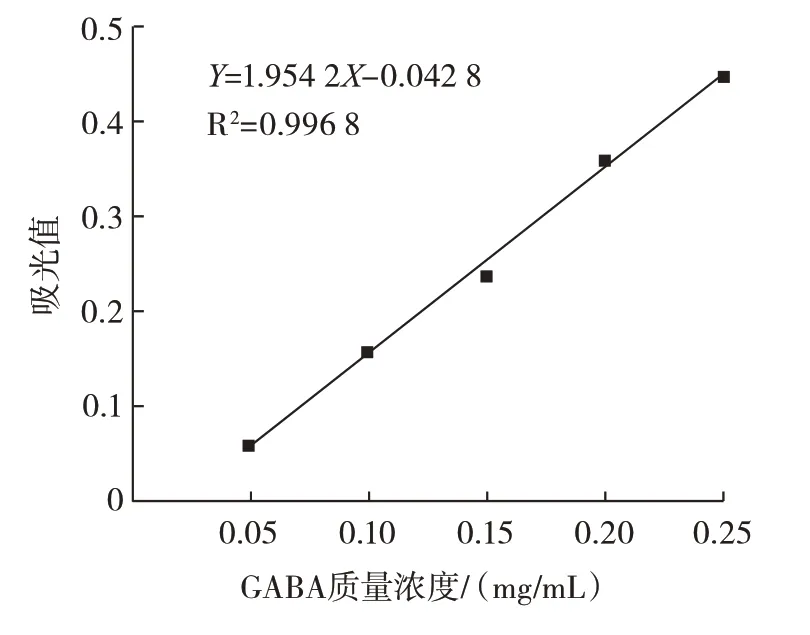
图1 GABA 标准曲线Fig.1 Standard curve of GABA
由图1 可知,在645 nm 的条件下GABA 含量和吸光值的线性关系为Y=1.954 2X-0.042 8,R2=0.996 8。为了让重复性符合要求,本次试验重复测定3 次,使得其结果稳定,准确性高。因此,采用该方法对黑青稞提取液的GABA 含量进行测定可行。
2.2 黑青稞GABA 提取单因素试验
2.2.1 提取温度对GABA 含量的影响
提取温度对GABA 含量的影响见图2。
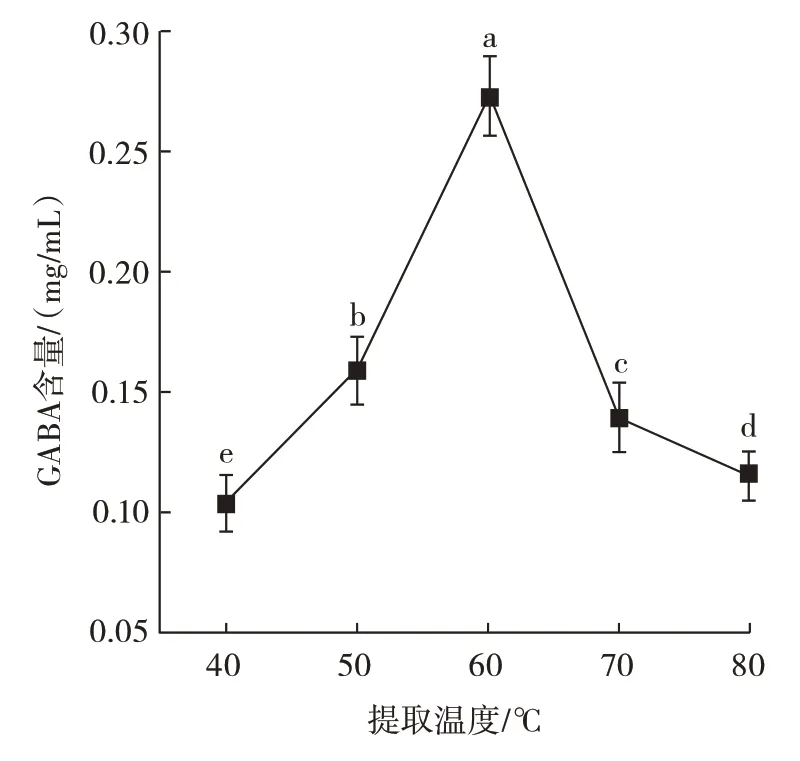
图2 提取温度对GABA 含量的影响Fig.2 Effect of extraction temperature on GABA content
由图2 可知,当提取温度从40 ℃升高到60 ℃时,黑青稞中GABA 含量随着提取温度的升高而升高,在60 ℃时GABA 含量达到峰值(0.273±0.017)mg/mL;提取温度进一步升高,黑青稞中GABA 含量呈下降趋势。提取温度为40 ℃时,黑青稞中GABA 含量最低,仅为(0.103±0.013)mg/mL。这可能是因为提取温度未达到60 ℃时,水溶液对GABA 的溶解度较低,从而导致GABA 含量比峰值低,提取温度高于60 ℃使得GABA 发生降解,在一定程度上破坏了黑青稞提取液中的GABA,使得GABA 分解、氨基脱离,也可能是因为分子间发生剧烈碰撞会产生能量,这部分能量使GABA 的氨基解离,所以提取液中的GABA 含量下降[24]。因此选择提取黑青稞GABA 提取温度50、60、70 ℃进行响应面优化试验。
2.2.2 提取时间对GABA 含量的影响
提取时间对GABA 含量的影响见图3。
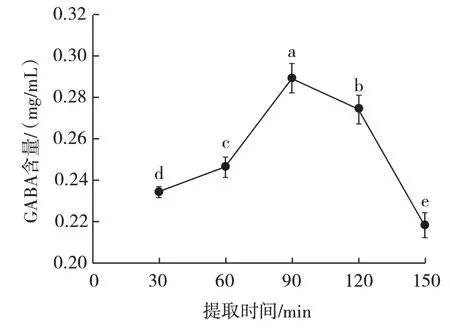
图3 提取时间对GABA 含量的影响Fig.3 Effect of extraction time on GABA content
由图3 可知,控制其它3 个变量,逐渐延长提取时间,黑青稞中GABA 含量随着提取时间的延长而升高,在90 min 时黑青稞中GABA 含量达到峰值(0.289±0.007)mg/mL;提取时间进一步延长,黑青稞中GABA 含量呈下降趋势;当提取时间为150 min 时,黑青稞中GABA 含量最低,仅为(0.218±0.006)mg/mL。这可能是因为提取时间太短,黑青稞中GABA 未完全溶出,导致GABA 含量较少,长时间的浸提使得GABA被破坏,从而导致GABA 含量比峰值低。因此选择黑青稞GABA 提取时间60、90、120 min 进行响应面优化试验。
2.2.3 液料比对GABA 含量的影响
液料比对GABA 含量的影响见图4。
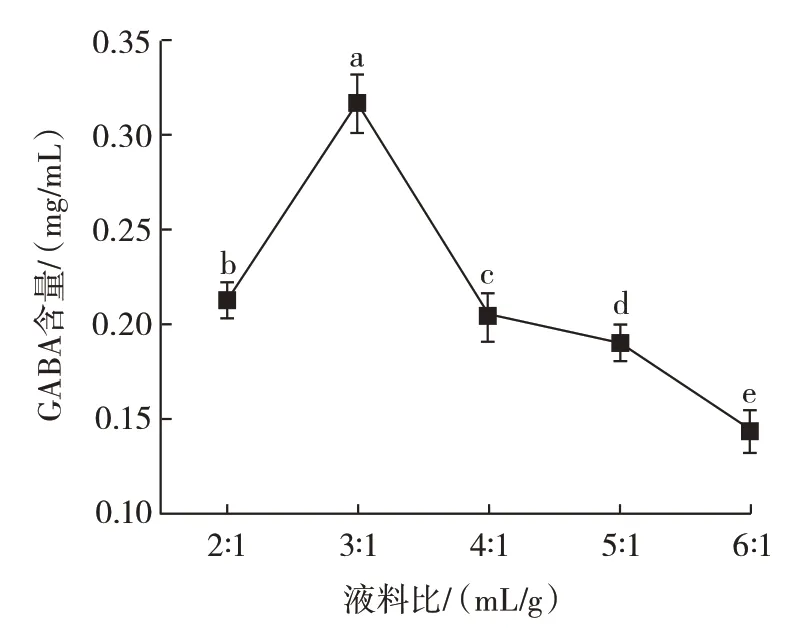
图4 液料比对GABA 含量的影响Fig.4 Effect of liquid-material ratio on GABA content
由图4 可知,随着溶剂体积增加,黑青稞粉没有完全浸湿,黑青稞中的GABA 没有增加,黑青稞中GABA含量先增加后减小,在液料比为3∶1(mL/g)时,黑青稞中GABA 含量达到峰值(0.316±0.015)mg/mL;液料比为6∶1(mL/g)时,黑青稞中GABA 含量最低,仅为(0.144±0.012)mg/mL。这可能是因为溶剂体积过小,黑青稞粉没有完全浸湿,黑青稞中的GABA 没有完全被溶出;溶出的GABA 在液料比为3∶1(mL/g)时达到最大,继续增加溶剂用量,会溶解出其他物质,所以GABA 含量降低。最终选择液料比2∶1、3∶1、4∶1(mL/g)进行响应面优化试验。
2.3 黑青稞GABA 提取工艺响应面试验结果
2.3.1 响应面试验设计及结果
以提取温度(A)、提取时间(B)、液料比(C)为影响因子,以黑青稞中GABA 含量(Y)为响应值,采用Box-Behnken 模型设计出包括17 次试验的提取方案[25],测定每组试验条件下黑青稞GABA 含量,试验方案及结果见表2。
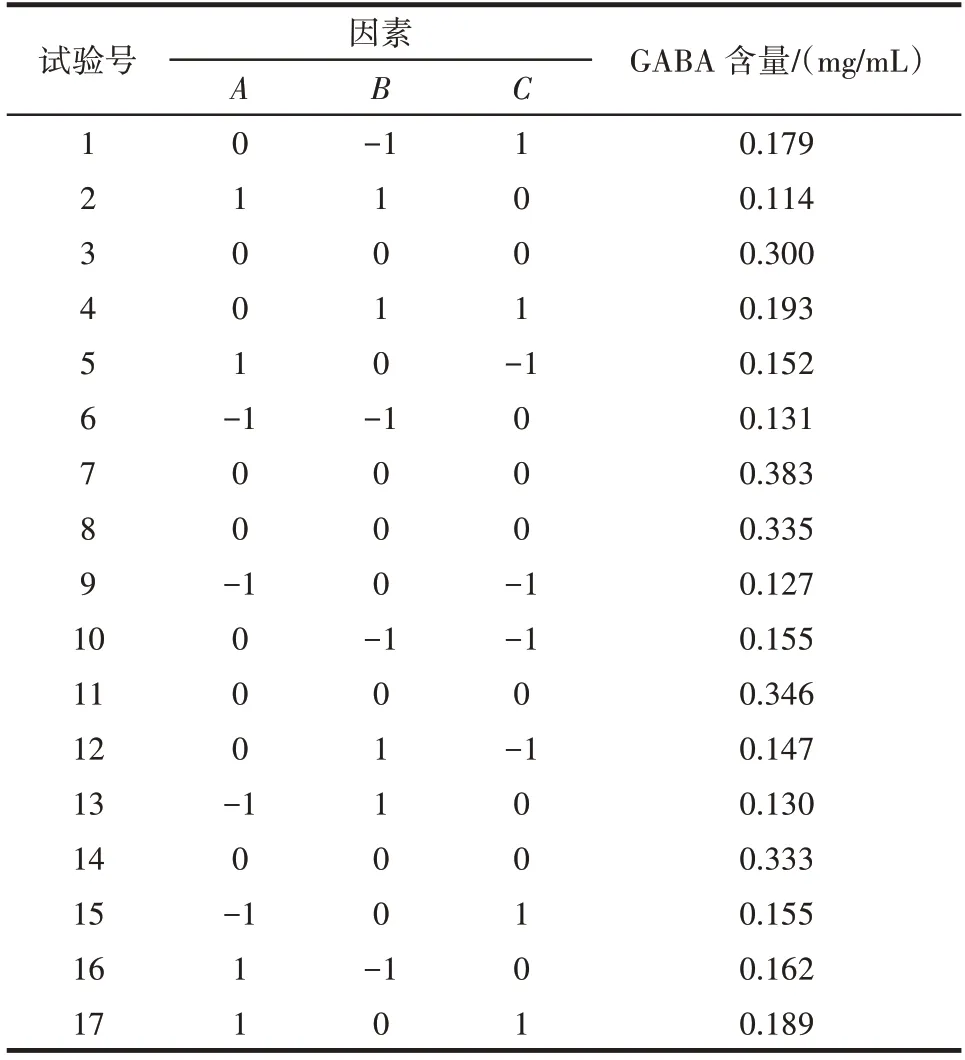
表2 响应面试验设计与结果Table 2 Design and results of response surface methodology
2.3.2 回归模型的建立与显著性分析
将表2 得到的试验结果进行方差分析,得到Y关于A、B、C的二次多项回归拟合模型为Y=0.34+9.250×10-3A-5.375×10-3B+0.017C-0.012AB+2.250×10-3AC+5.500×10-3BC-0.11A2-0.096B2-0.075C2。
方差分析结果见表3。

表3 回归方程试验方差分析Table 3 Analysis of variance(ANOVA)for regression equations
由表3 可知,回归拟合模型的p<0.01,说明该模型极显著。失拟项=0.861 表现出不显著,说明拟合效果比较好。且R2=0.968 6>0.9,R2Adj=0.928 3;C.V.=11.77%,可得结论:模型的拟合结果符合实际试验结果。因此该试验模型的设计比较合理,可以拟合试验数据,能用于黑青稞中GABA 提取工艺的分析。
2.3.3 交互作用分析
通过影响因素之间的响应面图和等高线图来进行分析,响应面图可以形象直观地反映出两因素之间的交互作用。通过Design-Expert 8.0.6 软件,各试验因素交互作用对结果影响的响应面及等高线见图5~图7。
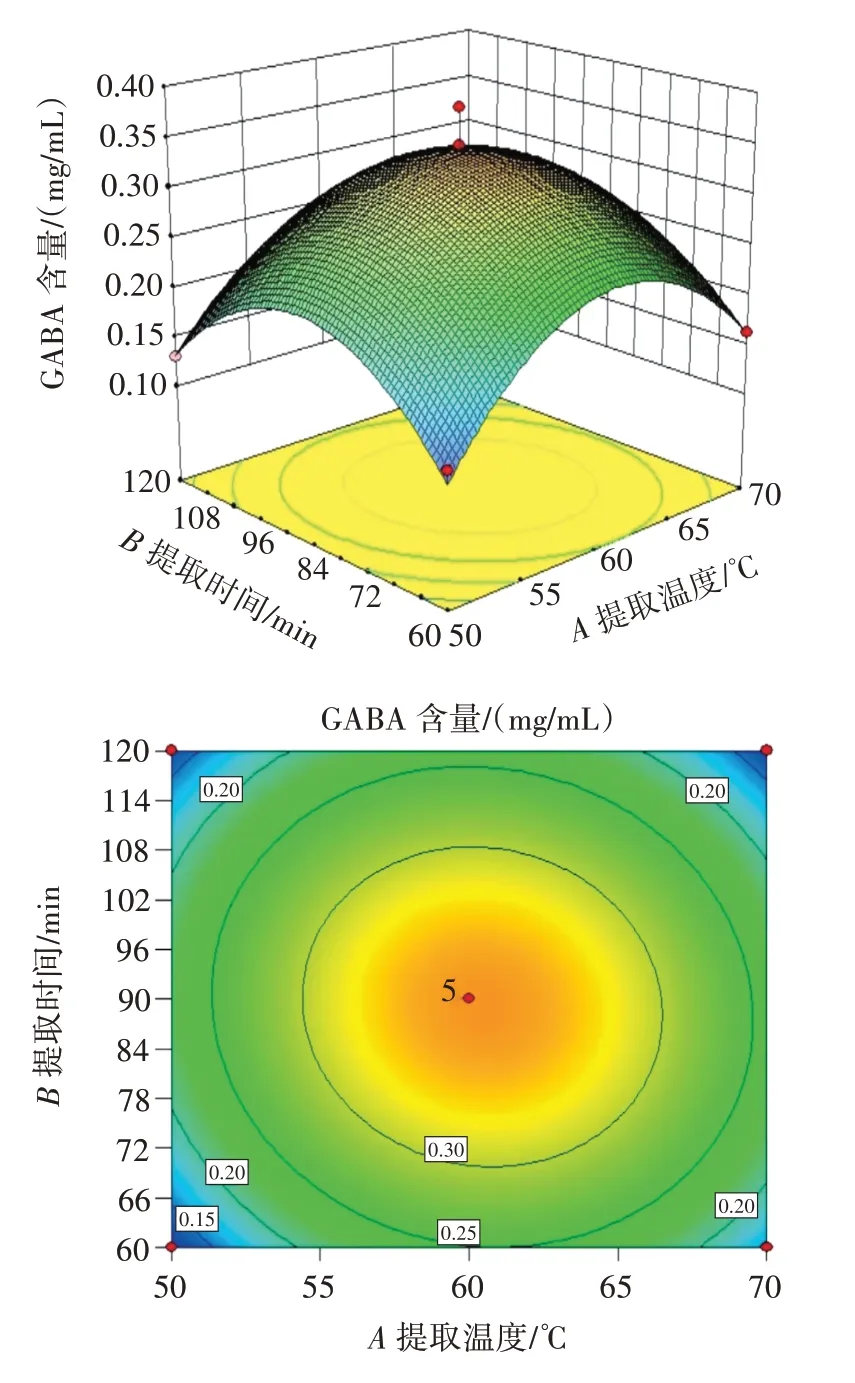
图5 提取温度和提取时间对GABA 含量影响的响应面和等高线Fig.5 Response surface and contour plots of the effects of temperature and time on GABA content
由图5 可知,A与B的交互作用的三维图最陡峭,曲面变化最为明显,等高线图呈椭圆,说明A、B的交互作用对黑青稞中GABA 含量在三者中影响最大。
由图5、图6、图7 的等高线图可知,提取温度和提取时间对黑青稞中GABA 的提取量的影响显著大于提取温度和液料比与提取时间和液料比对黑青稞中GABA 的提取量的影响。其中,图6 的等高线比图5、图7 的等高线更接近于圆形。因此,两因素相互作用对黑青稞中GABA 的含量影响最小的是提取温度和液料比。根据表3 的数据可以看出,AB相互作用的p值最小,数值为0.368;AC相互作用的p值最大,数值为0.859;BC相互作用的p值介于两者之间,数值为0.666。所以两因素相互作用对黑青稞中GABA 含量影响大小依次排序为AB>BC>AC[26]。
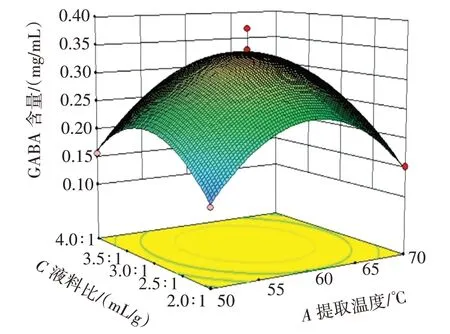
图6 提取温度和液料比对GABA 含量影响的响应面和等高线Fig.6 Response surface and contour plots of the effects of temperature and liquid-material ratio on GABA content
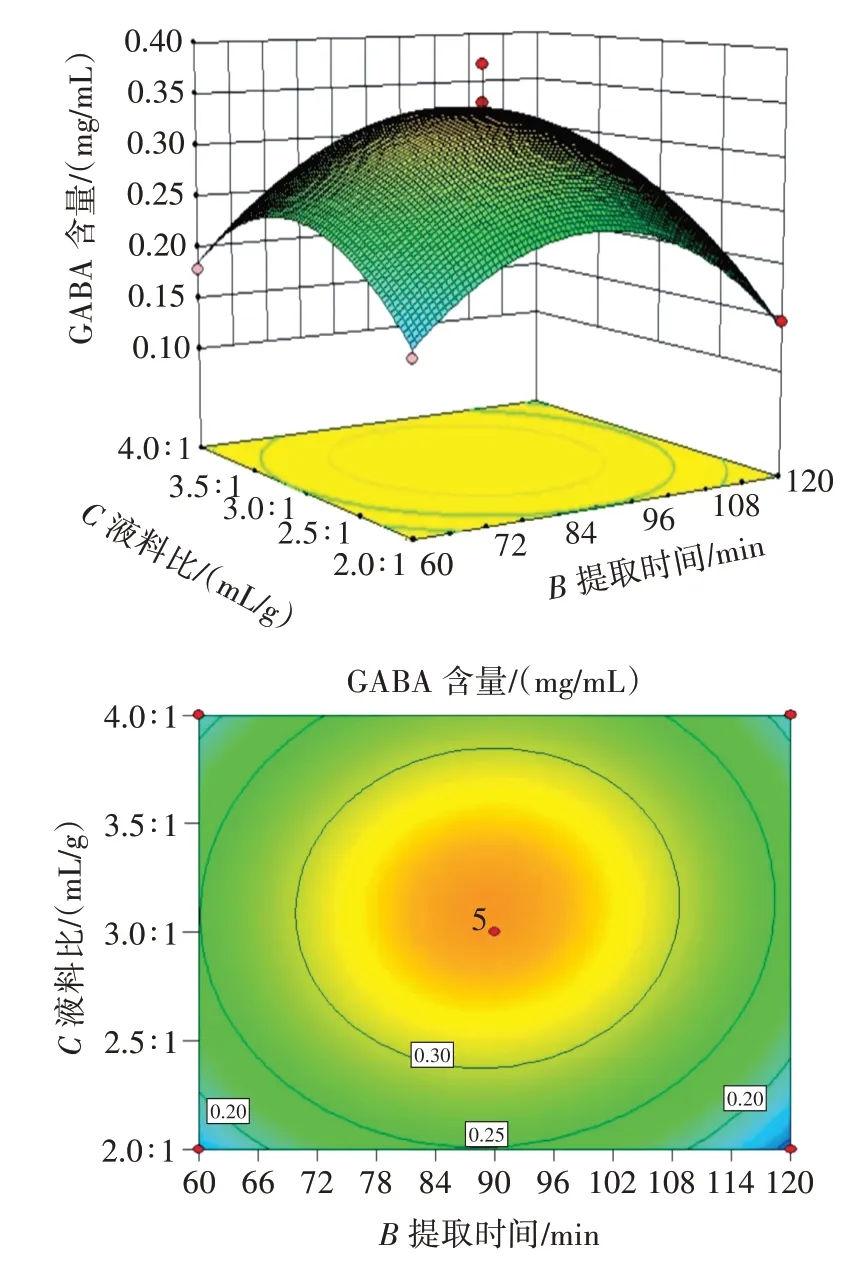
图7 提取时间和液料比对GABA 含量影响的响应面和等高线Fig.7 Response surface and contour plots of the effects of time and liquid-material ratio on GABA content
2.3.4 响应面验证试验
响应面分析得到,在提取温度为60 ℃、提取时间为90 min、液料比3∶1(mL/g)条件下,预测的最优黑青稞GABA 含量为0.341 mg/mL。为了检验响应面法得到的优化数据的可靠性,进行验证试验,做3 次平行试验,取平均值,最后计算GABA 含量为(0.338±0.012)mg/mL,与理论上预测的最优值0.341 mg/mL 基本相符,验证了黑青稞中GABA 含量回归模型的有效性,所以黑青稞γ-氨基丁酸含量可以采用该模型进行分析。
2.4 黑青稞GABA 体外降血糖活性研究结果
体外降血糖活性分析见表4。

表4 体外降血糖活性分析Table 4 Hypoglycemic activity in vitro
由表4 可知,根据响应面试验的最佳条件提取GABA,取未处理青稞粉溶液和富集GABA 溶液进行α-淀粉酶的抑制活性试验,富集GABA 溶液对α-淀粉酶的抑制效果更佳,其抑制率为(72.41±0.43)%,未处理青稞粉溶液的抑制率为(22.82±0.33)%。
由表4 可知,根据响应面试验的最佳条件提取GABA,取未处理青稞粉溶液和富集GABA 溶液进行α-葡萄糖苷酶抑制活性试验,富集GABA 溶液对α-葡萄糖苷酶的抑制效果更佳,其抑制率为(82.29±0.38)%,未处理青稞粉溶液的抑制率为(41.46±0.43)%。
以上试验结果表明,黑青稞中GABA 对α-淀粉酶和α-葡萄糖苷酶能够产生抑制效果,具有良好的体外降血糖作用,为研发功能性食品和研究以青稞为原料的产品提供了理论基础。
3 结论
本试验以黑青稞为原料,以黑青稞中GABA 含量为响应指标,探究提取温度、提取时间、液料比对GABA 含量的影响,并进行体外降血糖活性研究。以单因素试验为基础,进行响应面试验,结果表明黑青稞提取GABA 最佳工艺参数:提取温度为60 ℃、提取时间为90 min、液料比3∶1(mL/g),在此条件下,黑青稞中GABA 含量为(0.338±0.012)mg/mL,与模型预测值0.341 mg/mL 基本相符。根据响应面试验的最佳条件提取黑青稞中GABA,结果发现富集GABA 溶液的体外降血糖效果更佳,黑青稞中GABA 对α-淀粉酶的抑制率为(72.41±0.43)%,对α-葡萄糖苷酶抑制率为(82.29±0.38)%,具有良好的降血糖效果。

