西瓜皮中3种多糖的初步表征及抗氧化活性对比
刘盈,张欣,刘会平,王兵,马笑笑,张慧慧,李灿
(天津科技大学食品科学与工程学院,天津 300457)
西瓜是一种遍布全球且具有一定经济价值的水果[1],由于其清爽的口感以及丰富的营养深受人们的喜爱,其含有丰富的维生素、矿物盐、氨基酸和多种抗氧化活性成分[2]。西瓜主要由3 部分组成,即果肉、种子和果皮。果肉约占果实总量的68%,种子约占2%,果皮约占30%。西瓜的果皮常常被丢弃,这不仅会带来环境问题,还是一种巨大的资源浪费[3]。
近年来,从果皮中提取多糖的研究越来越多。蒋文明等[4]从椰子皮中提取多糖研究其生物活性,其体外抗细胞增殖试验表明,椰子皮多糖对HepG2 细胞显示出明显的抗增殖活性。叶美芝等[5]从山药皮中分离纯化多糖研究其体外抗氧化性,综合比较了不同浓度两种多糖组分对DPPH 自由基、羟自由基、ABTS+自由基和超氧阴离子自由基的体外清除效果。张瑞平等[6]从香加皮中提取香加皮多糖研究其抗氧化活性,通过分析12 种香加皮多糖对DPPH 自由基、ABTS+自由基、羟基自由基、超氧阴离子自由基的清除能力以及还原能力,表明香加皮多糖均具有一定的抗氧化活性,其中香加皮多糖-0 组分抗氧化能力最好。郎杰等[7]研究西瓜皮多糖对衰老小鼠抗衰老及降血糖作用,表明西瓜皮多糖具有一定的抗衰老作用及降血糖作用。Romdhane 等[8]表征了西瓜皮多糖的物理性质和抗氧化活性,结果表明,西瓜皮多糖是一种很有前途的抗氧化剂和抗高血压药物的天然来源。目前从西瓜皮中提取多糖并探究其生理活性的研究较少[9-11]。本研究从西瓜皮中以水提醇沉法提取西瓜皮多糖,通过2-(二乙氨基)乙醚纤维素52(DEAE-cellulose DE-52,DEAE-52)和葡聚糖凝胶G200(Sephadex G-200)对其分离纯化,通过物理和化学方法结合对西瓜皮多糖进行研究和表征并评估了其体外抗氧化活性,以期为果皮作为功能性膳食补充剂的开发和应用提供理论基础。
1 材料与方法
1.1 材料与仪器
西瓜皮:市售;岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、核糖、半乳糖醛酸、葡萄糖醛酸(均为标准品)、Sephadex G-200 凝胶柱、植物总酚(total phenols,TP)含量检测试剂盒:北京索莱宝科技有限公司;DEAE-52 纤维素:北京瑞达恒辉科技发展有限公司;Sephadex G-200 凝胶柱、植物总酚(total phenols,TP)含量检测试剂盒、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-azlnobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS](均为分析纯):北京索莱宝科技有限公司;DEAE-52 纤维素:北京瑞达恒辉科技发展有限公司。
101-3BS 电热恒温鼓风干燥箱:天津华北实验有限公司;WN-500 型高速粉碎机:广州市旭朗机械设备有限公司;Model680 型酶标仪:美国Bio-Rad 公司;Agilent 1200 型高效液相色谱(high performance liquid chromatograph,HPLC)仪:美国安捷伦公司;IS-50 型傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪:德国Karlsruhe 公司;UV-1800 型紫外光谱仪:日本岛津公司;ICS-5000+型离子色谱(ion chromatography,IC)仪:美国黛安(DIONEX)公司;TGA-Q500型热重分析(thermal gravimetric analyzer,TGA)仪:美国TA Instruments Waters LLC 公司;SU1510 型扫描电子显微镜(scanning electron microscope,SEM):日本日立公司。
1.2 西瓜皮多糖的制备
取2.0 kg 西瓜皮清理去除杂质,洗净后于60 ℃烘箱中烘干水分,用高速粉碎机粉碎。粉碎后过80 目筛,将西瓜皮粉末按照料液比1∶15(g/mL)用蒸馏水在70 ℃条件下提取120 min,4 000 r/min 离心10 min,过滤保留上清液,用4 倍体积的无水乙醇4 ℃沉淀12 h,4 000 r/min 离心10 min,收集沉淀。将得到的沉淀用适量蒸馏水复溶,用Sevag 试剂(氯仿与丁醇体积比4∶1)脱蛋白,用AB-8 型大孔树脂过滤脱脂脱色素,再用1.00×10⁴Da 透析袋透析后冷冻干燥得到粗多糖并命名为ECP。
将60 mg ECP 用6 mL 蒸馏水溶解并用0.45 μm滤膜过滤,使用DEAE-52 纤维素柱(16.0 mm×50.0 cm)分离。以蒸馏水和不同浓度的NaCl 水溶液(0.1 mol/L和0.3 mol/L)以0.75 mL/min 的流速洗脱[12]。在490 nm处通过苯酚-硫酸法监测分离组分。获得3 个组分,蒸发浓缩冷冻干燥后分别命名为ECP-1、ECP-2 和ECP-3以进一步纯化。将20 mg 冻干多糖粉末溶解在1 mL蒸馏水中,然后装入Sephadex G-200 凝胶柱(16.0 mm×50.0 cm),以0.25 mL/min 的流量用蒸馏水洗脱,并用苯酚-硫酸法监测。收集主要多糖组分,减压浓缩,冻干收集,用于结构和活性分析。
1.3 西瓜皮多糖结构表征
1.3.1 化学组成测定
总糖含量测定以葡萄糖为对照品,参考苯酚-硫酸法进行[13]。
蛋白质含量以牛血清白蛋白为对照品,参考考马斯亮蓝染色法进行[14]。
糖醛酸含量测定以半乳糖醛酸对照品,采用间羟基联苯法进行[15]。
1.3.2 相对分子质量的测定
称量ECP-1、ECP-2 和ECP-3 各1 mg 溶于1 mL超纯水中,0.22 μm 滤膜过滤。采用高效液相色谱仪和TSKgel G4000PWxL 色谱柱(7.8 mm×30 cm,10 μm)检测3 种多糖的相对分子质量分布。
色谱条件:示差折光检测器(reflective index detector,RID),检测温度35 ℃,进样量20 μL(1 mg/mL),流动相为超纯水,用0.6 mL/min 的流速进行洗脱分析。
将已知相对分子质量的葡聚糖T-10(1×104Da)、T-40(4×104Da)、T-70(7×104Da)、T-110(1.1×105Da)、T-500(5×105Da)、T-2000(2×106Da)作为标准品,建立标准曲线,根据保留时间-相对分子质量标准曲线计算3 种多糖的相对分子质量。
1.3.3 单糖组成测定
通过离子色谱对ECP-1、ECP-2 和ECP-3 的单糖组成进行测定[16]。将岩藻糖(Fuc)、鼠李糖(Rha)、阿拉伯糖(Ara)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、甘露糖(Man)、核糖(Rib)、半乳糖醛酸(GalA)和葡萄糖醛酸(GlcA)作为单糖对照品。分别将10 种单糖对照品加超纯水溶解,各吸取1 mL 混匀制得对照品混合溶液。将对照品混合溶液稀释至50 mg/L,过0.22 μm 滤膜后备用。
分别称取5 mg ECP-1、ECP-2 和ECP-3,加入1 mL三氟乙酸(2 mol/L),涡旋溶解后于110 ℃条件下密封反应2 h。反应完全后,通N2吹干,随后加入1 mL 甲醇溶液充分溶解后N2吹干,重复3 次以除尽反应体系中的三氟乙酸,最后得到ECP-1、ECP-2 和ECP-3 的降解产物。向降解产物中加入超纯水溶解并稀释至100 mg/L,依次过0.22 μm 滤膜及RP-10 活化柱,上样检测。
色谱条件:流动相A 为超纯水,流动相B 为NaOH 溶液,流动相C 为NaAC-NaOH 溶液,流速为0.45 mL/min,柱温30 ℃,色谱柱型号PA20(150 mm×3 mm),进样量1 mL。
通过与各种单糖对照品的保留时间进行比较,分析ECP-1、ECP-2 和ECP-3 的单糖组成,根据相应的峰面积,利用校正因子校正归一化法计算ECP-1、ECP-2和ECP-3 中每种单糖摩尔比例。
1.3.4 傅里叶变换红外光谱
分别称取1.0 mg 的ECP-1、ECP-2 和ECP-3 干燥多糖置于石英研钵,与红外级(IR 级)KBr 充分混合(质量比1∶120)并研磨均匀,使用液压机制备含有样品的薄片,使用傅里叶变换红外光谱扫描仪分析,扫描范围4 000~400 cm-1。
1.3.5 紫外全波长扫描
称取ECP-1、ECP-2 和ECP-3 干燥多糖溶于超纯水,配制质量浓度为0.1 mg/mL 的多糖溶液。以超纯水为参比校准基线,用紫外光谱仪(utraviolet-visible spectroscopy,UV-Vis)在波长200~400 nm 对多糖溶液进行扫描。
1.3.6 扫描电子显微镜
将少量的ECP-1、ECP-2 和ECP-3 干燥多糖,均匀平铺在导电胶上,真空喷镀仪(加速电压3.0 kV)在其表面喷一层导电膜,经扫描电子显微镜以不同放大倍数观察3 种多糖的表面微观结构。
1.3.7 刚果红实验
精确称取3 种多糖样品各5.0 mg,溶解于2 mL 蒸馏水中配制成2.5 mg/mL 的多糖溶液,同时配制浓度为80 μmol//L 刚果红溶液和浓度为1 mol/mL 的NaOH溶液。取洁净试管11 支,吸取2 mL 多糖溶液与2 mL刚果红溶液混匀,加入适量的NaOH 溶液,使各管内溶液中NaOH 的最终浓度依次为0、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mol/L。将各管溶液充分混匀,静置10 min,使用酶标仪在400~600 nm范围内进行扫描,测定在不同浓度的NaOH 溶液下混合液最大吸收波长的变化,并以NaOH 浓度为横坐标,最大吸收波长为纵坐标绘制曲线图。
1.3.8 热重分析
使用热重分析仪分析3 种多糖的热稳定性。称取3 种多糖样品各5.0 mg 于铝制样品坩锅内,将样品盘置于热重分析仪内进行测定。测定温度25~600 ℃,加热速率为20 ℃/min,得到样品TGA 曲线图。
1.4 西瓜皮多糖体外抗氧化活性
1.4.1 DPPH 自由基清除活性测定
配制0.1 mmol/L DPPH 溶液,取质量浓度分别为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mg/mL 的3 种多糖溶液100 μL 与100 μL DPPH 溶液混合摇匀,置于黑暗条件下反应30 min,在波长517 nm 处测其吸光度,记为A1,取100 μL 多糖样品溶液加入100 μL 无水乙醇,在波长517 nm 处测定吸光度,记为A2,取100 μL 蒸馏水加入100 μL DPPH 溶液,在波长517 nm 处测定吸光度,记为A3。以VC为阳性对照,DPPH自由基清除率(RDPPH,%)计算公式如下。
1.4.2 ABTS+自由基清除活性测定
配制7 mmol/L ABTS 溶液、2.45 mmol/L 过硫酸钾溶液,等体积混匀后室温避光反应12 h 以上,取适量混合液与无水乙醇混合稀释,使其在波长734 nm 处的吸光度为0.70±0.02,即得到ABTS 工作液。
取浓度分别为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mg/mL 的3 种多糖溶液各40 μL 加入4 mL ABTS 工作液,均匀混合后,30 ℃避光反应20 min,在734 nm 处检测其吸光度,记为A4。取40 μL 不同浓度各多糖溶液加入4 mL 蒸馏水,在734 nm 处测定吸光度,记为A5,取40 μL 蒸馏水加入4 mL ABTS 工作液,在734 nm 处测定吸光度,记为A6。以VC为阳性对照,ABTS+自由基清除率(RABTS,%)计算公式如下。
1.4.3 羟基自由基清除活性测定
取质量浓度分别为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mg/mL 的3 种多糖溶液1 mL,与1 mL FeSO4溶液(6 mmol/L)、1 mL H2O2溶液(6 mmol/L)混匀,室温下反应10 min,再加入1 mL 水杨酸溶液(6 mmol/L),37 ℃水浴30 min,测定510 nm 下吸光度,记为A7,用1 mL 蒸馏水代替水杨酸溶液测得吸光度,记为A8。用1 mL 蒸馏水代替多糖样品溶液测得吸光度,记为A9。以VC为阳性对照,羟基自由基清除率(ROH,%)计算公式如下。
1.5 数据处理
试验过程中产生的数据均采用SPSS 20.0 处理,组间数据比较采用t检验。统计结果采用平均数±标准差表示,P<0.05 表示组间差异显著。
2 结果与分析
2.1 基本成分
3 种西瓜皮多糖的基本成分大致相同,但仍有差异,鉴定结果如表1所示。
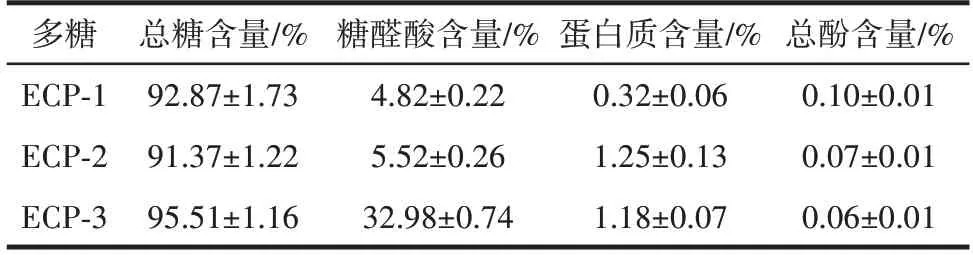
表1 基本化学成分测定结果Table 1 Results of basic chemical composition determination
由表1 可知,3 种多糖的总糖含量都在90%以上,蛋白质和总酚含量较低,表明纯化过程较为成功,多糖的纯度较高。糖醛酸含量表明3 种多糖都含有相应的糖醛酸,均为含有酸性基团的多糖,其中ECP-3 的糖醛酸含量最高。
2.2 相对分子质量的测定结果分析
相对分子质量的大小是影响生物活性的主要因素之一[17]。3 种多糖的HPLC 图谱如图1所示,由T 系列不同相对分子质量葡聚糖标准品绘制的标准曲线如图2所示。
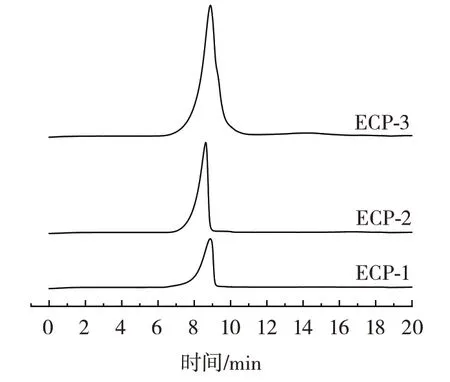
图1 3 种多糖的HPLC 图谱Fig.1 HPLC chromatograms of three polysaccharides
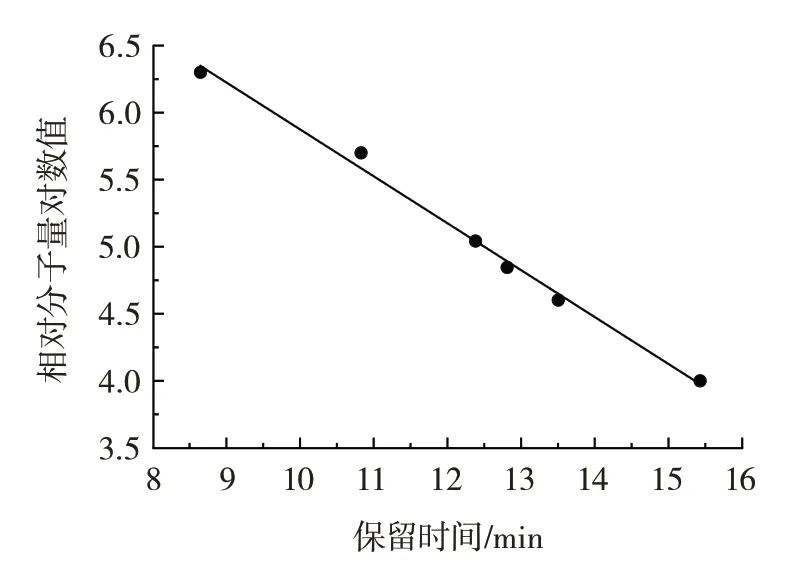
图2 T 系列葡聚糖标准曲线Fig.2 Standard curve of T series dextran
由图1 可知,3 种多糖的图谱均为单一对称均匀窄峰,表明多糖的组分较为均一[18]。由图2 得到回归方程为y=-0.349 9x+9.374 1(R2=0.993 9)。将出峰时间代入计算得出ECP-1、ECP-2 和ECP-3 的相对分子质量分别为1.69×106、1.67×106Da 和1.94×106Da,与许多植物多糖相似[19-21],都属于水溶性大分子多糖。
2.3 单糖组成
将3 种多糖的离子色谱图与标准单糖的离子色谱图对比分析,结果见图3。
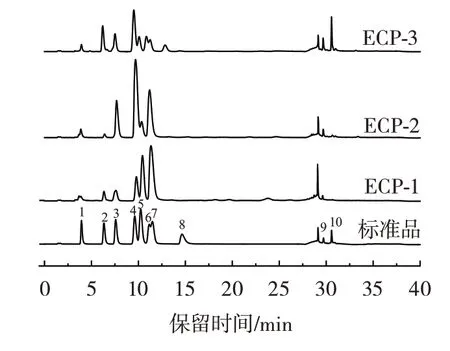
图3 离子色谱Fig.3 Ion chromatograms
根据图3 并对照标准单糖的出峰面积以及校正因子进行面积归一法计算得出[22],ECP-1 的单糖组成为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、半乳糖醛酸的摩尔比为0.26∶0.22∶0.54∶0.65∶1.00∶4.01∶0.40;ECP-2 的单糖组成为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、半乳糖醛酸的摩尔比为3.15∶1.02∶12.47∶23.58∶1.00∶25.70∶7.16;ECP-3 的单糖组成为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、核糖、半乳糖醛酸、葡萄糖醛酸的摩尔比为0.88∶2.94∶2.30∶3.72∶1.00∶2.11∶1.38∶1.54∶5.04∶6.85。ECP-1 和ECP-2 的单糖组成较为相似,主要由阿拉伯糖、半乳糖、葡萄糖和甘露糖组成,ECP-3 则含有较多的糖醛酸。
2.4 傅里叶变换红外光谱分析
红外光谱是考察多糖主要官能团的有效方法[23]。3 种多糖的傅里叶变换红外光谱图见图4。
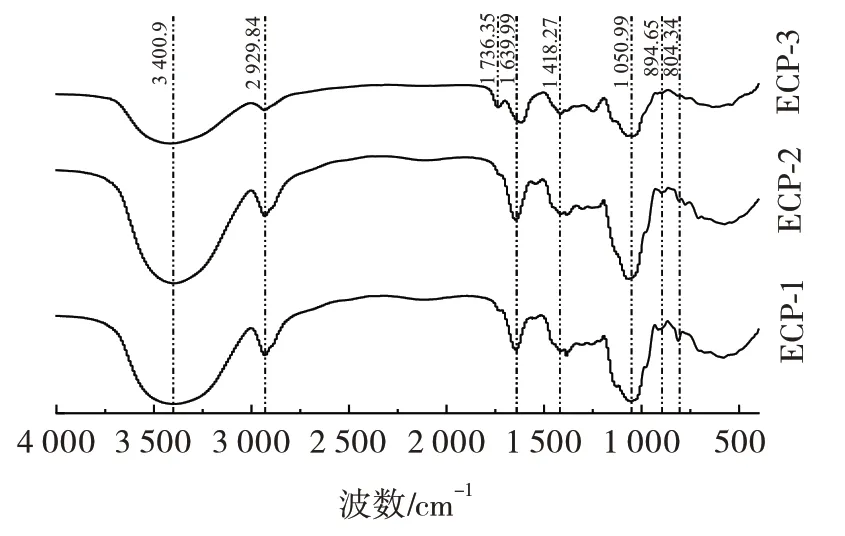
图4 3 种多糖的傅里叶变换红外光谱图Fig.4 Fourier transform infrared spectra of three polysaccharides
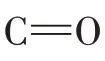
2.5 紫外光谱分析
在现有对多糖的研究中,多糖的紫外吸收峰在200 nm,此外,常用光谱中260 nm 和280 nm 处的吸收峰来判定是否存在核酸和蛋白质,从而检测多糖的纯度[25]。3 种多糖的紫外光谱图见图5。
图5 3 种多糖的紫外光谱Fig.5 UV spectrum of three polysaccharides
由图5 可知,3 种多糖在260 nm 和280 nm 处均无明显的吸收峰,可能含有微量或不含蛋白质和核酸,表明3 种多糖的纯度较高。
2.6 扫描电镜分析
扫描电镜在各个领域都被用来观测物质微观形态和结构,使用不同放大倍数的SEM 扫描观察3 种多糖的微观表面形态。图6 为ECP-1、ECP-2 和ECP-3 在500 和3 000 放大倍数下的扫描电镜图。

图6 3 种多糖的电镜图Fig.6 SEM images of three polysaccharides
由图6 可知,3 种多糖的表面特质大致相似,均呈不规则碎屑状,表面粗糙无孔洞且相互连接,存在部分球状和棒状颗粒结构且ECP-2 较为明显,研究表明多糖冻干样品大多呈片层状连接,但仍存在差异,这可能与多糖分子结构以及相互作用力有关[26]。
2.7 刚果红实验分析
刚果红作为一种酸性染料,与具有三股螺旋的多糖反应后会形成一种络合物,使其最大吸收波长发生红移,但NaOH 的浓度超过一定范围后,络合物发生水解,最大吸收波长又会出现下降[27]。刚果红染色分析结果见图7。
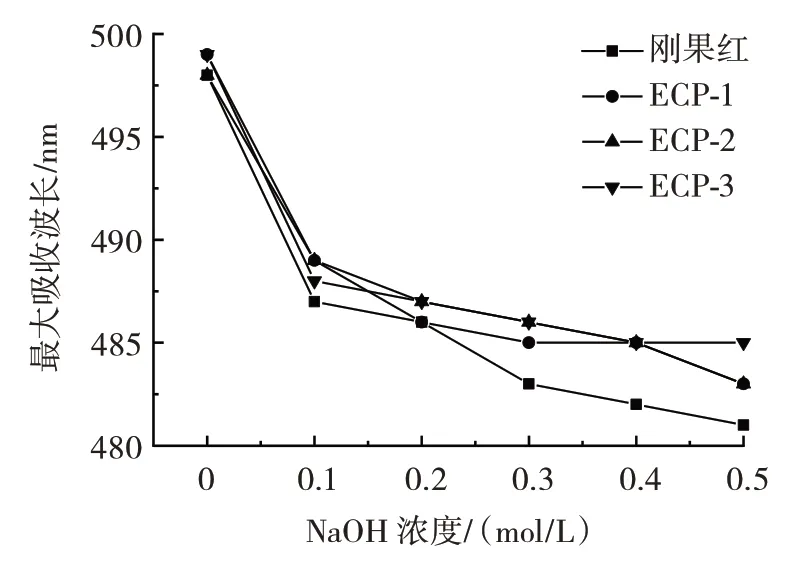
图7 刚果红染色分析Fig.7 Maximum absorption wavelength of Congo red staining
由图7 可知,3 种多糖与刚果红溶液混合后,与刚果红溶液的最大吸收波长呈现相同的变化趋势,最大吸收波长(λmax)随着NaOH 浓度的增加而减小,λmax没有出现明显的红移。因此,ECP-1、ECP-2 和ECP-3 中可能不存在三股螺旋结构。
2.8 热稳定性分析
图8 为ECP-1、ECP-2 和ECP-3 在25~600 ℃的热重图。
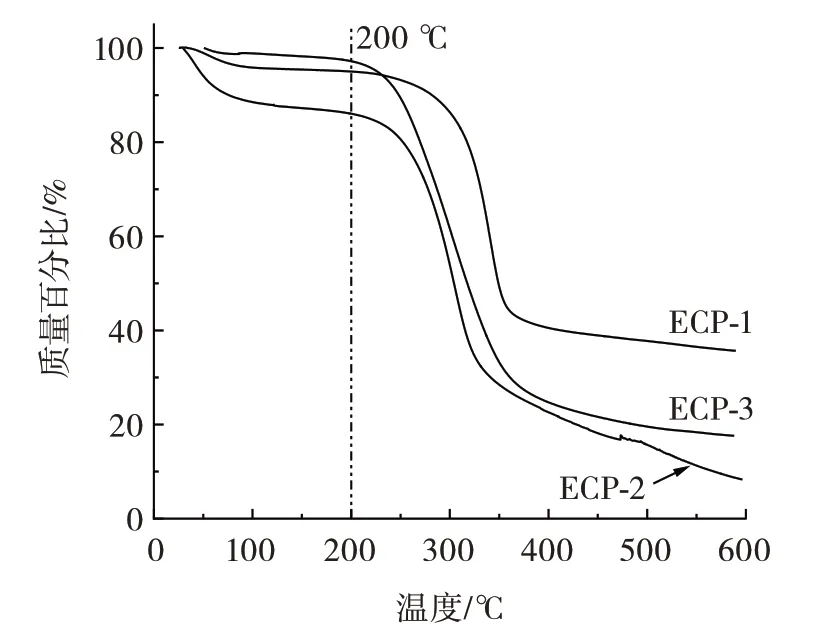
图8 3 种多糖的热重Fig.8 Thermogravimetric curves of three polysaccharides
由图8 可知,3 种多糖符合大多数多糖的热稳定性,具有相似的温度变化曲线,大致可分为3 个阶段,第一阶段,在35 ℃左右,多糖开始轻微失重,此时可能为多糖中吸附的水分和提取分离纯化过程残留的一些有机挥发成分;第二阶段,温度变化范围为200~450 ℃,此阶段失重最为明显,表明多糖在该温度范围内出现了分解反应,此阶段多糖的结构已经被破坏,同时也说明多糖在200 ℃以下的环境中具有良好的热稳定性;第三阶段,温度变化范围是450~600 ℃,此阶段样品的质量变化趋于平缓,为缓慢碳化阶段,大部分多糖样品在此阶段内分解为灰分和无机成分,最后剩下不分解、不氧化的玻纤成分。TGA 结果表明,3 种多糖在200 ℃以下都具有良好的热稳定性。
2.9 DPPH 自由基清除活性
3 种多糖的DPPH·清除率见图9。
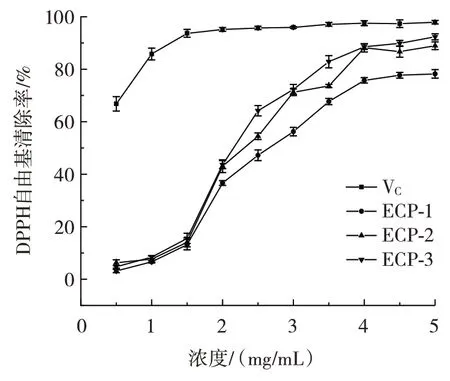
图9 3 种多糖的DPPH·清除率Fig.9 Clearance of DPPH·by three polysaccharides
由图9 可知,ECP-1、ECP-2 和ECP-3 对于DPPH·的EC50值分别为2.35、2.30 mg/mL 和2.17 mg/mL。ECP-3 的DPPH·清除能力强于另外两种酸性多糖,同时随着多糖浓度的增加,对DPPH·的清除能力逐渐增强,呈现出剂量依赖性。多糖的DPPH·清除能力与位于支链的阿拉伯糖和半乳糖含量有关,推测ECP-3 的支链含有较多的阿拉伯糖和半乳糖。
2.10 ABTS+自由基清除活性
3 种多糖的ABTS+·清除率如图10所示。
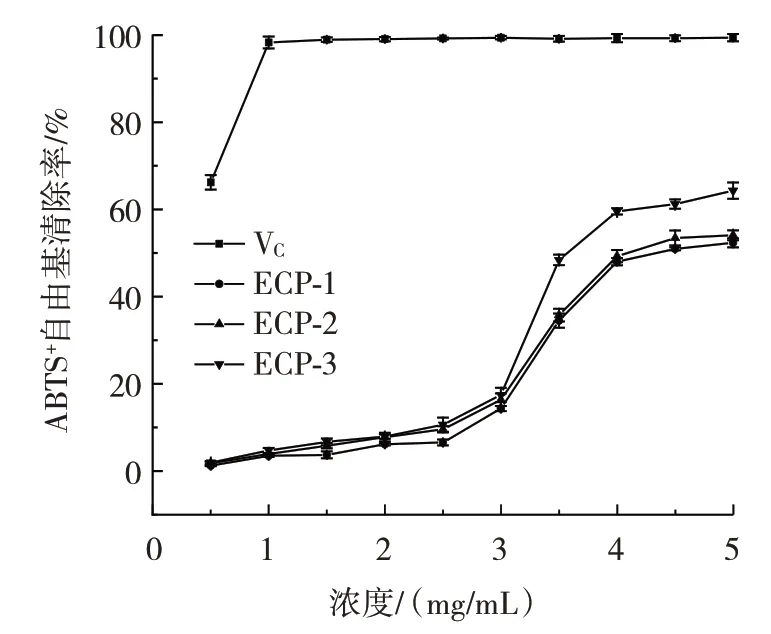
图10 3 种多糖的ABTS+·清除率Fig.10 Clearance of ABTS+·by three polysaccharides
由图10 可知,ECP-1、ECP-2 和ECP-3 ABTS+·清除率的EC50值分别为4.42、4.22 mg/mL 和3.65 mg/mL。结果表明ECP-3 的ABTS+·清除能力虽然强于另外两种酸性多糖,但差别不大,同时随着3 种多糖浓度的增加,ABTS+·清除能力逐渐增强,呈现出剂量依赖性。多糖对于ABTS+·的清除能力往往与多糖分子量大小、溶解度等因素有关,3 种多糖同为大分子多糖,具有相似的物理性质,可能是导致其对ABTS+·清除能力没有明显差异的原因。
2.11 羟基自由基清除能力
3 种多糖的羟基自由基清除率见图11。
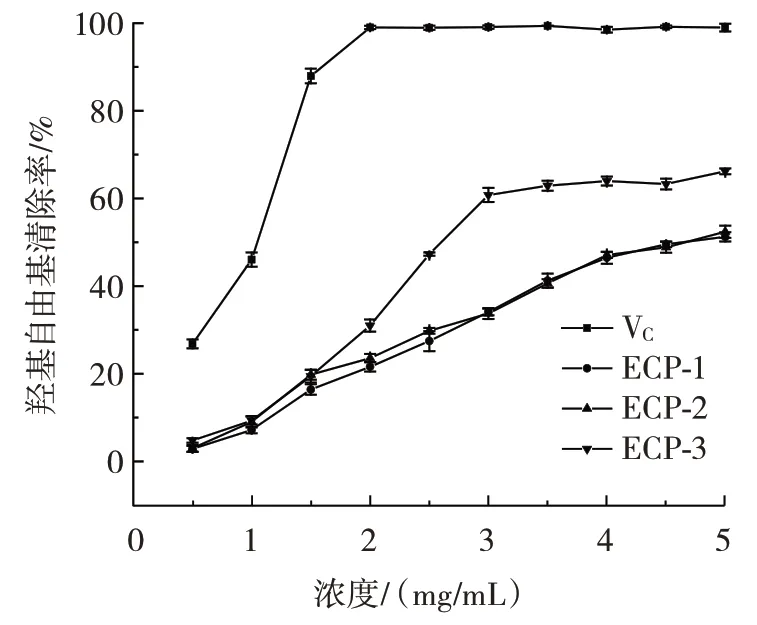
图11 3 种多糖对·OH 的清除率Fig.11 Clearance of·OH by three polysaccharides
由图11 可知,ECP-1、ECP-2 和ECP-3 的羟基自由基清除率的EC50值分别为4.97、4.81 mg/mL 和2.67 mg/mL。结果表明ECP-3 的羟基自由基清除能力强于另外两种酸性多糖,同时随着3 种多糖浓度的增加,羟基自由基清除能力逐渐增强,呈现出剂量依赖性。造成3 种多糖对羟基自由基清除能力差异的原因可能与每种多糖的糖醛酸含量有关,含有更多糖醛酸的酸性多糖抗氧化活性更高。
3 结论
本研究采用DEAE-52 纤维素及Sephadex G-200柱从西瓜皮中分离纯化得到ECP-1、ECP-2 和ECP-3 3种组分,并利用FT-IR、UV-Vis、SEM、刚果红实验和TGA 对其结构进行表征,HGLP 结合离子色谱法明确了其单糖组成。研究表明,ECP-1、ECP-2 和ECP-3 的相对分子质量分别为1.69×106、1.67×106Da 和1.94×106Da;ECP-1 主要由葡萄糖和甘露糖组成,ECP-2 主要由阿拉伯糖、半乳糖和甘露糖组成,ECP-3 则含有丰富的半乳糖醛酸及葡萄糖醛酸;FT-IR 分析显示ECP-1、ECP-2 和ECP-3 既存在β-糖苷键,又存在α-糖苷键,且ECP-3 具有—COOH;扫描电子显微镜观察发现,3 种多糖具有相似的外观;3 种多糖均不含三股螺旋结构,同时在200 ℃以下具有良好的热稳定性;抗氧化活性试验显示ECP-3 相比另外两种酸性多糖具有较好的抗氧化活性。然而,多糖的抗氧化性不仅仅是单一因素的影响,而是多种因素相互作用的结果,因此需要进一步探究它们之间的相关性。由于其可能的抗氧化特性,分离纯化提取的酸性西瓜皮多糖可以作为天然抗氧化剂广泛应用于功能食品领域。

