体外模拟胃肠消化过程中黑果腺肋花楸果提取物活性成分及其抗氧化作用变化规律
王旭辉,钟方丽,王晓林,王云,封晴
(吉林化工学院化学与制药工程学院,吉林吉林 132022)
黑果腺肋花楸(Aroniamelanocarpa)简称“黑果”,是一种原产于北美东部的灌木,其果实富含原花青素、花青素、黄酮、酚酸等多种活性成分[1-2]。2018年,国家卫生健康委员会批准黑果果实作为新食品原料使用[3]。研究表明,原花青素具有抗氧化、抗菌、降糖、降脂等功能[4-5];花青素具有预防糖尿病及高血压、抗肿瘤、抗氧化等作用[4,6];多酚具有多种生理功能,如抗辐射、抑菌消炎、去脂降糖、保护心血管、抗肿瘤、抗氧化和改善肠道微生物群等[7-8];黄酮类化合物已经被证实具有良好抗氧化性、抗炎、抗癌、抗肿瘤、抗病毒、抗菌、降血压、降血糖、预防和治疗消化系统疾病及保护心血管等多种功效[9-10]。
生物活性物质必须具备一定生物利用度,才能对人体产生有益的作用[11]。研究表明,茶叶中的多酚类物质被吸收之前,易在胃肠道中发生降解或结构变化,其生物活性随之改变,尤其是抗氧化活性在消化前后差异巨大[12]。因体外模拟胃肠消化具有快速、廉价、不受伦理限制、重复性高等优势,在食品和营养科学的许多领域被广泛应用[4]。国内外学者已经对葡萄酒、果汁、蓝莓皮渣等多种食品及其副产品模拟消化过程中活性成分及其抗氧化活性变化规律进行了研究[13-15]。目前对黑果的研究主要集中在活性成分的提取纯化、含量测定及其提取物的体外活性上,有关黑果活性成分和抗氧化活性在人体胃肠消化过程中变化规律的研究鲜有报道。本研究旨在研究黑果提取物在体外模拟口腔、胃、肠消化过程中,多酚、黄酮、原花青素及花青素含量变化,以及其对羟基自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2-联氨-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]阳离子自由基、超氧阴离子自由基的清除能力,从而评价其抗氧化能力的变化规律,以期为黑果活性成分在食品领域的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
α-淀粉酶(分析纯,酶活力≥4 000 U/g)、胃蛋白酶(分析纯,酶活力3 000~3 500 U/g)、胰蛋白酶(分析纯,酶活力>250 U/mg)、ABTS(分析纯,含量≥98%):上海宝曼生物科技有限公司;DPPH(纯度>97%):东京化成工业株式会社;黑果:吉林省黑果花楸农业科技开发有限责任公司,经吉林化工学院薛健飞博士鉴定为蔷薇科腺肋花楸属植物黑果腺肋花楸[Aroniamelanocarpa(Michx.)Elliott]的果实。
1.2 仪器与设备
SHA-B 水浴恒温振荡器:金坛市科析仪器有限公司;FA3204B 电子分析天平:上海天美天平仪器有限公司;PHS-3CW 型pH 计:上海般特仪器制造有限公司;TU-1950 紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 样品制备
1.3.1.1 黑果提取物的制备
将黑果置于60 ℃干燥6~8 h,粉碎后过80 目筛,得黑果干粉。称取黑果干粉25 g,按液料比55∶1(mL/g)加入60%乙醇溶液,80 ℃提取2.5 h,采用同体积溶剂连续提取2 次,过滤,合并滤液,减压浓缩至稠膏,60 ℃真空干燥,恒重后即得黑果提取物。
1.3.1.2 模拟溶液的制备
唾液、胃液:按照封易成等[16]的方法进行制备。
肠液:准确称取KH2PO46.8 g,加蒸馏水500 mL溶解,用0.4% NaOH 溶液调节pH 值至6.8;另准确称取胰蛋白酶10 g,加蒸馏水适量使之溶解。将两者混合,加蒸馏水稀释至1 000 mL,得模拟肠液[17]。
1.3.1.3 模拟消化过程
口腔:取干燥的黑果提取物粉末准确称取1.5 g,加入100 mL 模拟唾液,按照封易成等[16]的方法进行处理,得口腔消化液,-20 ℃以下保存。
胃:重复口腔消化过程,水浴振荡后,用3 mol/L HCl溶液调节pH 值至1.5,加入100 mL 模拟胃液,按照封易成等[16]的方法处理后,其中的25% 于70 ℃水浴灭酶,其余未灭酶,得胃消化液,-20 ℃以下保存。
肠:重复口腔和胃消化过程,按照封易成等[16]的方法进行处理,得肠消化液,-20 ℃以下保存。
肠透析:重复口腔和胃消化过程,取未灭酶的模拟胃消化液30 mL 转移到30 cm 透析袋中,透析袋置于100 mL磷酸盐缓冲液中,37 ℃水浴振荡4 h。一半70 ℃水浴灭酶,一半未灭酶,得肠透析液,-20 ℃以下保存[16]。
1.3.2 生物活性成分的含量测定
黑果提取物溶液的配制:称取黑果提取物粉末0.25 g,于100 mL 容量瓶中,加水溶解并定容,摇匀。
1.3.2.1 总黄酮含量测定
以儿茶素为对照品,线性回归方程y=0.027 5x+0.049 8,R²=0.999 5,儿茶素在1.88~16.92 μg/mL 范围内与吸光度线性关系良好。取样品液适量,于25 mL容量瓶中,加5% NaNO2溶液0.3 mL,摇匀,静置6 min,加10% Al(NO)3溶液0.3 mL,摇匀,静置6 min,加入4% NaOH 溶液2 mL,50%甲醇定容,摇匀,静置15 min,以未显色的样品液为空白,按照紫外可见分光光度法,于500 nm 波长处测定吸光度,计算总黄酮的含量。
1.3.2.2 多酚含量测定
以没食子酸为对照品,线性回归方程y=0.086 28x+0.0291 9,R2=0.998 9。吸取样品液适量,置于25 mL 容量瓶中,加1.0 mL 的福林酚试剂,加入10 mL 蒸馏水,摇匀后加入14%的Na2CO3溶液稀释定容,摇匀,45 ℃水浴保温15 min,以未显色的样品液为空白,按照紫外可见分光光度法,于760 nm 波长处测定吸光度,计算多酚的含量。
以原花青素为对照品,线性回归方程y=2.844 6x+0.014 6,R2=0.999 0,原花青素在0.08~0.32 mg/mL 范围内与吸光度线性关系良好。吸取样品液适量,置于具塞试管中,将正丁醇与盐酸按95∶5 的体积比混合后,取9 mL 加入试管中,再加入0.3 mL 硫酸铁铵溶液,混匀,100 ℃沸水浴40 min,迅速冷却,以未显色的样品液为空白,按照紫外可见分光光度法,于548 nm 波长处测定吸光度,计算原花青素的含量。
1.3.2.4 花青素含量测定
以矢车菊素为对照品,线性回归方程y=0.039 3x-0.004 6,R2=0.999 4,矢车菊素在2.7~18.9 μg/mL 范围内与吸光度线性关系良好。吸取样品液适量,置于10 mL 容量瓶中,加入0.1 mol/L 柠檬酸水溶液定容。空白组在定容前加入0.5 mL 的10% Na2SO3溶液。按照紫外可见分光光度法,于510 nm 波长处测定吸光度,计算花青素的含量。
1.3.3 体外活性试验
1.3.3.1 羟基自由基的清除能力测定
分别吸取各消化液及黑果提取物溶液、维生素C溶液6 种样品适量,作为供试品溶液。
现阶段,基层畜牧兽医动物防疫工作主要基层畜牧兽医动物防疫机制不健全、畜牧兽医观念滞后、基层畜牧兽医动物防疫专业人才缺乏等问题。
取1.5 mmol/L 邻二氮菲无水乙醇溶液1 mL 于10 mL 比色管中,依次加入磷酸盐缓冲液(pH7.4)2 mL和不同体积的6 种供试品溶液,0.75 mmol/L 硫酸亚铁溶液1 mL,用蒸馏水补至6 mL,充分混合,加1 mL 0.1% H2O2溶液,37 ℃恒温反应60 min,于536 nm 处测其吸光度(As)。以1 mL 蒸馏水分别代替供试品溶液和0.1% H2O2溶液,同波长处测其吸光度(Ab)。以蒸馏水代替供试品溶液,同波长处测其吸光度(Ap)。羟基自由基清除率(X,%)的计算公式如下[[16]。
以羟基自由基清除率为纵坐标,消耗体积为横坐标绘制曲线,得出回归方程,计算各供试品的IC50值(清除率为50%时所消耗的供试品体积),进行比较。
1.3.3.2 DPPH 自由基的清除能力测定
取0.2 mmol/L DPPH 溶液1 mL 于比色管中,分别加入不同体积的供试品溶液,按照封易成等[16]的方法,在517 nm 波长处分别测定加入供试品溶液的吸光度(Ai)、蒸馏水代替供试品溶液的吸光度(A0)和蒸馏水代替DPPH 溶液的吸光度(Aj)。DPPH 自由基清除率(Y,%)的计算公式如下。
以DPPH 自由基清除率为纵坐标,消耗体积为横坐标绘制曲线,得出回归方程,计算各供试品的IC50值(清除率为50%时所消耗的供试品体积)进行比较。
1.3.3.3 ABTS+自由基的清除能力测定
吸取不同体积的供试品溶液于比色管中,用蒸馏水补至1 mL,分别加入3.9 mL 工作液(7 mmo/L 的ABTS 和2.45 mmol/L 过硫酸钾溶液体积比1∶1 配制混合溶液),23 ℃暗处孵育12~16 h,得ABTS+自由基基液,蒸馏水稀释基液(40~50 倍)至其在波长734 nm 处吸光度为0.700±0.005(A空白)得工作液。充分混合均匀后,23 ℃暗处孵育6 min,蒸馏水作空白对照,于734 nm 波长处测其吸光度A[16]。ABTS+自由基清除率(Z,%)的计算公式如下。
以ABTS+自由基清除率为纵坐标,消耗体积为横坐标绘制曲线,得出回归方程,计算各供试品的IC50值(清除率为50%时所消耗的供试品体积),进行结果比较。
1.3.3.4 超氧阴离子自由基的清除能力测定
取4.5 mL Tris-HCl 缓冲溶液(50 mmol/L,pH8.21)于比色管中,25 ℃水浴预热20 min,分别加入不同体积的供试品溶液和0.5 mL 邻苯三酚溶液(30 mmol/L),用蒸馏水补至8 mL,混匀后于25 ℃水浴反应30 min,加入0.5 mL HCl(0.5 mmol/L)终止反应,以Tris-HCl 缓冲溶液为空白对照,于420 nm 波长处测其吸光度A1。以蒸馏水代替邻苯三酚溶液(30 mmol/L),同波长处测其吸光度A2,以蒸馏水代替供试品溶液,同波长处测其吸光度A3[18]。超氧阴离子自由基清除率(B,%)的计算公式如下。
以超氧阴离子自由基清除率为纵坐标,消耗体积为横坐标绘制曲线,得出回归方程,计算各供试品的IC50值(清除率为50% 时所消耗的供试品体积)进行比较。
1.4 数据处理
试验重复3 次,采用WPS 和Origin 8 软件进行数据处理和作图,结果采用平均值±标准差表示。
2 结果与分析
2.1 生物活性成分的含量测定结果与分析
表1 为黑果提取物溶液及各模拟消化液中活性成分含量检测结果。
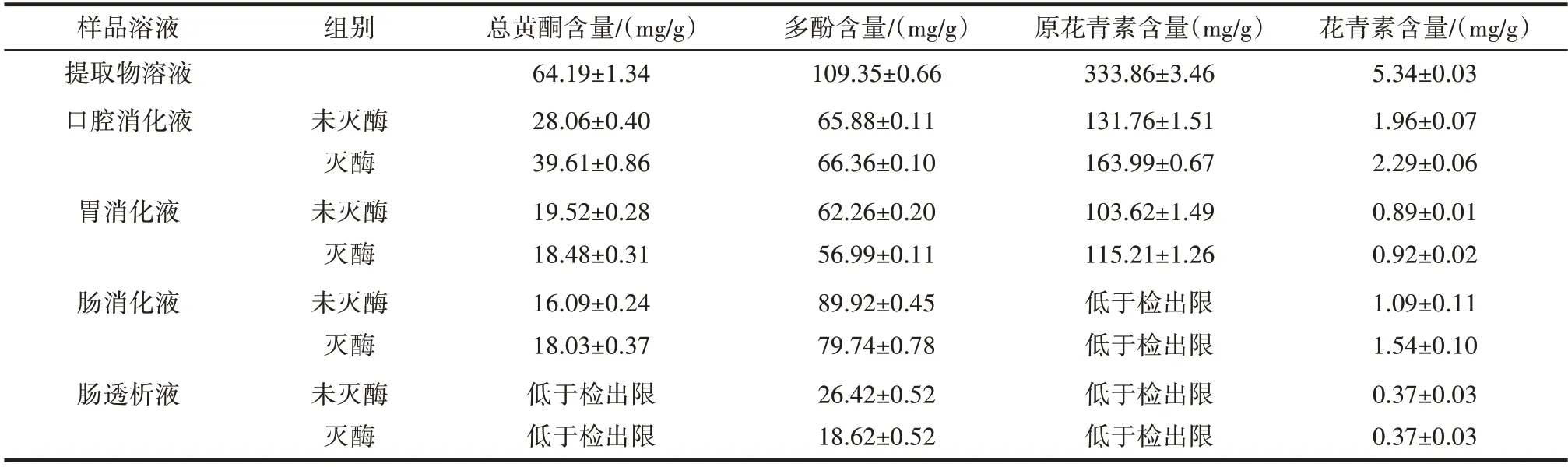
表1 活性成分含量Table 1 Content of active components
由表1 可知,黑果提取物中活性成分含量从高到低依次为原花青素、多酚、总黄酮、花青素。各消化液中,花青素含量在口腔消化液中最多,肠消化液次之,胃消化液和肠透析液中较少。原花青素在口腔消化液中最多,胃消化液中较少,肠消化液和肠透析液中低于检出限。多酚在肠消化液中含量最高,口腔和胃消化液中差距不大,肠透析液中明显减少。总黄酮在口腔消化液中含量最高,胃消化液、肠消化液中逐渐减少,肠透析液中低于检出限。
经过模拟消化后,花青素含量下降明显,肠消化后略有升高,但依然明显低于提取物溶液中含量。现有研究表明,花青素主要在胃和小肠被吸收[19]。花青素在经过小肠时发生分解代谢。所以肠透析液中花青素含量大幅下降[20]。在口腔和胃消化过程中,原花青素含量逐渐下降,在肠消化液和肠透析液中均未检出,此前刘楚[21]通过定量测得体外消化后的山竹果皮原花青素提取物中原花青素含量显著降低。这可能是由于肠道消化的化学环境呈弱碱性,而黄酮类物质对碱性条件比较敏感,容易在碱性条件下降解为其他化合物,导致原花青素在肠消化液中消失现象的出现[22]。模拟消化过程中,多酚含量在口腔消化、胃消化过程中均减少,而肠消化过程中有所增加,可能是由于多酚与蛋白质之间的共价键在胰蛋白酶作用下发生变化,产生了更多的自由酚[23],也可能是肠道碱性环境、酶的作用下,使得与多糖以酯键的形式形成的糖苷发生水解释放,从而在肠消化过程中多酚含量升高[24],肠透析液中含量更少,这可能是酚类化合物和其他成分之间的相互作用形成了低溶解度或大分子量的络合物,而这些络合物不能穿过透析膜。模拟消化过程中,总黄酮含量整体呈下降趋势,最后在肠透析液中低于检出限。可能在小肠消化阶段,胰蛋白酶使黄酮类非极性多酚形成水溶性的混合胶束,无法透过透析袋游离到肠透析液中[25]。
因为研究终止消化反应的方式为灭酶,所以进行了灭酶与未灭酶的对比试验,以评价灭酶对生物活性物质的潜在影响。灭酶前和灭酶后活性物质含量变化结果没有一致规律,可能是不同的活性物质在不同消化过程中,被完全消化所需的时间和试验设定的消化时间有差异,这一结果值得更深入的研究探讨。
2.2 体外活性试验结果与分析
2.2.1 羟基自由基的清除能力测定结果
不同消化液对羟基自由基清除能力结果见图1。
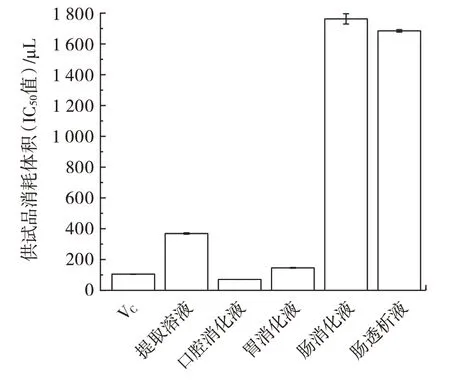
图1 羟基自由基清除能力Fig.1 Hydroxyl radical scavenging capacity
由图1 可知,供试品溶液消耗体积反映其清除羟基自由基的能力,其中肠消化液(1 762 μL)与肠透析液(1 685 μL)羟基自由基清除能力相近且较弱,口腔消化液羟基自由基清除能力最强(71 μL)且高于维生素C(105 μL)。结合图1 与表1 可以看出,各消化液清除羟基自由基的能力与原花青素和总黄酮的含量具有正向相关性,口腔消化液中总黄酮和原花青素含量较高,口腔消化液也呈现了最强的清除羟基自由基能力。黑果提取物溶液对羟基自由基的清除能力没有呈现与消化液相同的含量相关性,消化过程可能改变活性成分对羟基自由基的清除能力。胡佳慧等[26]的研究表明玉米须总黄酮具有较强的清除羟基自由基和DPPH 自由基的能力。王彦平等[27]研究表明葡萄皮渣原花青素对羟基自由基清除能力显著优于维生素C。
2.2.2 DPPH 自由基的清除能力测定结果
不同消化液对DPPH 自由基清除能力结果见图2。
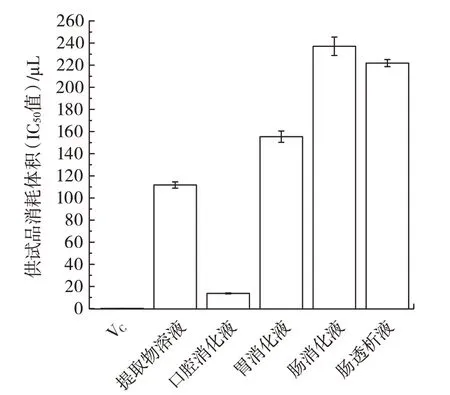
图2 DPPH 自由基清除能力Fig.2 DPPH radical scavenging capacity
由图2 可知,供试品溶液消耗体积反映其清除DPPH 自由基的能力,各消化液DPPH 自由基清除能力与羟基自由基清除能力呈现的规律相近,同样与原花青素和总黄酮的含量具有正向相关性。肠消化液(237.1 μL)与肠透析液(221.9 μL)DPPH·清除能力相近且较弱,口腔消化液DPPH·清除能力最强(13.7 μL),各消化液均弱于维生素C 对照(0.12 μL)。DPPH 自由基作为一种较为稳定的自由基,被广泛应用于抗氧化活性评价[28]。张欣[29]考察黑果原花青素对DPPH 自由基的清除能力,以维生素C 作对照。结果表明在一定浓度范围内原花青素对DPPH 自由基的清除能力强于维生素C。滕飞[30]研究表明黑果原花青素清除DPPH自由基能力强于维生素C。结合表1 可知,口腔消化液原花青素和总黄酮含量较高,所以口腔消化液清除DPPH 自由基的能力最强,两组结果相一致。
2.2.3 ABTS+自由基的清除能力测定结果
不同消化液对ABTS+自由基清除能力结果见图3。

图3 ABTS+自由基清除能力Fig.3 ABTS+radical scavenging capacity
由图3 可知,各消化液对ABTS+自由基清除能力均弱于维生素C(0.1 μL),其中口腔消化液(5.4 μL)清除ABTS+·能力最强,肠透析液(93.1 μL)的效果最差。ABTS 是一种水溶性的自由基引发剂,可用来评价天然产物的抗氧化能力。口腔消化液中活性成分总含量最高,模拟唾液为弱酸性条件,模拟胃液为强酸性条件,酸性条件会提高对ABTS+自由基的清除能力,并且酸性环境有利于促进抗氧化物质的释放,而弱碱性环境下,抗氧化物质可能会发生降解。肠消化液清除ABTS+自由基的能力强于肠透析液,可能与肠消化液中多酚含量高于肠透析液有关[16]。
2.2.4 超氧阴离子自由基的清除能力测定结果
模拟胃肠消化过程中,仅胃消化液表现出了消耗体积与超氧阴离子自由基清除率呈线性关系,其清除率为50%时所消耗的体积为1 616.66 μL,远大于维生素C 的15.45 μL。而黑果提取物溶液及其他消化液加入量为3 000 μL 时,超氧阴离子自由基清除率仍未达到50%,且样品消耗体积与超氧阴离子自由基清除率之间不呈线性关系。胃消化液表现出的超氧阴离子自由基清除能力可能与胃部的酸性环境有关,考虑利用超氧阴离子自由基清除率评价抗氧化能力不适用于黑果提取物溶液及其模拟消化液,相关内容有待进一步研究。
3 结论
本试验以黑果为原料,通过体外模拟研究其提取物在胃肠消化过程中活性成分和抗氧化作用变化规律,结果表明,模拟消化过程中黑果各活性成分变化趋势不尽相同,模拟消化液清除羟基自由基、DPPH 自由基的变化趋势相似,而清除ABTS+自由基能力的结果略有不同,清除超氧阴离子自由基的能力有待进一步研究。黑果提取物模拟消化产物具有较好的抗氧化活性。
样品抗氧化活性与部分活性成分含量有一定的相关性,模拟消化液对羟基自由基、DPPH 自由基的清除能力变化规律与总黄酮和原花青素含量呈正向相关性。模拟肠消化液对ABTS+自由基的清除能力可能与多酚含量相关。口腔消化液中各有效活性成分含量没有黑果提取物溶液高,却表现出了较提取物溶液更好的抗氧化活性,消化过程中活性成分的抗氧化能力可能得到了提升,研究消化过程对抗氧化活性的影响具有一定应用价值。
本研究通过体外模拟胃肠消化,分析黑果提取物的总黄酮、多酚、原花青素及花青素含量以及抗氧化活性的变化规律,反映黑果在人体内代谢情况,为今后黑果在食品领域的开发利用提供理论依据和数据基础。

