微生物源溶菌酶的抑菌及抗炎活性
司奇,胡雨,戴静,王珍珍,沙如意,毛建卫
(浙江科技学院生物与化学工程学院,浙江省农业生物资源生化制造协同创新中心,浙江省农产品化学与生物加工技术重点实验室,浙江杭州 310023)
溶菌酶(lysozyme)又称胞壁质酶(muramidase),广泛存在于自然界,具有抗病毒、抗菌、镇痛、消肿、加速组织修复等功能,因其具有生物相容性和对组织无刺激性、无毒性的特点,已被制成一种性质优良、可杀伤病原微生物而不破坏机体的酶制剂,广泛应用于医疗[1-2]、食品[3-4]、饲料[5-7]、日化[8-9]及生物研究[10-12]中。溶菌酶主要通过催化细菌细胞壁肽聚糖N-乙酰氨基葡糖和N-乙酰胞壁酸之间的β-1,4 糖苷键的水解[13],造成肽聚糖骨架结构断裂,使细菌的细胞壁受损最终破裂死亡。而不同细菌细胞壁的结构具有差异性,造成溶菌酶对不同菌种的抑菌活性具有差异,溶菌酶可与带负电荷的病毒蛋白相互结合,与DNA、RNA、脱辅基蛋白形成复盐[14],从而使病毒失去活力。
目前,溶菌酶被认为是一种安全的食品添加剂,许多国家和组织批准其作为食品防腐剂或保鲜剂使用,广泛应用于水产品[15-16]、肉制品[17]、果酒[18]及乳制品[19]等的防腐。国内外对溶菌酶的需求量不断增加,目前商业化溶菌酶的主要来源为蛋清提取和微生物源溶菌酶。近年来,国内外对溶菌酶的结构及理化性质研究日益增多,而微生物源溶菌酶因其较高的提取率、广泛的抑菌谱、保护动物肠道屏障受到研究人员越来越多的重视。对于微生物源溶菌酶的活性研究,多数报道只是偏重于微生物源溶菌酶的抑菌特性,较少关注其他活性(如抗炎、抗肿瘤、增强免疫力等)。研究微生物源溶菌酶的抑菌和抗炎双重特性,可以为其在防腐或保鲜等应用方案提供重要参考。本研究以微生物源溶菌酶为研究对象,评价其抑菌活性及抗炎活性,以期为其应用开发提供理论基础。
1 材料与方法
1.1 材料与试剂
微生物源溶菌酶(活力1 000 U/mg):浙江爱杰斯生物科技有限公司;大肠杆菌(Escherichiacoli)CMCC 44102、枯草芽孢杆菌(Bacillussubtilis)CMCC 63501、金黄色葡萄球菌(Staphylococcusaureus)CMCC 26001、黑曲霉(AspergillusNiger)CMCC 98003:北京百欧博伟生物技术有限公司;沙门氏菌(Salmonellasp.)ATCC 13311、酿酒酵母(Saccharomycescerevisiae)CICC 1012、单增李斯特菌(Listeriamonocytogenes)ATCC 19115、产黄青霉(Penicilliumflavum)AS3.546、保加利亚乳杆菌(Lactobacillusbulgaricus)CICC 6045、嗜热链球菌(Streptococcusthermophilus)ATCC 14485、酪丁酸梭菌(Clostridiumbutyricum)ATCC 25755:上海宝藏生物技术中心;耐热芽孢杆菌(Bacillusthermophilus)CICC 21144、乳酸乳球菌乳亚种(Lactococcuslactissubsp.lactis)CICC 20209、根霉(Rhizopusp.)CICC 40019:中国工业微生物菌种保藏管理中心;酵母浸粉、胰蛋白胨、蛋白胨、牛肉膏:北京奥博星生物技术有限责任公司;氯化钠(分析纯)、可溶性淀粉:国药集团化学试剂有限公司;琼脂粉:青岛海博生物技术有限公司;葡萄糖:江苏强盛功能化学股份有限公司;乙酸钠、L-半胱氨酸盐酸盐(均为分析纯):上海阿拉丁生化科技股份有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)、MRS 肉汤:杭州百思生物技术有限公司;马铃薯葡萄糖水(potato dextrose broth,PDB):广东环凯微生物科技有限公司;小鼠巨噬细胞RAW264.7:上海富衡生物技术有限公司;RAW264.7 细胞专用培养基:上海碧云天生物技术有限公司;噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)(纯度为98%):德国BIOFROXX 公司;Griess 试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒:武汉博士德生物工程有限公司;脂多糖(lipopolysaccharide,LPS):美国Sigma 公司;地塞米松(1 mg/mL):广州硕普生物科技有限公司。
1.2 仪器与设备
BPS-100CH 型恒温恒湿培养箱:上海一恒科学仪器有限公司;YQX-Ⅱ型厌氧培养箱:上海新苗医疗器械制造有限公司;SpectraMax iD3 多功能酶标仪:美谷分子仪器有限公司;BB150 二氧化碳培养箱、MSC-AdvantageTMA2 型Ⅱ级生物安全柜:美国Thermo Fisher Scientific 公司;CKX53 倒置显微镜:日本Olympus 公司。
1.3 试验方法
1.3.1 体外抑菌活性测定
1.3.1.1 培养基配制
LB 固体培养基:酵母浸粉10 g、胰蛋白胨5 g、氯化钠5 g、琼脂粉20 g,加水至1 L,121 ℃灭菌15 min。试验菌种:大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌、单增李斯特菌、耐热芽孢杆菌。
PDA 固体培养基:按说明比例称重,加水溶解,121 ℃灭菌20 min。试验菌种:黑曲霉、产黄青霉、根霉。
PDB 液体培养基:按说明比例称重,加水溶解,121 ℃灭菌20 min。试验菌种:黑曲霉、产黄青霉、根霉。
酵母膏胨葡萄糖琼脂(yeast extract peptone dextrose medium,YEPD)固体培养基:酵母浸粉10 g、蛋白胨20 g、葡萄糖20 g、琼脂20 g,加水至1 L,121 ℃灭菌15 min。试验菌种:酿酒酵母。
乳酸细菌固体培养基(MRS 固体培养基):按说明比例称重,按质量体积比为2% 加入琼脂粉,加水溶解,121 ℃灭菌15 min。试验菌种:保加利亚乳杆菌、嗜热链球菌、乳酸乳球菌乳亚种。
加强梭状芽孢杆菌(reinforced medium of clostridia,RCM)固体培养基:胰蛋白胨10 g、牛肉膏10 g、葡萄糖5 g、氯化钠5 g、酵母浸粉3 g、乙酸钠3 g、可溶性淀粉1 g、L-半胱氨酸盐酸盐0.5 g、琼脂15 g,加水至1 L,121 ℃灭菌15 min。试验菌种:酪丁酸梭菌。
1.3.1.2 菌悬液制备
从活化的固体斜面上挑取单菌落接种至液体培养基中,在菌种适宜的生长温度下,150 r/min 恒温振荡培养至对数生长期,10 000 r/min 离心15 min,去除上清液,使用生理盐水洗涤沉淀并制成含菌量1×106~2×106CFU/mL 的菌悬液,冷藏备用。
1.3.1.3 最小抑菌浓度测定
采用二倍稀释法[20]测定微生物源溶菌酶样品对14 种供试菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。先将样品制成初始质量浓度为80 mg/mL 的水溶液,再分别用菌种对应的液体培养基依次进行二倍稀释,共稀释10 个浓度作为样品溶液。每种测试菌液分别设置仅加液体培养基的试管作为阴性对照,加同体积样品溶液及菌悬液的试管作为试验组。混匀后将大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌、单增李斯特菌、耐热芽孢杆菌和酿酒酵母于37 ℃培养24 h,酪丁酸梭菌于37 ℃无氧条件下培养48 h,产黄青霉、黑曲霉和根霉于28 ℃培养36 h后,分别测定其OD600值。保加利亚乳杆菌和嗜热链球菌于37 ℃培养48 h、乳酸乳球菌乳亚种于28 ℃培养48 h 后,2 000 r/min 离心5 min,保留沉淀后烘干称重。
1.3.2 体外抗炎活性测定
1.3.2.1 小鼠巨噬细胞RAW264.7 细胞培养
将冻存的RAW264.7 细胞复苏后,于5% CO2、37 ℃饱和湿度的二氧化碳培养箱中培养。传至3 代后,待细胞状态稳定后用于正常试验操作。
1.3.2.2 样品对RAW264.7 存活率的影响试验
试验分组:用RAW264.7 细胞专用培养基配制最终质量浓度分别为1、10、50、100、200 mg/mL 的微生物源溶菌酶样品液。取对数生长期的RAW264.7 细胞,计数,调整细胞密度为1×105cells/mL。向96 孔板中每孔加入100 μL 细胞悬液,5% CO2、37 ℃饱和湿度的培养箱中培养24 h。吸去96 孔板中的培养基,按上述分组加入100 μL 的样品溶液,空白对照组只加100 μL RAW264.7 细胞专用培养基,每组设置6 个复孔,培养24 h 后每孔加入5 mg/mL 的MTT 溶液,继续培养3 h。吸去孔板中溶液加入100 μL 二甲基亚砜(dimethyl sulfoxide,DMSO),于570 nm 处测吸光度。记录结果并计算细胞存活率,计算公式如下。
式中:S为细胞存活率,%;A2为测定孔吸光度;A0为调零孔吸光度;A1为空白对照孔吸光度。
1.3.2.3 抗炎活性测定
取对数生长期的RAW264.7 细胞,计数并调整细胞浓度至1×105cells/mL,将其接于24 孔板,每孔中加入混合均匀的细胞悬液1 mL,置于5% CO2、37 ℃饱和湿度的培养箱中培养24 h。吸去孔内培养基,设置空白对照组、模型组、阳性对照组及样品组进行试验。样品组中加入不同浓度的微生物源溶菌酶样品1 mL,空白对照组和模型组均加入1 mL 培养基,阳性对照组加入1 mL 80 mg/L 的地塞米松溶液。每组设置3 个复孔,置于5% CO2、37 ℃饱和湿度的培养箱中培养24 h。在样品组及模型组中加入含1 mg/L LPS 的培养基,空白对照组加入等体积的培养基,继续置于5% CO2、37 ℃饱和湿度的培养箱中培养24 h。收集细胞培养上清,采用Griess 试剂盒测定不同样品处理下细胞中NO 的分泌量。采用TNF-α 试剂盒测定细胞上清中炎症因子TNF-α 的分泌量。
1.4 数据处理
试验所有数据用平均值±标准差表示,采用SPSS 19.0 软件进行统计分析,单因素方差进行显著性检验(P<0.05),使用GraphPad Prism 9.0 软件作图。
2 结果与分析
2.1 体外抑菌测定
微生物源溶菌酶对11 种供试菌的MIC 测定结果如表1所示。
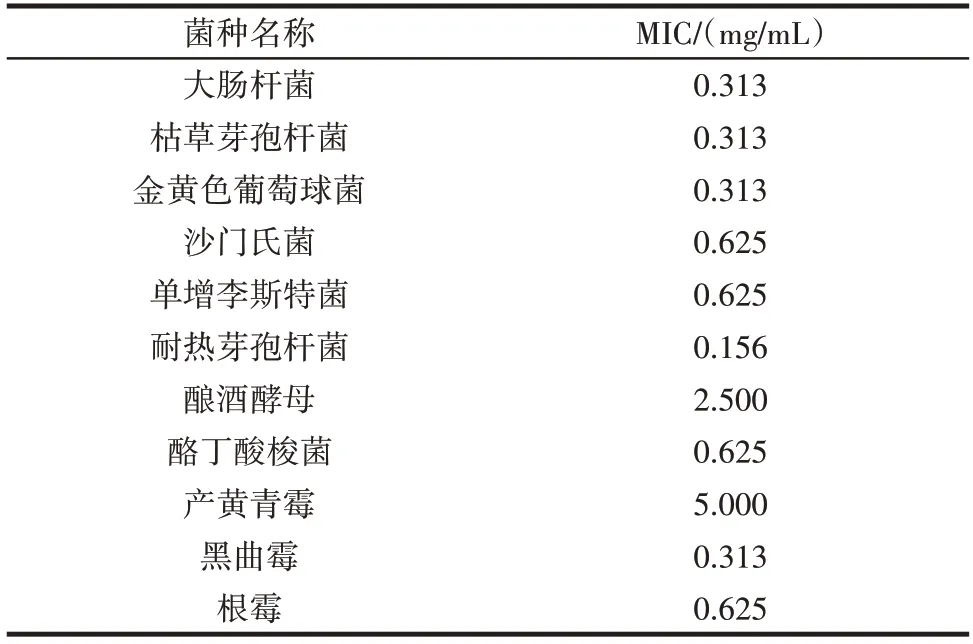
表1 微生物源溶菌酶对11 种供试菌的MIC 测定结果Table 1 Minimum inhibitory concentrations of microbial lysozyme against 11 microbial species
由表1 可知,微生物源溶菌酶对11 种供试菌均有一定的抑菌效果,其中对耐热芽孢杆菌的抑制效果最好,对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、黑曲霉次之,对产黄青霉、酿酒酵母的抑制效果相对较弱。
不同质量浓度微生物源溶菌酶对乳酸菌菌种干重的影响如图1所示。

图1 微生物源溶菌酶作用下3 种乳酸菌的质量变化Fig.1 Mass changes of three species of lactic acid bacteria treated with microbial lysozyme
由图1 可知,在试验浓度范围内,微生物源溶菌酶对保加利亚乳杆菌、嗜热链球菌、乳酸乳球菌乳亚种3 种益生菌均无抑制效果,反而对其生长具有一定的促进作用。对照组为加入相同体积液体培养基及菌悬液相同培养条件下的质量,由图1 可知,较高浓度处理下的菌种干重明显高于对照组。Dan 等[21]将含有重组人溶菌酶基因的改良细菌人工染色体注入小鼠胚胎中构建转基因小鼠模型,发现与野生型小鼠相比,转基因小鼠肠道中的双歧杆菌显著增加并对沙门氏菌的生长产生抑制。Tuncer 等[22]研究表明,嗜热链球菌ST8.01 能够在100 mg/L 溶菌酶浓度下生长,并显示出高的自聚集(49.55±6.24)%和疏水能力。Kunová 等[23]研究结果也证实了乳酸杆菌对溶菌酶具有良好的耐受性,在溶菌酶浓度为400 μg/mL 时,13 株试验菌株中有8 株对溶菌酶具有完全耐药性,而且能够正常利用所有益生元。刘纹芳等[24]对乳酸菌培养液和微生物溶菌酶联合应用的体外抑菌效果进行了测定,其结果表明乳酸菌培养液和微生物溶菌酶联合应用提高了微生物溶菌酶的抗菌活性,并且其抗菌活性为协同作用。目前保加利亚乳杆菌、嗜热链球菌、乳酸乳球菌乳亚种的抑菌活性已被证实[25-27],其与微生物源溶菌酶的联合可考虑作为新的抑菌组合被应用。
溶菌酶的抑菌效果主要归因于其能有效水解细菌细胞壁的肽聚糖,细菌细胞壁肽聚糖含量的差异使溶菌酶对革兰氏阴性菌及革兰氏阳性菌的抑菌效果有所不同。目前国内外市场使用较多的溶菌酶制剂为鸡蛋清溶菌酶,但是其对革兰氏阴性菌、真菌等的抑菌能力较差,因此会对其进行化学改性、生物改性和物理改性以扩大抑菌范围和提高抑菌效果[28]。吕淑霞等[29]发现植物源萝卜溶菌酶的抑菌谱较鸡蛋清溶菌酶更为广泛,其对大肠杆菌抑菌效果最好,优于其他3 种革兰氏阳性菌,对酿酒酵母、总状毛霉的抑菌效果较好,对鼠伤寒沙门氏杆菌、青霉相对较差。相较而言,微生物源溶菌酶或许具有更为广泛的抑菌谱,可以满足实际应用中不同的需求。
2.2 体外抗炎测定
2.2.1 微生物源溶菌酶对小鼠巨噬细胞RAW264.7 存活率的影响试验
巨噬细胞作为调控炎症反应的中心细胞,在炎症发生、维持、解决的过程中起着关键作用[30],巨噬细胞通过抗原呈递、吞噬、产生细胞因子等方式在炎症发生过程中进行免疫调节[31]。本文以RAW264.7 小鼠巨噬细胞为炎症模型,探究微生物源溶菌酶的抗炎活性。根据抑菌活性测定结果,选取微生物源溶菌酶样品具有较好抑菌效果的浓度进行体外抗炎活性测定,分别设置不同质量浓度(1、10、50、100、200 mg/mL)同时干预小鼠巨噬细胞RAW264.7 进行MTT 试验测定各组细胞的存活率,结果如图2所示。
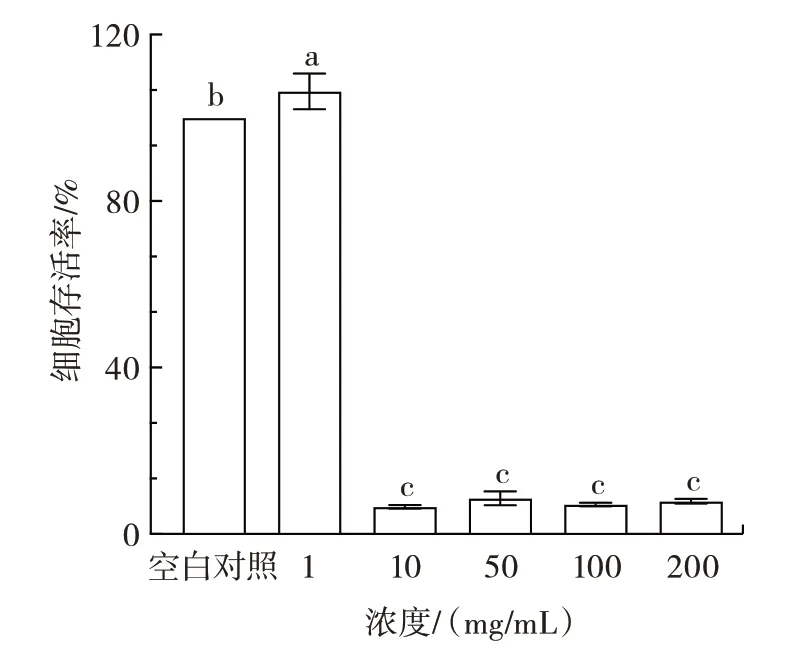
图2 不同浓度微生物源溶菌酶对RAW264.7 细胞存活率影响Fig.2 Effects of different concentrations of microbial lysozyme on the survival rate of RAW264.7 cells
由图2 可知,与空白对照相比,不同质量浓度的微生物源溶菌酶对RAW264.7 细胞的存活率产生了一定的影响。质量浓度在10~200 mg/mL 时,细胞存活率显著降低,说明过高浓度的微生物源溶菌酶对巨噬细胞毒性较大。当质量浓度为1 mg/mL 时细胞存活率没有受到抑制,说明低于1 mg/mL 的浓度对巨噬细胞无毒性。因此,选择质量浓度1 mg/mL 及以下的微生物源溶菌酶进行抗炎活性评价。
2.2.2 微生物源溶菌酶处理下细胞中NO 分泌量分析
NO 作为跨膜分子信号能损伤机体周围组织,当发生炎症反应时巨噬细胞会分泌大量NO,因此在炎症模型中,通过NO 分泌量的变化可以判断炎症反应是否得到改善[32]。LPS 是革兰氏阴性菌细胞壁的重要组成成分,能够诱导机体的免疫反应,作为巨噬细胞的活化剂可以使其分泌多种炎症因子,使RAW264.7 细胞产生炎症急剧增加NO 分泌量[33]。地塞米松是一种糖皮质激素,被广泛应用于治疗炎症性疾病[34]。因此,本文采用LPS 诱导的巨噬细胞炎症模型探究微生物源溶菌酶的抗炎活性。微生物源溶菌酶处理对细胞中NO分泌量影响结果如图3所示。
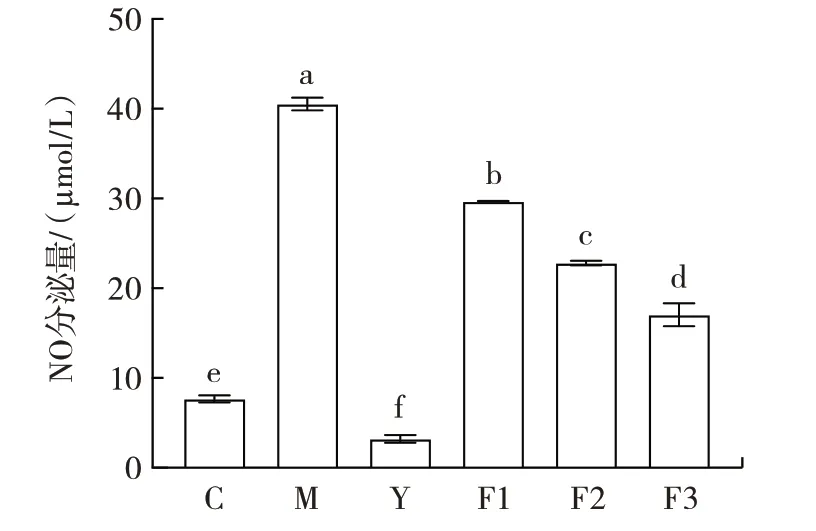
图3 微生物源溶菌酶处理对细胞中NO 分泌量影响Fig.3 The secretion of NO in cells treated with microbial lysozyme
由图3 可知,与空白对照组(C)相比,模型组(M)RAW264.7 细胞中的NO 分泌量显著提高(P<0.05),阳性对照组(Y)由于加入药物地塞米松显著降低了细胞中NO 分泌量(P<0.05),由此证明本试验建模成功。不同质量浓度的微生物源溶菌酶(0.2~1.0 mg/mL)在一定程度上降低了RAW264.7 细胞中的NO 分泌量,且浓度越高,NO 分泌量越小,与模型组相比最高可降低57.92%,说明微生物源溶菌酶具有一定的抗炎作用。当微生物源溶菌酶质量浓度为1.0 mg/mL 时,可以在保证细胞较高存活率的同时,使细胞中的NO 分泌量最低。
2.2.3 微生物源溶菌酶处理下细胞中TNF-α 分泌量分析
NF-kB 是经典的炎症信号通路,炎症发生时该通路被激活,进而促进炎症因子TNF-α 的大量表达[35],在炎症性疾病中TNF-α 水平过高会引起巨噬细胞释放多种炎症因子[36],因此,炎症因子TNF-α 的分泌量是抗炎活性评价的指标之一。不同质量浓度的微生物源溶菌酶对RAW264.7 细胞的炎症因子TNF-α 分泌量的影响见图4。
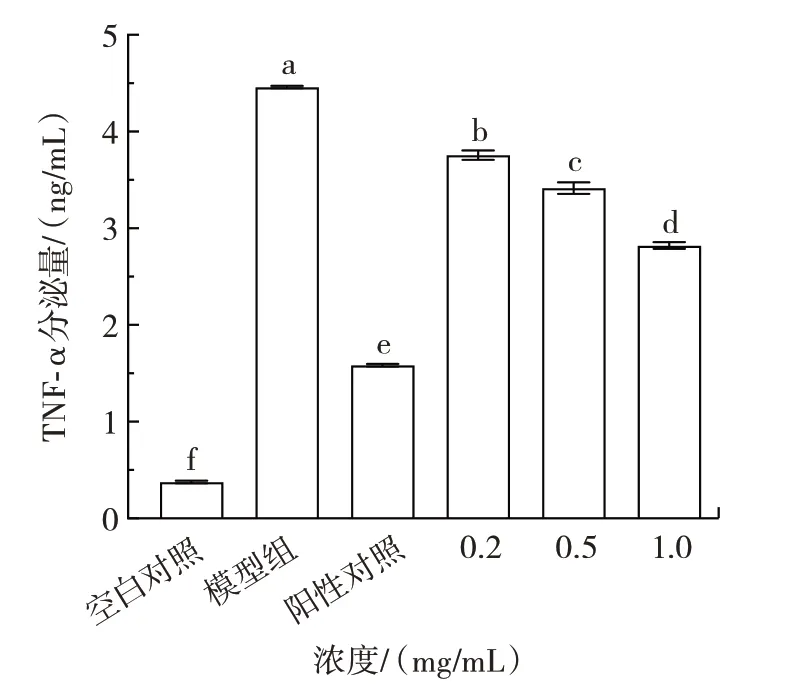
图4 不同浓度微生物源溶菌酶处理下细胞中TNF-α 分泌量Fig.4 The secretion of TNF-α in the cells treated with different concentrations of microbial lysozyme
由图4 可知,与模型组相比,3 个质量浓度的微生物源溶菌酶对炎症因子TNF-α 的分泌有较明显抑制作用,最高可降低36.75%。随着质量浓度的增加,巨噬细胞内TNF-α 的分泌量呈下降趋势,与NO 分泌量变化趋势相一致,说明微生物源溶菌酶具有良好的改善炎症的效果。
3 结论
溶菌酶在不同的生物类群中都有发现,不同来源的溶菌酶抑菌效果和抑菌机制都有所不同。本研究对微生物源溶菌酶进行了体外抑菌活性及抗炎活性的测定,针对试验中的14 种供试菌,微生物源溶菌酶具有良好的广谱抑菌效果,MIC 数据表明对不同菌种而言微生物源溶菌酶的抑菌效果有所差异,具有选择抑菌性。同时,微生物源溶菌酶在一定程度上对保加利亚乳杆菌、嗜热链球菌、乳酸乳球菌乳亚种3 种乳酸菌的生长具有促进作用,微生物源溶菌酶和乳酸菌的联合利用是否可以提高抑菌效果使其具有更为广泛的抑菌谱可作为新的研究方向。微生物源溶菌酶对LPS 诱导的小鼠巨噬细胞RAW264.7 炎症模型也表现出明显的抗炎效果,在预防或治疗炎症性疾病方面具有一定应用潜力,其良好的抑菌效果和抗炎活性为进一步开发新型功能性产品提供了依据。

