不同分期非透析慢性肾脏病患者自主神经功能变化及其影响因素分析
杨正婷,贾乐文
1.四川大学华西医院全程管理中心,四川成都 610041;2.大连医科大学附属第一医院肾内科,辽宁大连 116000
慢性肾脏病(CKD)是非传染性疾病中导致患者死亡的重要疾病之一,已经成为全球性的公共卫生问题。全球疾病负担研究(GBD)慢性肾脏病协作组相关研究数据显示,1990—2017年全球CKD患者全年龄病死率增加了41.5%,而2017年CKD患病率为9.1%,相较于1990年增加了29.3%[1]。在我国,CKD面临的现状更加严峻,我国CKD患病人数居全球首位[1],国内最新研究数据显示,我国CKD患病率为8.2%,疾病现状可用“三高一低”来概括,包括高发病率、高病死率、高医疗消费和低认知[2]。心血管疾病是CKD患者最常见的并发症,也是终末期肾脏病患者最主要的死亡原因。导致CKD患者心血管疾病发生率升高的因素包括氧化应激、自主神经功能紊乱、慢性炎症反应,以及脂蛋白、同型半胱氨酸和纤维蛋白原水平升高等。其中自主神经功能紊乱主要通过影响心率变化来导致心血管疾病。心率变异性(HRV)是目前临床评估自主神经功能和压力反射的敏感性指标,其反映的是连续心跳间隔之间的逐搏变化,HRV下降提示自主神经功能紊乱,交感神经与副交感神经处于不平衡状态。目前,有多种疾病已被证实存在HRV改变,例如在心脏器质性病变、糖尿病、高血压、慢性阻塞性肺疾病、甲状腺功能亢进、严重脑血管疾病患者中均观察到HRV下降[3-5]。在肾脏疾病中的研究发现终末期肾脏病患者HRV下降可能与其发生不良心血管事件相关[6];同时HRV检测也是预测血液透析患者远期病死率的一个有效方法[7];血液透析前后HRV的动态变化相较于血液透析之前的静息HRV更能准确反映患者自主神经功能损伤情况,血液透析前后HRV变化值是患者心血管疾病病死率和总体病死率升高的独立影响因素[8]。目前,关于肾脏病患者自主神经功能的相关研究多集中于血液透析或终末期肾脏病患者,对非透析CKD患者的研究较少,基于此,本研究选取非透析CKD患者作为研究对象,分析不同分期患者的自主神经功能变化及其影响因素,以期为降低CKD患者心血管疾病发生风险提供干预指导。
1 资料与方法
1.1一般资料 通过医院电子病历系统选取2014—2019年于大连医科大学附属第一医院住院治疗并进行动态心电图检查的CKD患者236例为研究对象,其中男137例,女99例;年龄21~89岁,中位年龄58.8岁;肾脏原发病类型:慢性肾小球肾炎69例,高血压肾病58例,糖尿病肾病50例,肾病综合征19例,常染色体显性多囊肾、慢性间质性肾炎各9例,痛风性肾病、缺血性肾病各4例,慢性肾盂肾炎、梗阻性肾病各3例,IgA肾病、狼疮性肾炎各2例,肝肾综合征、血管炎肾损害、干燥综合征肾损害、肾错构瘤各1例。纳入标准:诊断明确,进行24 h动态心电图检查的非透析CKD患者。排除标准:合并心脏器质性病变患者,如冠心病、心肌梗死、心力衰竭、各种原发性心肌病等;植入心脏起搏器患者;基础心率为非窦性心律(如房扑、心房颤动等)患者;Ⅱ度以上房室传导阻滞患者;慢性阻塞性肺疾病患者;严重急性感染患者;甲状腺功能异常患者;恶性肿瘤患者;严重脑血管疾病患者;1周内服用过影响自主神经功能及心律的抗心律失常药物患者。
CKD诊断及分期标准参考《KDIGO慢性肾脏病评价及管理临床实践指南(2012版)》,并根据CKD分期将研究对象分为CKD1~5期组,其中CKD1期组49例,CKD2期组51例,CKD3期组58例,CKD4期组40例,CKD5期组38例。各组年龄、性别、吸烟史、饮酒史,以及糖尿病、高血压患者所占比例比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究为横断面研究,研究过程遵从保密原则。
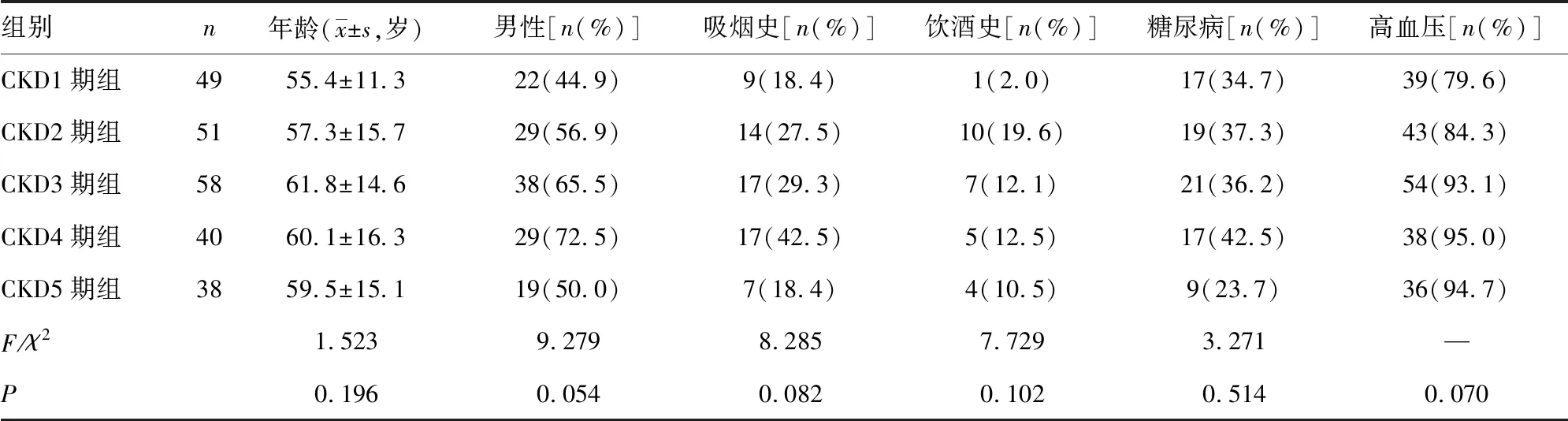
表1 不同分期非透析CKD患者一般资料比较
1.2方法
1.2.124 h动态心电图检查 (1)检查方法:24 h动态心电图分析系统购自中国康泰集团有限公司,检查时间为8:00至次日8:00。要求患者检查前24 h及检查期间避免剧烈运动及饮用咖啡、浓茶及含酒精类饮料等。对24 h动态心电图进行常规分析及HRV时域分析和频域分析。排除检查时基本心律为非窦性心律、合格心搏数少于85%及记录时间少于24 h患者的资料。(2)收集HRV时域分析及频域分析指标:时域分析指标包括24 h正常R-R间期的标准差(SDNN)、24 h内每5 min R-R间期平均值的标准差(SDANN)、24 h全程相邻R-R间期之差的均方根(rMSSD),频域分析指标包括低频功率(LF)、高频功率(HF)、LF/HF,其参考值及意义见表2、3。HRV下降的判断标准:SDNN<100 ms[9]。

表2 时域分析指标及其意义
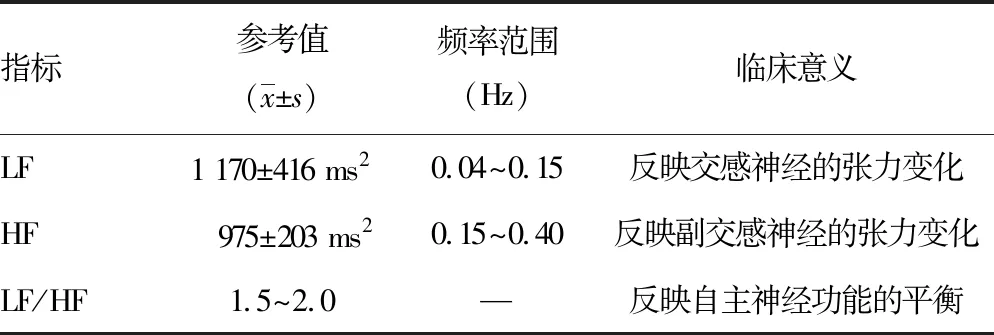
表3 频域分析指标及其意义
1.2.2临床指标采集 通过医院电子病历系统采集并记录患者血压水平及实验室指标[包括血肌酐(Scr)、尿酸(UA)、24 h尿蛋白定量、血清清蛋白(ALB)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甲状旁腺激素(PTH)、糖化血红蛋白(HbA1c)、血红蛋白(Hb)、同型半胱氨酸(Hcy)、血钙(Ca)、磷(P)、钾(K)],并计算预估肾小球滤过率(eGFR)。

2 结 果
2.1不同分期非透析CKD患者HRV时域分析指标比较 CKD1~5期组患者SDNN、SDANN水平比较,差异有统计学意义(P<0.05),其中CKD5期组患者SDNN水平明显低于CKD1~3期组患者,CKD1期组患者SDNN水平明显高于CKD3~4期组患者,差异有统计学意义(P<0.05);CKD5期组患者SDANN水平明显低于CKD1~2期组患者,差异有统计学意义(P<0.05)。CKD1~5期组患者rMSSD水平比较,差异无统计学意义(P>0.05)。见表4。
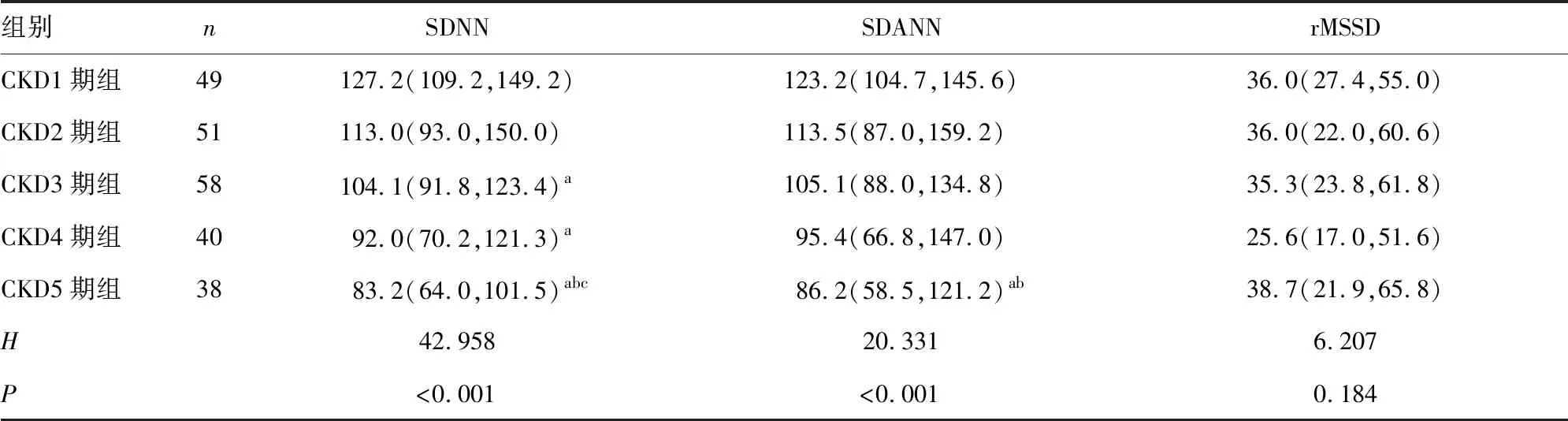
表4 不同分期非透析CKD患者HRV时域分析指标比较[M(P25,P75),ms]
2.2不同分期非透析CKD患者HRV频域分析指标比较 CKD1~5期组患者LF、LF/HF水平比较,差异有统计学意义(P<0.05),其中CKD5期组患者LF水平明显低于CKD1~2期组患者,LF/HF明显低于CKD1~4期组患者,差异有统计学意义(P<0.05);CKD1~5期组患者HF水平比较,差异无统计学意义(P>0.05)。见表5。
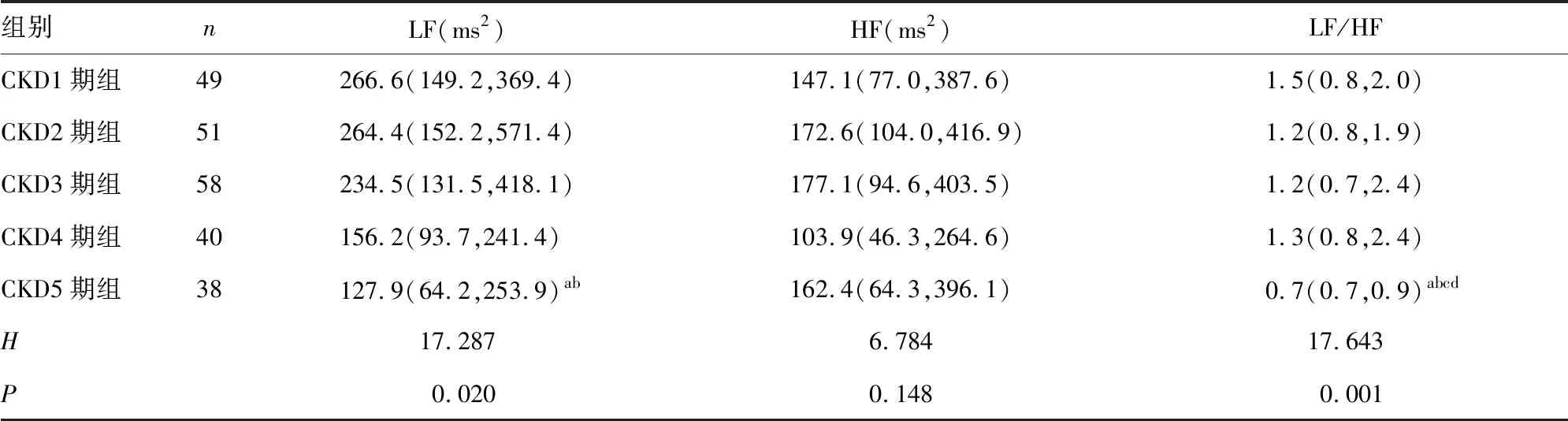
表5 不同分期非透析CKD患者HRV频域分析指标比较[M(P25,P75)]
2.3不同分期非透析CKD患者HRV下降情况分布 根据HRV下降的判断标准,纳入的236例患者中有100例(42.4%)患者存在HRV下降,CKD1~5期分别有7、19、23、24、27例,占各期总人数的构成比分别为14.3%、37.3%、39.7%、60.0%、71.1%,各组间构成比比较,差异有统计学意义(χ2=34.443,P<0.001)。
2.4非透析CKD患者HRV时域、频域分析指标与各临床指标的相关性分析 相关性分析结果显示,SDNN与年龄、收缩压、24 h尿蛋白定量、PTH、P、K、Hcy水平呈负相关(r=—0.203、—0.138、—0.293、—0.405、—0.230、—0.158、—0.339,P<0.05),与eGFR、ALB、Hb、Ca、HDL-C水平呈正相关(r=0.428、0.137、0.336、0.254、0.181,P<0.05)。SDANN与24 h尿蛋白定量、PTH、P、Hcy水平呈负相关(r=—0.308、—0.288、—0.151、—0.195,P<0.05),与eGFR、ALB、Hb、Ca水平呈正相关(r=0.283、0.191、0.238、0.200,P<0.05)。rMSSD与收缩压、舒张压水平呈负相关(r=—0.244、—0.132,P<0.05)。
LF与年龄、PTH、P、Hcy水平呈负相关(r=—0.261、—0.252、—0.138、—0.143,P<0.05),与eGFR、ALB、Hb、Ca水平呈正相关(r=0.265、0.140、0.250、0.158,P<0.05)。HF与收缩压、TC水平呈负相关(r=—0.151、—0.150,P<0.05)。LF/HF与年龄、PTH、P水平呈负相关(r=—0.323、—0.231、—0.200,P<0.05),与eGFR、Hb、收缩压、舒张压、Ca、HDL-C水平呈正相关(r=0.203、0.398、0.175、0.258、0.130、0.145,P<0.05)。
2.5引起非透析CKD患者HRV下降的单因素分析 单因素分析结果显示,HRV下降患者年龄大于HRV未下降患者,糖尿病患者所占比例、收缩压、24 h尿蛋白定量、HbA1c、Hcy、PTH、P水平高于HRV未下降患者,eGFR、Hb、HDL-C水平低于HRV未下降患者,差异有统计学意义(P<0.05)。见表6。
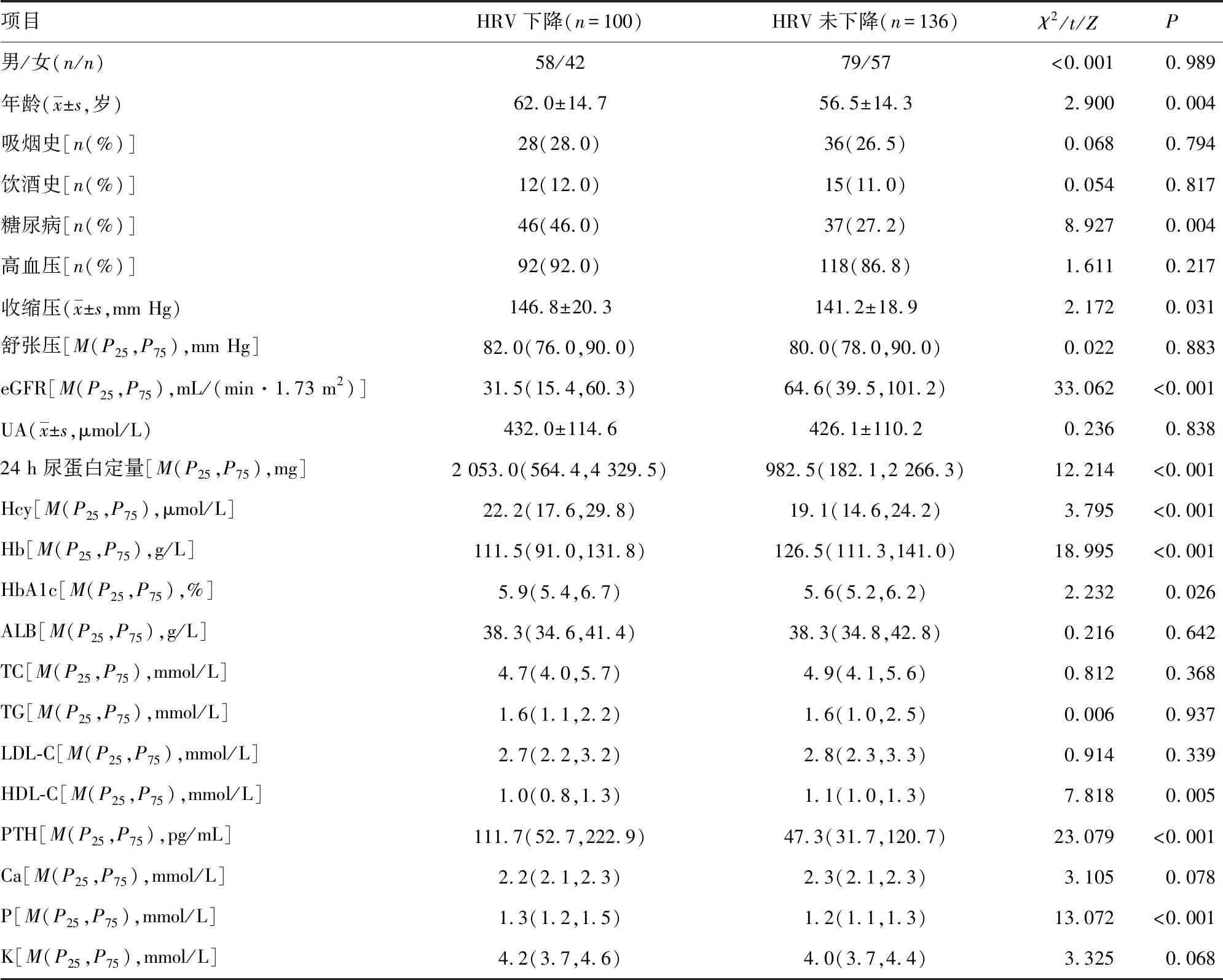
表6 引起非透析CKD患者HRV下降的单因素分析结果
2.6引起非透析CKD患者HRV下降的多因素Logistic回归分析 以HRV是否下降作为因变量(赋值:HRV下降=1;HRV未下降=0),单因素分析中差异有统计学意义的指标作为自变量(赋值:有糖尿病=1,无糖尿病=0;其他指标使用原始数据进行分析)进行多因素Logistic回归分析,结果显示,年龄增长、合并糖尿病、eGFR下降是非透析CKD患者HRV下降的独立危险因素(P<0.05)。见表7。
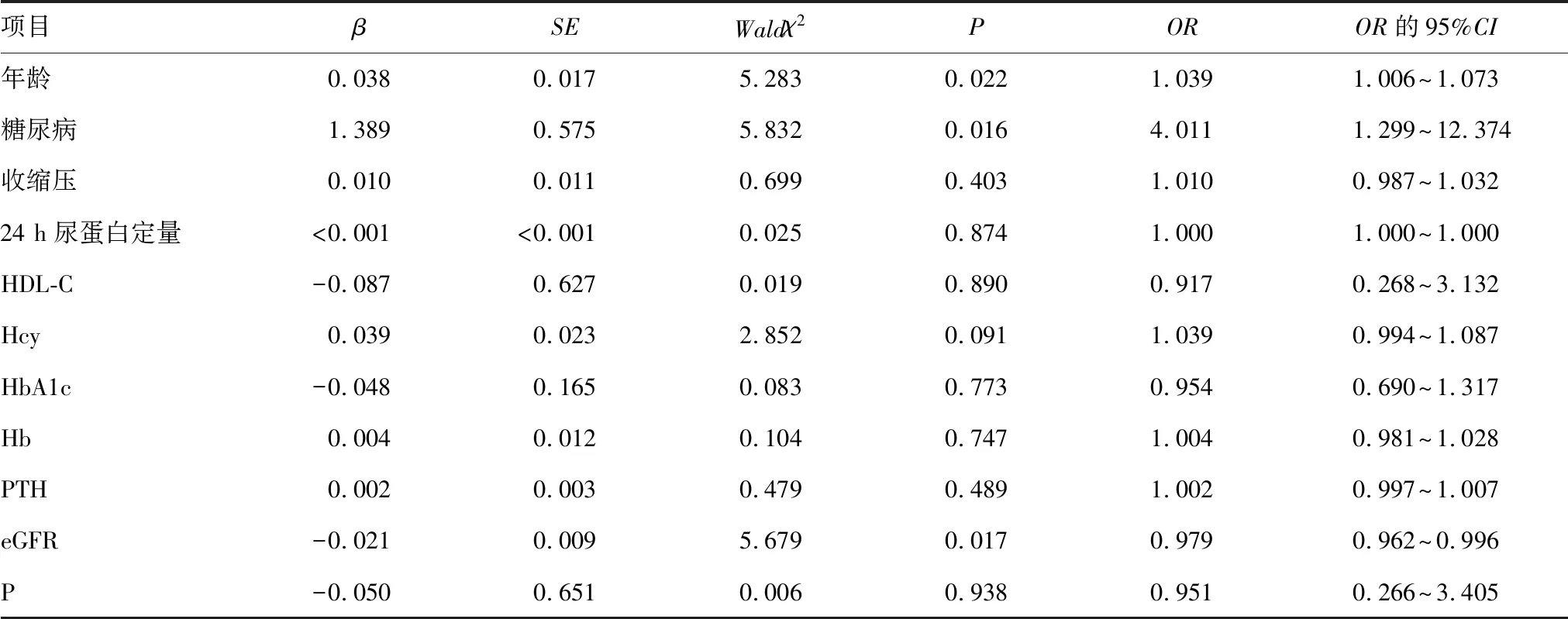
表7 多因素Logistic回归分析结果
3 讨 论
自主神经系统在控制心率、血压和呼吸功能方面发挥着重要作用。临床上最常用的HRV测量方法是时域分析法和频域分析法。时域分析法是通过评估个体RR间期的分布特征来判断RR间期的变异度,常用参数为SDNN、SDANN、rMSSD,其中SDNN主要反映交感神经和副交感神经的综合活性,可用于从总体上对心脏自主神经系统的损伤和恢复情况进行评价。频域分析法是通过快速傅立叶变换将心率的周期性变化转换为频谱表示,常用参数为LF、HF和LF/HF,其中LF/HF反映交感神经与副交感神经的相互作用,异常代表交感与副交感神经处于不平衡状态。本研究中,各组时域分析指标比较结果显示,CKD1~5期组患者SDNN、SDANN水平呈下降趋势,其中CKD5期组患者SDNN水平为83.2(64.0,101.5)ms,明显低于CKD1~3期组患者(P<0.05),CKD1期组患者SDNN水平明显高于CKD3~4期组患者(P<0.05);CKD5期组患者SDANN水平明显低于CKD1~2期组患者(P<0.05),表明随着CKD的进展,患者自主神经功能逐渐变化,尤其以CKD5期患者自主神经功能异常最为显著,主要表现为交感神经活性增强。频域分析指标比较结果显示,CKD5期组患者LF水平明显低于CKD1~2期组患者(P<0.05),LF/HF明显低于CKD1~4期组患者(P<0.05),同样提示CKD5期患者存在自主神经功能的不平衡,主要表现为交感神经张力异常。进一步分析患者HRV下降情况,结果显示,纳入的236例非透析CKD患者中有42.4%存在HRV下降,且随着CKD进展,发生HRV下降的患者比例逐渐升高,提示非透析CKD患者自主神经功能的变化可能与疾病的严重程度有关。研究发现,CKD患者存在自主神经功能改变,CKD患者的HRV低于健康对照者[10],尤其是终末期肾脏病患者存在明显的HRV下降[6],该结果与本研究结果类似。同时,本研究中有一定比例的早期非透析CKD患者也存在自主神经功能紊乱,提示对早期CKD患者进行HRV检测是非常有必要的。
本研究多因素Logistic回归分析结果显示,eGFR下降是非透析CKD患者HRV下降的独立危险因素(P<0.05)。THIO等[11]开展的一项前瞻性研究发现,CKD患者SDNN水平与eGFR存在显著正相关(P<0.05),即随着eGFR的下降,SDNN水平也逐渐下降,本研究相关性分析结果与其一致。非透析CKD患者自主神经功能紊乱的机制考虑与以下几方面相关:(1)肾脏缺血。一方面,缺血可引起肾脏组织内缺氧,导致腺苷聚积,肾脏传入神经信号的传导增加,从而引起中枢交感神经流出增加;另一方面,肾缺血可激活肾素-血管紧张素-醛固酮系统(RAAS),产生的血管紧张素Ⅱ(AngⅡ)可通过直接和间接作用激活交感神经系统,从而增强交感神经活性[12]。(2)CKD患者,尤其是终末期肾脏病患者体内累积的非对称性二甲基精氨酸(ADMA)是一种天然存在的一氧化氮(NO)合酶抑制剂,可导致NO合成减少,引起交感神经活性增强[13]。(3)CKD患者体内累积的神经毒素可通过抑制维持能量产生所需的神经纤维酶而直接损伤轴突,导致神经传导通路的损伤;其次,神经毒素进入末梢神经间隙可引起水、电解质变化,导致末梢神经间隙缩窄或扩张,从而损伤神经功能[14]。同时,自主神经功能的损伤也会加速CKD的进展,如CHOU等[15]研究发现,低LF/HF水平与CKD的快速进展相关。交感神经过度兴奋对CKD患者疾病进展的影响主要表现在:交感神经末梢连接肾血管、肾小管和肾小球旁颗粒细胞,交感神经活性增强可以增加肾素的释放、肾小管的重吸收,减少肾血流量,同时升高的AngⅡ可引起细胞因子如转型生长因子-β和游离氧自由基释放,导致肾血管发生病理改变,从而引起进行性的蛋白尿和肾小球硬化[16]。此外,交感神经活性增强可以直接损伤肾小球,有研究表明,肾小球足细胞上表达肾上腺素能受体,交感神经兴奋性增加可促使足细胞钙内流增多,足细胞皱缩,从而破坏肾小球的滤过屏障,最终产生蛋白尿,并逐渐导致肾小球硬化、血压升高及肾功能恶化[17]。考虑如果对患者的自主神经功能紊乱进行早期纠正可能可以延缓CKD的进展,但是目前需要更多的研究来证明这一猜想。
本研究中,年龄增长是非透析CKD患者HRV下降的独立危险因素(P<0.05)。PAL等[18]研究发现,随着年龄的增长,HF、SDNN水平明显降低(P<0.05),LF水平明显升高(P<0.05)。但目前关于自主神经功能随年龄变化的机制尚不清楚,考虑可能与衰老的机制相关,SHIMAZU等[19]发现,衰老与自主神经系统结构和功能的变化直接相关;同时,随着年龄的增长,心血管老化所引起的最大心率下降,氧气摄取、携氧能力下降,动脉硬化,心脏储备功能受损等都有证据表明与HRV下降相关;此外,随着衰老所出现的端粒缩短、氧化应激和炎症反应也可能是自主神经功能随年龄变化的相关机制[20]。在临床实践中,医生应加强对高龄CKD患者的关注,及早识别自主神经功能严重下降患者,提供有效干预指导。
HRV最早被用于评估糖尿病患者的自主神经功能,糖尿病患者合并自主神经功能紊乱可能与其病死率,以及心血管疾病、慢性肾脏病的发生率升高相关[21]。一项针对755例2型糖尿病患者历时9.6年的随访研究发现,自主神经功能紊乱是CKD发生的独立预测因子[22]。本研究中,合并糖尿病的患者与未合并糖尿病的患者相比,HRV下降的风险增加至4.011倍(P<0.05)。合并糖尿病的非透析CKD患者自主神经功能紊乱可能与以下几点相关:首先,高血糖可引起线粒体功能障碍形成活性氧(ROS),氧化应激可以诱导DNA损伤,导致活化的DNA修复酶和甘油-3-磷酸脱氢酶被抑制,反馈性的激活多元醇途径、己糖胺途径而引起神经元损伤[23]。此外,ROS可抑制自主神经节突触传递,导致致命性心律失常风险增加[24]。其次,与自身免疫相关,糖尿病患者自主神经节处存在针对烟碱乙酰胆碱受体的抗体,从而导致严重的自主神经传导异常[25]。最后,胰岛素抵抗和肥胖作为糖尿病的先决条件,也被证明与自主神经功能障碍有关[26]。针对合并糖尿病的CKD患者,应加强健康知识宣教,让其了解血糖控制的重要性。
采取有效的干预措施,改善非透析CKD患者的自主神经功能,对患者的远期生存有重要意义。研究发现,有氧训练可以增加健康人群和疾病患者的HRV水平,心理社会压力过大会导致HRV下降[27];健康青年人群中,吸烟者rMSSD、SDNN、HF明显下降,而戒烟后其各指标得到明显改善[28]。上述研究提示通过改变生活方式可改善患者的自主神经功能。在临床上,除了从危险因素入手进行干预外,临床医生还可给予患者一定的康复指导,包括加强有氧锻炼、接受心理干预、保持充足睡眠、减少环境刺激(保持生活环境的安静、舒适)及戒烟限酒等,必要时还可建议患者接受中医针灸、推拿、气功调养等治疗。
高血压患者通常存在明显的自主神经功能紊乱,但本研究多因素Logistic回归分析未能得出高血压是非透析CKD患者HRV下降的独立危险因素这一结论,考虑可能与本研究纳入的患者多来源于高血压科就诊患者(高血压科就诊患者多进行HRV检测),几乎均合并高血压(89.0%),因此未能得出有差异性的结果,这也是本研究的不足之处,样本选择存在一定偏倚。
综上所述,非透析CKD患者自主神经功能紊乱以交感神经活性增强为主,且随着疾病进展,自主神经功能紊乱发生率逐渐升高;合并糖尿病、eGFR下降及年龄增长是非透析CKD患者自主神经功能紊乱的独立危险因素,临床应加强关注,积极采取干预措施,以预防因自主神经功能紊乱导致的不良心血管事件的发生。

