乳腺癌脑转移分子机制的研究进展
刘睿涵, 毛思怡, 叶熹罡, 董薇, 朱惠珊, 谭维格
1.广州医科大学,广东广州510180;2.广州医科大学附属第一医院乳腺外科,广东广州510800
乳腺癌(breast cancer,BC)是女性最常见恶性肿瘤之一,具有高复发率、高转移率和高耐药性的特点。乳腺癌的远处转移常见于骨骼、肺、肝脏及大脑等部位,其中约有10%~16%的转移性乳腺癌患者出现脑部远处转移,一旦发生脑转移,乳腺癌患者只有4~6个月的中位生存期[1]。因此,乳腺癌脑转移(breast cancer brain metastasis,BCBM)是乳腺癌患者死亡的主要原因之一,对于患者的生存及预后有极大负面影响。
研究发现,乳腺癌发生脑转移需经过几个重要步骤,包括肿瘤细胞迁移、内渗进入血液循环、抵达大脑毛细血管、跨越血脑屏障(blood brain barrier,BBB)和在脑内增殖形成临床可诊断的转移灶。与其他部位转移机制不同的是,脑转移过程中,肿瘤细胞需要穿过血脑屏障才能到达其目的地[2]。因此,深入探索并完善乳腺癌脑转移的发生及进展机制,是提高未来乳腺癌诊疗效果的最佳途径。
1 与脑转移相关的基因和非编码RNA
1.1 影响BCBM的相关基因
近期研究表明,多种基因与BCBM有关。NF1、ESR1、PTEN、FOXM1、YTHDF3、OR5B21、GBX2和P53的异常表达均可促进BCBM的进展(表1)。同一基因可通过影响多种信号通路影响BCBM。PTEN既是PI3K/Akt又是NF-κB通路的调节因子,PTEN通过调节这两种通路从而影响BCBM的进展[3-4]。此外,不同的基因表达也通过影响相同的信号通路从而促进BCBM的发展。例如,PTEN与FOXM1可调节PI3K/Akt通路影响BCBM的进展[4-5];P53与GBX2通过激活Wnt/β-catenin信号通路从而促进BCBM[8-9]。
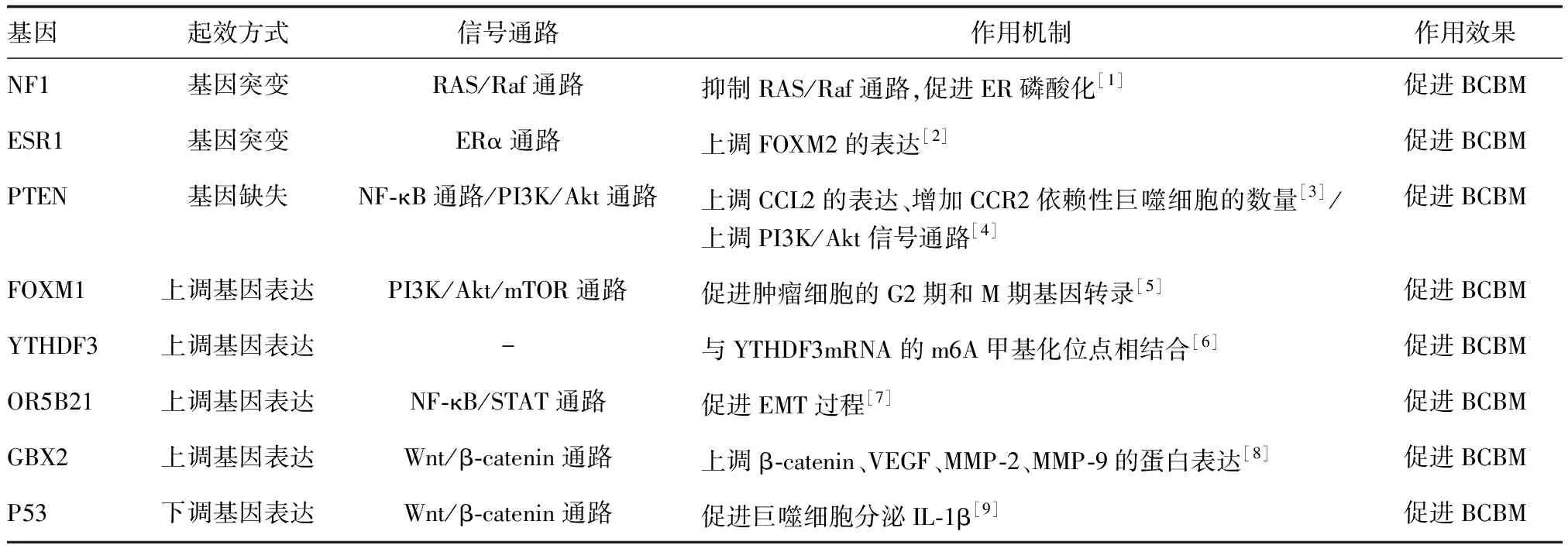
表1 影响BCBM的相关基因
1.2 影响BCBM的非编码RNA
环状RNA(circular RNA,circRNA)是一类具有环状结构的非编码RNA,在乳腺癌细胞增殖和转移中起着重要作用(表2)。Hsa_circ_0008039一方面能作为miR-432-5p的竞争性内源性RNA(competitive endogenous RNA,ceRNA)提高E2F3表达,另一方面能通过竞争性结合miR-515-5p增强CBX4表达,进而在乳腺癌脑转移中发挥关键性作用[10]。
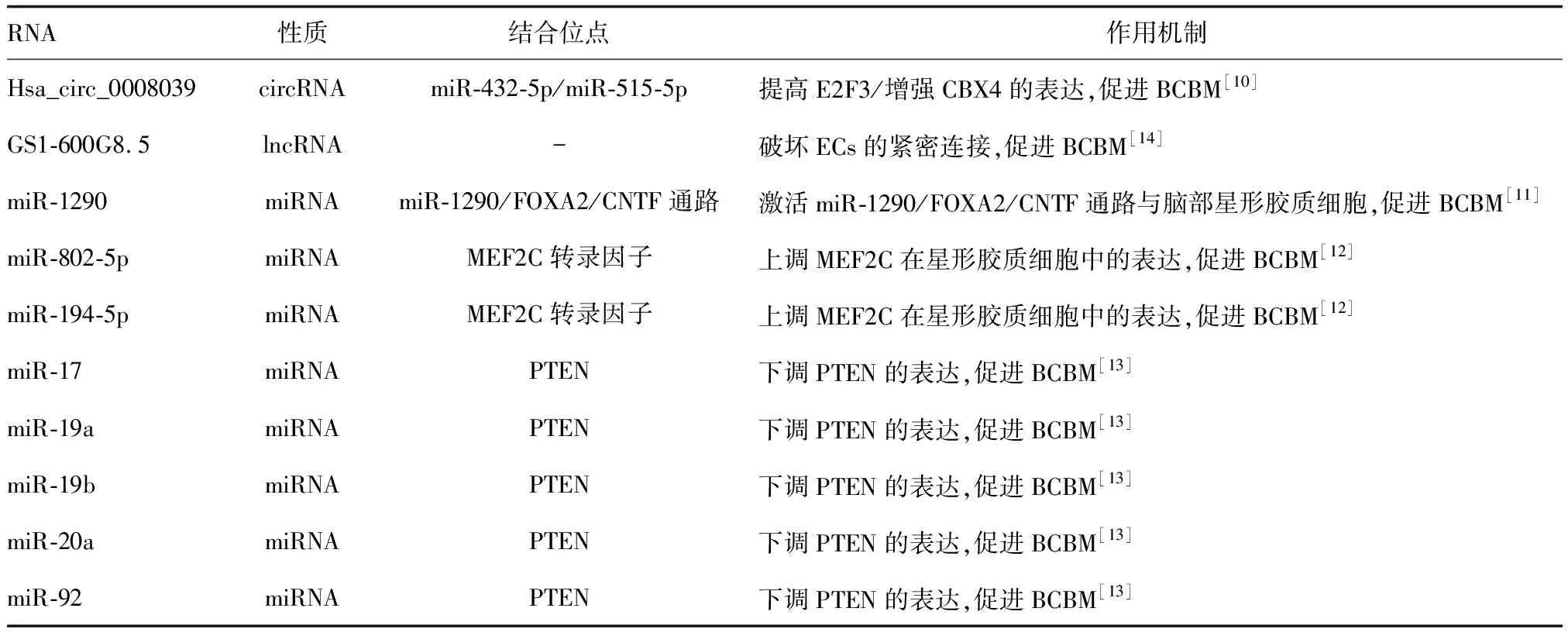
表2 影响BCBM的非编码RNAs
微小RNA(microRNA,miRNA)作为一类小分子单链RNA,与乳腺癌脑转移的发展有着密切联系(表2)。miR-1290、miR-802-5p和miR-194-5p能调节星形胶质细胞的活性,促进BCBM的进展[11-12]。miR-17、miR-19a、miR-19b、miR-20a和miR-92可通过下调抑癌基因PTEN的表达,促进乳腺癌细胞的脑转移[13]。
长链非编码RNA(long noncoding RNA,lnc RNA)是长度超过200 nt的非编码RNA。lncRNA GS1-600G8.5在BCBM细胞内高表达,并能通过破坏大脑微血管内皮细胞(endothelial cells,EC)的紧密连接,实现乳腺癌细胞在脑内的定植(表2)[14]。
2 与脑转移相关的信号通路
研究发现,PI3K/Akt信号通路、Wnt/β-catenin信号通路、RAS/ERK信号通路、EGFR信号通路、STAT3信号通路、NF-κB信号通路和PDGFB/血小板源性生长因子受体-β(platelet-derived growth factor receptor-beta,PDGFR-β)旁分泌信号通路与乳腺癌的脑转移过程密切相关(表3)。

表3 与脑转移相关的信号通路
2.1 PI3K/Akt信号通路与BCBM
PI3K/Akt信号通路是一种细胞内信号通路,可促进肿瘤细胞的生长过程,包括增殖、代谢和血管生成[15]。激活PI3K/Akt通路有助于上调免疫抑制因子以及促转移基因的表达,例如PD-L1、CTLA4、CSF1以及脑转移肿瘤微环境中CSF1受体(CSF1 receptor,CSF1R),最终促进脑转移细胞的增殖[16]。与此同时,PI3K/Akt通路能通过激活下游的mTOR,增加血管内皮生长因子数量,促进生成肿瘤新生血管[25]。因此,该信号通路已成为治疗BCBM的潜在治疗靶点。
2.2 Wnt/β-catenin、RAS/ERK、EGFR信号通路与BCBM
众所周知,Wnt/β-catenin信号通路在干细胞的生成及分化过程中具有重要作用。近期研究表明,乳腺癌患者体内Wnt/β-catenin通路的激活能诱导发生BCBM[18]。通过激活Wnt/β-catenin通路,能诱导发生EGFR过表达,进而激活RAS/ERK通路,最终导致乳腺癌细胞增殖和远处转移[19]。与此同时,BCBM癌灶中EGFR表达要明显高于其他转移灶,EGFR高表达的患者更易早期形成脑转移灶[20]。因此,Wnt/β-catenin、RAS/ERK与EGFR通路之间可以相互调节从而影响BCBM的进展。
2.3 STAT3、NF-κB信号通路与BCBM
STAT3信号通路是一种信号转导机制,能促进神经元轴突再生,在BCBM过程中起着重要作用[21]。有研究表明,pSTAT3+反应性星形胶质细胞通过激活MIF/CD74轴,进而激活NF-κB途径,促进BCBM细胞增殖[22]。此外,抑制因子TaGln2可激活ROS/NF-κB通路导致乳腺癌的远处转移。这些说明了STAT3、NF-κB通路与BCBM的进展有关[23]。
2.4 PDGFB/PDGFR-β旁分泌信号通路与BCBM
PDGFR-β是一种发现于成纤维细胞和周细胞等间质细胞的酪氨酸激酶受体。研究证明,PDGFB蛋白与PDGFB mRNA的高表达为脑转移复发的特异性预后因素,激活PDGFB/PDGFR-β旁分泌信号通路能加速BCBM进程,而使用PDGFR特异性抑制剂crenolanib,能明显抑制乳腺癌细胞的颅内生长[24]。
3 乳腺癌通过血脑屏障的分子机制研究
血脑屏障(blood brain barrier,BBB)是由星形胶质细胞、周细胞、内皮细胞、神经血管等组成的功能性屏障,位于血液和脑组织之间。BBB参与信号传递和维持中枢神经系统稳态,负责精确控制血-脑两侧的物质转运情况,维护中枢神经系统的内环境稳定。因此,BBB结构的破坏是BCBM进展的关键步骤。
研究显示,血管内皮生长因子(vascular endothelial growth factor,VEGF)、HER3/HER2配体外源生长因子的高表达能促进BCBM[25]。VEGF一方面直接诱导生成BCBM新生血管,另一方面通过结合血管内皮细胞表面受体,激活VEGF受体2(VEGF receptor 2,VEGFR2),诱导肿瘤细胞穿越BBB。人表皮生长因子受体2(human epideral growth factor receptor,HER2)阴性乳腺癌的脑转移风险明显高于其他亚型的乳腺癌,HER3是与HER2高度相关的信号转导因子,两者能形成HER2-HER3二聚体,该二聚体及其配体外源生长因子均有利于BCBM[26]。
此外,ZO-1、3-磷酸肌醇依赖性蛋白激酶-1(3-phosphoinositide-dependent protein kinase-1,PDPK1)的低表达也与BCBM进展有关。Zhou等[27]发现,抑制紧密连接蛋白ZO-1的表达水平,能破坏ECs间紧密连接的完整性,诱导肿瘤细胞迁移至大脑内。乳腺癌细胞中的PDPK1与肌动蛋白具有相关性,降低PDPK1的表达能提高血脑屏障的通透性,最终导致BCBM[28]。
4 乳腺癌细胞与脑部肿瘤微环境
除了破坏BBB结构,乳腺癌脑转移灶的形成还依赖于肿瘤细胞与脑部肿瘤微环境(tumor microenvironment,TME)的相互作用。脑部肿瘤细胞的微环境不同于其他组织和器官,其包含有内皮细胞、星形胶质细胞、细胞因子和特定代谢成分等,这种微环境可以促进脑转移灶的形成和进展[29]。
4.1 乳腺癌细胞在脑内增殖的特点
在肿瘤发展过程中,高水平招募免疫细胞易被功能异常的微环境重塑,从而影响免疫细胞的功能。该过程有利于促进细胞增殖、保护肿瘤细胞不被清除,进而促进肿瘤细胞的远处转移。研究表明,源于肿瘤的外泌体,充当着免疫细胞及肿瘤细胞之间信号转导的重要媒介。外泌体能诱导巨噬细胞发生M2型极化,分泌促血管生成因子和细胞因子,有利于BCBM的进展[30]。另一方面,外泌体能介导microRNAs自星形胶质细胞转移至BCBM细胞内,下调抑癌基因PTEN的表达,有利于肿瘤细胞定植于大脑内[13]。
4.2 脑部肿瘤微环境特点
星形胶质细胞是大脑中最丰富的神经胶质细胞。近期研究结果显示,星形胶质细胞不仅能通过分泌C-C基序趋化因子配体2、胰岛素样生长因子结合蛋白2抗体和血清壳多糖酶3样蛋白1,促进大脑皮层内的BCBM细胞增殖和转移灶的形成,还能通过调控细胞外糖蛋白Reelin的表达,促进乳腺癌细胞在大脑微环境的定植[31]。BCBM癌灶中的星形胶质细胞常以STAT3磷酸化(pSTAT3)形式来表达,在小鼠模型和人类临床样本中,pSTAT3+反应性星形胶质细胞能通过上调免疫抑制分子数量,建立免疫抑制环境,促进BCBM的发展[22]。与此同时,星形胶质细胞和脑转移癌细胞株之间存在一种缝隙连接通道,该通道由CX43和PCDH7共同介导,肿瘤细胞经由该通道向星形胶质细胞提供第二信使cGAMP,从而激活STING通路并产生γ干扰素、肿瘤坏死因子等细胞因子,激活BCBM相关信号通路,最终促进乳腺癌细胞的增殖和远处转移[17]。
乳腺癌的代谢多样性是决定其脑转移适应性的基础。缺氧状态下的肿瘤微环境与肿瘤侵袭性、预后不良明显相关,缺氧诱导因子HIF-1α与乳腺癌细胞的脑转移潜力呈正比,BCBM较原发肿瘤细胞更易激活缺氧信号转导[32]。乳酸代谢与肿瘤细胞的脑部定植有关,BCBM细胞产生的乳酸能限制自然杀伤细胞从而逃避其介导的先天免疫监视[33]。糖代谢也与BCBM密切相关,有学者发现BCBM细胞能表达更高水平的糖原和果糖-1,6-二磷酸酶(fructose-1,6-bisphosphatases,FBPs),而FBPs表达与肿瘤细胞生存能力呈正相关[26]。此外,相关研究结果证明,SREBF1、SCD等脂质代谢特征基因的富集是大脑的特征,该基因介导的脂质代谢有利于肿瘤的脑转移[34]。
因此,确保大脑内供氧平衡,抑制糖代谢、乳酸代谢和脂质代谢,可阻碍早期乳腺癌的脑部转移,提高患者的生存率。
5 小结与展望
近年来,系统性全身治疗的加速发展有效地控制了乳腺癌的颅外病变,提高了患者的生存率,也增加了脑部远处转移的可能性。此外,影像学的日益精确和体检筛查也提高了颅内病变的检出率,因此,乳腺癌的脑部远处转移在临床上愈发常见。综上,从肿瘤细胞生长、增殖到转移,癌症进展是个复杂的过程,受多种因素影响,包括细胞信号通路、基因、外泌体和代谢因素等。至今为止,BCBM的各细胞分子机制之间是否存在交叉影响,还有待进一步探索。
现有的BCBM治疗方法仍以手术和放化疗为主,由于血脑屏障的存在,血液中的大分子药物难以抵达脑部对应的病灶发挥作用,传统化疗方案疗效不佳,使得BCBM患者的预后较差。对BCBM机制的深入研究不仅有利于病情的监测,还能发现新的治疗靶点。预测BCBM相关靶点的可用性及相关靶向治疗的药物研发是未来研究的新方向和新热点,能让患者的获益最大化,为BCBM患者带来新的希望。

