骨形态发生蛋白9对肝细胞癌肿瘤干细胞干性、增殖和侵袭的影响及机制
卢金喜,余红梅,齐孝安,方超,魏新宝,李立鑫
武汉市新洲区人民医院普通外科,武汉430400
肝细胞癌(HCC)是肝癌的主要类型,是肿瘤相关死亡的主要原因[1-2],目前我国HCC 5 年生存率仅12.1%[3-5]。肿瘤干细胞(CSCs)亦称为肿瘤起始细胞,是肿瘤中一小部分具有内在干细胞样特征,能自我更新和分化的癌细胞,其在肿瘤发生、维持和复发过程中发挥重要作用[6-7]。靶向治疗CSCs 是治疗多种癌症最有希望的疗法[8]。骨形态发生蛋白(BMP)在组织形态发生、器官发生和成人组织稳态中发挥作用[9]。文献报道,BMP2 可正向调节HCC 中癌细胞恶性行为和肿瘤生长[10]。BMP9 在HCC 中表达增加并参与肝实质组织纤维化和肝硬化发生、进展[11]。2020 年1 月—12 月,我们探讨了BMP9 对HCC的CSCs干性、增殖和侵袭的影响及机制。
1 材料与方法
1.1 材料 HCC 细胞系(HCC-LM3、SMMC77721、Huh7、Hep3B和HepG2)、正常肝细胞L-02、HepG2干细胞(HepG2 CSCs)均由华中科技大学同济医学院实验室馈赠、Eagle培养基(Gibco公司,美国)、10%胎牛血清(美国Gibco 公司)、BMP9 慢病毒干扰载体[BMP9-short hairpin RNA(shRNA)]及其阴性对照(NC)(scramble)由广州锐博生物科技有限公司构建、LipofectamineTM3000 转染试剂盒购自美国Invitrogen公司、MAPK/ERK 通路激活剂DIPQUO 购自美国MedChemExpress 公司、TRIzol试剂购自日本TaKaRa公司、BMP9 一抗、ERK1/2 一抗、p-ERK1/2 一抗、MEK1/2 一抗、P-MEK1/2 一抗、GAPDH 一抗均购买自美国Abcam公司。
1.2 细胞培养及分组 HCC 细胞系(HCC-LM3、SMMC77721、Huh7、Hep3B 和HepG2)、正常肝细胞L-02 及HepG2 CSCs 均培养于Eagle 培养基中,均于37 ℃、5% CO2的培养箱中培养。待培养至对数增长期后,将慢病毒干扰载体sh-BMP9 转染HepG2-CSCs,并分成HepG2-CSCs 组、HepG2-CSCs-BMP9 敲低组。以行HepG2-CSCs 干细胞特性、细胞增殖和侵袭实验。加入DIPQUO(MEK/ERK 信号通路激活剂)后,将细胞分为三组:HepG2-CSCs 组、HepG2-CSCs 敲低组及HepG2-CSCs 敲低+ DIPQUO 组。以行HepG2-CSCs 干细胞特性维持和细胞功能及MAPK/ERK信号通路实验。
1.3 BMP2 干扰载体转染 慢病毒干扰载体BMP2-shRNA 及其NC 滴度为4×108CFU/mL,将新构建载体按照LipofectamineTM3000 转染试剂盒要求转染至肝HepG2 CSCs中。
1.4 BMP9 mRNA 表达检测 采用RT-qPCR 法。使用TRIzol 试剂提取总RNA,超微分光光度计测量RNA 浓度和纯度。将符合要求的RNA(20 μg)按照反转录试剂盒说明书操作获得cDNA。RT-qPCR 检测使用 SYBR®Premix Ex TaqTMⅡ(TaKaRa)在ABI 7900HT 快速PCR 实时系统上进行,反应条件:95 ℃10 min(预变性)、95 ℃ 10 s(变性)、60 ℃ 20 s(退火)、72 ℃ 34 s(延伸),持续40个循环。甘油醛-3-磷酸脱氢酶(GAPDH)作为内部参考,2-ΔΔCt方法用于计算目的基因相对表达。引物序列:BMP9 正向引物:5ʹ-ATCACCTGAACTCCACGAA-3ʹ,反向引物:5ʹ-TACCACCTTCTCATTCTCATC-3ʹ;CD44 正向引物:5ʹ-CCTCTCATTACCCACACACG-3ʹ,反向引物:5ʹ-CCCATGTGAGTGTCCATCTG-3ʹ;SOX2 正向引物:5ʹ-GAGAACCCCAAGATGCACAA-3ʹ;反向引物:5ʹ-GGCAGCGTGTACTTATCCTT-3ʹ;OCT4 正向引物:5ʹ-TCTGCAGAAAGAACTCGAGC-3ʹ;反向引物:5ʹ-TTGTTGTCAGCTTCCTCCAC-3ʹ。GAPDH 正向引物:5ʹ-TGGGTGTGAACCATGAGAAG-3ʹ;反向引物:5ʹ-CTCGCTTCGGCAGCACA-3ʹ。
1.5 MAPK/ERK 通路蛋白表达检测 采用蛋白质印迹实验。RIPA 裂解液分别裂解HepG2-CSCs 组、HepG2-CSCs-BMP9 敲低组、HepG2-CSCs 敲低+DIPQUO 组细胞。使用二辛可宁酸蛋白质定量试剂盒测定蛋白质浓度。各组细胞分别取等量蛋白经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,电转移法转移至聚偏二氟乙烯膜上,5%牛血清白蛋白室温封闭2 h,封闭非特异性结合抗原。4 ℃下与一抗孵育过夜后,冲洗膜并在室温下与辣根过氧化物酶标记的二抗孵育1 h,然后加入增强化学发光工作溶液。采用Image Pro Plus 6.0量化图像中每个波段灰度值,以GAPDH 为内参。实验中使用的抗体如下:BMP9(1∶500)、ERK1/2(1∶800)、p-ERK1/2(1∶400)、MEK1/2(1∶400)、P-MEK1/2(1∶500)、GAPDH(1∶500)。
1.6 HepG2-CSCs 细胞干性检测 采用RT-qPCR法测定HepG2-CSCs 细胞中干性分子CD44、SOX2及OCT4 mRNA 表达。方法同1.4。采用Western blotting 检测HepG2-CSCs 细胞中干性分子CD44 蛋白表达。HepG2-CSCs 经培养至对数生长期后,采用RIPA 裂解液裂解HepG2-CSCs 细胞。使用二辛可宁酸蛋白质定量试剂盒测定蛋白浓度。各组细胞分别取等量蛋白经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,电转移法转移至聚偏二氟乙烯膜上,5%牛血清白蛋白室温封闭2 h,封闭非特异性结合抗原。4 ℃下与一抗孵育过夜后,冲洗膜并在室温下与辣根过氧化物酶标记的二抗孵育1 h,然后加入增强化学发光工作溶液。采用 Image Pro Plus 6.0量化图像中每个波段灰度值,以GAPDH 为内参。CD44抗体浓度为1∶300。
1.7 HepG2-CSCs 细胞增殖能力检测 采用CCK-8实验。将 HepG2-CSCs 接种到 96 孔板(1 × 106个细胞/孔)中,HepG2-CSCs 组、HepG2-CSCs-BMP9 敲低组、HepG2-CSCs 敲低+ DIPQUO 组各设12 个复孔。将细胞培养1~7 d,每个时间点设置3个复孔。CCK-8溶液添加到无细胞培养基中作为空白对照,分别培养24、48、72 和96 h,在每个时间点将10 μL CCK-8溶液加入相应孔中,然后继续孵育2 h,使用酶标仪测量细胞在450 nm处的吸光度值(A450)。
1.8 细胞侵袭能力检测 采用Transwell 实验。HepG2-CSCs 组、HepG2-CSCs-BMP9 敲低组、HepG2-CSCs 敲低+ DIPQUO 组 细胞转染48 h 后,在Transwell 上室中置入细胞悬液(200 μL,1×105个细胞),并将含有20% FBS培养基(800 μL)加入每个基底下室,稀释方法为200 μL 无血清培养基在4 ℃稀释同体积的Matrigel 基质胶添加至Transwell 上下室中间。将细胞置于培养箱中培养24 h 后取出,PBS 洗涤2次,甲醛中浸泡10 min,清水洗涤3次,室温下用0.1%紫罗兰染色细胞30 min,PBS洗涤2次,显微镜下观察迁移和侵袭细胞数目。
1.9 统计学方法 采用SPSS21.0 统计软件。符合正态分布的计量数据以-x±s表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,随后采用Tukey 多重比较检验。P<0.05 为差异有统计学意义。
2 结果
2.1 BMP9 在HCC 细胞中的表达 RT-qPCR 结果示,正常肝细胞(THLE3)中BMP9 mRNA 相对表达量为0.89 ± 0.12,而HCC 细胞(HepG2、Hep3B、SMMC7721 和Huh7)中 BMP9 mRNA 相对表达量依次为3.63 ± 0.42、3.47 ± 0.52、3.41 ± 0.39、2.91 ±0.68,HCC细胞中BMP-9表达高于正常肝细胞(P均<0.05)。Western blotting 结果示,BMP9 蛋白在正常肝细胞中相对表达量为0.69 ± 0.11,而HCC 细胞(HepG2、Hep3B、SMMC7721 和Huh7)中BMP2 相对表达量依次为2.99 ± 0.55、2.64 ± 0.52、2.41 ±0.29、1.91 ± 0.78,与正常肝细胞(THLE3)相比,BMP9在HCC中高表达(P均<0.05)。
2.2 HepG2-CSCs 细胞干性鉴定 CD44、SOX2 及OCT4 mRNA 表达在HepG2-CSCs 中较HepG2 细胞增加(P均<0.05)。HepG2-CSCs 中CSC 标记分子CD44 蛋白表达较HepG2 增加(P<0.05),见表1。上述实验结果表明 HepG2-CSCs具有干细胞特性。
2.3 HepG2-CSCs 和HepG2 细胞中BMP 9 表达比较 RT-qPCR 结果示,HepG2-CSCs 细胞、HepG2 细胞中BMP9 mRNA 相对表达量分别为7.17 ± 0.88、3.63 ± 0.42,HepG2-CSCs 细胞中BMP9 mRNA 表达高于HepG2细胞(P<0.05);Western blotting 结果示,HepG2-CSCs 细胞、HepG2 细胞中BMP9 蛋白相对表达量分别为6.05 ± 0.73、2.91 ± 0.45,HepG2-CSCs细胞中BMP9蛋白表达高于HepG2细胞(P<0.05)。
2.4 敲低BMP9 对HepG2-CSCs 干细胞特性的影响 HepG2-CSCs 组、HepG2-CSCs 组BMP9 蛋白表达分别为2.01 ± 0.45、6.25 ± 0.44,两组BMP9蛋白表达比较差异有统计学意义(P<0.05),提示转染成功。RT-qPCR结果显示,BMP9 敲低后CD44、SOX2、OCT4 mRNA 表达较对照组降低(P均<0.05),见表2。

表2 HepG2 CSCs 敲低组和HepG2-CSCs 组干细胞特性相关标记分子mRNA表达比较(-x ± s)
2.5 敲低BMP9 对HepG2-CSCs 细胞增殖和侵袭的影响 CCK-8 结果示,BMP9 敲低可显著抑制HepG2-CSCs在48、72和96 h细胞增殖能力,即A450较HepG2-CSCs 组降低(P均<0.05),见表3。Transwell 侵袭实验显示,HepG2-CSCs -BMP9 敲低组、HepG2-CSCs组侵袭细胞数分别为(60.5 ±8.6)、(102.3 ± 12.8)个,HepG2-CSCs -BMP9敲低组侵袭细胞数少于HepG2-CSCs 组(P<0.05)。

表3 HepG2 CSCs 敲低组和HepG2-CSCs 组细胞增殖能力比较(-x ± s)
2.6 敲低BMP9 后对HepG2-CSCs 干细胞特性和细胞生物学功能的影响 敲低BMP9 后,HepG2-CSCs中p-ERK1/2 和 p-MEK1/2 蛋白表达分别为0.35 ±0.03、0.46 ± 0.07,HepG2 中表达分别为1.35 ±0.16、1.65 ± 0.27,HepG2-CSCs 中p-ERK1/2 和p-MEK1/2 蛋白表达较HepG2 降低(P均<0.05)。与HepG2-CSCs 敲低组相比,加入DIPQUO 后,HepG2-CSCs 干细胞特性增加,即HepG2-CSCs 细胞中干细胞相关标志物CD44、SOX2、OCT4 mRNA 表达增加(P均<0.05),可部分恢复至HepG2-CSCs 组水平(表4)。细胞功能实验显示,与HepG2-CSCs敲低组相比,加入DIPQUO 后,HepG2-CSCs 细胞在各时间点增殖能力得以恢复(P均<0.05),见表5,同时细胞侵袭能力得以恢复[侵袭细胞数分别为(102.3 ± 12.8)、(60.5 ± 8.6)、(99.3 ± 16.8)个,F=29.41,P<0.05]。
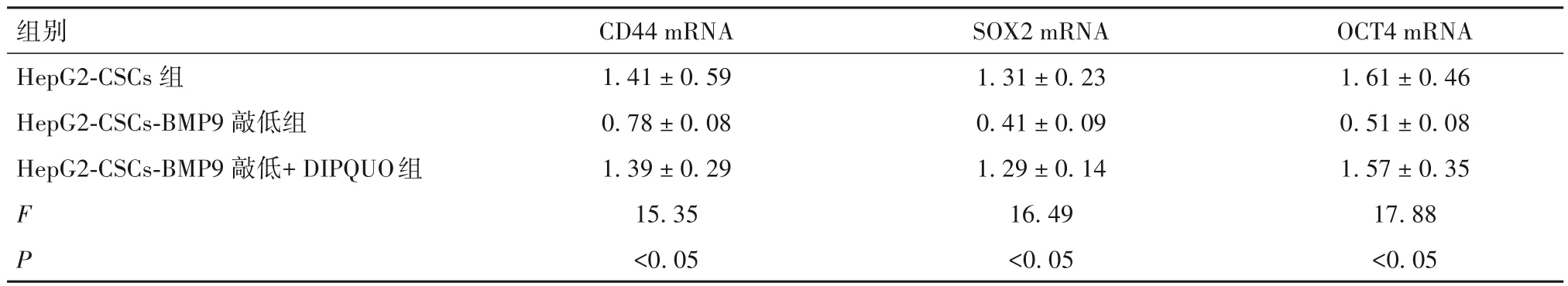
表4 三组干细胞特性相关标记分子mRNA表达比较(-x ± s)
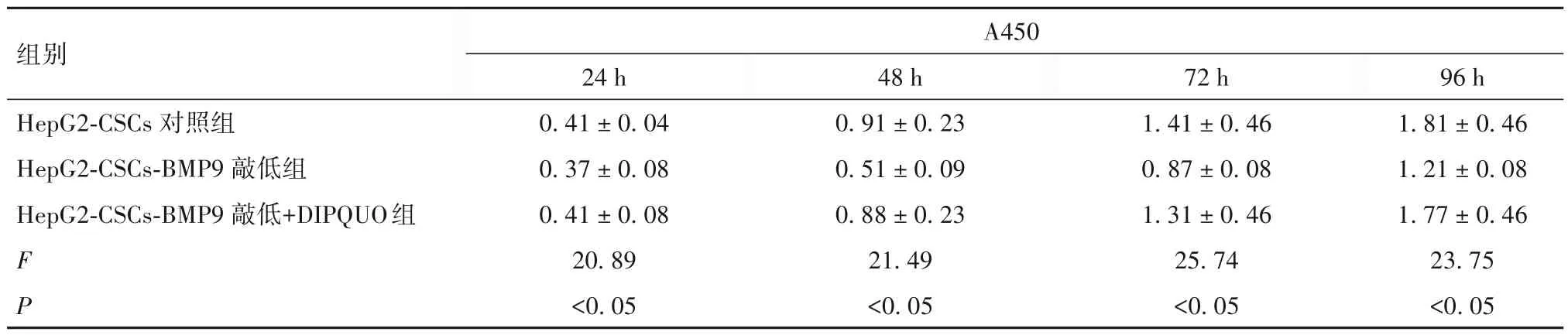
表5 HepG2 CSCs 敲低组、HepG2-CSCs 组及HepG2-CSCs-BMP9 敲低+ DIPQUO组细胞增殖能力比较(-x ± s)
3 讨论
文献报道,在HCC 组织和细胞中均发现BMP9蛋白表达增加,其可促进HCC 细胞增殖[12]。文献报道,在体外培养的HCC 细胞系中BMP9 高表达,并且可促进上皮间质转化(EMT)过程[13]。HepG2-CSCs 中BMP9 mRNA 和蛋白表达高于对应肝癌细胞(HepG2)。本研究发现,肝癌细胞系中BMP9 mRNA 和蛋白表达增加。文献报道,HepG2-CSCs 中BMP9-ID1 信号通路激活后,可维持HCC 的CSCs 干细胞特性,并通过上调Wnt/β-catenin 信号通路参与CSCs增殖和侵袭[14]。文献证实,CSCs在多种原发性肿瘤中广泛存在,并通过自我更新和增殖能力驱动肿瘤细胞生存、增殖、侵袭和复发[15]。本研究发现,与肝癌细胞(HepG2)相比,HepG2-CSCs 中代表干细胞的生物标志物CD44 和多能转录因子SOX2 和OCT4 表达均增加,证实HepG2-CSCs 细胞存在干细胞特性[6,16]。
在HepG2-CSCs 中敲低BMP9 后,HepG2-CSCs中代表干细胞的生物标志物CD44 和多能转录因子SOX2 和OCT4 表达均降低。而CD44、SOX2 、OCT4是HCC 的 CSCs 干性功能维持的标志物[17],上述结果提示BMP9 可能在HepG2-CSCs 干性维持中发挥重要作用。文献报道,在HepG2-CSCs 中BMP2 高表达,敲低BMP2 表达后可阻止HepG2-CSCs 干性维持,鉴于BMP2 和BMP9 同属于BMP 家族,两者可能存在功能类似性[18]。
在HepG2-CSCs 中敲低BMP9 后,HepG2-CSCs细胞增殖、迁移和侵袭能力均降低。文献报道,HCC中BMP9 高表达可通过激活血管内皮生长因子A(VEGFA)促进HCC 血管生成、增殖和侵袭[19]。MAPK/ERK 与CSCs 干性维持关系密切。本研究推测MAPK/ERK 信号通路激活转导有助于促进CSC增殖和迁移。本实验结果证实,HepG2-CSCs 细胞中,BMP9被敲低后,MAPK/ERK 信号通路中关键蛋白p-ERK1/2 和p-MEK1/2 表达下调,提示MAPK/ERK信号通路被抑制。文献报道,阻断 MAPK/ERK通路抑制有助于阻碍肾脏CSCs干性维持、增殖和体内成瘤能力[20],与本研究结果类似。加入DIPQUO后,HepG2-CSCs 细胞中干细胞特性标志物(CD44、SOX2、OCT4)表达可恢复到HepG2-CSCs 水平,同时可逆转HepG2-CSCs 细胞增殖、迁移和侵袭受抑的现象。
综上所述,HCC 和HCC 干细胞中BMP9 表达上调,BMP9 敲低可抑制 HepG2-CSCs 干性维持并抑制增殖和侵袭能力,机制可能与抑制MAPK/ERK 通路有关。

