基于“肝病实脾”理论探讨逍遥散对肝纤维化大鼠肝星状细胞铁死亡的影响
胡哲君,汤穆浛,张 锐,金 泓,严 伦,何鸿志,曾凤兰,周志鹏
(广州市红十字会医院,广东 广州 510220)
肝纤维化是各种慢性肝病进展中的共同病理结果,肝炎病毒感染、酒精、药物损伤等是其主要病因,随着病情的进展,患者最终会因肝硬化或肝细胞癌而导致肝衰竭,甚至危及生命[1-3]。免疫系统异常激活与脂质毒性等是触发肝脏炎症及其纤维化变性的主要病理机制[4],其中肝星状细胞(Hepatic stellate cell,HSC)受免疫炎症刺激活化,进而转变为肌成纤维细胞是肝纤维化的关键步骤[5],铁死亡作为一种细胞死亡形式在该过程中扮演着重要角色,通过诱导HSC铁死亡可有效减少肝组织细胞外基质的过度增生和沉积,最终延缓肝纤维化进展[6-7]。《金匮要略》里张仲景提出“见肝之病,知肝传脾,当先实脾”的治疗肝病思路,对于肝纤维化引发的肝硬化的临床治疗具有重要指导意义,基于“肝病实脾”理论来调控免疫功能、肠道菌群可有效防治肝硬化[8],运用“实脾”之法以“治肝”,可通过改善肠道菌群与脾胃升降失调来减轻非酒精性脂肪性肝病相关症状[9]。逍遥散是始载于《太平惠民和剂局方》中的方剂,具有调和肝脾、补肝疏郁、肝脾同治的功效,可通过“肝病实脾法”恢复肠道菌群正常结构,进而对肝纤维化大鼠起到抗纤维化与肝脏保护作用[10],能对肝郁脾虚型肝纤维化发挥治疗作用[11],但HSC铁死亡在逍遥散对肝纤维化治疗中的作用目前还不清楚,本文通过构建肝纤维化大鼠模型,基于“肝病实脾”理论探讨逍遥散对其HSC铁死亡的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:SD健康大鼠自成都药康生物科技有限公司购买,生产许可证号SCXK(川)2020-0034,雄性,SPF级,体重215~240 g,鼠龄7周左右,分笼饲养在明暗12 h/12 h交替进行照明屏障环境动物房中,每笼饲养大鼠少于5只,大鼠自由进食饮水且饲养房内温度为23~25 ℃、湿度为55%~65%。
1.1.2 试剂与仪器:四氯化碳(批号TMST-715875,纯度99.4%),自国家标准物质销售平台购买;逍遥散方剂组分:柴胡(批号404319T)、当归(批号406242T)、白芍(批号312267T)、白术(批号405219T)、茯苓(批号405218T)、生姜(批号404245T)、薄荷(批号404395T)、炙甘草(批号404243T),各中药组分均为颗粒剂,均自广东一方制药有限公司购买;水飞蓟宾葡甲胺片(规格50 mg/片,国药准字H14023291),自山西仟源医药集团股份有限公司购买;percoll细胞分离液,自上海山进生物科技有限公司购买;抗兔和小鼠HRP-DAB免疫组化检测试剂盒,自杭州斯达特生物科技有限公司购买;粪便基因组DNA快速提取试剂盒,自上海泽叶生物科技有限公司购买;Nextera XT DNA文库制备试剂盒、Illumina Miseq测序试剂盒,自美国Illumina公司购买;Masson染色试剂盒、谷胱甘肽(Glutathione,GSH)含量检测试剂盒、PCR反应试剂盒、铁含量检测试剂盒、丙二醛(MDA)含量检测试剂盒,自北京索莱宝科技有限公司购买;兔源抗大鼠抗-长链脂酰辅酶A合成酶4(ACSL4)一抗、兔源抗大鼠抗-α平滑肌肌动蛋白(α-SMA)一抗、兔源抗大鼠抗-谷胱甘肽过氧化酶4(GPX4)一抗、兔源抗大鼠抗-β-actin一抗、兔源抗大鼠抗-环加氧酶2(PTGS2)一抗、辣根过氧化物酶(HRP)偶联小鼠抗兔二抗,自美国CST公司购买等。
全自动生化分析仪(型号DT-480),自盛世东唐江苏生物科技有限公司购买;冷冻切片机(型号ALQ-2000),自湖北安立信医疗实业有限公司购买;双目生物显微镜(型号XSP-2CA),自华熙昕瑞(青岛)分析仪器有限公司购买;全自动酶标分析仪(型号HED-SY96A),自山东霍尔德电子科技有限公司购买;垂直电泳系统(型号XCell SureLock Mini-Cell)、转印系统(型号XCell Ⅱ Blot Module)、电泳仪电源(型号Power Ease Touch),自赛默飞世尔科技(中国)有限公司购买等。
1.2 实验方法
1.2.1 肝纤维化大鼠模型制备及分组给药:参考文献[12]制备肝纤维化大鼠模型:将四氯化碳与玉米油混合制为40%(质量分数)的溶液,于SD大鼠腹腔内注射,剂量为1 ml/kg,2次/周(相隔3 d),持续8周后随机选3只大鼠,进行肝脏病理检测发现其肝组织内形成明显纤维间隔,且以全自动生化分析仪检测外周血中肝功能指标:天冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT),发现其水平相比正常大鼠明显升高,即表明肝纤维化大鼠模型制备成功,随机分为模型组、逍遥散组、水飞蓟宾葡甲胺组,每组12只,另取12只SD大鼠于其腹腔内注射1 ml/kg的玉米油设为对照组。
逍遥散由柴胡、当归、白芍、白术、茯苓各15 g,生姜、薄荷各6 g,炙甘草9 g组成,根据颗粒剂与生药剂量换算关系,取相对应质量的各种单味中药颗粒剂溶于0.9%氯化钠溶液配制为0.155 g/ml的药液备用;将水飞蓟宾葡甲胺片研碎溶于0.9%氯化钠溶液中配成5 mg/ml的药液备用。各组大鼠于造模成功后进行分组处理:逍遥散组大鼠灌胃10 ml/kg逍遥散药液(逍遥散剂量达到1.55 g/kg)[10],水飞蓟宾葡甲胺组大鼠灌胃10 ml/kg水飞蓟宾葡甲胺药液(水飞蓟宾葡甲胺剂量达到50 mg/kg)[12],对照组、模型组灌胃10 ml/kg 0.9%氯化钠溶液,各组大鼠均处理3周(1次/d)。
1.2.2 检测各组大鼠肝功能指标、肝指数并采集标本:末次给药结束后24 h使用乙醚麻醉各组大鼠,采集其腹主动脉血1 ml左右进行离心(4 ℃、3000 r/min、20 min),获取血清并使用全自动生化分析仪检测其中肝功能指标AST、ALT水平;再次采集各组大鼠腹主动脉血1 ml左右进行离心(4 ℃、3000 r/min、20 min),获取其中血清储存在-20 ℃备用。
自每组大鼠中随机选出6只大鼠称量其体重,采集其粪便标本保存在液氮中备用;打开腹腔并取出肝脏,称量其重量后依据公式算出各组大鼠肝指数,公式:肝指数=肝脏重量/体重×100%;然后以0.9%氯化钠溶液漂洗称重后的肝脏,做包埋处理后于液氮内快速冷冻,取出肝冷冻组织块放入冷冻切片机内切成约4 μm厚的薄片备用。
每组剩余的6只大鼠,整体消毒后在无菌操作台中打开腹腔,结扎其上腔静脉,以乙二醇四乙酸、胶原酶和链霉蛋白酶溶液从门静脉灌注肝脏,剪下消化后的肝脏于无菌DMEM/F12培养基中剥碎、漂洗,然后置于胶原酶和链霉蛋白酶组成的混合酶溶液中继续消化,过200目筛后获得细胞悬液,置于15 ml离心管中离心(37 ℃、1000 r/min、15 min),以30%的percoll细胞分离液8 ml和70%的percoll细胞分离液3 ml重悬细胞,接着离心(37 ℃、2500 r/min、20 min),通过细胞密度区分细胞类型,HSC在上层细胞层中富集,将其小心吸出后离心(37 ℃、1000 r/min、10 min),采用含有20%胎牛血清及1%双抗的DMEM/F12培养基进行原代培养。
1.2.3 以Masson染色检测各组大鼠肝纤维化:取出上述所得的肝组织冰冻切片在室温下静置5 min,然后浸没在冰丙酮中固定15 min,取出用蒸馏水漂洗后滴加Masson染液进行染色(具体方法如Masson染色试剂盒说明书中所示),用蒸馏水漂洗后采用中性树脂封片观察,采用生物显微镜采集各组大鼠肝组织图像,以Image J软件分析所得图片,并定量计算各组大鼠肝组织切片中被染成蓝色的胶原纤维面积和视野总面积,根据公式算出各组大鼠肝胶原容积分数(CVF),公式:CVF(%)=切片胶原纤维面积/切片视野总面积×100%。
1.2.4 以免疫组织化学染色检测各组大鼠肝星状细胞活化:取出上述所得的肝组织冰冻切片以同样方法固定、漂洗,以3%过氧化氢去除切片内源性过氧化物酶,进行抗原修复后采用5%山羊血清封闭切片,滴加兔源抗大鼠抗-α-SMA一抗溶液覆没切片,摇动孵育过夜后洗片,滴加相对应二抗溶液覆没切片,摇动孵育2 h后洗片,采用抗兔和小鼠HRP-DAB免疫组化检测试剂盒并按其说明书中方法进行染色,封片后观察,以生物显微镜采集各组大鼠肝组织图像并以Image J软件进行分析,定量各组大鼠肝组织切片中被染成棕色的α-SMA阳性细胞数和细胞总数,根据公式算出各组大鼠肝组织α-SMA阳性比,公式:α-SMA阳性比(%)=α-SMA阳性细胞数/细胞总数×100%。
1.2.5 通过16SrRNA基因测序检测各组大鼠肠道菌群改变:取上述采集的各组大鼠粪便标本,采用粪便基因组DNA快速提取试剂盒并按其说明书中方法分别提取其中基因组DNA,进行琼脂糖凝胶电泳纯化,获得1 ng/μl的DNA采用PCR反应试剂盒并按其说明书中方法对16S V4区进行PCR扩增,引物序列为:Forward-5’-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG-3’;Reverse-5’-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC-3’,再次进行琼脂糖凝胶电泳来纯化所得PCR产物,将5倍量的每组PCR产物混为一个合并文库,以Illumina Miseq测序平台测序后采用Mothur软件拼接处理,获取非冗余的有效数据,以Uparse软件聚类序列为多个操作分类单元,默认97%的一致性,基于R语言对微生物群落组成多样性进行分析,获取Alpha多样性指数ACE,并采用Mothur方法和SILVA132的SSUr RNA数据库做物种注释分析来获取重要肠道菌群(拟杆菌目、梭菌目)丰度。
1.2.6 以试剂盒测定各组大鼠HSC铁死亡指标:取上述进行原代培养的各组大鼠HSC,分别置于预冷RAPI裂解液内混匀,在冰水浴中进行裂解,2 h后离心(4 ℃、3000 r/min、20 min),获得各组大鼠HSC样品液,以BCA法测出其中蛋白总浓度后每组取出0.34 ml采用GSH含量检测试剂盒、铁含量检测试剂盒、MDA含量检测试剂盒分别测量其中GSH、MDA水平与铁含量,具体测量方法见各自试剂盒说明书。
1.2.7 以免疫印迹检测各组大鼠HSC铁死亡标志蛋白表达:取上述提取的各组大鼠HSC样品液,放入沸水浴内加热变性其中蛋白,根据蛋白浓度测定结果每组取出20 μg蛋白样品,依次进行电泳、湿式转印,在PVDF膜上获取各组按分子量大小分离开的蛋白,在5%脱脂牛奶中封闭蛋白非特异抗原,并分别孵育兔源抗大鼠Anti-ACSL4、GPX4、PTGS2、β-actin一抗和HRP偶联小鼠抗兔二抗,使各组ACSL4、GPX4、PTGS2、β-actin蛋白发生抗原抗体反应后用化学发光试剂使其显色,摄取其图像后采用Image J软件定量各组蛋白灰度值,计算各组ACSL4、GPX4、PTGS2蛋白与内参β-actin蛋白灰度值的比值,即可获得其相对表达量。
1.3 统计学方法 采用SPSS 26.0统计学软件进行分析。以均数±标准差进行表示,多组间数据的差异比较进行单因素方差分析,组间两两差异进一步比较进行SNK-q检验;P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠血清AST、ALT水平比较 见表1。与对照组相比,模型组大鼠血清AST、ALT水平均明显升高(P<0.05);与模型组相比,逍遥散组、水飞蓟宾葡甲胺组大鼠血清AST、ALT水平均降低(P<0.05);与逍遥散组相比,水飞蓟宾葡甲胺组大鼠血清AST、ALT水平和肝指数差异无统计学意义(P>0.05)。

表1 各组大鼠血清AST、ALT水平比较(U/L)
2.2 逍遥散对大鼠肝指数与肝纤维化的影响 与对照组相比,模型组大鼠肝指数与肝CVF明显升高(P<0.05);与模型组相比,逍遥散组、水飞蓟宾葡甲胺组大鼠肝指数与肝CVF均降低(P<0.05);与逍遥散组相比,水飞蓟宾葡甲胺组大鼠肝指数与肝CVF均无明显变化(P>0.05)。见表2(图1)。
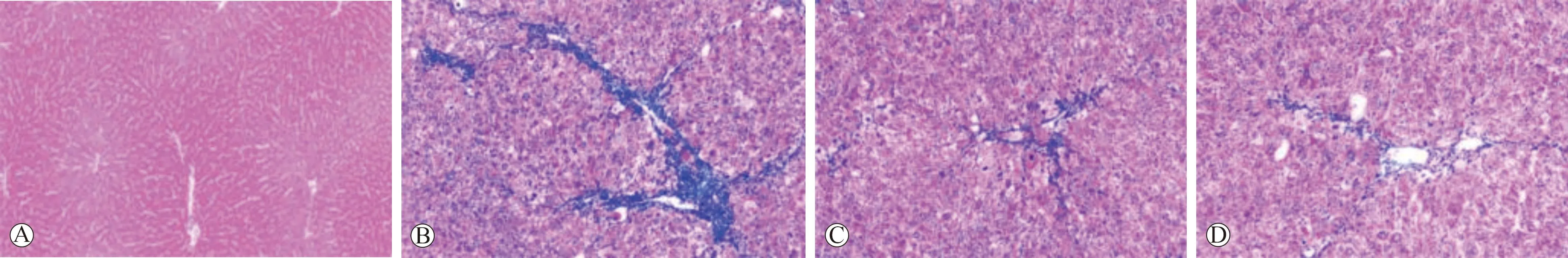
A:对照组;B:模型组;C:逍遥散组;D:水飞蓟宾葡甲胺组
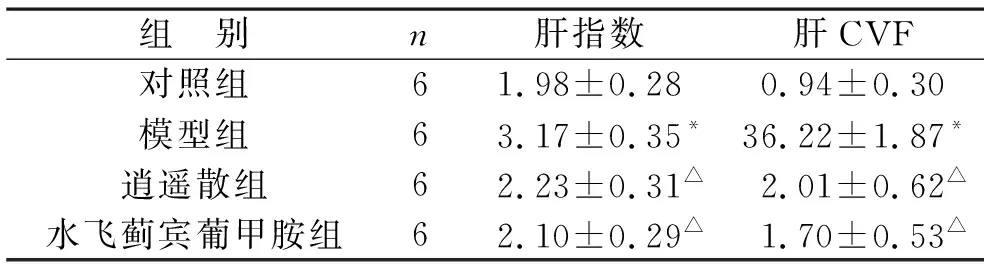
表2 各组大鼠肝指数与肝CVF比较(%)
2.3 各组大鼠肝星状细胞活化比较 见图2。对照组、模型组、逍遥散组、水飞蓟宾葡甲胺组大鼠肝组织α-SMA阳性比分别为(5.31±1.63)%、(54.93±3.75)%、(8.52±2.43)%、(7.16±2.10)%。与对照组相比,模型组大鼠肝组织α-SMA阳性比明显升高(P<0.05);与模型组相比,逍遥散组、水飞蓟宾葡甲胺组大鼠肝组织α-SMA阳性比均降低(P<0.05);与逍遥散组相比,水飞蓟宾葡甲胺组大鼠肝组织α-SMA阳性比差异无统计学意义(P>0.05)。

A:对照组;B:模型组;C:逍遥散组;D:水飞蓟宾葡甲胺组
2.4 各组大鼠ACE指数、梭菌目丰度、拟杆菌目丰度比较 见表3。与对照组相比,模型组大鼠ACE指数、梭菌目丰度均明显升高(P<0.05),拟杆菌目丰度明显降低(P<0.05);与模型组相比,逍遥散组、水飞蓟宾葡甲胺组大鼠ACE指数、梭菌目丰度均降低(P<0.05),拟杆菌目丰度均升高(P<0.05);与逍遥散组相比,水飞蓟宾葡甲胺组大鼠ACE指数、梭菌目丰度、拟杆菌目丰度差异无统计学意义(P>0.05)。

表3 各组大鼠ACE指数、梭菌目丰度、拟杆菌目丰度比较
2.5 各组大鼠HSC铁死亡指标铁含量、GSH及MDA水平比较 见表4。与对照组相比,模型组大鼠HSC铁死亡指标铁含量、MDA水平均明显降低(P<0.05),GSH水平明显升高(P<0.05);与模型组相比,逍遥散组、水飞蓟宾葡甲胺组大鼠HSC铁死亡指标铁含量、MDA水平均升高(P<0.05),GSH水平均降低(P<0.05);与逍遥散组相比,水飞蓟宾葡甲胺组大鼠HSC铁死亡指标铁含量、GSH及MDA水平差异无统计学意义(P>0.05)。

表4 各组大鼠HSC铁死亡指标铁含量、GSH及MDA水平比较
2.6 各组大鼠HSC铁死亡标志蛋白表达比较 见表5(图3)。与对照组相比,模型组大鼠HSC铁死亡标志蛋白ACSL4、PTGS2表达明显降低(P<0.05),GPX4蛋白表达明显升高(P<0.05);与模型组相比,逍遥散组、水飞蓟宾葡甲胺组大鼠HSC铁死亡标志蛋白ACSL4、PTGS2表达均升高(P<0.05),GPX4蛋白表达均降低(P<0.05);与逍遥散组相比,水飞蓟宾葡甲胺组大鼠HSC铁死亡标志蛋白ACSL4、PTGS2、GPX4表达差异无统计学意义(P>0.05)。

图3 免疫印迹检测各组大鼠HSC铁死亡标志蛋白表达

表5 各组大鼠HSC铁死亡标志蛋白相对表达比较
3 讨 论
因代谢紊乱、病毒感染或药物刺激等引发的慢性肝病是世界范围内主要的公共卫生问题,肝纤维化作为慢性肝病的共同病理结果,一直是临床研究热点,现有治疗手段均以延缓纤维化进展为主,对于肝纤维化的进展难以逆转,因此还需探索更有效的抗肝纤维化方法[13-15]。本文采用腹腔注射四氯化碳的方法建立肝纤维化大鼠模型,结果显示,造模大鼠肝组织内形成明显纤维间隔,血清AST与ALT水平、肝指数、肝CVF相比对照组大鼠明显升高,表明四氯化碳可引发大鼠肝组织纤维化变性并损害其肝功能,提示肝纤维化大鼠模型构建成功。
中医脏腑学说认为肝脾在病理生理上联系密切,“见肝之病,知肝传脾,当先实脾”就是张仲景基于“肝病实脾”理论提出的肝病治疗原则,是中医“治未病”思想的具体体现,现代医学研究证实肠-肝轴参与脂肪肝的发病机制,肠道菌群失衡作为脾虚的微观表现,是基于“肝病实脾”理论进行肝脾同病治疗的病理基础,促进肠道菌群稳态恢复可有效延缓脂肪肝的发展[16],并可减轻肝脏炎症与保护非酒精性脂肪性肝病大鼠肠黏膜屏障功能[17];遵从“肝病实脾”理论还可在肝硬化的治疗中发挥重要作用[18]。逍遥散由柴胡、当归、白芍、白术等组成,柴胡作为君药,可疏肝解郁、条达肝气。当归、白芍同为臣药,能柔肝养血。白术、甘草、茯苓共起健脾益气、生化营血之效,薄荷疏郁散热,生姜温胃和中,共为佐药。众药合用既补肝解郁又兼顾气血,肝脾同治,作为调和肝脾之名方可通过恢复肠道菌群正常结构来减少内毒素,进而改善大鼠肝纤维化[10,19],还能通过抑制氧化应激、炎症级联反应和凋亡信号激活而显著减轻四氯化碳诱导的急性肝损伤[20]。本文结果显示,以逍遥散处理肝纤维化大鼠,可升高其拟杆菌目丰度,降低其血清AST与ALT水平、肝指数、肝CVF、肝组织α-SMA阳性比、ACE指数、梭菌目丰度,表明逍遥散可降低肠道菌群丰富度,恢复肠道菌群正常结构,抑制四氯化碳诱导的大鼠HSC活化及肝纤维化,改善其肝功能,进一步证实了逍遥散可基于“肝病实脾”理论治疗肝纤维化。
HSC的活化是肝纤维化发生发展的细胞学基础,抑制其活性并促进活性HSC死亡是防治肝纤维化的有效策略[21-22],铁死亡作为一种新型的程序性细胞死亡方式,在包括肝纤维化在内的多种生理病理过程中起到重要调节作用,通过诱导HSC铁死亡可有效抑制HSC活化,进而减轻肝纤维化[23-25]。本文结果显示,肝纤维化大鼠HSC铁含量、MDA水平、ACSL4与PTGS2蛋白表达相比对照组大鼠明显降低,GSH水平与GPX4蛋白表达明显升高,表明四氯化碳可导致大鼠HSC铁死亡水平降低;以逍遥散处理肝纤维化大鼠可升高其HSC铁含量、MDA水平、ACSL4与PTGS2蛋白表达,并降低其GSH水平与GPX4蛋白表达,表明逍遥散可增强四氯化碳诱导的大鼠HSC铁死亡,揭示促进HSC铁死亡可能是逍遥散治疗肝纤维化的药理机制之一。
综上所述,逍遥散可降低肠道菌群丰富度并恢复其正常结构,促进HSC铁死亡,进而减轻四氯化碳诱导的大鼠HSC活化及肝纤维化,改善大鼠肝功能,增强HSC铁死亡可能是其药理机制之一。

