奈妥匹坦帕洛诺司琼预防化疗引起的恶心呕吐:从临床试验到日常临床实践
Matti Aapro Karin Jordan Florian Scotté Luigi Celio Meinolf Karthaus Eric Roeland
1 CINV
CINV 是由某些化疗药物和化疗方案引起的一种常见、令人苦恼的副作用[1-4], 对患者生活质量具有负面影响[5], 导致患者无法顺利完成抗癌治疗[6]。因此,在以患者为中心的支持性治疗中, 预防CINV 至关重要。临床医生应该注重于提供最佳可行的抗癌治疗方法, 恰当处理好治疗过程中不断变化的疾病有关的不良事件[7]。此外, 通过开展患者报告结局项目对CINV等不良事件进行适当监测, 最终将可能改善患者的总生存质量[8]。
根据CINV 相对于化疗的发生时间和CINV 既往史[9-15], 可将CINV 分为五类。见表1。化疗药物引发的呕吐反应可归因于一些神经递质的释放, 包括5-羟色胺、P 物质(substance P, SP)和多巴胺, 这些神经递质分别特异性地激活分布于中枢神经系统和外周神经系统中的5-羟色胺-3(5-HT3)受体、神经激肽-1(NK1)受体和多巴胺2 型受体[1,16]。急性CINV(发生在开始化疗后0~24 h)的发生机制主要是通过胃肠道肠嗜铬细胞释放血清素, 激活肠道5-HT3受体, 5-HT3受体将信号传递至脑干, 激活呕吐反射;P 物质对触发急性呕吐也有一定作用, 但程度较轻。各种化疗药物都可引起延迟性CINV(发生在开始化疗后24~120 h), 其发生机制主要为脑内P 物质的释放, 激活NK1受体。随后通过背侧迷走神经复合体(由呕吐中枢、后区和迷走传入神经)增强刺激信号, 并将信号传递至腹肌、胃和膈肌, 诱导呕吐反应[16]。恶心的病理生理机制尚不明确[17,18]。由于恶心是一种主观症状, 因此恶心评估始终是一个临床挑战[19]。在过去几年内, 随着5-HT3和NK1受体拮抗剂被开发用于急性和延迟性CINV 治疗中, 止吐药领域已经取得巨大进展。

表1 CINV 分类
根据未给予有效的预防止吐治疗时, 单独使用一种化疗药物或其联合方案引发急性呕吐的潜能, 可将化疗药物的致吐风险分为四个等级。见表2。致吐风险分级为不同癌症协会发布止吐建议提供了依据[9, 14, 20, 21]。

表2 化疗药物致吐风险分级
2 止吐指南和指南建议依从性
很多协会都发布过控制肿瘤患者呕吐的循证指南[10,21-23], 见表3。包括国际癌症支持护理协会(MASCC)/欧洲肿瘤内科学会(ESMO)[22,23]、美国临床肿瘤学会(ASCO)[21]、2021 年美国国立综合癌症网络(NCCN)[10]。神经激肽-1 受体拮抗剂(NK1RA)、5-羟色胺-3 受体拮抗剂(5-HT3RA)和糖皮质激素(地塞米松最常用)组成的三联方案通常被推荐用于接受HEC的患者和接受MEC 的部分患者, 包括接受蒽环类和环磷酰胺(AC)方案、含卡铂方案的患者, 这两种化疗方案被ASCO 和NCCN 归为HEC 类别, 被MASCC/ESMO归为MEC 类别。按指南建议, 现有的止吐药能有效预防大部分患者呕吐[24-27], 但预防恶心仍然是一个医学挑战[19]。
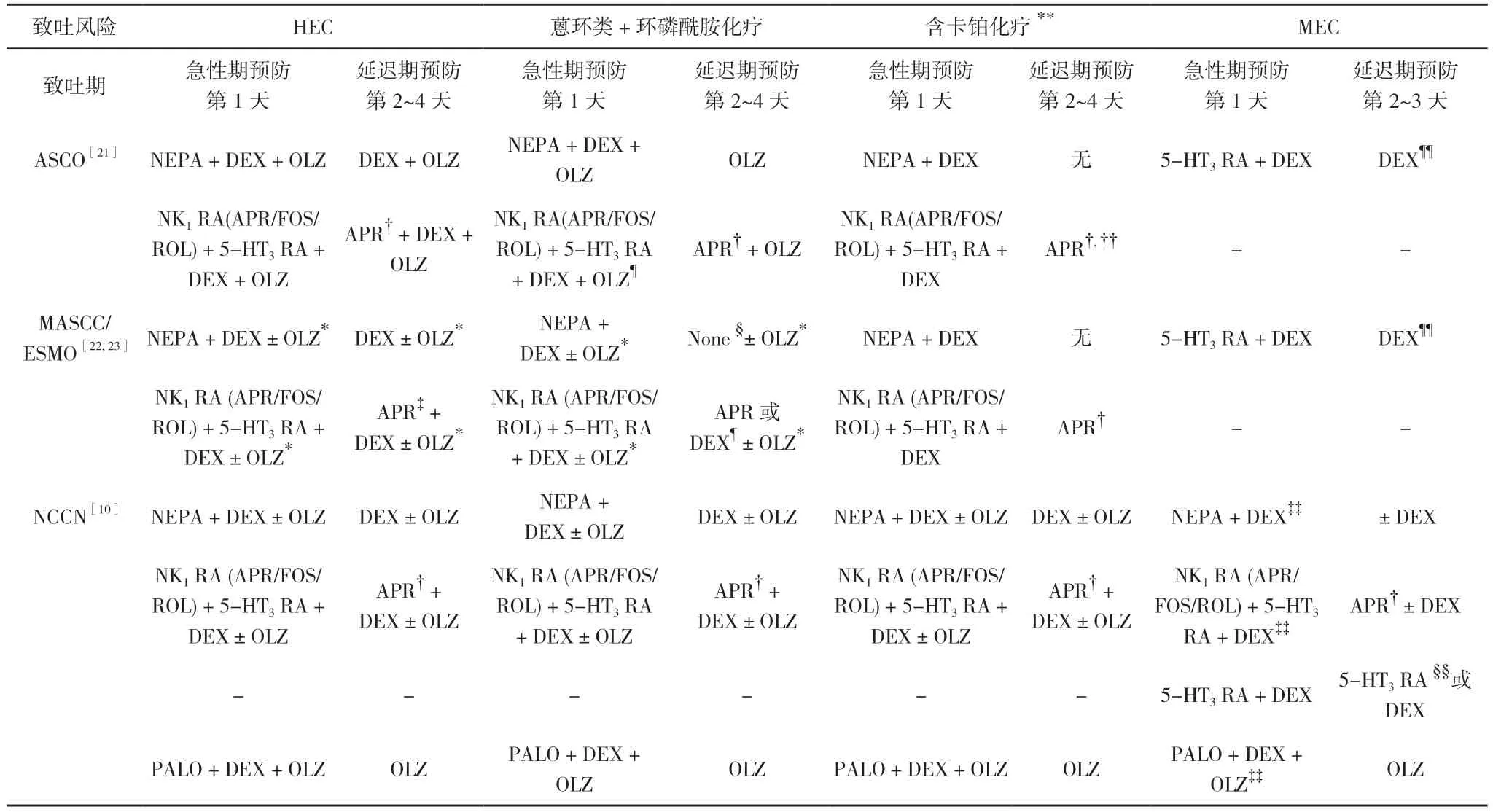
表3 HEC、含蒽环类和环磷酰胺化疗、含卡铂化疗和MEC 方案的止吐治疗指南建议
无法有效预防CINV 的部分原因是肿瘤科医生[28,29]和护士[30,31]对指南建议的依从性总体较低[27]。一些研究发现, 在日常临床实践中, 依从指南的止吐药物处方率低。在欧洲35 个研究中心开展了一项大型观察性研究, 共入组1089 例接受HEC 或MEC 的患者, 这些患者按照研究者选择接受了预防性止吐治疗[32]。仅23%的患者在急性期和迟发期使用的预防性止吐方案与MASCC/ESMO 建议一致。在HEC 患者中, 最常见的指南偏离原因是NK1RA 药物使用率低,45%的患者仅在第1 天使用5-HT3RA 联合或不联合糖皮质激素。在MEC 患者中, 62%的患者接受了与指南一致的预防性止吐治疗。值得一提的是, 依从止吐指南提高了HEC 患者和MEC 患者的完全缓解(complete response, CR)率。
这些研究结果得到了另一项使用欧洲真实世界处方信息数据集进行的研究支持, 该数据集涵盖了489049 例需要使用含NK1RA 预防性止吐方案(根据MASCCESMO 止吐指南)的抗癌治疗数据[29]。在接受含顺铂(45%)或含AC(42%)方案化疗的患者中, 使用NK1RA 的患者比例不到一半, 在接受含卡铂方案化疗的患者中, 使用NK1RA 的患者比例低至19%;在这些化疗患者(使用顺铂、AC 或卡铂化疗)中, 第1 天依从指南使用NK1RA+5-HT3RA+地塞米松方案进行预防的比例仅占18%、24%、7%。重要的是, 低估化疗致吐风险仅仅是不依从指南的一个潜在原因。在另一项类似的数据集分析中, 使用了来自美国217 名医生2012~2018 年的处方数据, 35%的医生在处方含顺铂方案时(n=2543 个疗程)遵循了指南建议, 58%的医生在处方含AC 方案时(n=1490 个疗程)遵循了指南建议[33]。去除预防性止吐方案中的NK1RA 是不依从指南的主要原因。导致指南依从性低的其他原因包括患者用药错误, 患者按医嘱使用止吐方案通常存在很多挑战, 尤其是在家中用药时[28,34]。近期在意大利开展了一项前瞻性观察性研究(NAVY), 对246 例计划接受含AC 方案化疗的乳腺癌患者的CINV 发生率进行了评估, 有99%的患者使用了5-HT3RA+地塞米松预防急性CINV, 但按照国家指南使用NK1RA 阿瑞匹坦联合5-HT3RA、地塞米松的患者不到一半(46%)。值得注意的是, 依从止吐指南使全程CINV 完全防护率增加90%[35]。
止吐方案的复杂性可能会影响止吐指南的依从性,比如给药次数和治疗计划, 这在很大程度上取决于所选择的NK1RA 药物以及三联还是四联预防方案。简单的止吐方案有助于临床医生开具与指南一致的止吐处方, 提高患者用药依从性, 从而提高对指南建议的依从性。治疗便利性最终将有可能改善临床实践中的止吐治疗效果[28,36,37]。
本文对奈妥匹坦(口服)/福奈妥匹坦[静脉推注(i.v.)]联合帕洛诺司琼组成的唯一一款固定剂量复方止吐药NEPA 预防CINV 的疗效和安全性进行了概述。文中讨论了NEPA 关键随机对照试验的结果, 并讨论了如何对这些结果与近期获得的研究结果进行比较。本文也评价了在关键试验之外的其他环境下使用NEPA 获得的初步止吐作用证据。此外还比较了预防性使用NEPA 与首个批准的NK1RA 药物阿瑞匹坦的结局。最后对疾病过程中使用NEPA 控制恶心和维持患者生活质量(止吐药领域的两大主要临床挑战)的支持性研究结果进行了分析。
3 方法
对NEPA 临床开发中的关键研究进行了汇总, 并报告了从批准后研究和临床实践中获得的其他发现。由于研究数量非常有限, 未进行正式的文献检索。关于CINV 和预防性止吐治疗的背景文献筛选是基于作者记录、侧重于CINV 的最新文献检索, 以及论文撰写时最新发布的止吐指南(来自各协会网站)(最后一次访问时间为2021 年10 月)[10,21-23]。
4 NEPA
NEPA 是首个也是唯一一个固定剂量复方止吐药,由高选择性NK1RA 奈妥匹坦(300 mg, 口服)或福奈妥匹坦(235 mg, 静脉给药)与具有独特药理学和临床特点的第二代5-HT3RA 帕洛诺司琼(0.50 mg, 口服;0.25 mg, i.v.)组成。奈妥匹坦和帕洛诺司琼的药代动力学(PK)特征互为补充, 不会产生PK 相互作用, 对NK1受体具有协同抑制作用。因此, NEPA 可通过两个主要呕吐通路有效预防CINV, 其疗效可以覆盖化疗后全程(0~120 h)[38,39]。NEPA 可在化疗开始前大约60 min 口服给药一次, 也可在化疗开始前30 min 静脉输注给药一次。因此, NEPA 给药简单方便, 有助于提高临床医生开具与指南一致的止吐处方, 同时改善患者对治疗的依从性。2014 年, 美国食品药品监督管理局(FDA)依据口服NEPA 联合地塞米松用于化疗初治患者的三项关键临床试验的疗效数据, 批准了口服NEPA, 用于预防单个或多个周期HEC 和MEC 化疗引起的急性和延迟性CINV[38,40-42]。2015 年, 欧洲药品管理局(EMA)批准了口服NEPA 用于接受含顺铂的HEC 和MEC 化疗患者, 预防急性和延迟性CINV[38]。NEPA 可以对各类癌症患者(不考虑性别或年龄)提供有效的预防性止吐, 包括控制恶心。因此, NEPA 一经批准便迅速引起了各大癌症协会的关注, 并纷纷将其纳入各自的止吐指南中[10,21-23]。随后, NEPA 静脉制剂也获得FDA(2018 年)和EMA(2019 年)的批准, 止吐指南也建议NEPA 静脉制剂可以与其口服制剂互换使用, 从而为改善CINV 管理增加了一个剂型选择[43], 进一步方便了患者(尤其是吞咽困难的患者)和临床医生。
5 NEPA 临床开发
5. 1 NEPA 关键临床试验:疗效和安全性 按照监管机构的注册要求, 在多项随机对照试验中评价了NEPA的止吐疗效, 现汇总于表4[40-42,44-51]和表5[40-42,44,46-51]中。在接受HEC 的患者中, 口服NEPA+地塞米松方案对急性期、延迟期和全程完全缓解、无明显恶心(no significant nausea, NSN)方面的疗效优于帕洛诺司琼+地塞米松方案[42]。在一项比较两种NK1RA 疗效和安全性的Ⅲ期头对头研究中, 单次口服NEPA+地塞米松方案的全程完全缓解率非劣效于3-日口服阿瑞匹坦+格拉司琼+地塞米松方案。此外, 与阿瑞匹坦方案相比, 口服NEPA 在延迟期和全程不需要挽救治疗患者比例方面, 也具有显著优势。在延迟期和全程无呕吐和无明显恶心方面, 尽管组间差异未达到统计学意义,但口服NEPA 组无呕吐和无明显恶心患者的比例在数值上高于阿瑞匹坦组[44]。值得注意的是, 口服NEPA组每日爆发性CINV 发生率在化疗后5 d 内逐步下降,而阿瑞匹坦治疗组的每日爆发性CINV 患者都维持在一定的比例;在化疗后第5 天, 口服NEPA 组的爆发性CINV 发生率从14%显著降低至8%, 差异具有统计学意义(P=0.006)[52]。NEPA 不同制剂比较显示, 静脉NEPA 具有与口服NEPA 相似的疗效, 而且也与既往在HEC 顺铂化疗患者中开展的研究结果一致[42,44]。
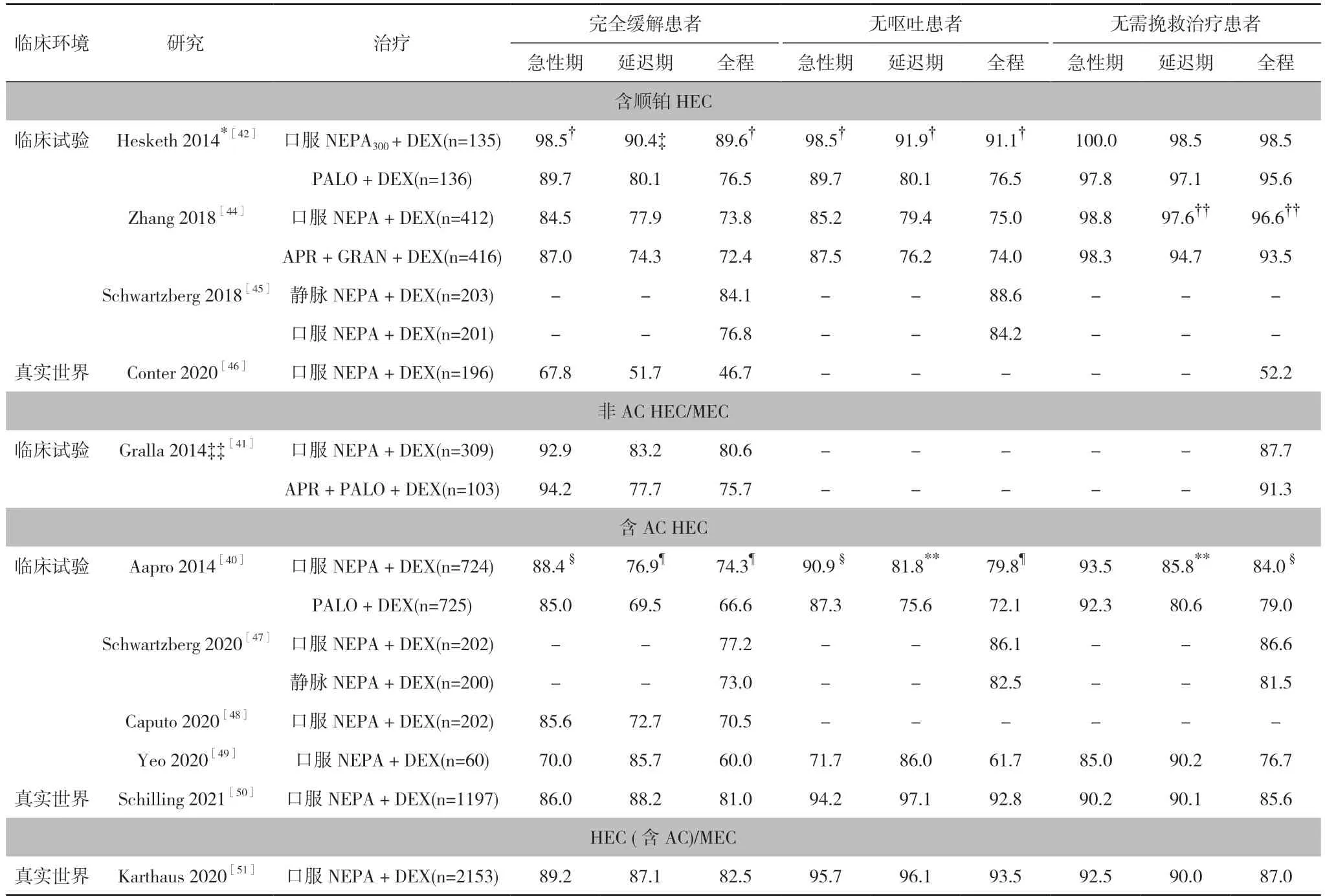
表4 NEPA 在临床试验和真实世界研究中止吐疗效的完全缓解率、无呕吐率和无需挽救治疗率- 单周期化疗汇总(%)
在接受含AC 方案化疗的患者中, 口服NEPA+地塞米松组单周期化疗后急性期、延迟期和全程的完全缓解率均显著高于帕洛诺司琼+地塞米松组, 并持续了多个化疗周期。此外, 口服NEPA 显著降低了延迟期和全程无明显恶心率[40]。对于静脉NEPA, 第1 个化疗周期的止吐活性与口服制剂对所有分析的疗效终点相似, 且这种相似在4 个化疗周期都得到维持[47]。
一项Ⅲ期安全性研究评价了口服NEPA 用于非-AC HEC 和MEC 化疗患者的疗效, 患者按3∶1 的比例随机分组, 接受口服NEPA+地塞米松治疗或阿瑞匹坦+帕洛诺司琼+地塞米松治疗[41]。尽管疗效是该研究的次要目的, 而且未对治疗组间差异进行统计学分析, 但在口服NEPA 组患者中, 全程和延迟期完全缓解率在数值上高于接受阿瑞匹坦方案的患者。同样,口服NEPA 组的延迟期和全程无明显恶心率较高, 在数值上优于阿瑞匹坦组[41]。
在各种化疗中使用NEPA 的安全性特征已经在多项关键研究中得到充分描述。累计对2387 例在单周期或多周期化疗中使用NEPA 口服和静脉制剂的患者进行了评估。NEPA 始终表现出良好的耐受性和有利的安全性特征。见表6[40-42,44,45,47,50,51,53]。与口服NEPA 相关的不良事件(AE)严重程度主要为轻度或中度[40-42,44-47]。最常见的不良事件包括便秘、呃逆和头痛, 与NK1RA 和5-HT3RA 治疗中报告的事件一致。此外, 在单周期和多周期化疗过程中, 口服NEPA 的耐受性良好, 未出现关于心脏安全性担忧的报道[40-42,44]。对于静脉注射NEPA, 治疗中出现的不良事件(TEAE)发生率及特征均与口服NEPA 相似[45,47]。重要的是,静脉注射NEPA 不会引起治疗相关的注射部位超敏反应或过敏性不良事件[45,47]。
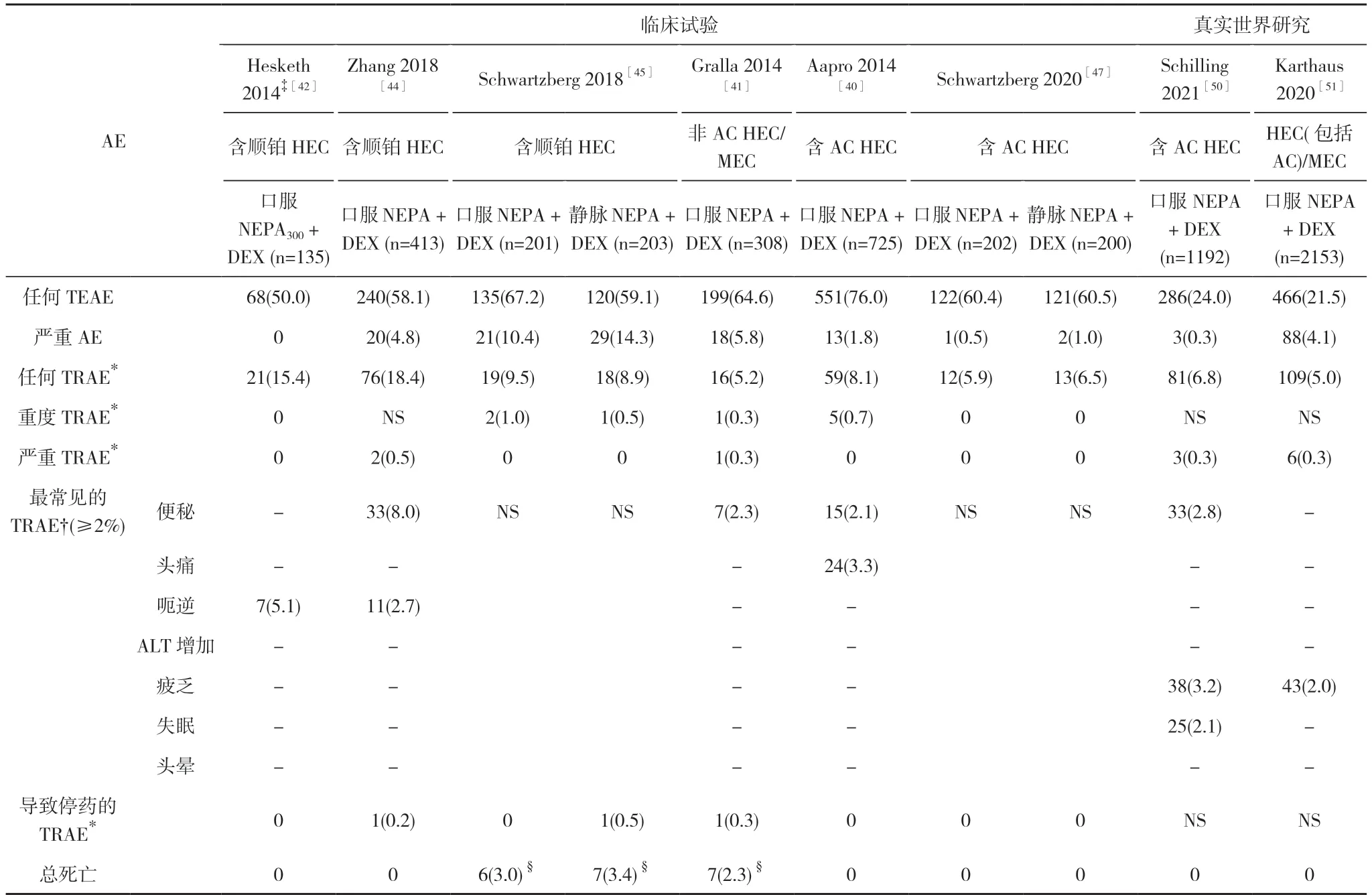
表6 NEPA 在关键试验和真实世界研究中单周期化疗后的安全性 - 安全性人群[n(%)]
5. 2 口服NEPA 上市后经验:止吐疗效和安全性随机对照试验是获取药物疗效和安全性证据的“金标准”。但随机对照试验需要按照监管机构要求, 在严格的试验条件下开展, 包括入组标准、时间期限、选择非典型对照药, 这些因素都会限制试验结果推广到常规临床实践。真实世界数据能提供日常临床实践中关于药物疗效和耐受性方面的信息, 以及对医疗资源利用、医疗成本、药物经济学结局和患者报告结局的影响等信息。因此, 对开展上市后研究的需求越来越大。总体而言, 在日常临床实践环境下开展的按说明书建议使用口服NEPA 的研究证实临床试验中观察到的止吐疗效和安全性。
5. 2. 1 根据说明书使用口服NEPA 的真实世界研究自获批以来, NEPA 已被广泛用于日常临床实践中预防CINV。这种应用有助于在具有不同基线特征和临床环境的各类患者中捕获有价值的信息。这些信息能反映在真实世界中使用NEPA 预防CINV 的结局。在不同国家开展了两项前瞻性真实世界研究, 这些研究中的患者在日常临床实践环境下都按说明书要求口服NEPA。一项大型观察性研究(AkyPRO)在德国162 个研究中心入组了共2173 例患者, 调查在最多3 个HEC和MEC 化疗期间口服NEPA 的临床结局[51]。口服NEPA 在完全缓解率、无呕吐率和无挽救治疗率的疗效终点均与临床试验报告的结果相似, 但在无显著恶心发生率和无恶心率的疗效终点上略低于临床试验的结果。相反, 阿瑞匹坦/福沙匹坦+帕洛诺司琼+地塞米松止吐方案的真实世界研究中的止吐疗效要显著低于其临床试验中报道的疗效, 这可能是因为在日常临床实践中实施该止吐方案的难度较大[54]。值得注意的是, 在AkyPRO 研究中, 大部分医生(≥89%)和患者(≥86%)对3 个化疗周期内使用NEPA 预防止吐的疗效评估结果均为“非常好”或“好”, 这也许说明了该方案在真实世界能带来明确的临床获益[51]。重要的是, 口服NEPA 在日常临床实践中的安全性特征基本上反映了临床试验中报告的安全性。Schilling 等[50]研究中对1197 例接受AC 化疗的乳腺癌患者的亚组分析,在第1 个AC 化疗周期, 急性期、延迟期和全程完全缓解率和无呕吐率均与临床试验数据一致, 但无显著恶心率略有下降, 特别是急性期。
第二项研究是在加拿大开展的多中心、观察性、真 实 世 界 研 究(EVOLVE;NCT03649230)[46], 纳 入了197 例口服NEPA 胶囊预防HEC 相关CINV 的患者, 其中47%的患者接受AC 化疗方案, 21%的患者接受顺铂治疗, 22%的患者接受卡铂治疗[浓度-时间曲线下面积≥4 mg/(ml·min)]。虽然主要研究目的是评估口服NEPA 对患者生活质量的影响, 也评估了疗效和安全性。在第1 个化疗周期, 口服NEPA 对控制CINV 非常有效;急性期、延迟期和全程完全缓解率和无明显恶心率从第2~4 周期逐步升高;而患者对挽救治疗的使用需求在各化疗周期间持续下降。总体而言, 口服NEPA 的耐受性良好。治疗相关不良事件的严重程度大多为轻至中度, 其中以便秘最为常见[41,45-47,50,51,53]。见表7。

表7 NEPA 在关键试验和真实世界研究中多周期化疗后安全性- 安全性人群[n(%)]
5. 2. 2 口服NEPA 用于已批准临床环境的干预性研究近期开展了两项不属于监管机构要求的临床开发项目的前瞻性、非随机、单臂研究, 评估口服NEPA 用于接受AC 化疗的乳腺癌患者。第一项临床Ⅱ期研究在意大利开展, 入组了139 例接受4 个周期AC 化疗的患者[48]。第1 个化疗周期的全程完全缓解率为71%, 口服NEPA 的疗效与其关键Ⅲ期试验报告结果(74%)相似[40]。值得注意的是, 后续化疗全程完全缓解率得以维持, 大部分在第1 个周期得到完全缓解的患者能在第2~4 个周期保持完全缓解状态。总体上, 口服NEPA的耐受性良好, 未发现在各化疗周期间毒性增加的证据。第二项研究在中国的2 个研究中心开展, 入组了60 例接受新辅助/辅助AC 化疗的乳腺癌患者, 其中很多患者伴有其他风险因素[49];35%的患者有晕动病病史, 40%的患者曾在妊娠期发生呕吐。急性期、延迟期和全程的完全缓解率分别为70%、86%和60%, 无明显恶心发生率分别为87%、90%、78%, 无恶心发生率分别为70%、76%、53%。此外, 之前还有一项随机研究比较了口服NEPA 的预防性作用与接受阿瑞匹坦+昂丹司琼+地塞米松方案的患者历史对照数据。口服NEPA 组急性期完全缓解率70%与历史对照阿瑞匹坦组的72%相似。但口服NEPA 组的延迟期完全缓解率86% 和全程完全缓解率60% 完全缓解率均高于阿瑞匹坦对照组64%、47%, 这些临床效果在4 个化疗周期间得以维持。此外, 在控制延迟期和全程无明显恶心方面, 口服NEPA 显示优于阿瑞匹坦对照组(急性期分别为87%、89%, 延迟期分别为90%、74%, 全程分别为78%、66%)。口服NEPA 也表现出良好的耐受性。
5. 2. 3 在其他临床环境中使用口服NEPA 的干预性研究
5. 2. 3. 1 5-HT3RA 治疗失败后使用口服NEPA 的结果 自NEPA 获得批准以来, 也探讨了NEPA 使用在关键试验中描述的临床环境以外的其他临床环境, 以满足当前的各种不同的临床需求。在真实世界环境下开展了多项单中心研究, 这些研究分析了口服NEPA+地塞米松止吐方案对既往接受过5-HT3RA+地塞米松治疗后仍然发生CINV 患者的挽救治疗作用。其中一项研究评价了口服NEPA+地塞米松方案在不同实体瘤患者中的应用, 这些患者均在第1 个卡铂+吉西他滨化疗周期中使用5-HT3RA+地塞米松止吐预防后发生了CINV[55]。共有30 例患者入组, 其中15 例患者(50%)在第1 个化疗周期发生CINV, 并在后续化疗时改用口服NEPA 治疗。在上述15 例患者中, 有13 例患者(87%)在口服NEPA+地塞米松治疗期间实现全程完全缓解, 13 例(87%)和12 例(80%)患者在急性期和延迟期能完全控制呕吐和恶心。口服NEPA 治疗的耐受性良好, 仅2 例患者发生1 级便秘。另一项回顾性研究评价了口服NEPA+地塞米松方案在霍奇金淋巴瘤患者中的应用, 这些患者均曾接受过既往帕洛诺司琼+地塞米松方案预防多柔比星、博莱霉素、长春碱、达卡巴嗪(ABVD)联合化疗, 但仍然发生CINV[56]。在接受ABVD 化疗的32 例患者中, 15 例(47%)患者使用帕洛诺司琼未能控制CINV;因此在后续化疗周期中改用口服NEPA 止吐方案。改用口服NEPA 治疗未导致不良事件增加。8 例(53%)呕吐患者在所有后续化疗周期中实现CINV 控制。尽管这些研究的患者数量较少, 但研究结果表明口服NEPA 对既往预防性使用5-HT3RA 和地塞米松治疗失败的各类化疗患者的疗效依然显著。
5. 2. 3. 2 口服NEPA 在多日化疗中的应用 如何控制CINV 是患者接受多日化疗方案时面临的一个严重问题, 尤其是接受造血干细胞移植(HCT)恶性血液病患者, 因为他们需要接受多日的高剂量预处理化疗方案,而这些化疗方案往往属于HEC 和MEC。对于这些患者,止吐指南建议使用一个NK1RA(阿瑞匹坦)联合5-HT3RA、地塞米松的三联方案[21,23], 或者再加一个奥氮平的四联方案[21]。尽管如此, CINV 控制始终是接受强化预处理化疗方案患者面临的一个临床挑战。含阿瑞匹坦/福沙匹坦的三联或四联止吐方案Ⅲ期试验显示, 仅大约60%的患者能实现全程和延迟期完全缓解[57,58]。
基于一项PK 模型研究中奈妥匹坦总暴露量的预测支持在多日化疗方案中使用奈妥匹坦[59], 有3 项临床Ⅱ期试验已显示口服NEPA 用于多日高剂量化疗患者CINV 预防的证据。
一项前瞻性研究纳入18 例将接受多日表柔比星+异环磷酰胺治疗(21 d 为1 个治疗周期, 每个周期的第1~3 天用药)的肉瘤患者, 评估第1 天单次口服NEPA,同时第1~3 天使用地塞米松对5 d 内(3 d 化疗加化疗后2 d)CINV 的控制作用[60]。第1、2、3 个化疗周期的全程完全缓解率分别为89%、89%、82%。急性期完全缓解率(第1、2、3 个化疗周期分别为100%、99%、94%)和延迟期完全缓解率(第1、2、3 个化疗周期分别为89%、99%、88%)均较高, 在7 d 评估期内,所有患者都不需要挽救治疗。这些结果表明单次口服NEPA 胶囊可以有效预防多日化疗的CINV。
另一项研究在复发/难治性非霍奇金淋巴瘤患者中开展, 这些患者在自体造血干细胞移植(AHCT)前将接受高剂量的多日化疗。本研究将评价多次口服NEPA 单药(不含地塞米松)是否能有效地预防这些患者的CINV[61]。患者从预处理化疗方案给药的首日开始隔日口服一粒NEPA 胶囊。止吐方案不含有地塞米松是因为地塞米松的免疫抑制作用可增加免疫功能已受损人群发生严重感染的风险。在70 例入组患者中,全程(第1~8 天)、急性期(第1~6 天)和延迟期(第7~8 天)的完全缓解率分别为87%、89%、99%。口服NEPA 也能有效控制恶心, 每日无恶心率为65%。尤其是, 隔日一次口服NEPA 方案的耐受性良好, 仅报告了1 例与口服NEPA 相关的不良事件(便秘)。由于地塞米松会进一步抑制这些患者的免疫功能, 因此未将地塞米松纳入预防性止吐方案中;因而, 口服NEPA单药方案对控制CINV 非常有效。有一项研究在进行HCT 并在第1~6 天接受BEAM(卡莫司汀、依托泊苷/阿糖胞苷和美法仑)预处理化疗的43 例患者中评价了多日NEPA 方案[62,63]。患者在预处理的第1、3、6 天口服1 粒NEPA 胶囊, 同时在第1~6 天服用地塞米松。42 例患者完成研究, 其中13 例(31%)患者实现完全缓解(定义为无呕吐、轻度至中度恶心且无需挽救治疗);急性期(第1~6 天)和延迟期(第7~11 天)的呕吐控制率分别为100%、81%。25 例(60%)患者出现显著缓解(显著缓解定义为仅有1 天发生1~2 次呕吐并伴有任何程度的恶心;或无呕吐伴有重度恶心)。与口服NEPA 治疗相关的最常见的不良事件包括便秘(56%)、腹泻(42%)和腹痛(37%)。
这些研究结果表明, 单次或多次口服NEPA 可有效预防多日化疗的CINV。口服NEPA 单药治疗的结局表明在免疫功能受损人群中, 不使用地塞米松可能有助于改善止吐方案的耐受性。初步临床经验表明口服NEPA 方案可提供灵活的给药方案, 可根据特定的多日化疗方案进行调整。
5. 2. 3. 3 口服NEPA 方案中节省地塞米松剂量 尽管NEPA 与地塞米松联合给药, 但正如Di Renzo[61]研究所示, 口服NEPA 单药治疗也能预防CINV。这种单药预防CINV 的意义重大, 因为尽管地塞米松在CINV 管理具有不可或缺的作用, 但地塞米松即使短期使用也会引起副作用。有一项研究发现, 基于医生判断为预防延迟期CINV, 在开始MEC 化疗前给予患者10 或20 mg地塞米松, 这些患者会出现失眠、胃肠道症状、激越、食欲增加、体重升高、皮疹等事件[64]。此外, 地塞米松减量方案也可能有助于解决多药止吐方案给患者带来的额外负担。
多个研究调查了是否降低地塞米松给药频率和总剂量能在激素降低毒性的同时而不影响止吐疗效。一项研究分析纳入了7 项在HEC 和MEC 患者中开展的随机对照试验数据, 共有659 例和649 例患者分别接受1 d 或3 d 的地塞米松治疗, 分析显示两种地塞米松方案具有相似的安全性特征和相当的CINV 控制效果[65]。另一项研究分析仅纳入了在MEC 或含AC 化疗背景下开展的研究, 共包括1970 例患者, 结果证实帕洛诺司琼联合1 d 对比3 d 的地塞米松的止吐方案提供相似的CINV 预防疗效, 包括对延迟性恶心的预防[66]。基于该结果, 在新冠疫情期间, ESMO 建议所有化疗患者使用地塞米松时, 应仅限于第1 天, 并应减量使用[67]。一项临床Ⅲ期非劣效性研究在接受含顺铂化疗的肺癌患者中评价了口服NEPA 联合地塞米松减量的止吐方案[68]。共有228 例患者在化疗前接受了单次口服NEPA 和地塞米松(12 mg, 第1 天), 然后随机分组(1∶1∶1), 进入不含地塞米松组(第2~4 天, DEX1)或4 mg 地塞米松治疗组(第2~3 天, DEX3), 1 次/d,或按指南建议接受4 mg 地塞米松治疗组(第2~4 天,DEX4), 2 次/d。两个地塞米松减量组(DEX1 和DEX3)的全程完全缓解率76%非劣效于指南建议组的75%。治疗组间与地塞米松相关的不良事件严重程度差异不具有临床意义。同样, 在既往一项Ⅲ期对接受HEC 化疗(顺铂或AC)的患者给予阿瑞匹坦联合地塞米松减量方案的研究中[69], 使用阿瑞匹坦/福沙匹坦+帕洛诺司琼+仅第1 天给予地塞米松方案预防CINV 的全程完全缓解率(47%)非劣效于第1~3 天都给予地塞米松的标准方案(44%)。按化疗方案分析时, 在接受含AC 方案化疗的患者中, 采用仅第1 天给予地塞米松的方案进行预防性治疗时, 全程完全缓解率也非劣效于3 d 地塞米松治疗方案;但在接受顺铂化疗的患者中未得到类似结果。因此, HEC 患者预防性使用含NK1RA的方案(即NK1RA+5-HT3RA+地塞米松)时, 第2 天和第3 天可以停用地塞米松。Celio 等[68]开展的研究提供了在顺铂化疗中使用地塞米松减量方案进行止吐预防的初步证据。该研究表明, 口服NEPA 单药治疗能有效预防CINV。口服NEPA 联合减量地塞米松的简化止吐方案可以作为发生过地塞米松相关不良事件的脆弱患者、伴有某些合并症(如糖尿病)的患者, 或在家中易于不依从随访治疗的患者(如老年人, 无家人/护理人员支持的患者)的替代选择。
5. 3 预防CINV:口服NEPA VS 阿瑞匹坦方案 对口服NEPA 联合地塞米松方案与基于其他NK1RA 的止吐方案进行了比较[37,41,42,44,70]。见表8。在上述支持HEC 化疗中使用口服NEPA 的Ⅲ期研究中, 对接受顺铂的化疗初治患者单次口服NEPA 与3 d 阿瑞匹坦+格拉司琼方案进行了直接比较;在第1~4 天, 两组患者同时也接受了地塞米松[44]。在全程完全缓解率上,口服NEPA 组(n=412)非劣效于阿瑞匹坦+格拉司琼组治疗(n=416), 完全缓解率分别为74%、72%。有显著差异的是, 与阿瑞匹坦+格拉司琼组的患者相比, 更多口服NEPA 的患者在延迟期和全程阶段不需要挽救治疗。在5 d 的研究期内, 阿瑞匹坦+格拉司琼组报告每日发生CINV 事件(定义为发生呕吐和/或使用挽救治疗)的患者比例保持稳定为13%~15%, 而口服NEPA 组报告每日发生CINV 事件的患者比例从第1 天的16%,逐步下降至第5 天的8%;一项探索性分析显示, 第5 天两组间的差异具有显著的统计学意义[口服NEPA组为8%, 阿瑞匹坦+格拉司琼组为14%(P=0.0063)]。两组间的不良事件发生率和严重程度均相似。

表8 口服NEPA 和阿瑞匹坦方案的止吐作用总结(%)
对注册研究中接受含顺铂HEC 化疗的患者单次口服NEPA 方案(n=621)和使用3 d 阿瑞匹坦方案(n=576)的数据进行了回顾性的汇总分析[70]。两种方案在急性期的完全防护(complete proection)、完全缓解和无显著恶心(NSN)方面的疗效相似。相反, 对于延迟期的上述3 个疗效终点以及全程阶段的无明显恶心率, 口服NEPA 显著更有效。此外, 口服NEPA 组患者在第3~5 天发生爆发性CINV 的比例显著更低。口服NEPA 组里有405 例患者、阿瑞匹坦组里有353 例患者接受了高剂量顺铂(≥70 mg/m2)化疗[71]。总体而言, 两个高剂量顺铂亚组人群在所有终点的止吐疗效均低于总体人群, 且这种下降在接受阿瑞匹坦止吐预防的患者中显得更显著。高剂量顺铂亚组的口服NEPA 相比于阿瑞匹坦在延迟期的获益优势要比总体人群更大。此外,口服NEPA 组全程阶段的完全防护率和无显著恶心率均显著高于阿瑞匹坦组。
近期在法国开展了一项实效性、随机、前瞻性真实世界研究, Zelek 等[37]比较单次口服NEPA 止吐方案与标准的3 d 阿瑞匹坦止吐方案。该研究入组了接受AC 和各种MEC 方案的患者, 并按照化疗方案进行了分层随机化。与口服NEPA 关键试验不同, 本研究对接受AC 和MEC 方案的患者可进行独立评估分析,而按当地监管机构要求开展的口服NEPA 关键试验接受AC 和MEC 方案的患者是混在一起分析的。NEPA组所有患者[100%(187/187)]都接受了口服NEPA[89%(165/186)]的阿瑞匹坦组患者完成了3 剂阿瑞匹坦给药。第1天, 两组大部分患者都使用了糖皮质激素;但第2 天和第3 天, 使用糖皮质激素的患者降至大约1/2, 第4 天, 只有1/3 的患者使用了糖皮质激素。口服一粒NEPA 方案非劣效于3 d 阿瑞匹坦方案在总体人群的全程完全缓解率上得到证实(口服NEPA 组为65%, 阿瑞匹坦组为54%);与阿瑞匹坦组相比, 口服NEPA 组在急性期和延迟期的完全缓解率分别增加了7%、4%。此外, 口服NEPA 组患者在所有观察期内的无呕吐、不需要挽救治疗和无明显恶心率也在数值上高于阿瑞匹坦组。按化疗方案进行分析时, 接受AC 和MEC 化疗方案的口服NEPA 患者的急性期、延迟期和全程完全缓解率均较高;差异最明显的是MEC 亚组中口服NEPA 患者的全程完全缓解率增加了13%。值得注意的是, 与阿瑞匹坦相比, AC 组中13%的患者在口服NEPA 的延迟期和总体的恶心程度较低。最后, 两组的不良事件和治疗中出现的不良事件发生率及模式相似。
这些研究表明单次口服NEPA 非劣效于3 d 阿瑞匹坦方案, 并提示口服NEPA 可能对延迟期每日CINV提供更好的保护和控制。这些研究也表明在真实世界,口服一粒NEPA 胶囊的依从性优于3 d 阿瑞匹坦方案。
5. 4 NEPA 用于未满足的医疗需求:恶心控制 尽管现有的止吐药和联合止吐方案能有效预防化疗引起的呕吐, 但恶心控制仍然是一个临床挑战, 尤其是延迟期的恶心控制。在临床试验中, 口服NEPA+地塞米松方案是唯一的含NK1RA 的止吐方案被证明其恶心控制效果始终优于5-HT3RA+地塞米松方案[40-42,44,46-51]。见表5。对含顺铂或AC 化疗, 口服NEPA 对延迟期和全程的恶心控制显著优效于帕洛诺司琼[40,42];对非AC 的HEC 和MEC 化疗, 口服NEPA 对延迟期和全程的恶心控制在数值上要优于阿瑞匹坦方案[41,44]。上述在顺铂化疗中比较口服NEPA 和阿瑞匹坦方案的Ⅲ期研究的事后汇总分析[70], 显示口服NEPA 在延迟期和全程无明显恶心率和化疗后3~5 d 的爆发性恶心的获益上要显著高于阿瑞匹坦[70]。值得注意的是, 上述两种止吐方案之间的差异在接受高剂量顺铂的亚组人群中(≥70 mg/m2;口服NEPA 组, n=405;阿瑞匹坦组,n=353)更为明显[71]。此外, 口服NEPA 对恶心的控制作用能持续多个化疗周期。在4 个周期的AC 化疗中,口服NEPA 对恶心控制率始终高于帕洛诺司琼, 口服NEPA 组全程无明显恶心率达到75%~80%, 口服帕洛诺司琼组为69%~75%。尽管是探索性分析, 但每个周期的治疗组间差异均具有统计学意义[72]。在6 个周期非AC HEC 或MEC 化疗中, 口服NEPA 组的全程无显著恶心率也比阿瑞匹坦方案具有数值优势[41,72]。在接受顺铂化疗的患者中, NEPA 静脉和口服制剂控制恶心的疗效相似, 任何级别恶心的发生率分别为10%、7%[45];在4 个AC 化疗周期中也观察到相似的结果[47]。
在日常临床环境下开展的研究证明口服NEPA 预防恶心的疗效与临床试验结果相似[40-42,44,46-51]。见表5。随机试验和真实世界研究在恶心控制方面存在差异, 这些差异可能反映了患者的特征差异。与临床试验的入组人群不同, 观察性研究纳入的是非初治化疗患者, 这些患者可能在既往治疗中发生过恶心, 且更多的患者会有合并症[51]。在这仅有的真实世界环境下直接比较口服NEPA 与阿瑞匹坦方案的研究中, 口服NEPA 方案与3 d 阿瑞匹坦方案在急性期、延迟期和全程无明显恶心率上至少是一样有效[37]。这表明与其他NK1RA 相比, 口服NEPA 在日常临床实践中能维持其对恶心的控制作用。
5. 5 NEPA 对患者生活质量的影响 CINV 对患者生活质量带来的负面影响可能会阻碍患者完成既定的化疗方案[5,6]。因此, 能改善生活质量的治疗策略对优化癌症患者管理至关重要。一些NEPA 的临床试验也对生活质量终点进行了评价[40,44,46,47,50,51]。见表9。对AC 化疗患者, 报告日常生活活动未受到恶心、呕吐影响或恶心呕吐共同影响的口服NEPA 患者比例显著高于接受帕洛诺司琼的患者[40]。对顺铂化疗的患者, 无论是急性期还是延迟期, 口服NEPA 组报告日常生活未受到恶心、呕吐影响或恶心呕吐共同影响的患者比例高于含阿瑞匹坦方案[44], 延迟期恶心未对日常生活影响的评估, 组间差异具有统计学意义。值得注意的是, NEPA 口服和注射两种剂型能给接受一个或两个AC 化疗周期的乳腺癌患者带来类似的生活质量获益[47]。评估口服NEPA 治疗期间的生活质量是大型观察性真实世界研究AkyPRO 的主要临床终点[51]。在第1 个化疗周期, 大部分接受HEC 和MEC 化疗的患者报告呕吐对其日常生活没有影响, 约1/2 患者报告恶心对日常生活没有影响, 约2/3 的患者报告恶心呕吐对日常生活量没有影响。在后续化疗周期中, 呕吐对生活质量的影响保持稳定, 而恶心对生活质量的影响略有增加。乳腺癌患者亚组分析显示, 在第1 个化疗周期中报告呕吐、恶心和恶心+呕吐对其日常生活没有影响的比列分别为84%、53%、64%, 第2、3 个化疗周期的比例略有增加[50]。在加拿大HEC 患者中开展的EVOLVE 研究显示, 在第1 个周期口服NEPA 止吐药期间, 报告呕吐和恶心对其日常生活没有影响的患者比例分别为79%、50%[46]。在第1 个化疗周期报告恶心+呕吐对其日常生活没有影响的患者比例为58%,这个比例在第2、3、4 个化疗周期分别增加至66%、71%、77%。这些研究表明临床试验中口服NEPA 对生活质量的有益作用在真实世界临床实践得到验证。
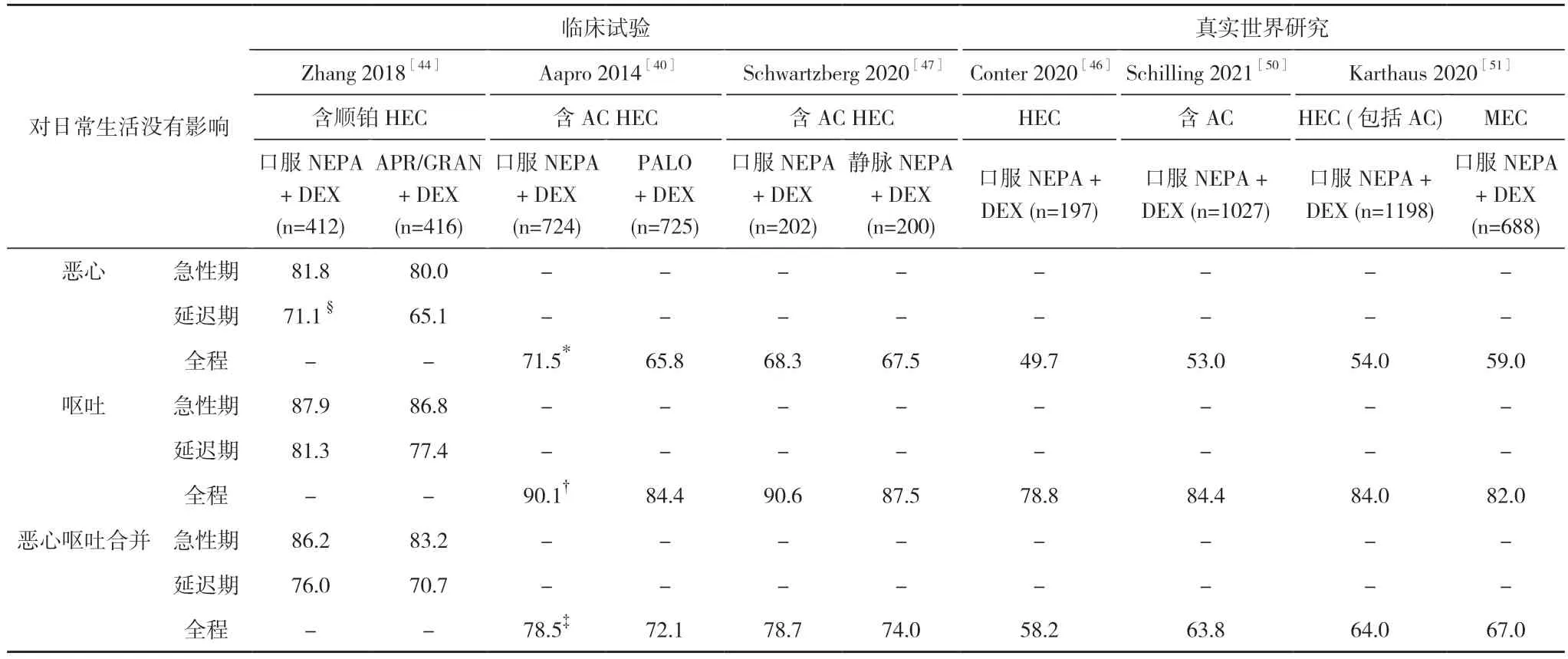
表9 预防性使用NEPA 止吐治疗的患者生活质量(%)
6 口服NEPA 在真实世界的应用及指南依从性
与不依从止吐指南相比, 止吐方案依从指南总能改善HEC、AC 和MEC 化疗方案的CINV 管理[24,26]。日常临床实践中影响指南依从性的因素包括医师是否能开具与指南一致的止吐处方, 患者是否能尊医嘱使用这些止吐药, 以及止吐药本身的安全耐受性[28,30,31]。因给药是在密切监督下进行的, 临床试验中预防止吐方案与指南保持一致通常不是一个问题, 但对CINV 控制效果在真实世界研究中就变得很明显。降低止吐方案的复杂性, 包括减少给药次数和简化治疗计划, 可能是确保依从指南推荐处方和遵从医嘱的关键。含NK1RA 止吐药的给药方案概述见图1。因此, 能够减少给药次数并尽可能减少患者在家中继续使用止吐药的三药联用方案将是有益的。
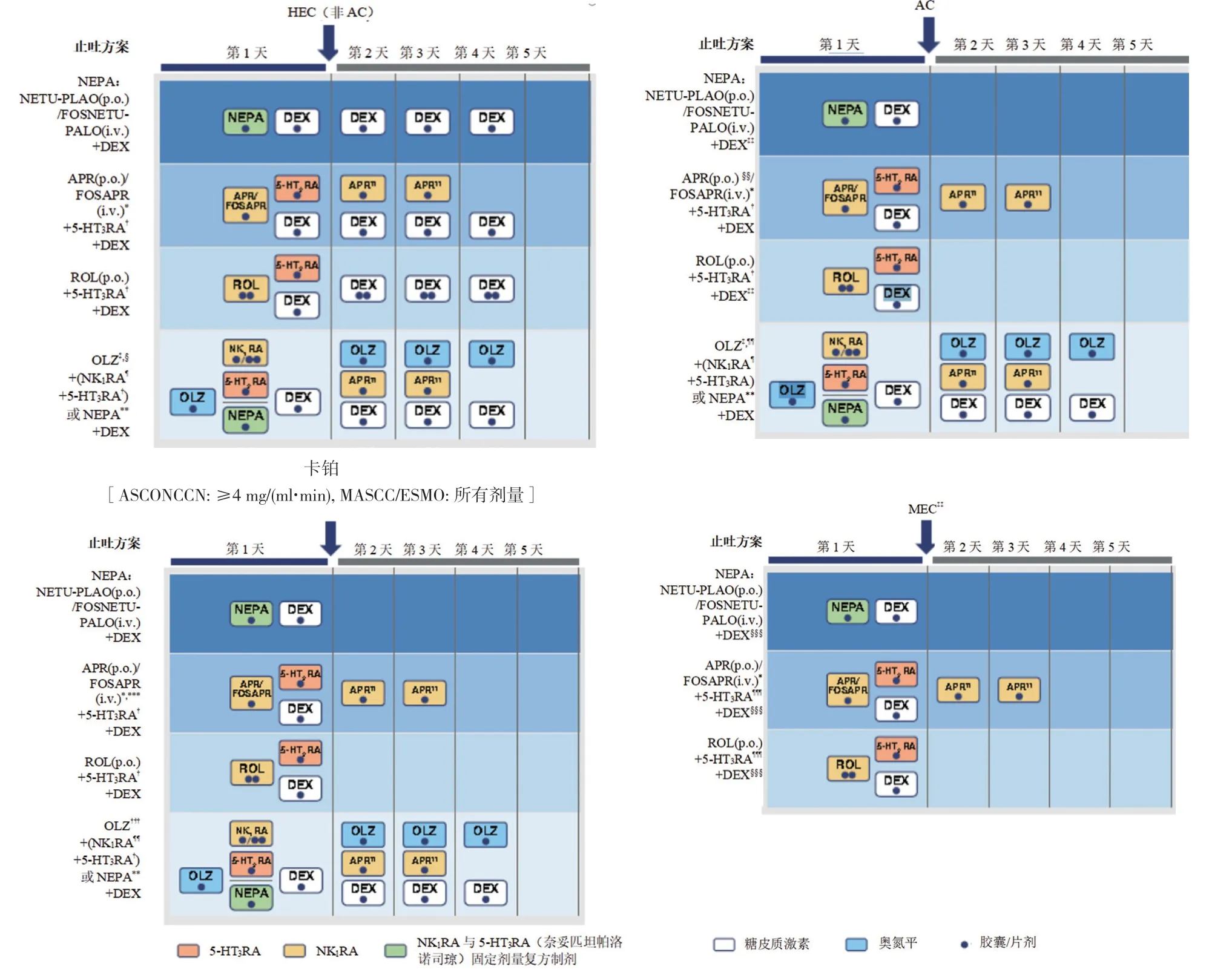
图1 含NK1 RA 止吐方案的给药计划
奈妥匹坦的半衰期(96 h)比阿瑞匹坦(9~13 h)的更长, 这样每个化疗周期的第1 天只需单次口服NEPA即可预防整个致吐风险期。相反, 阿瑞匹坦需要连续使用3 d。口服NEPA 的更便捷给药方案在日常临床实践中给AC 和MEC 患者带来比阿瑞匹坦方案更高的治疗依从性[37]。单次口服NEPA 可以同时给予NK1和5-HT3RA 两种药物;而采用阿瑞匹坦或罗拉匹坦方案时, 5-HT3RA 需要分开给药, 而且给药次数要取决于选用的具体药物。关于糖皮质激素的给药次数, 由于奈妥匹坦和阿瑞匹坦都会抑制细胞色素P450 3A4 酶(CYP3A4)的活性, 而地塞米松主要由CYP3A4 酶代谢。因此与这些药物联合使用时, 地塞米松剂量需要降低。在日常临床实践中, 仅三分之一的患者能坚持使用4 d的地塞米松[37]。口服NEPA 联合地塞米松减量方案仅需要患者在化疗当天单次口服NEPA 外加给予地塞米松, 12 mg/次, 其止吐效果与连续给予4 d 的地塞米松的方案相似[68]。因此, 在化疗当天单次口服NEPA 和一次地塞米松就可以有效控制CINV。该简化方案在临床实践中HEC 患者的应用有待进一步分析。关于药物治疗耐受性方面, 使用较少的药物与较少的给药次数相结合可减少药物-药物相互作用和治疗相关不良事件的机会。值得注意的是, 奈妥匹坦和帕洛诺司琼之间无显著的药物-药物相互作用, 且两种药物有互补的药理学特征[73]。此外, 减少地塞米松剂量可有助于提高虚弱患者和可能不适合糖皮质激素治疗的已有疾病的患者的耐受性[64,67]。因此, NEPA 止吐方案给药简便、灵活, 有助于提高真实世界对止吐指南建议的依从性。
7 结论
本篇综述概述了NEPA 在临床实践中的应用, 讨论了NEPA 在随机对照试验和真实世界环境中的潜在获益。药物获批后, 监管机构越来越多地要求开展在日常实践环境下的研究, 以提供药物相对疗效和耐受性方面的纵向数据, 包括药物对医疗资源利用、医疗成本、药物经济学和患者报告结局的影响。除此之外,非干预性研究对临床医生也具有重要意义。这些研究可以提供止吐药的疗效和安全性的真实世界证据, 因为非干预性研究纳入的患者具有不同的基线特征和临床状况, 往往更能代表整个患者群体。此外, 这些研究不遵循临床试验中的严格给药方案, 从而可以收集患者用药依从性方面的信息。因日常环境会出现超出产品说明书规定的适应证和用药方法的情况, 告知临床医生、患者和政策制定者关于当前使用口服NEPA 及其止吐预防获益的真实世界数据就显得至关重要。
在日常临床实践中按照产品说明书规定的适应症和给药方案使用时, 口服NEPA 对患者的安全和生活质量的影响与关键临床试验中描述的数据一致[46,49-51], 且患者对口服NEPA 治疗的依从性也高[37]。
患者安全和改善生活质量的日常用药经验突显口服NEPA 可适用于有CINV 风险的整个患者人群;这些结局可能与口服NEPA 的良好耐受性和治疗依从性有关。对超出口服NEPA 说明书用药的情况也进行了评价。对于既往曾使用5HT3RA+地塞米松止吐方案预防各类化疗方案CINV 而失败的患者, 口服NEPA 联合地塞米松能有效控制其CINV[55,56]。此外, 也探索了单次和多次给药口服NEPA 预防为准备进行HCT 而进行多日高剂量化疗预处理患者的CINV[60-62]。对该化疗人群,多次口服NEPA 显示良好的耐受性和较高的止吐疗效。相比之下, 只在化疗当天单次口服NEPA 和地塞米松与标准的4 d 地塞米松方案具有相似的止吐疗效。尽管这些研究的样本量有限, 但令人鼓舞的结果支持进一步研究NEPA 用于各种日常临床实践环境。最后,口服NEPA 在全程完全缓解率上一直显示非劣效于阿瑞匹坦方案, 但在延迟期和全程各种止吐疗效终点的控制上要更好[37,44,70,71]。总之, 真实世界数据支持口服NEPA 用于临床开发中考察的各种临床环境, 证实了其在日常临床实践中的疗效和安全性, 及给患者生活质量和治疗依从性带来的获益。此外, 口服NEPA在其他临床环境中止吐预防的结果尚佳, 有可能为扩大NEPA 应用范围提供支持。
作者贡献:所有作者参与了论文撰写, 审阅并批准了论文终稿。
同意发表日期:不适用。
基金资助:Helsinn Healthcare SA(瑞士卢加诺)提供了编辑支持和医学写作协助经费。
利益冲突:Matti Aapro 担任Eisai、Helsinn、Merck、Mundipharma、Roche 和Tesaro 公 司 顾 问, 获 得 了Eisai、Helsinn、Merck、Mundipharma、Roche 和Tesaro 提 供 的 酬 金, 并 获 得Helsinn、Merck、Roche 和Tesaro 资 助。Karin Jordan 担 任MSD、Amgen、Hexal、Riemser、Helsinn、Voluntis、Pfizer、Pommemed、art tempi、AstraZeneca、Takeda、Mundipharma 和Onko Update 顾 问 委 员 会 成员, 并获得了这些公司提供的演讲酬金。Florian Scotté 担任Roche、Amgen、Tesaro、Vifor、MSD、Pierre Fabre Oncology、LEO Pharma、Sanofi、Helsinn 和Pfizer 顾问委员会成员或代言人。Luigi Celio 获得了Italfarmaco SpA 和Kyowa Kirin 提供的咨询费。Meinolf Karthaus 曾担任Helsinn Healthcare 和Riemser Pharma 顾问委员会成员, 获得过Helsinn Healthcare and Riemser Pharma 提供的旅行经费。Eric Roeland担 任Mitobridge Inc.、Asahi Kasei Pharmaceuticals、DRG Consulting、Napo Pharmaceuticals、American Imaging Management、Immuneering Corporation 和prIME Oncology 公司顾问。此外, 他还担任Heron Pharmaceuticals、Vector Oncology 和Helsinn Pharmaceuticals 的 顾 问委员会成员, 也是Oragenics、Galera Pharmaceuticals 和Enzychem Lifesciences Pharmaceutical Company 数据安全监查委员会成员。
致谢:作者感谢参加研究的各研究中心志愿者、研究者和研究团队。感谢Aptitude Health(荷兰海牙)的 Iratxe Abarrategui Ph.D.CMPP 提供了编辑和医学写作协助, Helsinn Healthcare SA 提供了编辑和协助经费。作者对本论文所有内容和编辑决定负全责。Helsinn Healthcare SA 的Carole Terrasanta MSc 和Helsinn Healthcare SA 也参与了论文撰写、审查和批准。

