基于靶标诱导滚环扩增的无标记适配体生物传感器快速检测赭曲霉毒素A
方鹏,王帅,毛瑜,刘长虹
(合肥工业大学食品与生物工程学院,安徽合肥 230009)
赭曲霉毒素A(ochratoxin A,OTA)是由青霉素属和曲霉素属的某些真菌在适宜条件下代谢产生的有害真菌毒素,其在赭曲霉毒素中具有最大毒性[1]。OTA对动物具有致癌性、基因毒性和诱变作用[2],国际癌症研究机构(International Agency for Research on Cancer,IARC)将其指定为2B 类潜在致癌物[3]。OTA 广泛存在于各种农作物和加工类食品中,对食品安全产生了严重威胁[4]。基于色谱的OTA 传统检测方法虽然具有精确和灵敏的特性,但其设备昂贵、样品处理繁琐和检测时间长[5⁃7]。目前最常用的OTA 快速检测方法是酶联免疫吸附试验(enzyme⁃linked immunosorbent assay,ELISA)。该方法具有检测速度快、可携性强的特点[8⁃10],但其使用的抗体容易受到环境因素的影响,难以储存和运输[11],而且OTA 作为一种小分子毒素,具有较低的免疫原性,难以得到相应的优异抗体[12]。在此基础上,需要开发一种灵敏、实时、简便的OTA 检测方法。
适配体是一种新的识别元件,为OTA 的分析检测提供了新的途径,其原理是一条寡核苷酸单链(ssDNA或RNA)通过折叠形成特定的三维结构并对靶标特异性识别[13⁃15]。适配体具有高亲和力、高特异性和优良的热稳定性,并且对靶标的识别能力与抗体相似。与抗体相比,适配体因具有成本较低、批量差异小、易于合成且稳定性高的特性而被广泛应用。基于适配体的生物传感器已经逐渐应用于OTA 检测,包括荧光、比色和电化学传感器等[16⁃18]。相比其他传感器,基于荧光的适配体生物传感器具有操作简单、成本低、高灵敏性等优点[19⁃20]。但是许多基于荧光检测的方法需要对适配体进行化学荧光修饰,这极大地影响了适配体对靶标的特异性识别,因此迫切需要开发一种特异性强、灵敏性高、成本低的无标记适配体检测方法。
SYBR Gold 是一种具有良好生物相容性的核酸染料,可与适配体结合,增强检测的荧光信号[21⁃23]。因此可以结合SYBR Gold 增强荧光信号的特点,构建一种灵敏性高、特异性强的OTA 适配体生物传感器。由于在各种扩增反应策略中,包括杂交链反应(hybridiza⁃tion chain reaction,HCR)、聚合酶链反应(polymerase chain reaction,PCR)、链置换扩增(strand displacement amplification,SDA)、解旋酶依赖性扩增(helicase⁃de⁃pendent amplification,HDA)和滚环扩增(rolling circle amplification,RCA),RCA 因其恒温和简单高效的酶促反应而突出[24⁃25]。故RCA 扩增产生一个相当长的单链序列,可以与SYBR Gold 结合,产生强烈的荧光信号[26⁃28]。
为了建立无复杂化学标记的基于适配体的OTA检测方法,本研究利用无标记DNA 探针建立一种简化的荧光“开启”适配体生物传感器,用于高灵敏性和强特异性的OTA 检测。该DNA 探针由OTA 适配体与RCA 引物两部分组成,以OTA 适配体作为识别元件,RCA 引物作为RCA 的启动元件,在OTA 存在的特定环境中,适配体区域优先与OTA 特异性结合,探针自身结构被打开,RCA 引物区域与环状DNA 模板(circu⁃lar DNA template,CT)碱基互补从而启动RCA,产生一条长的ssDNA,可以与SYBR Gold 结合产生荧光信号,从而实现快速、无标记、高灵敏性和强特异性的OTA 检测,在食品安全检测中具有良好的应用前景。该传感器为无化学标记适配体生物传感器的进一步开发和探索提供新思路。
1 材料与方法
1.1 材料与试剂
OTA、玉米赤霉烯酮(zearalenone,ZEN):美国Sigma⁃Aldrich 公司;黄曲霉毒素B1(aflatoxin B1,AFB1)、MgCl2、1×磷酸盐缓冲液(phosphate buffered saline,PBS)、吐温⁃20:生工生物工程(上海)股份有限公司;呕吐毒素(deoxynivalenol,DON)、三(羟甲基)氨基甲烷盐酸盐[Tris(hydroxymethyl)aminomethane hydrochloride,Tris⁃HCl]:山东源野生物科技有限公司;T4 多核苷酸激酶(T4 polynucleotide kinase,T4 PNK)缓冲液、T4 DNA 连接酶、T4 PNK、腺嘌呤核苷三磷酸(adenosine⁃triphos⁃phate,ATP)、脱氧核糖核苷三磷酸(deoxy⁃ribonucleo⁃side triphosphates,dNTPs)、10×RCA 反应缓冲液、phi29 DNA 聚合酶(phi29 DNA polymerase,phi29 DP)、二硫苏糖醇(dithiothreitol,DTT):新英格兰生物实验室;SYBR Gold:美国赛默飞世尔科技公司;黑色96 孔板:北京兰杰柯科技有限公司;可拆卸式96 孔板:美国康宁公司。以上所有试剂均为分析纯。稻谷:市售。
不同长度的探针、环状模板和连接模板的序列见表1。探针3′端包含不同长度的线性RCA 引物,用于与CT 的碱基互补配对,5′端具有固定碱基(nucleo⁃tide,nt),能特异性识别OTA 的适配体。

表1 不同长度的探针、环状模板和连接模板的序列Table 1 Sequences of probes with different lengths,circular tem⁃plate,and ligation template
1.2 仪器与设备
紫外可见分光光度计(GENESYS 10S)、全自动酶标仪(Multiskan FC):美国赛默飞世尔科技公司;凝胶成像仪(Tanon MINI SPACE 2000):合肥吉象生物技术有限公司;全波长多功能酶标仪(Varioskan Flash):继圣(上海)医疗器械有限公司;手提紫外分析仪(ZF⁃5):上海嘉鹏科技有限公司;电泳仪(DYY⁃6C):北京六一生物科技有限公司;干式恒温器(MK2000⁃2E):杭州奥盛仪器有限公司;台式高速冷冻离心机(H1⁃16KR):湖南可成仪器设备有限公司。
1.3 方法
1.3.1 CT 的制备
将1.5 nmol/L 的ssDNA 与20 U T4 PNK、1 mmol/L ATP 和1×T4 PNK 缓冲液在37 ℃下孵育40 min,然后将孵育后的混合物在95 ℃下加热5 min 进行灭酶。将上述反应混合物与2µL 的100µmol/L DNA 模板(DNA template,LT)混合后将混合物在90 ℃下加热3 min,在室温下冷却15 min。加入40 µL 10×T4 DNA 连接酶缓冲液(400 mmol/L Tris⁃HCl,100 mmol/L MgCl2,100 mmol/L DTT,5 mmol/L ATP,25 ℃,pH7.8)和2 µL T4 DNA 连接酶(5 U/µL),在室温下孵育反应2 h,在90 ℃下加热5 min 使连接酶失活。用无水乙醇在⁃40 ℃下沉淀CT 并通过12%变性聚丙烯酰胺凝胶电泳(denaturing polyacrylamide gel electrophoresis,dPAGE)对CT 进行浓缩纯化,最后采用紫外分光光度计测定纯化后CT 的吸光度A260并计算得出其浓度。CT 的计算公式如下。
式中:C为CT 的纯化浓度,mmol/L;A260为CT 在吸收波长260 nm 处的吸光度;MW为CT 的分子量,µg/µmol;c为在1 mL、1 cm 光程标准比色皿中,260 nm 波长下吸光度为1 的寡核苷酸单链溶液的核酸浓度,33µg/mL。
1.3.2 OTA 的检测方法
将3µL 400 nmol/L 探针和2µL 400 nmol/L CT 与2.5 µL 不同浓度的OTA 在7.5 µL 1×结合缓冲液[1×PBS(pH7.2)、1 mmol/L MgCl2和0.05%吐温⁃20]中室温孵育30 min。加入2 µL dNTPs、2 µL 10×RCA 反应缓冲液和0.2µL phi29 DP 启动RCA 反应。RCA 扩增反应在30 ℃下进行30 min,在95 ℃下加热15 min 进行灭酶。将所得产物加入70µL 1×结合缓冲液和10µL 10×SYBR Gold 混合液中,测量荧光强度(λex/λem=498/540 nm)。对照组除未添加靶标外,其余反应步骤相同。OTA 的荧光信号强度百分比计算公式如下。
式中:W为相对荧光强度百分比,%;F1为有靶标样品的荧光强度;F2为无靶标样品的荧光强度。
1.3.3 探针长度优化
探针由36 nt 的适配体区域与不同长度的RCA 引物区域共同组成,其长度会影响适配体区域对靶标的特异性识别。分别将3 µL 400 nmol/L 不同长度的探针(探针1、探针2、探针3、探针4 和探针5)与2.5µL 50 nmol/L OTA 和2 µL 400 nmol/L CT 混合,在7.5 µL 1×结合缓冲液中室温孵育30 min。余下步骤与1.3.2相同,选择相对荧光强度百分比最大的探针作为检测方法的探针。
1.3.4 探针浓度优化
探针浓度的高低会影响检测方法的灵敏性,合适的探针浓度有利于OTA 适配体对靶标的特异性识别,产生更强荧光信号。稀释探针1(36+8 nt)浓度为0、400、600、800、1 000 nmol/L,分别将3 µL 不同浓度的探针1 与2.5µL 50 nmol/L OTA 和2µL 400 nmol/L CT混合,在7.5µL 1×结合缓冲液中室温孵育30 min。余下步骤与1.3.2 相同,选择相对荧光强度百分比最大的探针浓度作为检测方法的探针浓度。
1.3.5 孵育时间优化
将3µL 400 nmol/L 探针1 和2µL 400 nmol/L CT与2.5µL 50 nmol/L OTA 在7.5µL 1×结合缓冲液中室温孵育不同时间(0、15、30、45、60 min)。余下步骤与1.3.2 相同,选择相对荧光强度百分比最大的孵育时间作为检测方法的孵育时间。
1.3.6 RCA 时间优化
RCA 时间过短会导致荧光信号值不明显,时间过长会导致产物链过多,容易增加空间位阻不利于产物链与核酸染料的结合。将RCA 时间分别设定为15、30、45、60、120 min,将3µL 400 nmol/L 探针1 和2µL 400 nmol/L CT 与2.5µL 50 nmol/L OTA 在7.5µL 1×结合缓冲液中室温孵育30 min。余下步骤与1.3.2 相同,RCA 反应不同时间,测定荧光值,选择相对荧光强度百分比最大的RCA 时间作为检测方法的RCA 反应时间。
1.3.7 灵敏性验证
将2.5µL 不同浓度的OTA(6.6×10-4~660 nmol/L)与3 µL 400 nmol/L 探针和2 µL 400 nmol/L CT 混合,在7.5 µL 1×结合缓冲液中室温孵育30 min。余下步骤与1.3.2 相同。对数据进行处理分析,确定线性方程、检测限度和线性范围。
1.3.8 特异性验证
在上述参数优化条件下,对常见真菌毒素DON、AFB1和ZEN 进行检测,验证OTA 适配体的特异性。将3µL 400 nmol/L 探针1 和2µL 400 nmol/L CT 与2.5µL 100 nmol/L 不同真菌毒素(OTA、ZEM、DON、AFB1)在7.5µL 1×结合缓冲液中室温孵育30 min。余下步骤与1.3.2 相同,比较检测不同真菌毒素的相对荧光强度百分比,确定该无标记适配体生物传感器的特异性。
1.3.9 实际样品检测
在检验荧光无标记适配体生物传感器的准确性之前,对市售稻谷样品进行预处理。称取2 g 稻谷样品并使用粉碎机粉碎至粉末状即可,加入5 mL 的80%甲醇,在1 500 r/min 下振荡1 h,之后在5 000 r/min 下离心8 min。移取450µL 上清液于1.5 mL 离心管中,将OTA 加入到用1×结合缓冲液稀释20 倍的样品溶液中使其浓度为0.5、50 nmol/L,振荡2 h 完全混匀。通过1.3.2 无标记适配体检测方法和1.3.7 确定的线性方程对OTA 进行定量检测分析,验证无标记适配体传感器的实用性。
1.4 数据处理
数据以平均值±标准差表示(n=3);采用Excel、IBM SPSS Statistics 20 和Origin 2021 等软件处理和分析数据。
2 结果与分析
2.1 检测原理
OTA 检测的适配体传感原理如图1所示。
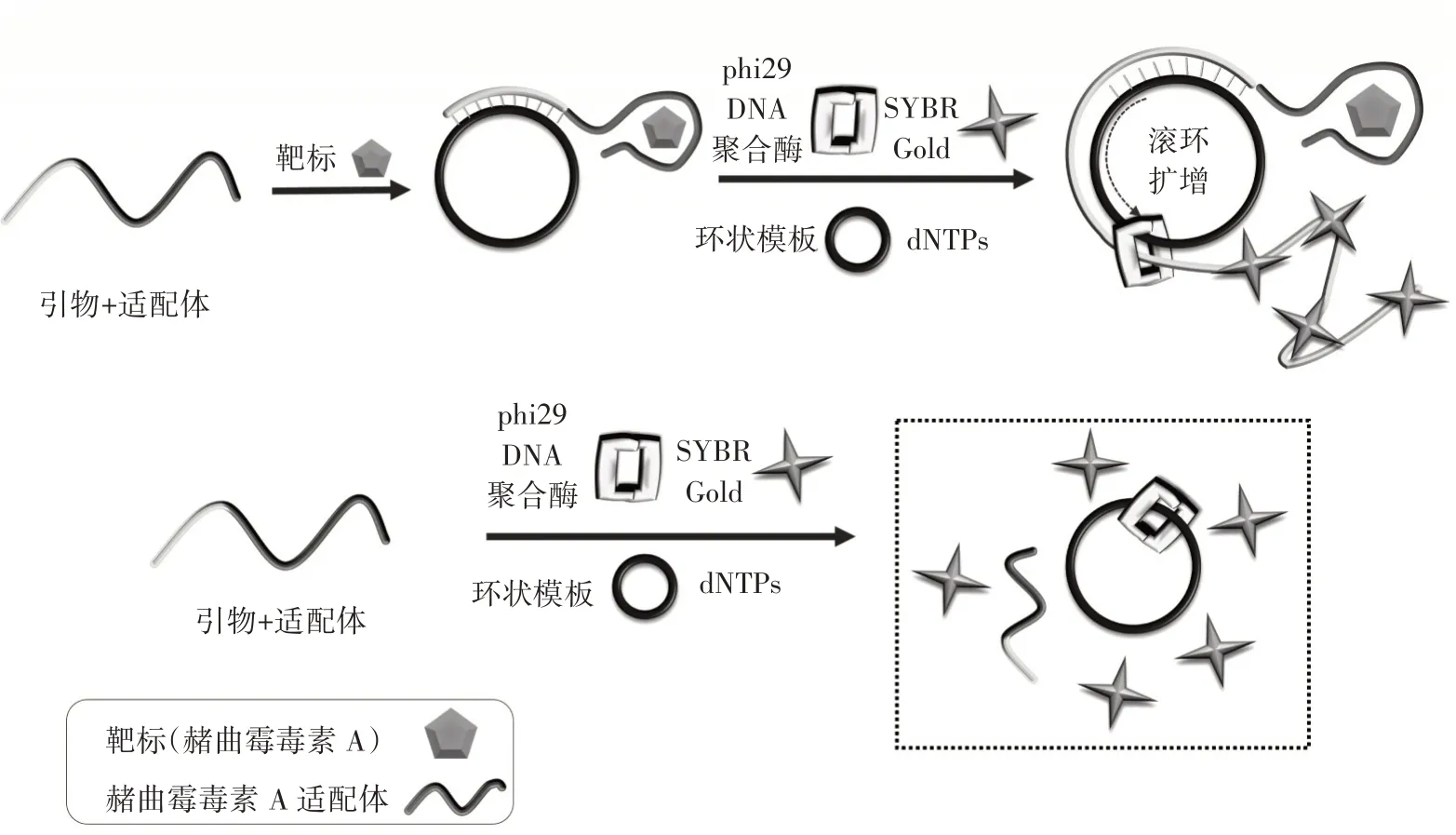
图1 荧光适配体生物传感器原理示意图Fig.1 Schematic diagram of the working principle of the fluorescent aptamer biosensor
由图1 可知,基于由OTA 适配体与RCA 引物两部分组成的双功能探针、RCA 扩增和SYBR Gold 核酸染料,设计一种荧光无标记适配体生物传感器。探针5’端适配体区域与靶标特异性结合,3’端引物区域可与CT 碱基互补。在OTA 存在的结合缓冲液环境中,适配体区域优先与靶标结合,探针自身结构被打开,RCA 引物区域可以自由地与CT 结合,由phi29 DP 启动RCA。随着RCA 的进行,产生了一个长的ssDNA反应产物,该产物可以与核酸染料SYBR Gold 结合,产生高荧光值信号。在没有OTA 的情况下,RCA 引物与OTA 适配体杂交从而使RCA 反应受到抑制,荧光值信号降低。因此,通过检测有无靶标的荧光信号的变化,可以达到快速检测OTA 的目的。
2.2 探针长度的优化
不同长度引物检测的相对荧光强度见图2。
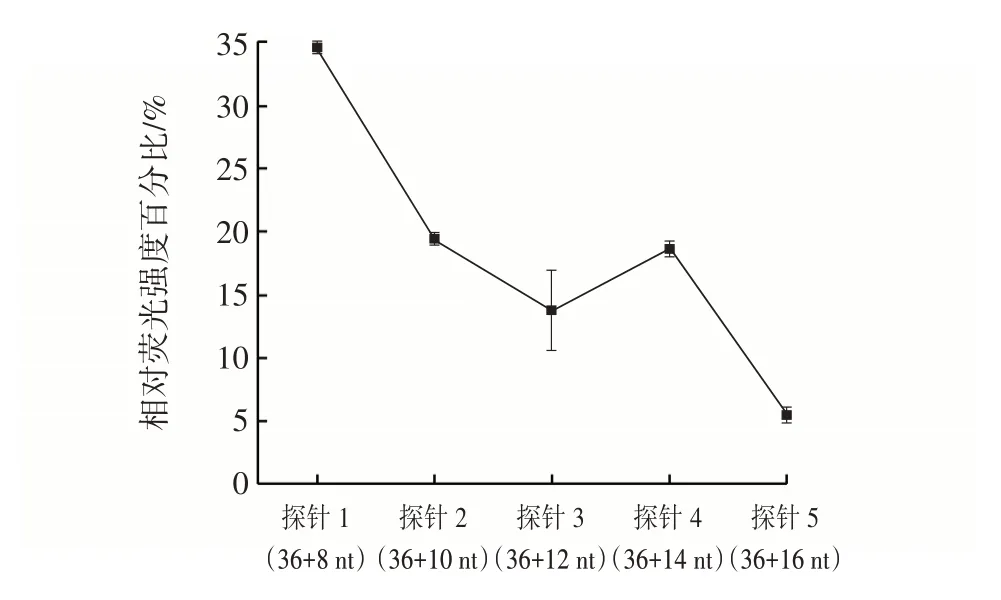
图2 不同长度引物检测的相对荧光强度Fig.2 Effect of primer length on the relative fluorescence intensity
探针由固定碱基的OTA 适配体区域与不同长度的RCA 引物区域共同组成,引物区域作为RCA 反应的启动元件,与该荧光适配体生物传感器的信号输出密切相关。从图2 可以看出,随着引物长度的增加,引物与适配体之间的相互作用增加,增加了适配体与靶标之间的竞争效应。此外,引物长度越长,没有靶标的背景荧光信号越强,相对荧光强度百分比整体随着引物长度的增加而逐渐降低。因此选择8 nt 引物的探针1 长度(36+8 nt)作为最佳探针长度。
2.3 试验条件的优化
为了提升该适配体传感器检测的准确性和灵敏性,同时尽可能缩短检测所需时间,需要对1.3.2 步骤中的试验条件(包括探针浓度、孵育时间和RCA 时间)进行优化,从而得到较为理想的OTA 适配体检测传感器,具体优化结果见图3~图5。
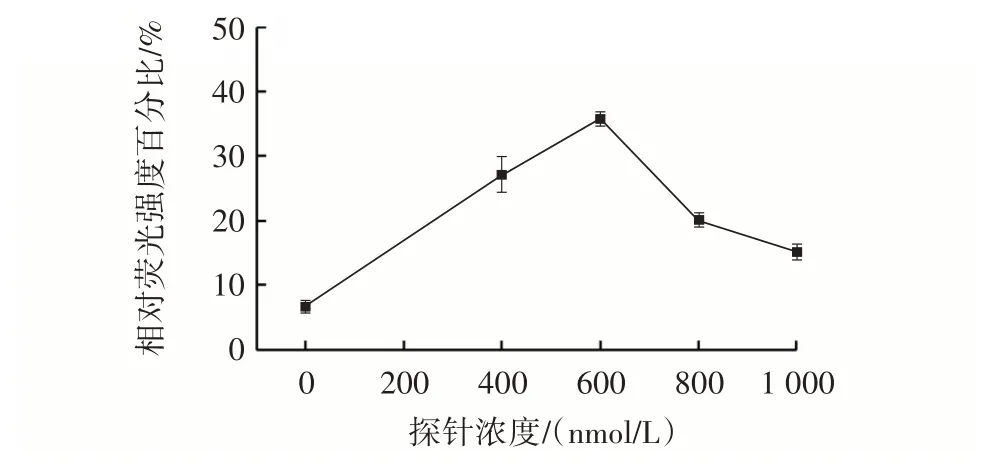
图3 探针浓度Fig.3 Concentration of probe
双功能探针5′端的OTA 适配体可以与靶标特异性结合,并且3′端的RCA 引物区域与CT 碱基互补配对会直接影响RCA 的反应效率,因此需要优化探针的浓度。如图3所示,随着探针浓度的增加,相对荧光强度百分比逐渐增加,在600 nmol/L 时达到最大值,当探针浓度超过600 nmol/L 时,相对荧光强度百分比缓慢下降。说明较低的探针浓度有利于RCA 产物的形成,过高的探针浓度使RCA 反应的产物链发生缠绕,空间位阻增加,RCA 产物与核酸染料的结合无效,导致灵敏性降低。因此,优化后的探针浓度选择为600 nmol/L。
由于不同孵育时间可能会导致靶标与探针特异性结合的量有差距,因此需要优化孵育时间。如图4所示,随着孵育时间的延长,相对荧光强度百分比逐渐增加,30 min 后趋于稳定。因此,确定30 min 为最佳孵育时间。
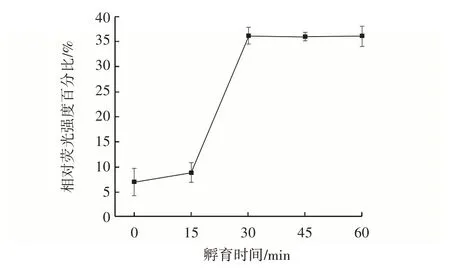
图4 探针孵育时间Fig.4 Incubation time of probe
如图5所示,在15~30 min,相对荧光强度百分比明显增加,在30 min 之后,相对荧光强度百分比降低。这可能是因为RCA 反应产物的增加导致在30 min 内与核酸染料结合更多,导致荧光信号增强,而由于RCA 时间高于30 min,RCA 产物链过长,空间位阻增大,不利于与核酸染料结合导致荧光信号减弱,因此,RCA 最适时间为30 min。
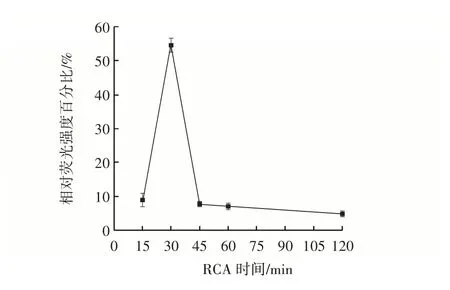
图5 RCA 时间Fig.5 Rolling circle amplification(RCA)time
2.4 OTA 检测的灵敏性分析
在优化条件下,通过检测不同浓度的OTA,验证基于双功能探针和RCA 扩增信号放大方法的荧光适配体生物传感器的灵敏性,结果见图6。
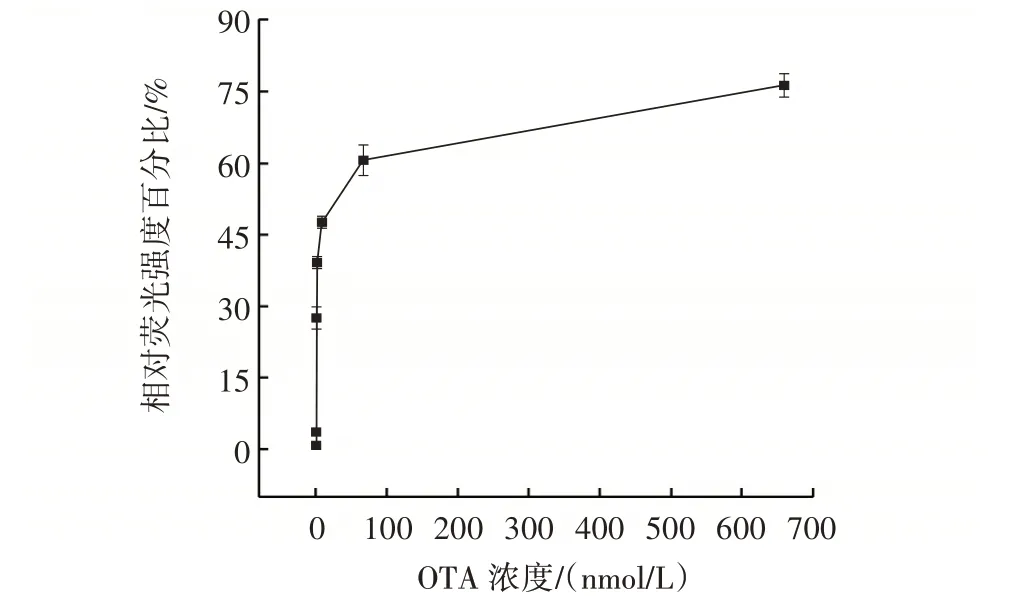
图6 加入不同浓度的OTA 后的相对荧光强度Fig.6 Relative fluorescence intensity after addition of different concentrations of ochratoxin A(OTA)
从图6 可以看出,相对荧光强度信号增强与OTA浓度密切相关,说明其具有较好的信号传感机制,并且当OTA 浓度从6.6×10-2nmol/L 变化到660 nmol/L 时,相对荧光强度信号逐渐增强,与OTA 浓度呈线性相关。线性方程为y=5.722 58x+28.085 95(R2=0.995),检测限度为6.6×10-2nmol/L。表2 总结了其他荧光检测法的检测限度和线性范围。
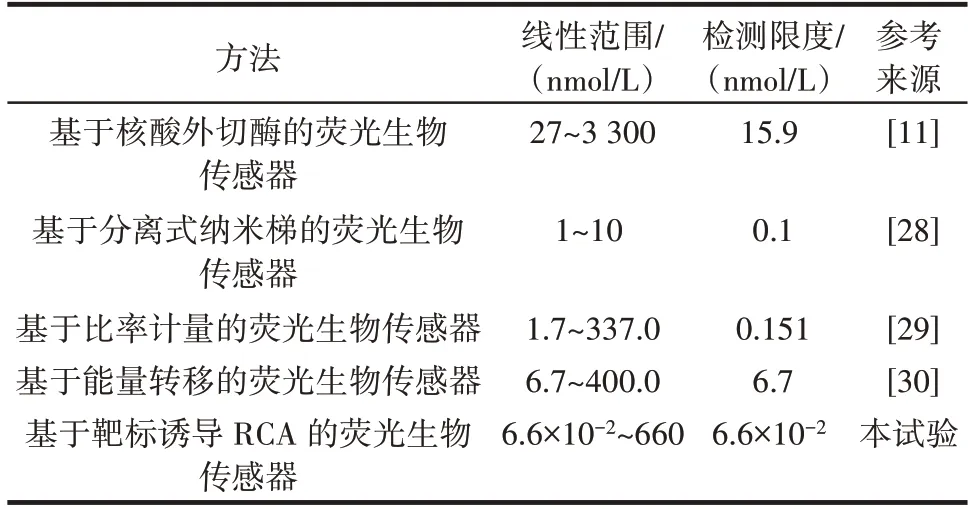
表2 不同适配体传感器对OTA 的检测分析性能的比较Table 2 Comparison on analytical performance among different aptamer sensors for OTA detection
由表2 可知,本研究的适配体生物传感器具有更好的灵敏性。
2.5 OTA 检测的特异性
为研究探针是否能特异性检测OTA,按照1.3.8 所提出的检测方法对其他一些真菌毒素(AFB1、ZEN、DON)进行检测。测试不同真菌毒素在相同浓度(100 nmol/L)下的检测情况,结果如图7所示。
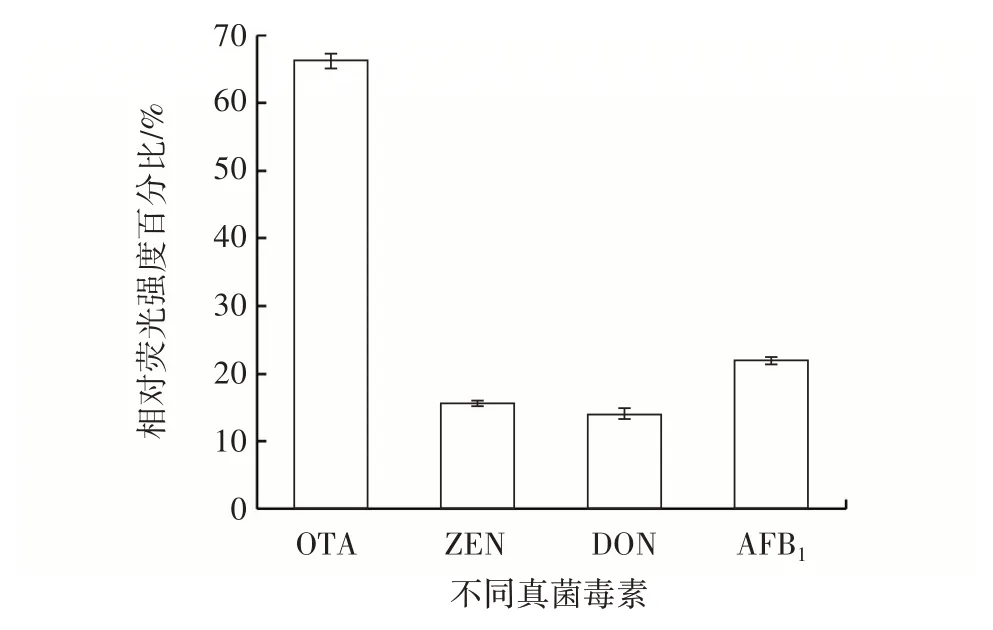
图7 检测各种真菌毒素的相对荧光强度Fig.7 Relative fluorescence intensity of mycotoxins
由图7 可知,OTA 适配体很难识别非特异性靶标,因此探针处于杂交状态,RCA 引物区域不能自由地与CT 结合并启动RCA 反应。以上结果表明,用于OTA 检测的荧光无标记适配体生物传感器具有合理的特异性,足以供实际应用。
2.6 在稻谷样品中的检测应用
为了研究所开发的OTA 适配体生物传感器在实际样品中的检测性能,按照1.3.9 步骤对市售的稻谷样品处理后进行OTA 检测,结果见表3。

表3 稻谷样品中OTA 的检测Table 3 Detection of OTA in paddy samples
如表3所示,在实际稻谷样品溶液中,0.5 nmol/L OTA 的回收率约为84%,50 nmol/L OTA 的回收率约为84%(回收率用OTA 检测值/OTA 添加值表示)。上述结果表明,该检测方法准确,适用于实际的稻谷样品检测分析。
3 结论
本研究中双功能探针由RCA 引物与OTA 适配体两部分组成,在OTA 存在的环境中,双功能探针中适配体区域优先与靶标特异性结合,探针自身结构被打开,引物区域可以自由地与CT 碱基互补启动RCA,产物链可以与核酸染料SYBR Gold 结合产生荧光信号,建立基于靶标诱导RCA 放大荧光信号的一种无标记适配体快速检测OTA 的生物传感器。结果显示,该生物传感器具有较高的特异性,检测限低至6.6×10-2nmol/L,线性动态响应范围宽至4 个数量级,且成功应用于稻谷样品的分析检测。该生物传感器无需复杂化学标记、操作简单、成本低,为食品安全现场快速检测提供参考。

