南酸枣多糖的体外抗氧化、降血糖与降血脂作用
李景恩,董金娇,谢美珍,隋文,吴南生
(1.江西农业大学食品科学与工程学院,江西南昌 330045;2.江西农业大学南酸枣研究所,江西南昌 330045)
代谢综合征是指肥胖、高血压、高血糖、血脂异常等多种心血管疾病的危险因素在同一个体同时存在的临床症候群[1]。高脂肪、高胆固醇等不良饮食的大量摄入以及久坐不动的生活工作方式,使其发病率呈现不断上升趋势。代谢综合征的发病机制十分复杂,主要以胰岛素抵抗和肥胖为核心,可发展为糖尿病、脂肪肝、心血管疾病等,目前应对策略是早发现和早预防,尚无有效治疗方法[2]。为了避免长期服用合成类药物对机体产生的体质量增加、低血糖、肝肾损伤等多种不良副作用,越来越多的研究转向低毒高效的天然产物[3]。
多糖是一类存在于动植物和微生物中的天然大分子活性物质,具有广泛的抗氧化、降血糖、降血脂、抗衰老、抗肿瘤、抗病毒、增强免疫力等生物学作用。研究表明多糖可以通过促进葡萄糖消耗、增加肝糖原、保护胰岛细胞、缓解体内氧化应激、增加糖代谢途径及阻止血糖来源等途径发挥降糖活性[4⁃6]。此外,多糖在血脂调节和心血管疾病的预防及治疗方面也表现出优异的作用。研究表明,多糖可以通过抑制三酰基甘油和总胆固醇合成通路、提高胆汁酸合成途径活性、调控脂代谢相关因子表达、减轻氧化应激反应、改善胰岛素抵抗作用、调节肠道菌群等途径达到降低血脂的效果[7]。
南酸枣[Choerospondiasaxillaris(Roxb)Burttet Hill]又名五眼果、醋酸果、鼻涕果等,主要分布在我国江西、云南、广西、湖南、贵州、四川等地,在印度、日本、中南半岛等国家与地区也有分布[8]。南酸枣鲜果口味酸涩,果肉富含氨基酸、膳食纤维、矿物质等营养元素以及多糖、黄酮、多酚等活性物质[9⁃10]。南酸枣的干燥成熟果实(广枣)具有行气活血、养心安神、消积解毒等功效;鲜食则具有健脾胃、助消化、防暑解毒和醒酒作用[11⁃14]。前期研究中我们以南酸枣果肉为原料,通过乙醇分级沉淀法于体积分数40% 处制备得到一个分子量分布较为均一的酸性多糖组分(Choerospondiasax⁃illarispolysaccahrdies,CAP⁃40)[15]。由于糖尿病、肥胖等疾病的发生发展都与氧自由基的过量产生密切相关[16⁃17],控制氧自由基显得尤为重要,然而目前有关南酸枣多糖在降糖、降脂方面的相关研究还较为缺乏。为了评价南酸枣多糖的体外抗氧化、降血糖、降血脂活性,本研究分别测定CAP⁃40 对DPPH·和ABTS+·两种自由基的清除能力、对α⁃淀粉酶、α⁃葡萄糖苷酶、胰脂肪酶的抑制作用,以及对甘氨胆酸钠和牛磺胆酸钠两种胆酸盐的结合能力,为南酸枣多糖的体内研究及功能开发提供新思路和理论依据,也为南酸枣资源的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜南酸枣:江西赣州;葡聚糖系列标准品(5 000、11 600、23 800、48 600、80 900、148 000、273 000、409 800、667 800 Da)、猪胰脂肪酶(≥125 U/mg):美国Sigma⁃Al⁃drich 公司;岩藻糖(fucose,Fuc)、鼠李糖(rhamnose,Rha)、阿拉伯糖(arabinose,Ara)、半乳糖(galactose,Gal)、葡萄糖(glucose,Glc)、木糖(xylose,Xyl)、甘露糖(man⁃nose,Man)、果糖(frucose,Fru)、核糖(ribose,Rib)、半乳糖醛酸(galacturonic acid,GalA)、葡萄糖醛酸(gluc⁃uronic acid,GlcA)、氨基半乳糖盐酸盐(galactose amino hydrochloride,GalN)、盐酸氨基葡萄糖(glucosamine hy⁃drochloride,GlcN)、N⁃乙酰⁃D⁃氨基葡萄糖(N⁃acetyl⁃D⁃glucosamine,GlcNAc)、古罗糖醛酸(guronuronic acid,GulA)、甘露糖醛酸(mannuronic acid,ManA):博睿糖生物技术有限公司;1,1⁃二苯⁃2⁃苦基肼(2,2⁃diphenyl⁃1⁃picrylhydrazyl,DPPH)、2,2′⁃联氨⁃双(3⁃乙基苯并噻唑啉⁃6⁃磺酸)二铵盐[2,2′⁃azinobis(⁃3⁃ethylbenzothiazoline⁃6⁃sulfonic acid),ABTS]、对硝基苯基⁃α⁃D⁃吡喃葡糖糖苷(p⁃nitro⁃phenyl⁃α⁃D⁃glucopynoside,PNPG)、可溶性淀粉、α⁃葡萄糖苷酶(50 U/mg)、α⁃淀粉酶(50 U/mg)、胃蛋白酶(猪胃黏膜,3 000 U/g)、胰蛋白酶(牛胰,250 U/g):上海源叶生物科技有限公司;三氟乙酸(trifluoroacetic acid,TFA):上海阿拉丁生化科技股份有限公司;甘氨胆酸钠、牛磺胆酸钠、月桂酸⁃4⁃硝基苯酯、乙酸钠、Tri⁃tion X⁃100:上海麦克林生化科技有限公司;无水乙醇、氯化钠、氢氧化钠、过硫酸钾、磷酸二氢钠、磷酸氢二钠、碳酸钠、酒石酸钾钠、3,5⁃二硝基水杨酸、苯酚(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
LC⁃10A 型高效液相色谱仪、RI⁃10A 型示差检测器、AUY 220 型电子分析天平:日本Shimadzu 公司;ICS5000 型离子色谱仪:美国Thermo Fisher 公司;Spectra Max M2 多功能酶标仪:美国Molecular Devices公司;TDL⁃5⁃A 型台式离心机:上海安亭科学仪器厂;SCIENNTZ⁃10N 型冷冻干燥机:宁波新芝生物科技股份有限公司;HH⁃2S 型数显恒温水浴锅:上海恩谊医疗科技发展有限公司。
1.3 方法
1.3.1 南酸枣多糖CAP⁃40 的制备
新鲜南酸枣洗净去皮去核,果肉干燥粉碎。根据前期研究结果[15,18],在最佳提取工艺下提取南酸枣多糖,即料液比1∶40(g/mL),提取温度100 ℃,提取时间5 h。提取液过滤、浓缩,采用不同体积无水乙醇对浓缩液进行分步沉淀,将乙醇浓度为体积分数40%处的沉淀组分命名为CAP⁃40,离心(4 800 r/min,10 min)、干燥后备用。
1.3.2 CAP⁃40 的分子量与单糖组成测定
通过高效凝胶渗透色谱测定CAP⁃40 的相对分子量及纯度。精密称取CAP⁃40 和不同分子量的系列葡聚糖标准品,分别配制成5 mg/mL 的溶液,12 000 r/min离心10 min,上清液经0.22µm 微孔滤膜过滤后待测。液相系统测定条件:采用BRT105⁃104⁃102 串联凝胶柱(8 mm×300 mm),柱温40 ℃,流动相0.05 mol/L NaCl,流速0.6 mL/min,进样量20µL,示差检测器监测60 min。
采用高效离子色谱法测定单糖组成。精密称量10 mg 多糖样品,加入10 mL 3 mol/L TFA,于120 ℃水解3 h 后用氮吹仪吹干;加入10 mL 超纯水涡旋混匀,从中吸取100 µL 加入900 µL 超纯水,12 000 r/min离心5 min,上清液经0.22 µm 微孔滤膜过滤后待测。测定条件:离子色谱柱CarboPacTMPA20(3 mm×150 mm),柱温30 ℃,流动相(A:H2O;B:15 mmol/L NaOH;C:15 mmol/L NaOH 及100 mmol/L NaOAc),流速0.3 mL/min,进样量5µL,电化学检测器监测60 min。根据绝对定量法,测定样品中各单糖质量,然后根据分子量换算为摩尔比。
1.3.3 CAP⁃40 体外抗氧化作用
1.3.3.1 DPPH·清除率测定
取不同浓度的CAP⁃40 多糖溶液(0.2~1.0 mg/mL)各2.0 mL 于试管中,分别加入2.0 mL 80 µg/mL 新鲜配制的DPPH⁃无水乙醇溶液,避光反应30 min 后于517 nm 测定吸光度[19]。按照公式(1)计算DPPH·清除率(D,%)。
式中:A1为样品组吸光度;A2为蒸馏水代替DPPH⁃无水乙酵溶液的背景吸收;A0为蒸馏水代替多糖溶液的空白对照组吸光度。
1.3.3.2 ABTS+·清除率测定
将7 mmoL/L ABTS 溶液与2.45 mmoL/L 过硫酸钾溶液等比例混合,避光反应24 h。采用磷酸盐缓冲液[phosphate buffered saline,PBS,(pH7.4,0.1 mol/L)]进行稀释,直至溶液在734 nm 处吸光度为0.7 左右,得到ABTS 工作液。取不同浓度的多糖溶液(0.2~1.0 mg/mL)各0.8 mL,迅速加入6 mL ABTS 工作液,避光反应6 min后于734 nm 处测吸光度[19]。按照公式(2)计算ABTS+·的清除率(A,%)。
式中:A1为样品组吸光度;A2为蒸馏水代替ABTS 工作液时的背景吸收;A0为以蒸馏水代替多糖溶液的空白对照组吸光度。
1.3.4 CAP⁃40 体外降血糖活性
1.3.4.1 CAP⁃40 对α⁃葡萄糖苷酶的抑制率测定
使用PBS 缓冲液(0.1 moL/L,pH 6.9)制备不同浓度(1.0、5.0、8.0、12.0、16.0 mg/mL)的CAP⁃40 多糖、α⁃葡萄糖苷酶(0.35 U/mL)及PNPG(1.5 mmol/L)溶液。取50 µL 多糖溶液与100 µL α⁃葡萄糖苷酶溶液混匀后于37 ℃下孵育10 min,分别加入100µL PNPG 后继续孵育20 min。最后加入1 mL Na2CO3溶液(1 mol/L)终止反应,在400 nm 处测吸光度[19]。根据公式(3)计算α⁃葡萄糖苷酶的抑制率(G,%)。
式中:As为样品组吸光度;Ab为PBS 缓冲液代替α⁃葡萄糖苷酶溶液的背景吸收;A0为PBS 缓冲液代替样品的空白对照组吸光度。
1.3.4.2 CAP⁃40 对α⁃淀粉酶的抑制率测定
根据文献[19]方法稍作修改,称取酒石酸钾钠18.2 g,溶于50 mL 蒸馏水,加热,于热溶液中依次加入3,5⁃二硝基水杨酸0.63 g、氢氧化钠2.1 g、苯酚0.5 g,搅拌至溶,冷却后用蒸馏水定容至100 mL,配制成3,5⁃二硝基水杨酸(3,5⁃dinitrosalicylic acid,DNS)试剂。以0.1 mol/L PBS 缓冲液(pH6.9)制备不同浓度的多糖(0.1、0.5、1.0、3.0、5.0 mg/mL)及质量分数1%可溶性淀粉;6.7 mmol/L NaCl 溶液制备1 U/mL α⁃淀粉酶。取50µL 多糖溶液与50µL α⁃淀粉酶混匀后于37 ℃孵育10 min,然后再加入50µL 可溶性淀粉继续孵育10 min。加入100µL DNS 试剂终止反应,并将试管在沸水中煮沸5 min 灭活淀粉酶。冷却至室温后,加入1 mL 蒸馏水稀释,于520 nm 处测定吸光度。根据公式(4)计算α⁃淀粉酶的抑制率(M,%)。
式中:As为样品组吸光度;Ab为PBS 缓冲液代替α⁃淀粉酶溶液的背景吸收;A0为PBS 缓冲液代替样品的空白对照组吸光度。
1.3.5 CAP⁃40 体外降血脂活性
1.3.5.1 CAP⁃40 对脂肪酶的抑制率测定
根据文献[20]方法稍作修改,0.8 mg/mL 的月桂酸⁃4⁃硝基苯酯溶液由5 mmol/L 的乙酸钠溶液(含1% Tri⁃tion X⁃100)配制,作为底物溶液。准确吸取50µL 不同浓度(1、5、10、15、20 mg/mL)的南酸枣多糖样品溶液于试管中,分别加入150µL 猪胰脂肪酶溶液(1 250 U/mL)与350 µL PBS 缓冲液(0.1 mol/L,pH7.4),37 ℃预热10 min,随后加入450 µL 底物溶液,充分混匀后置于37 ℃水浴反应2 h。多糖与胰脂肪酶均以PBS 缓冲液配制。随后12 000 r/min 离心10 min,取上清液于405 nm测吸光度。根据公式(5)计算胰脂肪酶抑制率(P,%)。
式中:Aa为空白组吸光度,以PBS 缓冲液代替多糖溶液;Ab为空白对照组吸光度,以PBS 缓冲液代替多糖和胰脂肪酶液;Ac为样品组吸光度;Ad为对照组吸光度,以PBS 缓冲液代替胰脂肪酶液。
1.3.5.2 CAP⁃40 对胆酸盐结合能力测定
根据文献[21]方法稍作修改,分别取1 mL 不同摩尔浓度的甘氨胆酸钠(0.03、0.06、0.12、0.18、0.24、0.30 mmol/L)或牛磺胆酸钠(0.05、0.10、0.15、0.20、0.25、0.30 mmol/L)标准溶液置于具塞试管中,加入3 mL 60% 浓H2SO4溶液,于70 ℃水浴20 min,冰浴5 min 后于387 nm 波长处测定吸光度。以胆酸盐含量为横坐标,吸光度为纵坐标绘制胆酸盐含量标准曲线。
以PBS 缓冲液(0.1 mol/L,pH6.3)分别配制10 mg/mL胃蛋白酶和胰蛋白酶。取1.5 mL CAP⁃40 溶液于具塞锥形瓶中,加入1.5 mL 胃蛋白酶及0.5 mL 0.01 mol/L HCl,在37 ℃下恒温振荡消化1 h,模拟胃消化过程。随后用0.1 mol/L NaOH 溶液调节溶液pH 值至6.3,后加入2 mL 胰蛋白酶,在37 ℃条件下恒温振荡消化1 h,模拟肠道环境进行消化。上述消化后的样品分别加入2 mL 0.4 mmol/L 甘氨胆酸钠或0.5 mmol/L 牛磺胆酸钠,37 ℃恒温振荡1 h 后转移至离心管,4 000 r/min 离心20 min,取1 mL 上清液,按照标准曲线方法分别测定甘氨胆酸钠和牛磺胆酸钠含量,每个样品平行测定3 次。按照公式(6)分别计算甘氨胆酸钠、牛磺胆酸钠结合率(C,%),计算公式如下。
式中:m1为结合前胆酸盐质量,mg;m2为结合后胆酸盐质量,mg。
1.4 数据处理
所有试验重复测定3 次,数据表示为平均值±标准差,利用Excel 绘制图形,使用SPSS 25.0 软件进行统计学分析及IC50的计算。
2 结果与分析
2.1 CAP⁃40 的分子量与单糖组成分析
2.1.1 CAP⁃40 的分子量
通过高效凝胶渗透色谱对CAP⁃40 分子量进行测定,结果如图1所示。
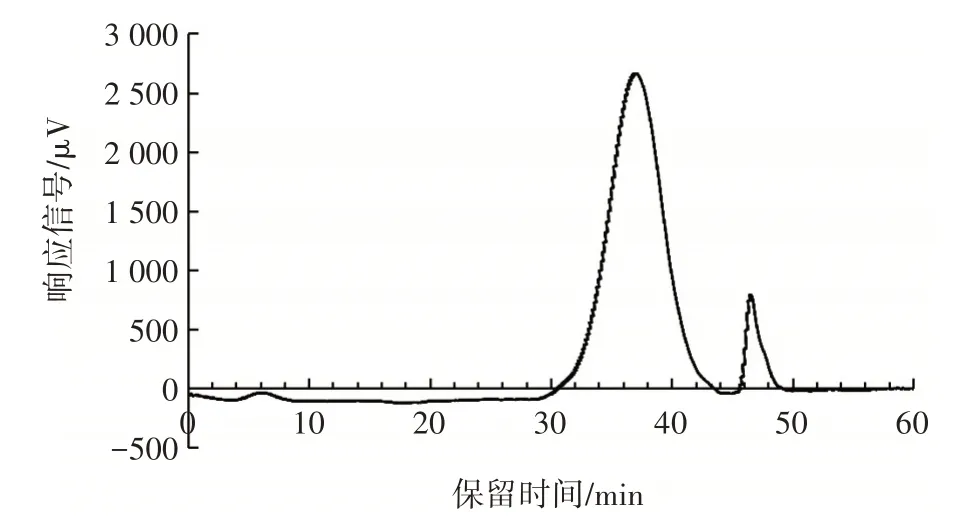
图1 CAP⁃40 的高效液相凝胶色谱图Fig.1 High performance gel permeation chromatography of CAP⁃40
由图1 可知,CAP⁃40 为单一对称的洗脱峰,证明CAP⁃40 为均一的纯化多糖。分别以葡聚糖标准品相对分子量的对数值(logarithm value of relative molecular weight,lgM)与保留时间(retention time,RT)为变量绘制校正曲线,得到lgMw⁃RT 校正曲线方程y=-0.200 1x+12.602,R2=0.994 7;lgMn⁃RT 校正曲线方程y=-0.185 6x+11.858,R2=0.994 1。CAP⁃40 的保留时间为37.023 min,根据标准曲线计算CAP⁃40 的重均分子量Mw为156 206 Da,数均分子量Mn为96 946 Da,分散系数(Mw/Mn)为1.611,表明CAP⁃40 分子量分布范围较均匀。
2.1.2 CAP⁃40 单糖组成分析
单糖混标和南酸枣多糖CAP⁃40 的离子色谱图如图2所示。
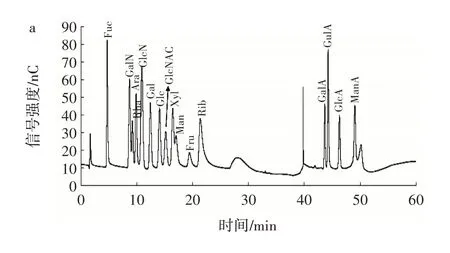
图2 单糖混合标准品及CAP⁃40 的离子色谱图Fig.2 Ion chromatographic analysis of monosaccharides mixed standards and CAP⁃40
CAP⁃40 的单糖组成结果如表1所示。
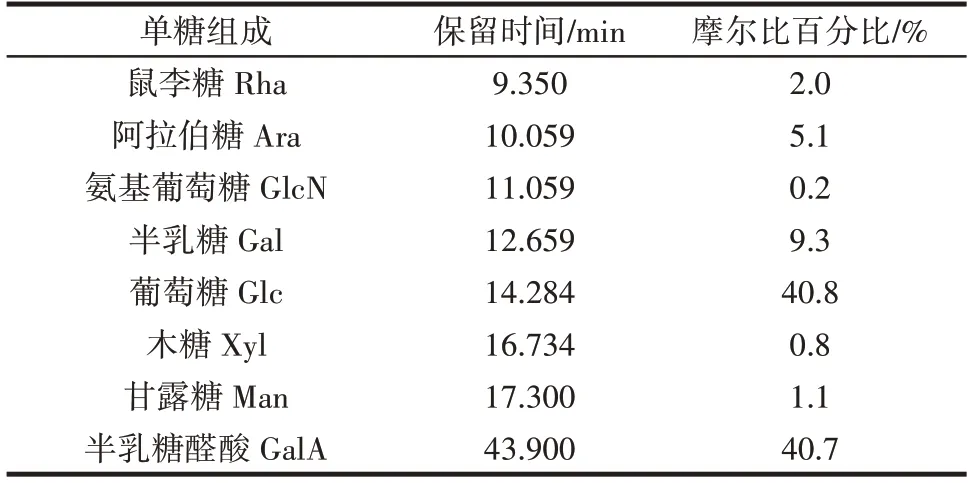
表1 CAP⁃40 单糖组成分析Table 1 Monosaccharide composition analysis of CAP⁃40
由表1 可知,CAP⁃40 是一种由8 种单糖组成的酸性多糖,其中葡萄糖、半乳糖醛酸、半乳糖及阿拉伯糖含量较高,摩尔百分比分别为40.8%、40.7%、9.3%、5.1%,此外还含有少量的鼠李糖、甘露糖、木糖及氨基葡萄糖。
2.2 CAP⁃40 对DPPH·和ABTS+·的清除作用
CAP⁃40 对DPPH·和ABTS+·的清除率如图3所示。
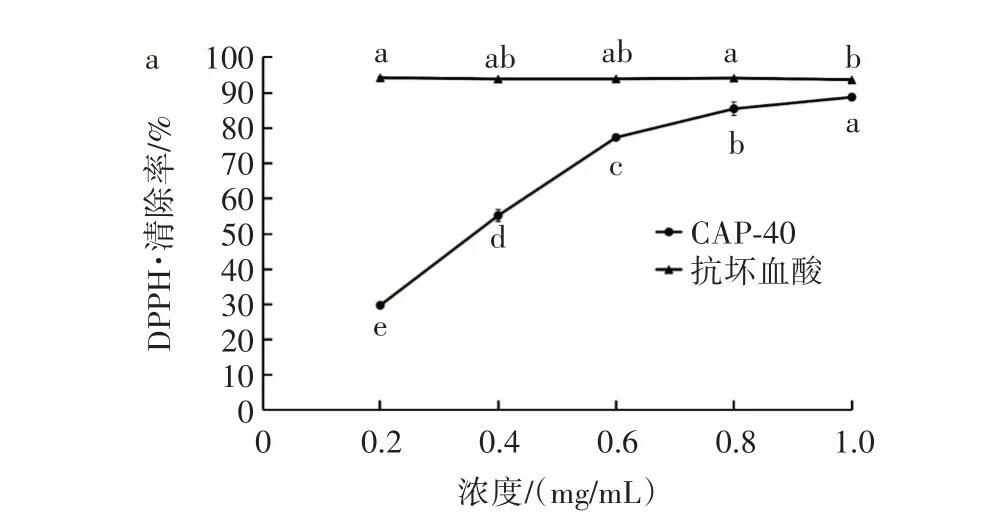
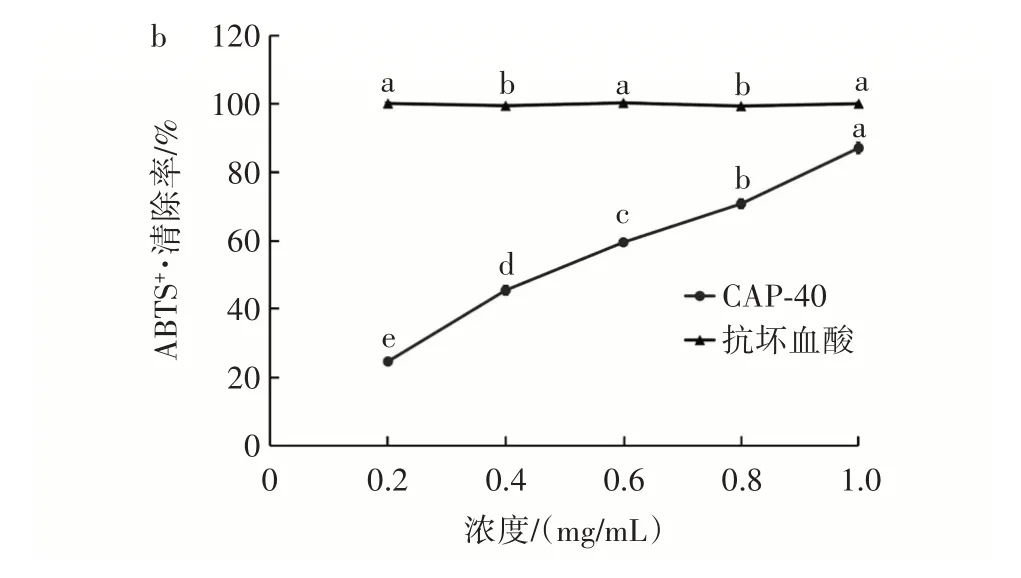
图3 CAP⁃40 对DPPH·和ABTS+·的清除率Fig.3 The scavenging rate of CAP⁃40 on DPPH·and ABTS+·
由图3a 可知,当多糖浓度由0.2 mg/mL 增加到0.6 mg/mL 时,CAP⁃40 对DPPH·清除率迅速上升;从0.8 mg/mL 增加到1.0 mg/mL 时,清除速度趋于平缓;1.0 mg/mL 时,CAP⁃40 对DPPH·的清除能力达到(88.85±1.91)%,但仍低于同浓度下的抗坏血酸的清除率(93.81±0.28)%,其半抑制率IC50为0.362 mg/mL。由图3b 可知,多糖浓度为0.2~1.0 mg/mL 时,CAP⁃40 对ABTS+·的清除能力随多糖浓度的增加而增强,并呈现出量效关系。在1.0 mg/mL 时,清除率达到(87.13±1.63)%,低于阳性对照(100.11±0.34)%,CAP⁃40 对ABTS+·的IC50为0.458 mg/mL。
2.3 CAP⁃40 对α⁃葡萄糖苷酶和α⁃淀粉酶的抑制作用
CAP⁃40 对α⁃葡萄糖苷酶和α⁃淀粉酶的抑制率如图4所示。
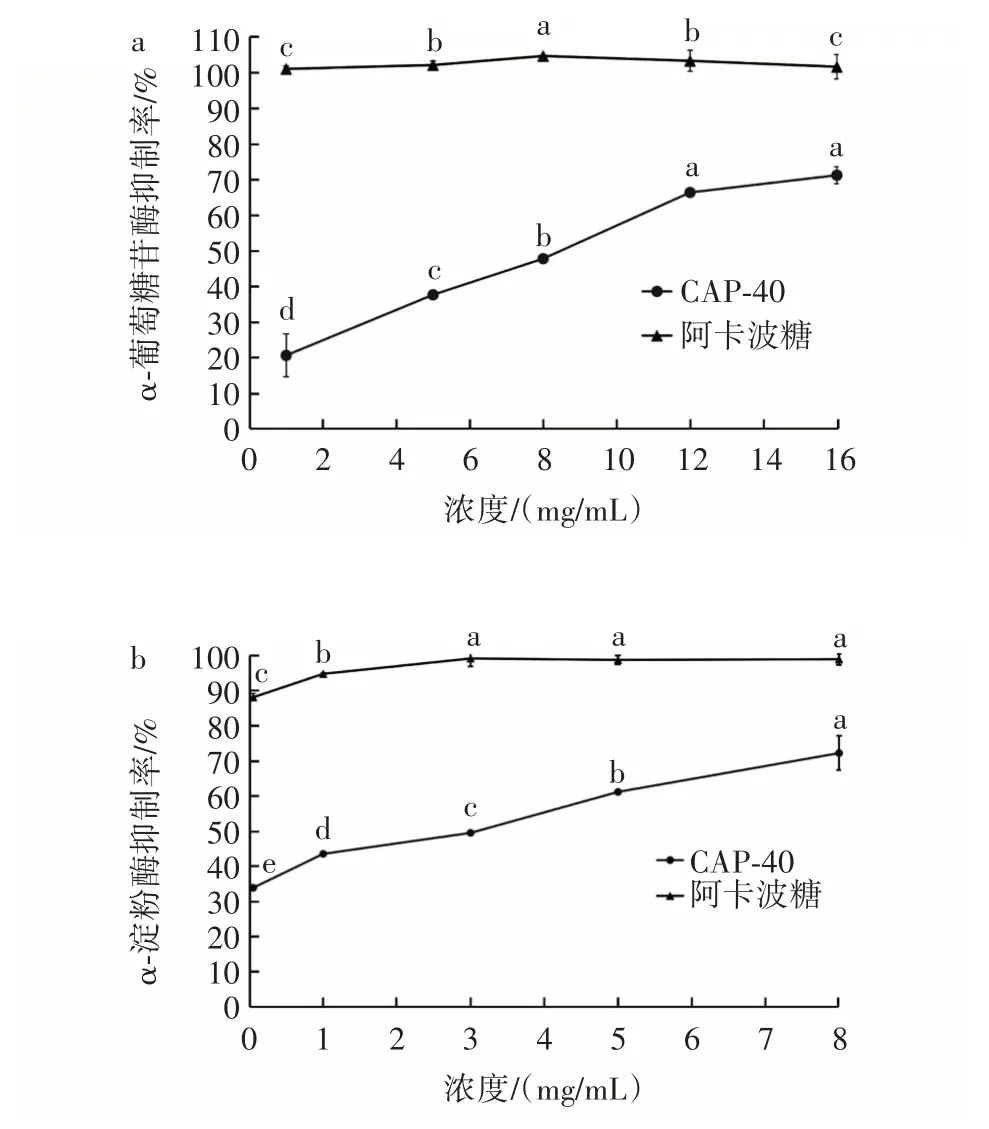
图4 CAP⁃40 对α⁃葡萄糖苷酶和α⁃淀粉酶的抑制率Fig.4 Inhibitory rate of CAP⁃40 on α⁃glucosidase and α⁃amylase
由图4a 可知,在浓度为1~16 mg/mL 时,CAP⁃40对α⁃葡萄糖苷酶活性的抑制率随浓度增加而增加,计算其IC50值为8.351 mg/mL。当大于12 mg/mL 时,CAP⁃40 对α⁃葡萄糖苷酶活性的抑制作用趋于平缓,说明抑制作用可能接近饱和状态,与朱振元等[22]的研究结果一致。在16 mg/mL 时,抑制率为(71.28±2.34)%,高于刘力萍等[23]研究的灰树花胞外粗多糖在50 mg/mL时对α⁃葡萄糖苷酶的抑制率(58.33%)。
由图4b 可知,CAP⁃40 多糖对α⁃淀粉酶活性产生了显著的抑制作用。当浓度由0.05 mg/mL 增至8 mg/mL时,CAP⁃40 对α⁃淀粉酶的抑制率从(33.96±0.36)%升高到(72.29±4.85)%,呈现浓度依赖性。当浓度为1 mg/mL 时,CAP⁃40 对α⁃淀粉酶的抑制率为(43.61±0.24)%,高于王鑫等[24]研究的甜玉米芯多糖在浓度为2 mg/mL 时的抑制率[(26.67±1.67)%];而在浓度为8 mg/mL 时,其抑制率为(72.64±3.53)%,接近甜玉米芯多糖在10 mg/mL 时的抑制率[(75.44±1.94)%],计算CAP⁃40 的IC50值约为3.321 mg/mL。
2.4 CAP⁃40 体外降血脂作用
2.4.1 CAP⁃40 对胰脂肪酶的抑制作用
胰脂肪酶可以将脂肪水解为游离脂肪酸和单酰甘油酯,因此可以通过抑制胰脂肪酶活性,减少机体对脂肪的吸收从而达到降脂目的。CAP⁃40 对胰脂肪酶的抑制率如图5所示。
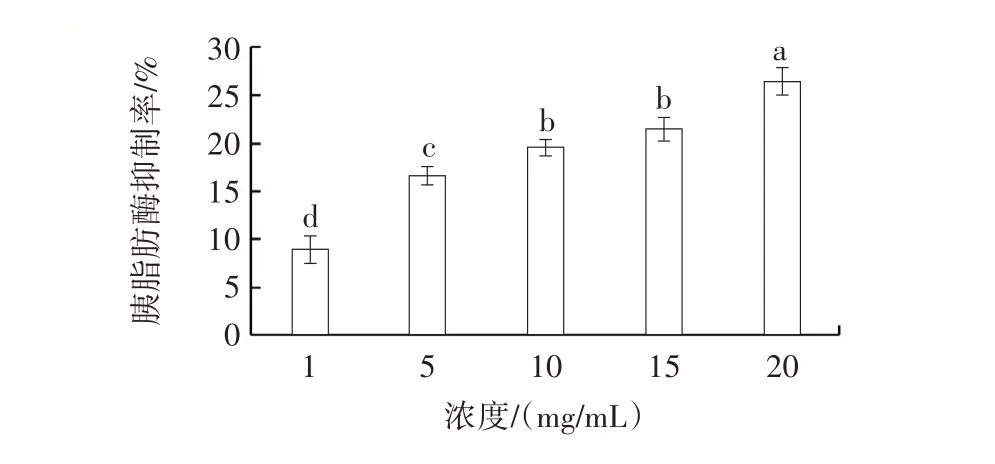
图5 CAP⁃40 对胰脂肪酶的抑制率Fig.5 Inhibition rate of CAP⁃40 on pancreatic lipase
由图5 可知,在试验浓度范围内CAP⁃40 对胰脂肪酶均具有抑制作用,且呈现一定的剂量依赖关系。当CAP⁃40 浓度低于10 mg/mL 时,对胰脂肪酶的抑制率呈显著上升趋势(P<0.05);而当CAP⁃40 浓度高于10 mg/mL 时,抑制率的上升趋势变得平缓。当CAP⁃40浓度为20 mg/mL 时,对胰脂肪酶的抑制率为(26.34±1.41)%。
2.4.2 CAP⁃40 对胆酸盐结合能力
甘氨胆酸钠与牛磺胆酸钠的标准曲线如图6所示。
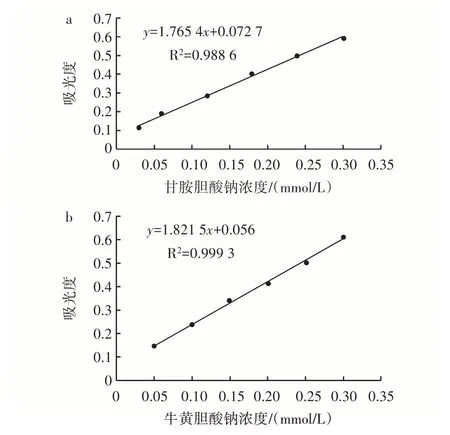
图6 甘氨胆酸钠与牛磺胆酸钠的标准曲线Fig.6 Standard curve of sodium glycocholate and sodium taurocholate
肝脏中的胆汁酸常以胆汁酸钠盐或钾盐的形式存在,其中甘氨酸胆酸钠或牛磺胆酸钠是两种主要的结合型胆酸盐,因此可以通过测定样品对胆酸盐的体外结合能力来预测其降血脂能力[21]。由图6 可知,甘氨胆酸盐标准曲线回归方程为y=1.765 4x+0.072 7,R2=0.998 6;牛磺胆酸盐标准曲线回归方程为y=1.821 2x+0.056,R2=0.999 3,线性关系均良好。
CAP⁃40 对甘氨胆酸钠和牛磺胆酸钠的结合率如图7所示。
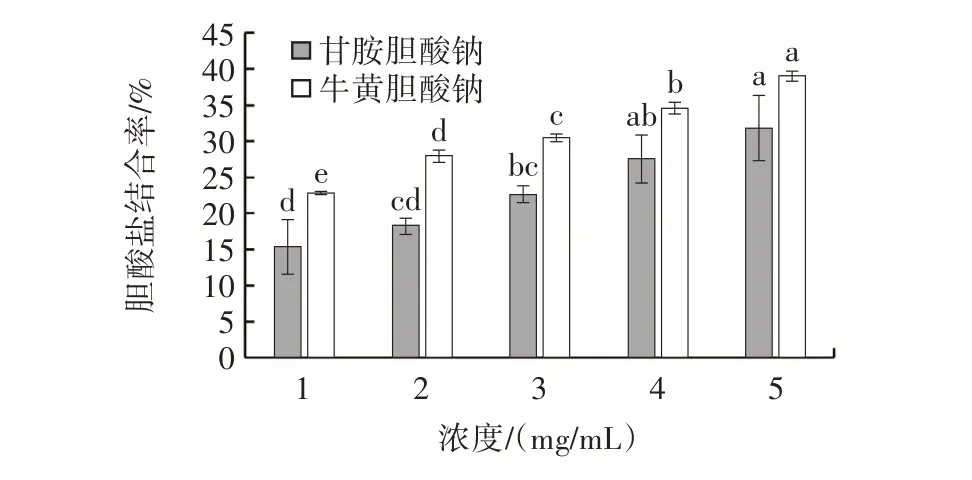
图7 CAP⁃40 与甘氨胆酸钠和牛磺胆酸钠的结合率Fig.7 The binding rate of CAP⁃40 with sodium glycholate and so⁃dium taurocholate
由图7 可知,相同浓度下CAP⁃40 对牛磺胆酸钠的结合率高于甘氨胆酸钠,并且与二者的结合量均随多糖浓度的增加而增加。当CAP⁃40 的浓度为5 mg/mL 时,经过体外模拟胃肠消化后CAP⁃40 与甘氨胆酸盐、牛磺胆酸盐的结合率分别达到(31.87±4.53)%和(38.98±0.60)%。
3 结论
以南酸枣多糖均一组分CAP⁃40 为试验对象,测定其Mw为156 206 Da,Mn为96 946 Da,单糖组成表明CAP⁃40 是一种由8 种单糖组成的酸性多糖,其中葡萄糖、半乳糖醛酸、半乳糖及阿拉伯糖含量较高,摩尔比为0.408∶0.407∶0.093∶0.051,还含有少量的鼠李糖、甘露糖、木糖及盐酸氨基葡萄糖。此外,CAP⁃40 对DPPH·和ABTS+·均具有一定的抑制作用,在1.0 mg/mL 时,对DPPH·和ABTS+·的清除能力分别达到(88.85±0.49)%、(87.13±1.63)%,IC50值分别为0.362、0.458mg/mL。在16、8 mg/mL 时,CAP⁃40 对α⁃葡萄糖苷酶和α⁃淀粉酶的抑制率分别为(71.28±2.34)%、(72.29±4.85)%,IC50值分别为8.153、3.321 mg/mL,说明CAP⁃40 对碳水化合物的水解具有一定的抑制作用。在20 mg/mL 时,CAP⁃40对胰脂肪酶的抑制率约为(26.34±1.41)%,对甘胺胆酸钠和牛磺胆酸钠也表现出一定的结合能力,表明南酸枣多糖能够在一定程度上抑制胰脂肪酶活性,以及通过吸附胆酸盐减少体内胆固醇含量,从而达到降脂效果。综上,南酸枣多糖CAP⁃40 具有一定的体外抗氧化、降血糖和降血脂作用,但能否作为天然功能因子在缓解或预防代谢综合征方面发挥一定的潜能,还需进一步探究其体内作用效果和机理。

