BPH术后前列腺尿道创面囊泡样化生31例分析*
钱 余,周恩谱,黄进宝
上海市控江医院泌尿外科,上海 200093
良性前列腺增生(Benign prostatic hyperplasia,BPH)是中老年男性泌尿生殖系统最常见的疾病之一,由于患者体内雌雄激素平衡的改变使前列腺尿道周围区域出现多发性纤维腺瘤样结节样增生,而真正的纤维肌性前列腺(外科包膜)被不断生长的结节挤到一旁。增生可累及前列腺侧壁(侧叶增生)或膀胱颈下缘组织(中叶增生)。BPN的治疗方式包括以下3 种:(1)药物治疗,主要包括5α-还原酶抑制剂及α1-AR阻滞剂等药物;(2)传统外科手术治疗,主要包括开放前列腺摘除手术及经会阴前列腺切除术;(3)腔内微创治疗,包括经尿道微波治疗、经尿道针刺消融治疗、高强度聚焦超声治疗、经尿道激光治疗、经尿道电气化治疗、腹腔镜前列腺切除术及尿道内支架治疗等。在过去的半个多世纪,开放前列腺摘除手术及经尿道前列腺切除术(Transurethral prostatectomy,TURP)一直是治疗BPH 最常用的手术方式,TURP 更是被医学界推崇为手术治疗BPH 的金标准,随着近20 多年来前列腺腔内治疗的普及,TURP 已是目前BPH 的常规手术术式,临床证实安全有效[1]。但在前列腺腔内手术后,患者前列腺尿道创面会继发囊泡,出现血尿、排尿不畅等一系列症状,临床对其报道较少[2]。根据患者术后的临床表现、尿常规及B 超检查一般难以诊断,常被误诊为前列腺尿道创面术后感染炎性水肿所致的下尿路症状(lower urinary tract symptoms,LUTS)、膀胱颈部瘢痕挛缩硬化、膀胱过度活动症(overactive bladder,OAB)及膀胱功能老化、退化等。本研究选取2012 年1 月—2021 年12 月上海市控江医院收治的31例良性前列腺增生术后前列腺尿道创面出现囊泡样病变合并出血患者作为研究对象,再次经尿道前列腺残留腺体切除和囊泡切除治疗,获得了满意的效果,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2012 年1 月—2021 年12 月上海市控江医院收治的31例良性前列腺增生术后前列腺尿道创面出现囊泡样病变合并出血患者作为研究对象,患者及家属均签署知情同意书,且本研究经医院医学伦理委员会审批。患者均为男性,年龄58~97 岁,平均年龄(78±19)岁,均为TURP后反复出现间歇性血尿而就诊。其中,肉眼血尿11例,镜下血尿20 例;伴下尿路症状如尿急、尿频及夜尿增多16例,排尿不畅9 例,耻骨上区胀痛不适5 例。采用国际前列腺评分表(international prostate symptomscore,IPSS)[3]评估患者前列腺症状评分为11~26 分,平均评分(18.2±7.6)分。追问患者症状出现距离第一次手术时间为术后8~62 个月,平均时间(19±11)个月;经直肠指检扪诊前列腺窝呈术后改变,无明显触痛。31例患者尿常规检查结果:红细胞++~满视野/hp,7例患者尿白细胞计数+~++/hp,常规中段尿细菌培养均为阴性。所有患者B 超检查双侧肾、输尿管均无积水或其他异常,但其中7 例患者诊断膀胱壁稍微增厚;残余尿量15~78 mL,平均残余尿量(34.8±12.1)mL。31 例患者经直肠腔内超声测前列腺内腺体积11~39 mL,平均体积(17.9±6.4)mL;尿流率检测最大尿流率11~27 mL/s,平均尿流率(14.2±5.4)mL/s;CT平扫检查未发现双侧肾、输尿管及膀胱有其他异常。31例患者中合并糖尿病8例,原发性高血压23例,冠心病心律失常9 例,其中3 例因冠状动脉狭窄安装支架服用阿司匹林出现血尿伴血块,但停药后仍有间隙镜下血尿发生。所有患者均排除其他内科疾病,如血液系统疾病、免疫系统疾病或慢性肾病所致血尿;排除泌尿系结石、膀胱肿瘤、前列腺癌等疾病所致血尿;通过尿流动力学检查均排除神经源性膀胱。31例患者的既往前列腺切除术式,见表1。

表1 31例患者既往术式情况
1.2 诊断方法
所有患者除常规前列腺B 超检查和泌尿系CT 检查外,均给予软性纤维膀胱镜检查,发现前列腺尿道或膀胱颈部出现大量透明状囊泡,同时合并前列腺腺体残留,其中前列腺两侧叶呈半岛状残留25 例,前侧叶呈半岛状残留12例,中叶残留7 例。残留前列腺腺组织表面外观均呈透明状囊泡,直径约3~12 mm,平均直径(3.4±0.9)mm,其中7 例有明显的毛细血管蔓状生长,见图1。前列腺尿道内散布透明囊泡12 例,大小不一,见图1、图2。膀胱颈口出现囊泡样改变累及1/3 圈10 例、累及半圈以上14 例,见图3、图4、图5。合并膀胱小梁增粗19例,合并膀胱假性憩室8 例。检查中均未发现膀胱及尿道创面上有明显出血点。在软性纤维膀胱镜下从膀胱内向膀胱颈口尿道方向观察,前列腺中叶向膀胱颈部隆起类似“堤坝”样抬高11例。以上病例全部取标本,病理检查诊断为前列腺组织伴囊泡化生,见图6。

图2 前列腺尿道内多发囊泡
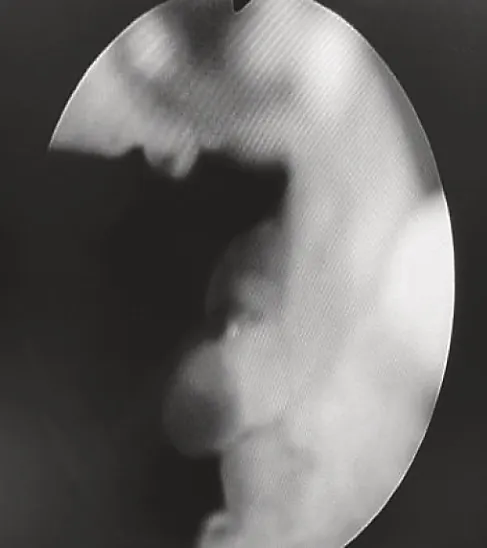
图3 前列腺左侧叶表面大量囊泡
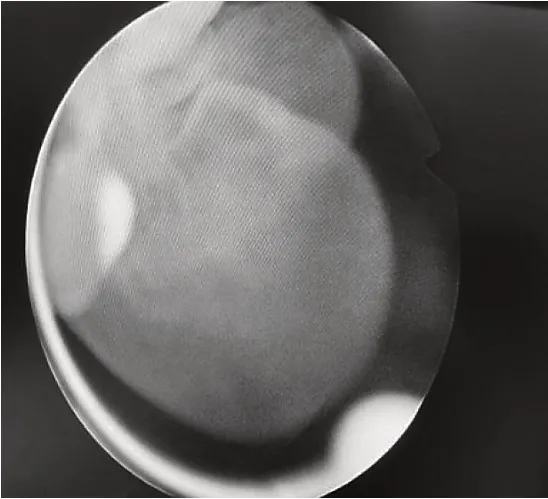
图4 膀胱颈部大量囊泡
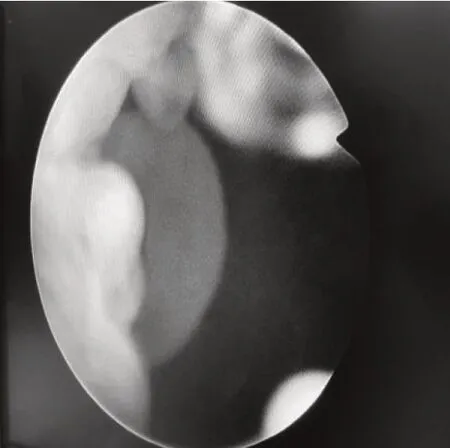
图5 前列腺右侧叶表面囊泡
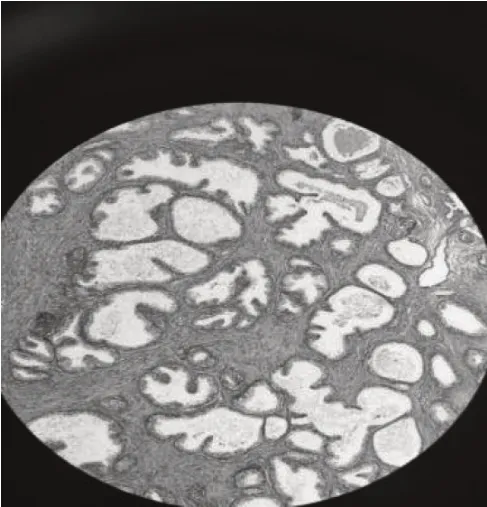
图6 病理图片(HE染色×20):前列腺组织伴囊泡化生
1.3 治疗方法
采取全麻或腰麻,以等离子电切镜经尿道切除前列腺尿道内囊泡、膀胱颈部囊泡,同时切除残留的前列腺中叶、侧叶及前叶,一并切平膀胱颈口后唇5~7点抬高部分中叶组织,切除深度达到环肌层。而对膀胱颈部的切除,要求外观看上去颈口充分敞开,且后尿道与膀胱三角区呈现平面状。最后用纽状电极修整手术创面,使前列腺尿道、膀胱颈口表面平滑光整,以减少术后排尿时形成涡流梗阻。术后建议患者多喝水多排尿,预防性使用抗生素类药物如左氧氟沙星2~4 周,防止继发感染;使用α-受体阻滞剂类药物如坦索罗辛4~6周改善下尿路LUTS。
1.4 观察指标
(1)治疗效果:依据患者临床症状及IPSS评分改善情况来评价治疗的临床疗效。(2)围手术期指标:手术时间及留置尿管时间等。(3)排尿、控尿功能:分别于术前、术后6 个月测量患者残余尿量、最大尿流率。(4)安全性评价:记录患者术后6 个月内并发症情况,包括继发性出血、暂时性尿失禁、膀胱痉挛、电切综合征、尿道狭窄等。
1.5 统计学方法
采用SPSS 22.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
31例患者再次手术时间为8~110 min,平均手术时间(21±13) min。术后留置导尿时间3~6 d,平均时间(3.8±0.2)d。手术后,患者前列腺内腺体积、IPSS 评分、残余尿量、最大尿流率较术前改善,差异有统计学意义(P<0.05),见表2。
表2 31例患者手术前后各项指标情况(±s)
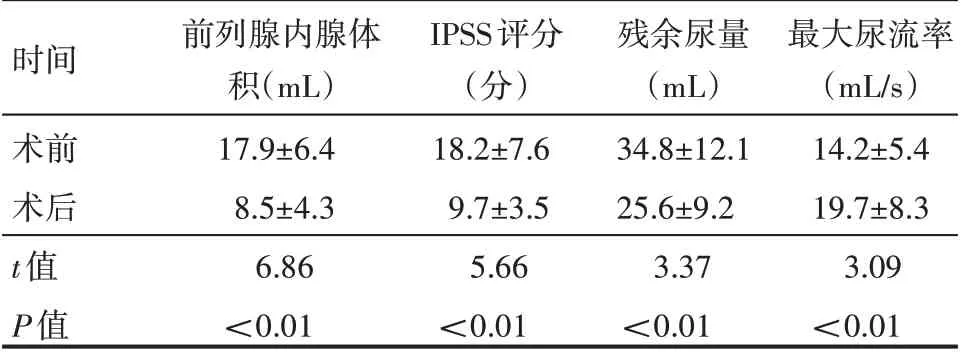
表2 31例患者手术前后各项指标情况(±s)
时间术前术后t值P值前列腺内腺体积(mL)17.9±6.4 8.5±4.3 6.86<0.01 IPSS评分(分)18.2±7.6 9.7±3.5 5.66<0.01残余尿量(mL)34.8±12.1 25.6±9.2 3.37<0.01最大尿流率(mL/s)14.2±5.4 19.7±8.3 3.09<0.01
术后切出的标本再次做病理检查,诊断为“前列腺组织合并囊泡化生”。出院前拔除患者导尿管,观察患者尿线较术前明显变粗,排尿也较术前明显通畅。术后随访6~12 个月,发现其中24 例患者尿频明显减少,无间歇性血尿发生,未出现尿失禁等,7 例患者术后仍有尿频、尿急及夜尿增多症状。复查膀胱镜结果显示,前列腺尿道创面光整,膀胱颈无抬高,未发现囊泡。
3 讨论
3.1 BPH术后前列腺尿道创面出现囊泡及出血的机理
BPH 患者的前列腺由增生的内腺和外膜构成,TURP是切除前列腺内腺,保留前列腺包膜,以解除前列腺尿道梗阻作为目的。手术后前列腺尿道创面在尿道内裸露,表面黏膜缺失,其创面的尿路上皮的修复过程分为炎症反应期、组织成形期及基质重建期,而尿道创面的尿路上皮再上皮化可贯穿以上3 个阶段,一般在术后1 个月左右创面可见岛状新生上皮细胞生长;术后3 个月,新生的尿路上皮覆盖整个尿道创面,但新生上皮尚单薄,缺乏极性;术后6~12个月,新生上皮厚度增厚且均匀。
关于尿路上皮修复的机制,国内外大量研究[4-7]结果表明,修复前列腺部尿道的尿路上皮源于创面下残余的前列腺腺泡和导管上皮,基底细胞有很强的增殖能力,是创面再上皮化的主要细胞,具有向腺上皮、移行上皮分化的能力,而膀胱颈切缘尿路上皮细胞的爬行并非前列腺切除后尿道创面再上皮化的主要来源。前列腺尿道创面的新生细胞首先呈岛状分布,随着上皮的进一步修复,新生的尿路上皮细胞层逐渐增厚,直至完整地覆盖尿道创面。在这2~3个月过程中。修复过程中若创面出现感染,创面修复往往还要延迟[8-9]。当尿路出现细菌感染时,由于毒素加上尿液中代谢产物、废物等炎症因子不断地刺激,会引起前列腺尿道创面的部分上皮再化生,这部分上皮细胞逐渐演变为Von Brunn 细胞巢,如果这些反应性刺激因素持续存在或增强,Von Brunn 细胞巢就会进一步演化,其内部出现间隙,扩大为内腔,再覆盖多层柱状或长柱状上皮细胞,随后柱状细胞分泌液体,形成囊泡,随着液体逐渐增多,囊泡越来越大,出现破裂而出血[8]。本研究31 例患者做膀胱镜检查发现前列腺组织残留过多,前列腺尿道欠光整,引起膀胱出口梗阻,加上老年人膀胱老化,稳定性降低,排尿速度减慢,排尿后残余尿量增多,就容易出现尿路感染,与尿液中废物一起对创面形成慢性刺激,最终出现囊泡样化生,导致前列腺尿道和膀胱颈部出现大量囊泡。尽管膀胱镜检查中未发现明显出血点,但患者在排尿过程中,随着膀胱颈部打开及闭合碰撞,会造成囊泡破裂而出现血尿现象,这也是术后患者再次就诊的原因。
3.2 BPH术后前列腺尿道创面发生囊泡样变的诊断
本组31 例患者均在第一次前列腺切除术后8~62 个月,平均时间(19±11)个月,因再次出现间歇性血尿或/和下尿路症状而就诊,行膀胱镜检查发现前列腺腺体有残留合并大量囊泡存在,取出囊泡做病理检查证实尿道创面出现囊泡化生。临床上使用软性纤维膀胱镜检查,患者痛苦小,依从性好,容易接受。除了可以直接观察前列腺尿道、膀胱颈、膀胱三角区、输尿管开口及膀胱内部病变情况外,还可以从膀胱内向尿道方向观察膀胱颈部尿道内口情况,并且根据病情需要直接取标本进行病理活检,以指导进一步治疗方案及随访观察。本研究认为软性纤维膀胱镜检查对BPH 术后远期出血、是否继发囊泡发生及后续手术方案有直接的指导意义。
3.3 BPH术后前列腺尿道创面囊泡化生的治疗
本研究31例患者均再次经尿道行腔内残留的前列腺切除、囊泡切除,对膀胱颈部是否需要切除,要求切除膀胱出口的堤坝状抬高组织,使尿道内口后壁与膀胱三角区基本处于一个平面[2,10-11]。手术后,患者前列腺内腺体积、IPSS 评分、残余尿量、最大尿流率较术前改善。出院前拔除患者导尿管,观察尿线较前变粗,排尿较前明显通畅。术后随访6~12 个月,发现其中24 例患者尿频明显减少,无间歇性血尿发生,未出现尿失禁等;7 例患者术后仍有尿频、尿急及夜尿增多症状。术后预防使用抗生素,如左氧氟沙星2~4 周,口服α-受体阻滞剂如坦索罗辛4~6 周改善LUTS。本研究认为通过手术切除前列腺尿道创面囊泡、残留的前列腺腺体和膀胱颈抬高组织削平处理、预防口服抗生素防止创面继发感染等治疗,前列腺尿道创面囊泡一般不会再次复发。
综上所述,BPH 术后远期若出现间歇性血尿或肉眼尿路出血,排尿不畅及LUTS 症状,建议及时给予膀胱镜检查;若发现前列腺尿道出现大量囊泡,即考虑前列腺尿道囊泡化生,建议再次经尿道手术治疗;手术除切除尿道创面囊泡外,还必须切除残留的前列腺腺组织及膀胱出口抬高的组织;术后预防使用抗生素、多喝水,改善LUTS 等,防止囊泡复发,能获得满意的效果。

