术前穿刺活检及术中冰冻病理技术用于乳腺导管原位癌伴微浸润诊断的价值
陈莎莎,王允玉
龙岩市第二医院病理科,福建 龙岩 364000
乳腺癌是常见的女性恶性肿瘤病变,多见于30~60 岁女性,疾病发生率和致死率明显上升,严重影响患者生命安全和生存质量,需注重疾病早期筛查[1]。彩色多普勒超声和乳腺钼靶是乳腺癌应用广泛的筛查方式,随着筛查工作的开展和技术的提升,更多的乳腺癌患者得以确诊。导管原位癌在新发现乳腺癌中的占比约为20%~30%,其主要特点为导管肿瘤细胞(终末导管小叶单位内)异常增殖于基底膜[2];乳腺导管原位癌伴微浸润占比为5%~10%,是前者突破基底膜后形成,其量化标准因癌灶数量和大小而存在差异[3]。美国癌症联合委员会肿瘤分期(第七版)[4]中将乳腺导管原位癌伴微浸润定义为癌细胞突破基底膜浸润间质最大直径不超出1 mm。乳腺导管原位癌本身较少出现间质浸润,但可能有淋巴结转移风险,需准确判定乳腺导管原位癌有无伴随间质微浸润。术前穿刺活检和术中冰冻病理是乳腺癌常用的诊断方式,前者创伤小、患者耐受性高,可明确肿块性质,为手术方案的选择提供依据[5];后者是在手术过程中切除部分病灶组织,快速冷却至-20 ℃以下,切片、染色,进而对疾病性质予以判定,并在此基础上确定后续治疗方案[6]。两种方式对乳腺导管原位癌伴微浸润的诊断效能尚不明确,未形成明确定论。本研究将术前穿刺活检和术中冰冻病理的诊断价值进行对比,并探讨乳腺导管原位癌和乳腺导管原位癌伴微浸润的临床特征与肿瘤浸润淋巴细胞分布状态,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2021年2月—2022年2月龙岩市第二医院62例乳腺导管原位癌患者,患者年龄30~55 岁,平均年龄(42.18±3.56)岁;肿瘤直径2.0~4.5 cm,平均肿瘤直径(2.98±0.24)cm;病程6~12 个月,平均病程(9.12±0.48)个月。纳入标准:肿瘤直径≥2.0 cm,年龄30~55岁,状态良好,主动配合。排除标准:重要脏器功能受损,伴随其他卵巢疾病,既往有乳房手术史,术后病理诊断为浸润性癌,妊娠或哺乳期女性。
1.2 方法
1.2.1 术前穿刺活检 使用彩色多普勒超声诊断仪(生产厂家:通用电气医疗系统有限公司,型号:Vivid iq,注册证编号:国械注准20173231432),配备穿刺引导装置,定位探头频率设置在5~12 MHz 之间,使用16G 活检针进行穿刺活检操作。检查人员需指导患者于检查床上仰卧,确保乳腺穿刺部位充分外露,进针处选在病灶与皮肤间距离最优处,使用75%的医用酒精对穿刺处皮肤予以消毒,予以盐酸利多卡因注射液(生产厂家:西安迪赛生物药业有限责任公司;批准文号:国药准字H61020714;规格:5 mL∶0.1 g)局部麻醉,待麻醉起效后,经超声引导,将穿刺针缓慢推入,针尖到达肿块内缘,推动针芯,使其进入肿块内,激发活检针后迅速拔针,将采集到的标本组织取出,各处病灶取出4~5 条组织条,长度在1.5~2.0 cm 之间;肿块较大时,于同一针道下从不同方向取材,将取出的标本固定在10%的甲醛溶液中,予以苏木精—伊红染色,行病理学诊断。
1.2.2 术中冰冻病理检查 手术操作过程中,从不同切面、不同部位取材,快速冰冻病理组织,并切成薄片制作标本,由病理科医生使用冰冻切片机(生产厂家:德国徕卡公司;批准文号:国械备20161067号;规格:CM1950)进行冰冻切片,仪器工作时,温度设置为-24~-22 ℃,将病灶组织切成厚度为4~5 μm 的薄片,固定于10%的甲醛溶液中,苏木精—伊红染色,中性树胶密封由病理医师置于光镜下观察,检查时间控制在15~30 min。
1.2.3 术后病理学检查 定位术前超声检查中发现的病灶,术中切除乳房组织15 min内获取病灶标本,浸入石蜡组织中,切片后行脱蜡与水化处理,予以苏木精—伊红染色,进行组织病理学检查。
1.3 观察指标
1.3.1 诊断价值情况 以术后病理为金标准,比较术前穿刺活检和术中冰冻病理诊断乳腺导管原位癌伴微浸润的真阳、假阳、真阴与假阴例数。乳腺导管原位癌伴微浸润病理诊断标准:癌细胞突破基底膜,浸润间质最大直径≤1 mm;微浸润灶≥2 h,测量时取长径最大者。
1.3.2 诊断效能 比较术前穿刺活检和术中冰冻病理对乳腺导管原位癌伴微浸润的诊断敏感性、特异性、准确性、阳性预测值和阴性预测值。
1.3.3 临床特征 对比乳腺导管原位癌和乳腺导管原位癌伴微浸润患者病灶直径、可触及肿块、组织学分级、增值细胞抗原(ki67)表达水平、孕激素受体阳性、雌激素受体阳性概率,其中ki67>30%为高表达,孕激素受体阳性、雌激素受体>1%为阳性,
1.3.4 肿瘤浸润淋巴细胞分布状态 分别于200 倍高倍镜下和400 倍高倍镜下比较乳腺导管原位癌和乳腺导管原位癌伴微浸润患者热点区域及平均值区域肿瘤浸润淋巴细胞分布状态。
1.4 统计学方法
采用SPSS 22.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 诊断价值情况
术后病理学研究结果显示,62 例乳腺导管原位癌中,38 例为原位癌患者,24 例为乳腺导管原位癌伴微浸润患者;以此为金标准,术前穿刺活检诊断乳腺导管原位癌伴微浸润的真阳、真阴、假阳和假阴分别为22 例、32 例、2例和6 例,术中冰冻病理诊断真阳、真阴、假阳和假阴例数分别为14例、21例、10例和17例。
2.2 诊断效能情况
术前穿刺活检诊断乳腺导管原位癌伴微浸润的敏感性、特异性、准确性、阳性预测值和阴性预测值高于术中冰冻病理技术,差异有统计学意义(P<0.05),见表1。

表1 诊断效能情况%
2.3 临床特征情况
乳腺导管原位癌伴微浸润病灶直径更长,可触及肿块更多,ki67 表达水平更低,组织学分级、孕激素受体阳性、雌激素受体阳性概率更低,与乳腺导管原位癌比较,差异有统计学意义(P<0.05),见表2。
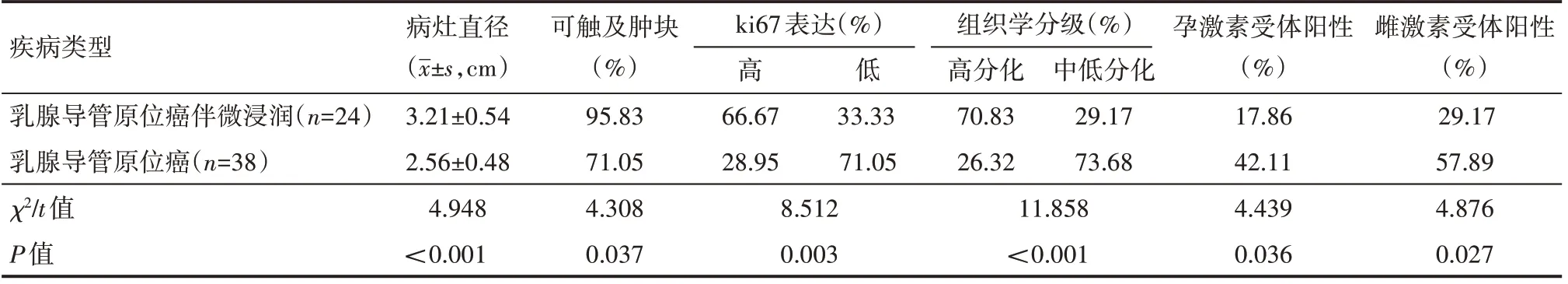
表2 临床特征情况
2.4 肿瘤浸润淋巴细胞分布情况
乳腺导管原位癌伴微浸润热点区域和平均值,肿瘤浸润淋巴细胞百分比高于乳腺导管原位癌,差异有统计学意义(P<0.05),见表3。
表3 肿瘤浸润淋巴细胞分布情况(±s)%
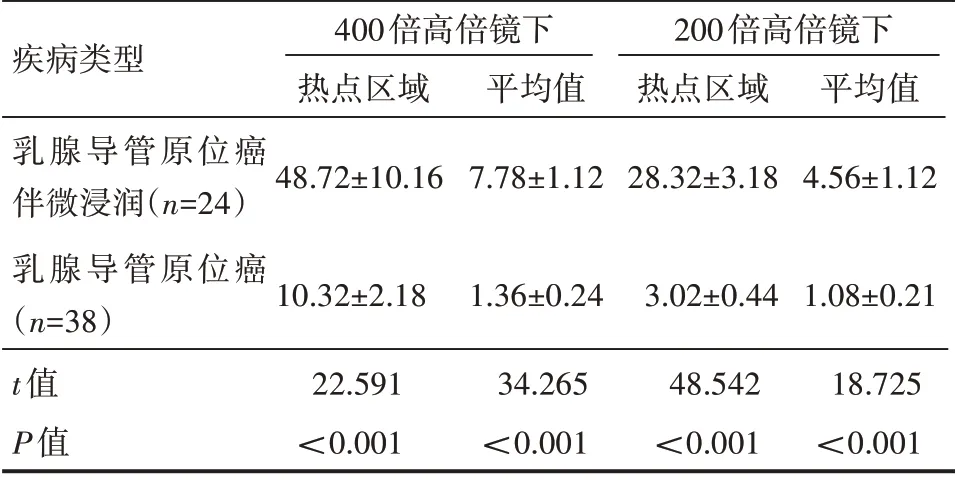
表3 肿瘤浸润淋巴细胞分布情况(±s)%
疾病类型乳腺导管原位癌伴微浸润(n=24)乳腺导管原位癌(n=38)t值P值400倍高倍镜下热点区域48.72±10.16平均值7.78±1.12 200倍高倍镜下热点区域28.32±3.18平均值4.56±1.12 10.32±2.18 22.591<0.001 1.36±0.24 34.265<0.001 3.02±0.44 48.542<0.001 1.08±0.21 18.725<0.001
3 讨论
乳腺导管原位癌为导管内病变,癌细胞可累及上皮组织,但无法突破基底膜,其生长范围局限于导管[7]。疾病进一步发展,演变为浸润性乳腺癌时,应有特异性表现,但尚无明确分子学标志物。乳腺导管原位癌患者接受手术治疗后,经病理检查确诊为乳腺导管原位癌伴微浸润时,需再次手术清扫腋窝淋巴结,手术并发症明显增加[8]。因此,需选择合理有效的方式评估乳腺导管原位癌患者有无伴随微浸润,为腋窝淋巴结处理方式的选择提供依据。
目前,临床对乳腺导管原位癌伴微浸润进行诊断时,主要是通过术前穿刺活检和术中冰冻病理实现的,术前穿刺活检分为细针穿刺和粗针穿刺两种,在超声引导下进行,细针穿刺也被称作是细胞学检查,采集到的样本量少,可判定癌细胞有无转移情况;粗针穿刺可取得条状病灶组织,样本量大,诊断疾病的准确性较高[9]。术中冰冻病理在获取标本后30 min内即可对病灶性质予以判定,其作用主要有以下几点[10-11]:(1)术中发现患者病情与前期诊断不符,需再次明确疾病类型;(2)明确肿瘤是否出现淋巴结转移,选择合适的清扫方案;(3)确定切除后周围组织有无病灶残余情况;(4)探查患者体内肿块和异常组织。目前,临床方式对乳腺导管原位癌伴微浸润的诊断准确性尚未明确,越来越多的学者对两种方式的诊断价值持不同观点,特别是诊断直径≥2.0 cm 的乳腺导管原位癌伴微浸润。
本研究发现,术前穿刺活检诊断乳腺导管原位癌和乳腺导管原位癌伴微浸润时,准确性均处于较高水平,可为患者术后是否需要清扫腋窝淋巴结提供参考依据。术前穿刺活检对乳腺导管原位癌伴微浸润的诊断敏感性、特异性、准确性、阳性预测值和阴性预测值均高于术中冰冻病理,可见与术中冰冻病理比较,表明术前穿刺活检对乳腺导管原位癌伴微浸润进行诊断时,准确性高、特异性强,可为腋窝淋巴结处理方式的选择提供依据。
现阶段,临床对乳腺导管原位癌伴微浸润的研究不断深入,发现疾病具有潜在的转移与侵袭能力,可将其作为实体瘤进行研究,分析疾病临床病理特征。乳腺导管原位癌发病时,临床症状特异性不强,乳腺钼靶的应用使得疾病检出率明显提高。与单纯乳腺导管原位癌比较,乳腺导管原位癌伴微浸润转移风险大,需重视分析疾病临床病理特点,以防控危险因素,延缓发病进程。乳腺导管原位癌伴微浸润和乳腺导管原位癌患者临床病理特征比较结果显示,乳腺导管原位癌伴微浸润病灶直径更长,可触及肿块病例数更多,组织学分级和ki67高表达率更高,孕激素受体阳性、雌激素受体阳性更低,可见肿块越大,出现微浸润的风险越高,ki67 高表达、孕激素受体阴性和雌激素受体阴性可能在早期浸润中发挥着重要作用[12-13]。
目前,临床对肿瘤微环境的研究不断深入,使得乳腺癌肿瘤免疫微环境的研究成为当前阶段的重点研究内容,肿瘤浸润淋巴细胞百分比较高时,提示三阴性及HER-2阳性乳腺癌预后良好,可能有抗肿瘤作用,但该指标对原位癌的保护作用尚不明确,需对乳腺导管原位癌伴微浸润患者肿瘤浸润淋巴细胞分布情况予以分析,以判定其分布与预后的关系,准确评估肿瘤免疫微环境的作用。本研究结果显示:乳腺导管原位癌伴微浸润患者肿瘤浸润淋巴细胞在400 倍高倍显微镜和200 倍高倍显微镜下的分布密度(热点区域和平均值)更高,可见乳腺导管原位癌伴微浸润与乳腺导管原位癌的免疫微环境间存在差异。这可能是因为肿瘤浸润淋巴细胞可推动肿瘤浸润进程,此类细胞中既有CD8+T 淋巴细胞、自然杀伤细胞,也可分泌免疫抑制因子,刺激肿瘤浸润与转移,浸润过程中,激活免疫系统,导致肿瘤浸润淋巴细胞大量聚集。

