半乳糖凝集素-9(Gal-9)介导的免疫调节作用在肝脏疾病中的研究进展
凌 珺,朱 冰,陈威巍,王卓然,余丽梅,游绍莉
1 遵义医科大学附属医院贵州省细胞工程重点实验室,贵州 遵义 563003
2 中国人民解放军总医院第五医学中心肝病医学部,北京 100039
1 半乳糖凝集素-9(galectin-9,Gal-9)基因与分子结构
Gal-9 是一种分子量为36 kDa 的β-D-半乳糖苷哺乳动物凝集素,1997年由Wada和Türeci等[1]从小鼠胚肾和人霍奇金淋巴瘤组织中分离鉴定。Gal-9基因定于17号染色体的短臂上17q11.2(HGNC:6570)。所有半乳糖凝集素(Gal)均含有一个由130个氨基酸残基组成的碳水化合物识别结构域(carbohydrate recognition domain,CRD),其家族共有15种蛋白质,根据其分子结构的不同可分为3 型:(1)原型,只有1 个CRD(包括Gal-1、Gal-2、Gal-5、Gal-7、Gal-10、Gal-11、Gal-13、Gal-14、Gal-15);(2)嵌合体型,由CRD 上富含脯氨酸和甘氨酸的短片段交联结合形成(包括Gal-3);(3)串联重复型,由2个CRD 串联融合形成(包括Gal-4、Gal-6、Gal-8、Gal-9、Gal-12)[2]。有研究[3]表明,Gal-9由一个肽链接2个CRD,分别是N端的N-CRD和C 端的C-CRD,二者氨基酸序列有较大差异且具有配体特异性,因此在介导Gal-9功能方面发挥不同的作用,其中C-CRD 是决定T 淋巴细胞受体识别和死亡信号转导途径的主要因素。迄今为止,Gal-9已被鉴定为T淋巴细胞免疫球蛋白和黏蛋白结构域分子-3(T cell immunoglobulin domain and mucin domain-3,Tim-3)、CD 44和Dectin 1 等多种受体的配体[4],在mRNA 的剪接、细胞凋亡、细胞周期的调控、细胞黏附、细胞迁移及细胞分化等多种生物学功能中发挥重要的作用,是一种多功能的免疫调节蛋白[5]。
2 Gal-9的表达分布
Gal-9 广泛分布于肝脏、胸腺、脾脏等器官。在免疫系统中,Gal-9 主要表达于巨噬细胞、树突状细胞等抗原提呈细胞、CD4+T 淋巴细胞、CD8+T 淋巴细胞及调节性T淋巴细胞(Treg)。Tim-3 是Gal-9 的配体,Tim 基因家族于2001年由Monney等[6]首次发现并鉴定,家族主要包括8个成员(Tim-1~8),其中Tim-1、Tim-3、Tim-4在人体中发现。Tim-3 是Gal-9 的配体,其选择性表达于Th1、Th17细胞,也可表达于抗原提呈细胞[7-8]。Gal-9 的2 个结构域(C-CRD、N-CRD)均可与Tim-3 结合,其中C-CRD 与Tim-3 的结合力更强,主要在获得性免疫中发挥功能,诱导T 淋巴细胞凋亡,N-CRD 则倾向于活化树突状细胞、巨噬细胞等,调节天然免疫反应。
3 Gal-9的免疫调节机制
Gal-9主要由Kupffer细胞(KC)分泌,研究[9-11]提示肝损伤环境下KC 细胞受刺激后可释放Gal-9。Gal-9 与CD4+T、CD8+T 淋巴细胞表面Tim-3 结合发挥生物学功能[11]。Caspase 家族在细胞凋亡的进程中起关键作用,caspase-1 在细胞中过表达可促使细胞早期凋亡[12]。caspase-1 的激活需要Ca2+依赖性蛋白酶(calpain),研究[13]证实Gal-9 可诱导Ca2+内流使calpain 激活,从而激活caspase-1,最终通过Ca2+-calpain-caspase-1 途径促进细胞凋亡,调节免疫反应。
Wang 等[11]通过肺炎克雷伯菌小鼠模型研究发现,腹腔注射Gal-9 可抑制CD4+T 淋巴细胞、CD8+T 淋巴细胞的数量,降低Th1和Th17细胞分泌的细胞因子如:IL-17、IFN-γ,且分离小鼠免疫细胞进行体外培养并加入Gal-9刺激后,可减少Th17细胞的数量并抑制IL-17的产生,提示Gal-9在Th17免疫反应中起重要作用。
CD4+CD25+Treg在免疫应答负调控中发挥重要作用,可通过细胞间直接接触或者分泌抗炎细胞因子发挥免疫抑制作用[14]。研究[15-16]发现Gal-9可在CD4+CD25+Treg上表达,诱导Treg 增殖,同时体外实验中使用荧光染料CFSE 标记的CD4+CD25-T 淋巴细胞和CD4+CD25+Treg 共培养,并加入可溶性CD3 和CD28 抗体刺激二者增殖,培养后发现CD4+CD25+Treg可抑制CD4+CD25-T淋巴细胞的增殖,而加入Tim3 抗体阻断Gal-9/Tim3 通路后可明显降低Treg 的抑制效应,导致CD4+T 淋巴细胞数量增加及分泌的相关细胞因子水平增高,提示CD4+CD25+Treg 可能通过Gal-9/Tim3通路抑制细胞增殖。在小鼠胶原诱导关节炎模型[17]中,敲除Gal-9蛋白的小鼠更容易患关节炎,且体内Treg 数量降低、CD4+Tim3+T 淋巴细胞增多,随后在体外实验中证实Gal-9 可使外周血CD4+Tim3+T 淋巴细胞减少,诱导幼稚T 淋巴细胞向Treg 分化,间接抑制其向Th17 分化,并以剂量依赖性方式抑制IL-17 的分泌。在ConA诱导的肝炎小鼠模型[18]中,将Tim-3阻断后病情加重,而经过Gal-9 治疗后病情得到改善。该模型中,Gal-9还可抑制促炎细胞因子TNF-α、IL-6的产生,通过增加Treg与效应T淋巴细胞因子的数量,诱导ConA激活的CD4+T 淋巴选择性凋亡,进一步阻止TNF-α、IL-6、IFN-γ的释放,抑制对肝细胞的细胞毒性作用。转录因子Foxp3 不仅是Treg 的标志物,还对Treg 具有调节作用[19],Gal-9 可促进肝Treg Foxp3 的表达,促进Treg 增加来抑制IFN-γ的产生,抑制炎症发展[20]。
自然杀伤T 淋巴细胞(NKT)可分泌IFN-γ 并作用于KC,KC 受到IFN-γ 刺激后释放IL-15 和Gal-9,IL-15 反过来可使NKT 细胞增殖[21]。Gal-9 可与NKT 细胞上Tim-3结合,诱导细胞凋亡进一步抑制炎症反应。Tang等[22]在非酒精性脂肪性肝病小鼠模型中,检测NKT细胞上Tim-3的表达,发现NKT细胞在肝脏中表达Tim-3,且腹腔注射Gal-9 可发现肝脏NKT 细胞凋亡率显著增高,随后分离出肝脏NKT 细胞和重组Gal-9 一起培养,通过膜联蛋白V/7-氨基放线菌素D(7AAD)染色测定NKT 细胞凋亡情况,发现Gal-9以剂量、时间依赖性方式诱导NKT 细胞凋亡,且可被Gal-9的竞争性抑制剂或Tim-3抗体阻断。以上研究显示Gal-9 在机体中可通过多种途径发挥重要生物学功能(图1)。
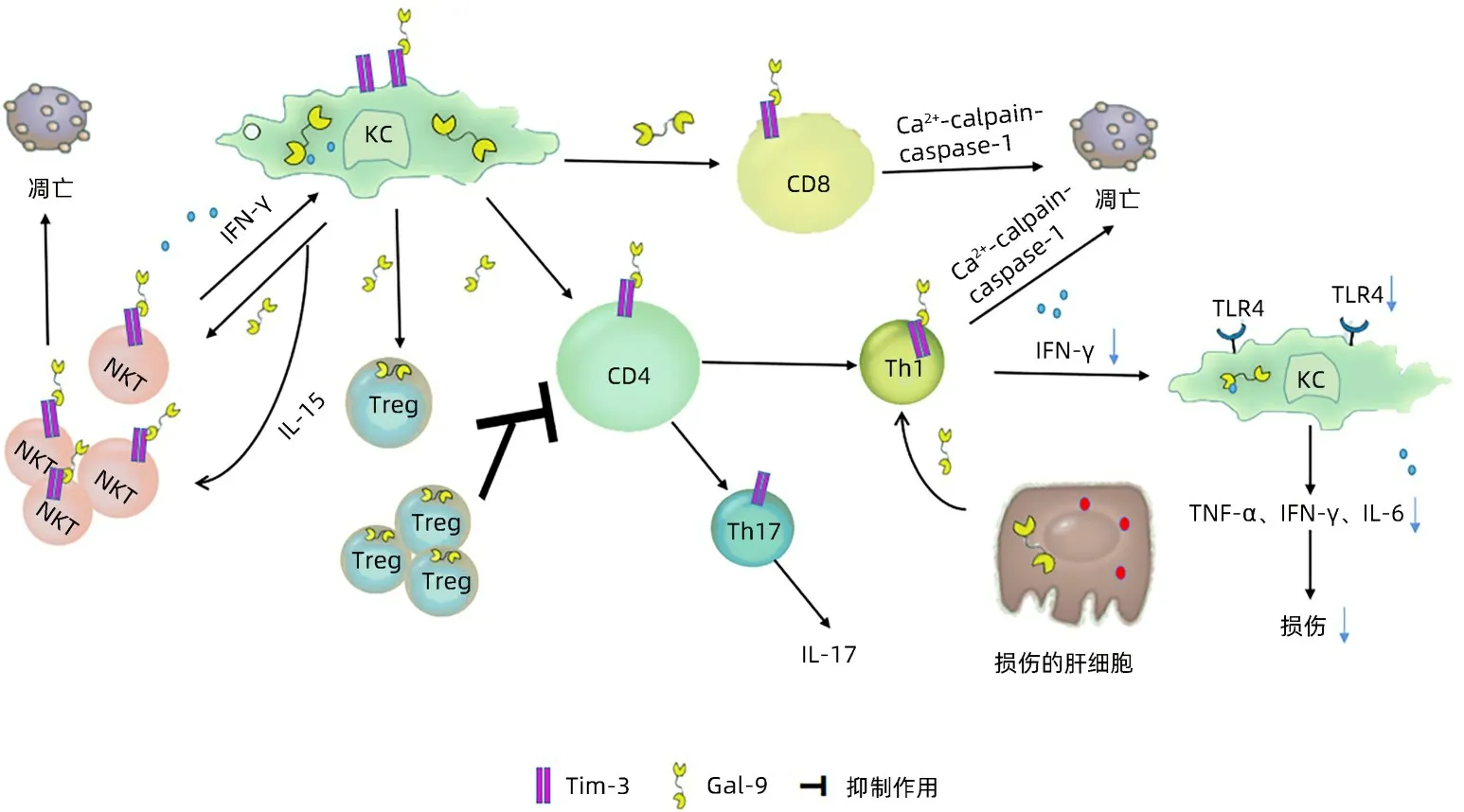
图1 Gal-9免疫调节通路示意图Figure 1 Schematic diagram of Gal-9 immunomodulatory pathway
4 Gal-9在不同肝脏疾病中的作用
目前Gal-9 在白血病、宫颈癌、艾滋病以及自身免疫性疾病中有较多研究[23-25]。利用Gal-9 可诱导幼稚T 淋巴细胞向Treg 分化,减少自身反应性T 淋巴细胞的数量,使Treg抑制Th1细胞和Th17细胞分泌促炎因子从而在自身免疫性疾病中发挥治疗作用。在痛风的小鼠模型[26]中使用Gal-9 可降低关节中各种促炎因子(IL-17、IL-12、IFN-γ)浓度从而改善疾病。在白血病相关研究中,运用实时定量PCR 技术分别检测白血病患者和正常人骨髓中的Gal-9 表达水平,白血病患者Gal-9 表达水平明显高于正常人,经过药物治疗后Gal-9 表达水平显著下降,且白血病患者Gal-9 表达水平与疾病危险程度和化疗治愈效果有相关性[23]。杨艳等[24]用流式细胞术检测宫颈癌患者外周单核细胞中Gal-9 的表达变化,发现宫颈癌Ⅲ~Ⅳ期患者的外周血Gal-9 表达水平明显高于Ⅰ~Ⅱ期的表达水平,且低分化的宫颈癌患者的Gal-9水平明显高于高分化、中分化的患者,推测Gal-9 的表达水平与宫颈癌的临床分期、病理分级相关。目前,肝病中关于Gal-9 的免疫调节效应的研究主要聚焦于肝缺血再灌注损伤(ischemia-reperfusion injury,IRI)、药物性肝损伤(drug induced liver injury,DILI)、病毒性肝炎、自身免疫性肝炎(autoimmune hepatitis,AIH)以及肝细胞癌(hepatocellular carcinoma,HCC)等疾病。
4.1 IRI 在IRI 小鼠模型[27]中发现,损伤的肝细胞分泌Gal-9 并与Th1 细胞上的Tim-3 结合,促使Th1 分泌的IFN-γ水平降低,从而减轻后续炎症反应。在IRI小鼠模型中,加入Tim-3 抗体的小鼠与对照组小鼠相比,加入Tim-3 抗体加剧了小鼠肝脏局部中性粒细胞浸润,促使T 淋巴细胞和巨噬细胞在肝脏局部聚集,加速肝细胞凋亡,小鼠肝损伤更严重。Toll样受体4(toll-like receptor 4,TLR4)是IRI 的关键因素[10]。研究[28-29]发现在IRI 动物模型中TLR4缺陷型小鼠比野生型小鼠的肝损伤更轻,并证实TLR4 受体参与了IRI 的起始阶段。研究[27-29]显示Gal-9与Tim-3结合后可使TLR4受体表达降低,减轻中性粒细胞、巨噬细胞、T 淋巴细胞的聚集,从而减缓肝脏炎症损伤。在CCl4诱导的小鼠急性化学性肝损伤模型中,Gal-9 的抑制作用[30]与IRI 小鼠模型相似,在体外实验中,将脾T淋巴细胞与巨噬细胞共同培养,阻断Tim-3后,T 淋巴细胞产生更多IFN-γ、IL-6,加剧炎症反应,而不阻断Tim-3 且加入Gal-9 后炎症因子水平降低,推测Gal-9/Tim-3 通路可减轻炎症反应。阻断Tim-3 通路后小鼠TLR4 和NF-κB 蛋白与对照组小鼠相比显著升高,然而在敲除TLR4 受体的小鼠模型中阻断Tim-3 通路则不影响肝损伤,进一步提示Tim-3 可以通过抑制NF-κB 通路来负调控TLR4并调节TNF-α、IFN-γ、IL-1β的水平,进一步证实Tim-3/Gal-9可通过调控TLR4信号通路来维持肝内免疫稳态。另有研究[31]利用Tim-3 转基因(Tim-3 Tg)的肝缺血小鼠模型中Gal-9 的表达进行动力学分析,发现肝组织Gal-9 mRNA 的表达在再灌注过程中升高,之后利用免疫荧光技术发现,肝细胞在缺血再灌注后分泌Gal-9 至肝窦中。将重组Gal-9 分别注射到对照组和Tim-3 Tg 组后,两组的ALT 和TNF-α、IL-1β 等促炎因子水平均降低,且Tim-3 Tg 组降低更明显,提示Gal-9 可增强肝脏对缺血再灌注损伤的抵抗力,发挥一定的保护作用。
4.2 DILI DILI 是肝损伤的重要病因,DILI 的严重程度可从轻度血清转氨酶升高发展到严重的肝损伤,甚至可进展为肝衰竭[32]。Rosen团队[33]分析了149例急性肝衰竭患者的血浆样本,其中110 例为对乙酰氨基酚诱导的肝损伤,39 例为非对乙酰氨基酚药物诱导的肝损伤,同时选择了年龄相似无肝脏疾病的健康个体作为对照。采用多克隆抗体和比色法测定血浆Gal-9的水平,发现肝衰竭患者血浆Gal-9水平明显高于健康对照组,对乙酰氨基酚诱导的肝损伤和非对乙酰氨基酚药物诱导的肝损伤二者之间无显著差异。且Gal-9水平高于690 pg/mL的患者在21 天内的死亡风险是Gal-9 水平低于690 pg/mL 患者的2.9倍,提示血浆Gal-9水平与急性肝衰竭死亡风险呈正相关。该团队进一步分析了血浆Gal-9 水平与全身炎症反应综合征的关系,发现肝衰竭患者的Gal-9水平高于386 pg/mL与其发生全身炎症反应综合征明显相关。
4.3 病毒性肝炎 HBV 感染具有持续性和慢性化的特点,这些特点是由于效应T 淋巴细胞和记忆T 淋巴细胞功能缺陷所致。从急性感染到慢性感染的特征是由于效应T 淋巴细胞功能减弱和Treg 增多[34-35]。研究[36]证明,KC 细胞中的Gal-9 与病毒特异性CD4+T、CD8+T 淋巴细胞上的Tim-3 结合可诱导T 淋巴细胞凋亡。与健康对照组相比,乙型肝炎患者外周血单个核细胞(PBMC)中Tim-3 表达显著增加,且随着炎症加重,CD4+T、CD8+T 淋巴细胞上Tim-3 的表达逐渐增高,乙型肝炎患者的血浆Gal-9循环水平也显著高于健康对照组,且与疾病严重程度呈正相关。对两组细胞进行7AAD染色,发现乙型肝炎患者Tim-3+CD4+T、Tim-3+CD8+T 淋巴细胞凋亡程度显著高于健康对照组。此外,在乙型肝炎患者细胞培养基中加入Tim-3的Fc段融合蛋白,可较大程度上减缓CD8+T淋巴细胞凋亡,使其产生IFN-γ、TNF-α。Mengshol等[16]发现丙型肝炎患者血浆Gal-9 水平显著升高,之后进行免疫组织化学分析健康志愿者和丙型肝炎患者的肝组织标本中Gal-9蛋白的表达,使用Gal-9抗体标记Gal-9蛋白并使用CD68 标记KC 细胞。与健康志愿者相比,丙型肝炎患者肝组织尤其门静脉周围区域CD68 及Gal-9 共定位且表达呈阳性,而健康志愿者肝组织中93%的肝门静脉区域没有Gal-9染色。Tim-3也可在丙型肝炎特异性T淋巴细胞表面高表达[37],McMahan 团队[38]发现阻断Tim-3能够阻止T 淋巴细胞耗竭并恢复CD4+T 淋巴细胞和CD8+T 淋巴细胞的功能,从而在病毒感染期间引起肝损伤[37,39]。用重组Gal-9刺激丙型肝炎患者和正常人PBMC可以促进Treg增多从而减缓疾病慢性化进程[16]。Gal-9/Tim-3 途径在病毒性肝炎感染中可导致病毒特异性T 淋巴细胞功能缺陷且数量减少,在慢性乙型肝炎患者体外培养PBMC 中,无论是加入Gal-9 抗体或是Tim-3 抗体阻断Gal-9/Tim-3 通路,CD8+T 淋巴细胞数量以及相关细胞因子水平都较对照组升高,提示阻断该通路可部分恢复CD8+T淋巴细胞功能,增强抗病毒治疗效果[40]。
4.4 AIH AIH 是一种具有高丙种球蛋白血症、肝组织学上大量浆细胞浸润为主的肝脏疾病。AIH患者Tim-3+CD4+T淋巴细胞在效应CD4+T淋巴细胞中的占比低于正常人,Gal-9+Treg在Treg中的比例更低,Gal-9诱导CD4+T淋巴细胞凋亡或使Treg 增殖作用减弱,且AIH 患者的Gal-9+Treg 亚群中含有更多的IFN-γ+和IL-17+细胞,而转化生长因子-β+(TGF-β+)和IL-10+细胞较少,从而炎症反应增强,免疫调节受损。此外,Gal-9+Treg 与自身免疫球蛋白G水平和自身抗体滴度(疾病的血清学标志物)呈负相关,提示Gal-9+Treg可调控AIH 的发展[41]。Gal-9促进Treg 增殖后对CD4+T 淋巴细胞的抑制作用提示Gal-9 在AIH 治疗中具有潜在价值,目前常规治疗对一部分AIH患者无效,将Treg细胞作为靶点,可能对AIH患者的免疫治疗有一定意义[41]。
4.5 HCC HCC 是全球常见的癌症之一,最常见的病因是慢性病毒性肝炎[42]。Gal-9 在乙型肝炎相关性肝癌中主要表达于CD68+CD163+KC细胞上,免疫荧光染色显示Gal-9+KC 与Tim-3+T 淋巴细胞共定位,CD4+T 淋巴细胞表面Tim-3 呈高水平表达,且与HCC 预后密切相关,推测Gal-9/Tim-3 参与了HCC 的免疫逃逸[43],Gal-9 在抗肿瘤免疫中也发挥重要作用。NK 细胞是抗肿瘤免疫的靶标,NK 细胞表面的Gal-9 可导致NK 细胞IFN-γ 分泌降低,从而降低NK 细胞介导的细胞毒性作用[44]。另外,有研究[45]认为Gal-9以剂量和时间依赖性方式在体外抑制HCC细胞系HLE和Li-7的生长,在体内诱导Li-7细胞的凋亡,并在异种移植无胸腺小鼠模型中抑制了HCC细胞的生长。上述研究提示Gal-9在HCC中表现出双面功能,既参与HCC 的免疫逃逸,又促进HCC 细胞凋亡。至于何种情况下,哪一方面机制占主导作用还需进一步研究。
5 小结与展望
Gal-9 在肝病免疫调节中具有多种生物学功能,这些功能与肝内免疫稳态相关。根据不同肝脏疾病,Gal-9可能通过不同通路发挥不同的功能。此外,检测Gal-9水平变化可作为疾病严重程度分型及预后的生物学标志物。但是,Gal-9 在体内免疫调节的具体机制尚未完全阐明,例如在DILI 中Gal-9 水平的升高是炎症反应的结局还是调控炎症的因子;在HCC 中Gal-9 既发挥免疫抑制又发挥免疫促进的作用等,还需进一步开展研究验证。通过深入研究Gal-9 在各类肝病中的作用机制,有助于Gal-9 作为治疗靶点研发新型治疗药物,进而改善病毒感染、自身免疫性疾病和癌症的临床结局。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:凌珺负责查找文献、撰写论文;朱冰负责拟定写作思路;陈威巍、王卓然负责修改论文;余丽梅、游绍莉负责拟定写作思路,指导撰写文章,修改论文并最后定稿。余丽梅与游绍莉对本文贡献等同,同为第一作者。

