MGAT3在胃癌组织中的表达及其对患者预后的影响



[摘" "要]" "目的:研究甘露糖甙乙酰氨基葡糖转移酶3(mannoside acetylglucosaminyltransferase 3, MGAT3)在人胃癌中的表达及其与患者预后的相关性。方法:利用在线Kaplan-Meier(KM) plotter数据库(https://kmplot.com/analysis/)初步分析MGAT3的表达与胃癌患者生存期的关系,利用免疫组织化学法检测MGAT3在人胃癌石蜡组织中的表达及其与患者临床病理特征、生存预后的相关性,利用在线基因表达谱交互分析(gene expression profiling interactive analysis, GEPIA)数据库进行基因的相关性分析。结果:KM plotter在线数据库分析结果显示MGAT3的表达与胃癌患者的总生存期(overall survival, OS)及进展后生存期(post-progression survival, PPS)均呈负相关(均Plt;0.05),免疫组化标记结果显示胃癌组织中MGAT3蛋白的表达比癌旁组织的表达更高,且与肿瘤的TNM分期、肿瘤的浸润深度、肿瘤的淋巴结转移及患者术前血癌胚抗原(carcinoembryonic antigen, CEA)水平存在相关性(均Plt;0.05)。进一步的生存分析结果显示,MGAT3的表达越高胃癌患者的OS越短,两者呈负相关(Plt;0.05)。回归分析结果显示MGAT3蛋白的高表达(P=0.035)、肿瘤的高TNM分期(Plt;0.001)及淋巴结有转移(Plt;0.001)独立影响胃癌患者的预后。基因相关性分析结果显示MGAT3与重组人E钙黏蛋白、波形蛋白、重组人酪氨酸激酶erbB-2、MutL同源基因1、减数分裂后分离时增加2及MutS同源基因6的表达相关。结论:MGAT3在人胃癌组织中高表达,其表达与患者的预后呈负相关。
[关键词]" "胃癌;甘露糖甙乙酰氨基葡糖转移酶3;免疫组织化学;临床病理特征;预后
[中图分类号]" "R735.2" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)06-0508-06
Expression of MGAT3 in gastric cancer and the effect on prognosis of patients*
ZHU Jun1**, SUN Yuying2, LIU Hongbin3, WANG Yan2, ZHANG Shu2***" " " " (1Department of Gastroenterology, Rugao Boai Hospital, Jiangsu 226500; 2Department of Pathology, Affiliated Hospital of Nantong University; 3Department of Pathology, Nantong First People?蒺s Hospital)
[Abstract]" "Objective: To study the expression of mannoside acetylglucosaminyltransferase 3(MGAT3) in human gastric cancer and its correlation with patients"prognosis. Methods: The relationship between the expression of MGAT3 and the survival of gastric cancer patients was preliminarily analyzed using the online Kaplan-Meier(KM) plotter database(https://kmplot.com/analysis/). The expression of MGAT3 in paraffin tissues of human gastric cancer, its correlation with the clinicopathological characteristics and the prognosis of the patients were detected by immunohistochemistry. The correlation analysis of genes was performed the online gene expression profiling interactive analysis(GEPIA) database. Results: Online KM plotter analysis showed that the expression of MGAT3 was negatively correlated with overall survival(OS) and post-progression survival(PPS) of gastric cancer patients(all Plt;0.05), and immunohistochemical analysis showed that MGAT3 protein was highly expressed in gastric cancer tissues and correlated with TNM stage, infiltration depth, lymph node metastasis and preoperative blood carcinoembryonic antigen(CEA) levels(all Plt;0.05). Further survival analysis showed that the higher the expression of MGAT3, the shorter the OS of gastric cancer patients, with a negative correlation between the two(Plt;0.05). Regression analysis showed that high MGAT3 expression(P=0.035), high TNM stage(Plt;0.001), and lymph node metastasis(Plt;0.001) independently affected the prognosis of gastric cancer patients. The results of gene correlation analysis showed that MGAT3 correlated with the expression of recombinant human cadherin-1, vimentin, human tyrosine kinase erbb-2, MutL homolog 1, postmeiotic segregation increased 2 and MutS homolog 6. Conclusion: MGAT3 is highly expressed in human gastric cancer tissues, and its expression negatively correlates with the prognosis of patients.
[Key words]" "gastric cancer; mannoside acetylglucosaminyltransferase 3; immunohistochemistry; clinical pathological characteristic; prognosis
胃癌是一种常见的消化道恶性肿瘤,其特点是发病率高、进展凶险、死亡率高,且大多数患者在确诊时已是晚期,5年生存率仅为6%[1]。手术仍是目前的主要治疗方式,但因其高侵袭性及转移性,患者术后预后很差,给公共卫生带来了巨大挑战[2]。因此,尽早探索抑制胃癌转移扩散的有效策略并确定用于预后评估的分子标志物,有望改善胃癌患者的预后和生活质量。
甘露糖甙乙酰氨基葡糖转移酶3(mannoside acetylglucosaminyltransferase 3, MGAT3)是糖链生物合成途径中的一个关键糖基转移酶,MGAT3基因的最初发现是在母鸡的输卵管中,可编码的N-乙酰氨基葡萄糖转移酶3(N-acetylglucos-aminyltransferase Ⅲ, GntⅢ),参与肿瘤的上皮间质转化(epithelial-mesenchymal transition, EMT)过程,在肿瘤发生发展过程中起着非常重要的作用[3]。研究[4]发现,胃癌的发生常会在同一个家族中聚集,其中常染色体显性的遗传性弥漫性胃癌中有1/4存在EMT相关因子E-钙黏蛋白的突变。MGAT3作为一个糖基转移酶,在胃癌组织中的表达情况、与肿瘤临床病理参数的相关性以及其与胃癌患者生存预后的相关性目前尚无研究。本文拟利用在线数据库及免疫组织化学法分析MGAT3在胃癌组织中的表达情况及其对胃癌患者预后的影响,明确MGAT3的临床预后价值。
1" "材料与方法
1.1" "在线Kaplan-Meier(KM) plotter数据库分析MGAT3 mRNA与胃癌患者生存期的相关性" " KM plotter数据库(https://kmplot.com/analysis/)通过利用基因芯片、RNA-seq或新一代测序(用于突变数据)技术分析超过50 000个样本来评估任何基因或基因组合对上皮性的癌症(乳腺、卵巢、肺、胃、结肠、前列腺、肾)、高低级别胶质瘤、黑色素瘤、弥漫大B细胞淋巴瘤(diffused large B cell lymphoma, DLBCL)、急性髓细胞白血病(acute myeloid leukemia, AML)和其他14种肿瘤生存期的影响[5],从而发现和验证与生存相关的生物标志物。本研究初步利用此数据库分析MGAT3与胃癌患者总生存期(overall survival, OS)及进展后生存期(post-progression survival, PPS)的关系。
1.2" "MGAT3蛋白在人胃癌组织中的表达情况
1.2.1" "临床资料" "随机选取如皋博爱医院及南通大学附属医院2016年1月—2018年12月125例胃癌患者的癌及癌旁组织石蜡标本,其中男89例,女36例。所有患者术前未做任何抗肿瘤治疗且其临床资料及随访资料完整,随访日期截至2023年12月31日,患者的生存时间为电话随访获得,为手术结束之日至随访结束之日。本研究符合伦理学标准并获得南通大学附属医院伦理委员会批准(2024-L11),患者本人或其家属知情并签署知情同意书。
1.2.2" "免疫组化染色" "根据说明书进行免疫组化检测,一抗抗体为兔抗人MGAT3抗体(1∶500,PA5-22212,Invitrogen),PBS 作为阴性对照。最后的染色结果由两名资深病理学家双盲分析。免疫组化染色的阳性结果为胃癌细胞的棕黄色或棕褐色细胞浆。染色强度评分:0(阴性)、1(弱强度)、2(中等强度)和3(强强度)。百分比评分:0(0%阳性)、1(1%~25%阳性)、2(gt;25%~50% 阳性)、3(gt;50%~75% 阳性)和4(gt;75%~100%阳性)。上述两个分数相乘作为最终得分:0~6表示无或低表达(阴性,-),7~12表示高表达(阳性,+)。随后分析MGAT3蛋白在胃癌及癌旁中的表达、与患者临床病理特征的关系,并绘制Kaplan-Meier生存曲线。
1.3" "基因的相关性分析" "利用在线基因表达谱交互分析(gene expression profiling interactive analysis, GEPIA)数据库(http://gepia.cancer-pku.cn/)进行基因相关性分析。GEPIA数据库是一款零代码操作的在线生化分析工具,它整理了每个可搜索基因在不同肿瘤样本中的表达值,可以计算某个基因在某个肿瘤中的表达水平,还可以分析基因与肿瘤预后的关系、基因之间的共表达等。本研究利用GEPIA数据库分析MGAT3与胃癌相关性分子标志物的相关性。
1.4" "统计学方法" "采用SPSS 21.0对所得数据进行统计分析,利用χ2检验分析MGAT3的表达与临床病理特征之间的相关性,利用Kaplan-Meier法进行生存分析,利用单变量和多变量Cox回归模型(Log-rank检验)进行预后分析,Plt;0.05为差异有统计学意义。
2" "结" " " 果
2.1" "MGAT3表达与胃癌患者生存期的关系" "在线数据库分析结果显示,MGAT3表达水平越高,患者的OS(HR=1.50, Plt;0.001)及PPS(HR=1.93, Plt;0.001)越短(图1),结果提示MGAT3可能与胃癌患者的生存存在相关性。
2.2" "MGAT3蛋白与人胃癌的关系
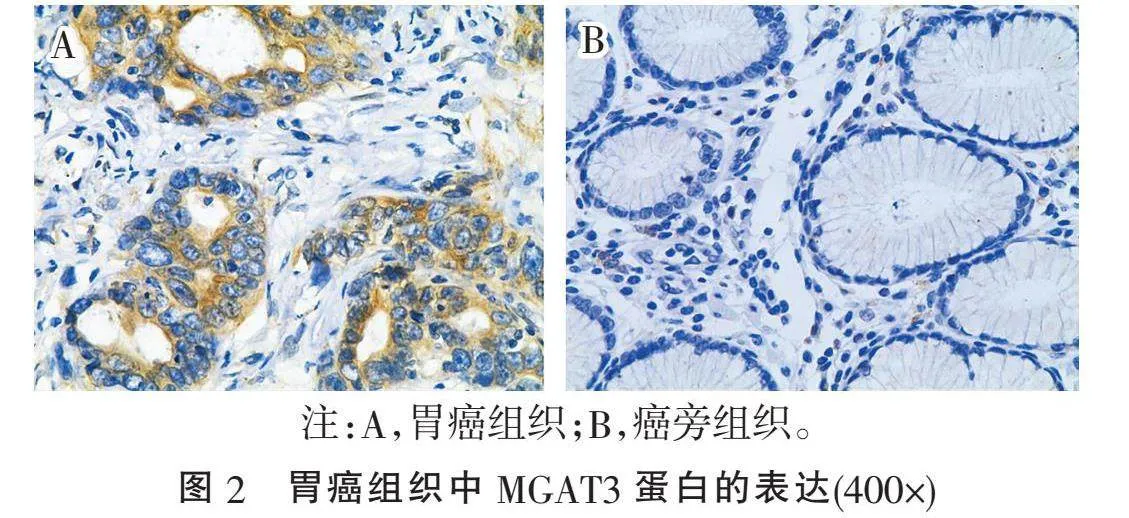
2.2.1" "MGAT3蛋白在人胃癌组织中的表达情况" "结果显示,MGAT3蛋白在胃癌组织中的表达率为75.2%(94/125),显著高于癌旁组织中的MGAT3蛋白表达率36.8%(46/125)( χ2=37.403, Plt;0.001)(图2),结果提示MGAT3蛋白在胃癌组织中高表达。
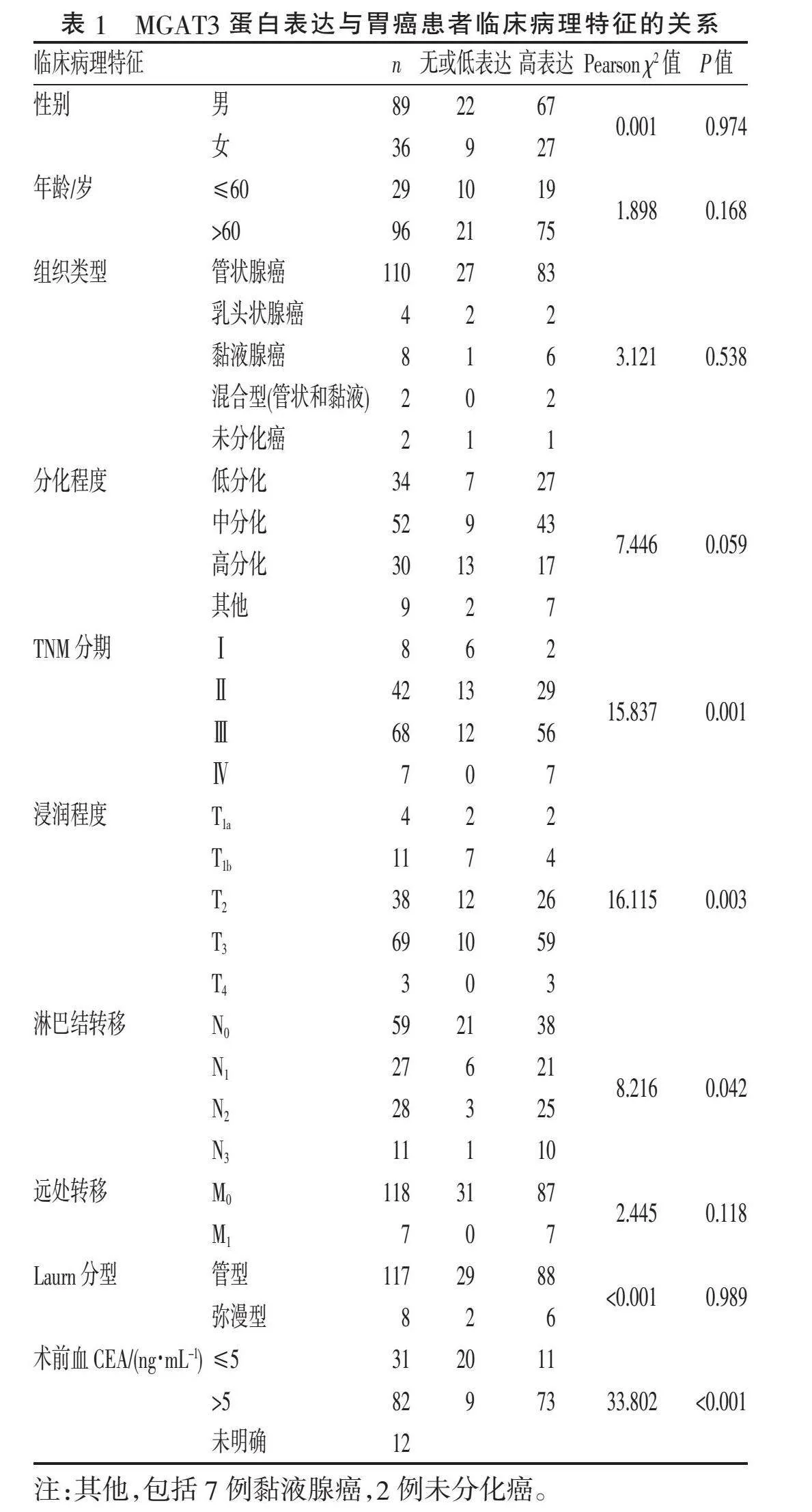
2.2.2" "胃癌石蜡组织中MGAT3蛋白的表达及其对患者临床病理特征的影响" "结果显示,临床病理特征中有4项与MGAT3蛋白高表达相关,即TNM分期、肿瘤的浸润深度、有无淋巴结转移及术前血癌胚抗原(carcinoembryonic antigen, CEA)水平。其中TNM分期越高,MGAT3蛋白表达率越高;肿瘤浸润程度越深,MGAT3蛋白表达率越高;淋巴结有转移者MGAT3蛋白表达率更高;术前血CEA水平高者MGAT3蛋白表达率更高;而与其他临床病理特征无相关性(Pgt;0.05),见表1。
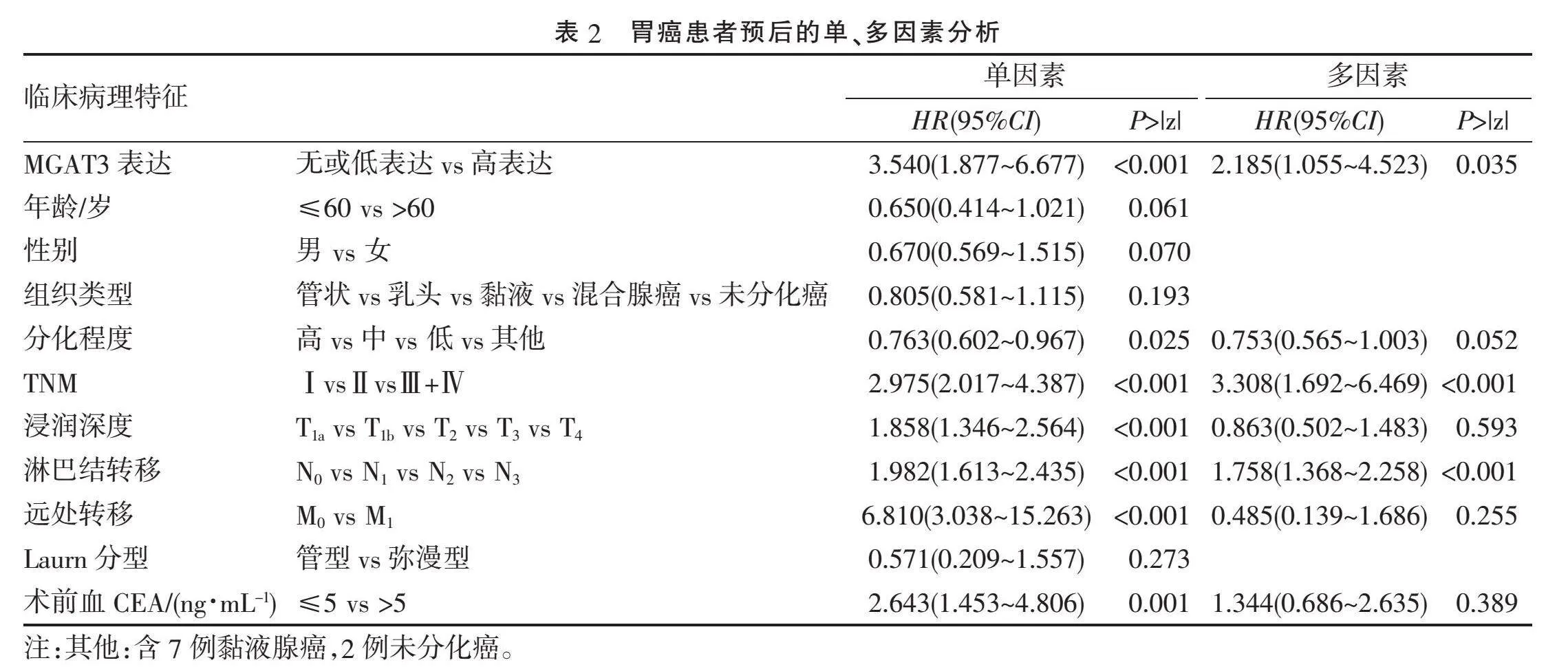
2.2.3" "MGAT3蛋白的表达对患者生存及预后的影响" "绘制Kaplan-Meier生存曲线,MGAT3蛋白的表达(Plt;0.05)(图3A)、TNM分期(Plt;0.001)(图3B)及淋巴结转移(Plt;0.001)(图3C)与患者的总生存率呈负相关。单因素分析结果显示MGAT3表达、肿瘤分化程度、TNM分期、肿瘤的浸润深度、淋巴结转移、远处转移及术前血CEA水平与患者的预后相关,进一步的多因素分析结果显示,其中MGAT3表达、TNM分期及淋巴结转移是独立的预后危险因素,见表2。
2.3" "MGAT3的基因相关性分析" "GEPIA在线数据库的数据分析结果显示,MGAT3与重组人E钙黏蛋白(recombinant human cadherin-1, CDH1)、波形蛋白(vimentin, VIM)、重组人酪氨酸激酶erbB-2(human tyrosine kinase erbb-2, ERBB2)、MutL同源基因1(MutL homolog 1, MLH1)、减数分裂后分离时增加2(pos-tmeiotic segregation increased 2, PMS2)及MutS同源基因6(MutS homolog 6, MSH6)的表达相关,见图4。
3" "讨" " " 论
胃癌被定义为源自胃部的原发性上皮性恶性肿瘤,是一种复杂的异质性疾病,具有多种风险因素,是全球第五大常见恶性肿瘤和第四大癌症相关死亡原因。尽管胃癌的全球负担呈显著下降趋势,但中国胃癌的发病率和死亡率在所有癌症类型中排名第三,分别占全球胃癌新发病例和胃癌相关死亡病例的近44.0%和48.6%[6]。胃癌的发生和发展的风险因素很多,有些是不可控的,如年龄、性别、种族和遗传等,有些是可控的,如幽门螺杆菌(H.pylori)感染、胃肠道微生物群、肥胖、不健康的饮食习惯和生活方式、吸烟和饮酒以及化学、辐射或病毒暴露等[6]。
随着分子生物学研究的快速发展,胃癌的治疗方法也在不断改进,包括免疫疗法[7]。此外,新型药物的出现也为胃癌中晚期的患者带来了希望。虽然这些干预措施提高了患者的术后生存率,但由于药物的毒副作用大、敏感性和特异性有限,胃癌的预后仍然充满挑战,尤其是中晚期患者[8]。
糖基化是蛋白质的一种主要翻译后修饰,在哺乳动物中高度保守,参与调节蛋白质功能和控制蛋白质质量的各种生物过程[9]。蛋白质N-糖基化是发生在内质网和高尔基体中的一个复杂过程,由多种酶调节,并在糖供体转运蛋白和辅助蛋白的协同作用下进行[10],N-糖分支的调控不仅在生理过程中且在各种疾病的发生和恶化中起着关键作用[11]。
MGAT3是塑造蛋白质和细胞N-糖结构的关键酶,它是一种驻留在高尔基的Ⅱ型膜蛋白,在脑、肾和肠中的表达量较高[12]。MGAT3与多种肿瘤的发生发展相关,包括肝癌[13]、肺癌[14]、宫颈癌[15]、乳腺癌[16]、结直肠癌[17]及前列腺癌[18]等。研究[19]显示,胰腺癌中MGAT3可能是miR-324-5p直接调控的下游靶基因,而miR-324-5p的低表达与患者预后差相关。因此推测MGAT3可能会影响胰腺癌患者的预后。另外,在神经母细胞瘤患者中,MGAT3的表达与总生存期和无复发生存期密切相关[20]。但MGAT3在胃癌中的表达及与患者预后的关系鲜见报道。
本研究首先通过在线GEPIA数据库初步分析MGAT3与胃癌患者生存期的关系,结果显示MGAT3表达与胃癌患者的生存相关,由此推测其与胃癌的发生发展可能相关。为进一步验证,本研究首先利用免疫组化检查MGAT3在胃癌中的表达水平,结果显示胃癌组织中MGAT3高表达,且与患者的TNM分期、肿瘤的浸润深度、淋巴结转移及术前血CEA水平相关,可见MGAT3的表达与胃癌的浸润和转移密切相关。作为一种糖基转移酶基因,MGAT3除了调控细胞表面碳水化合物链的功能外,还调控各种细胞事件[21]。本研究后续的生存预后分析结果显示MGAT3的高表达预示胃癌患者更短的生存期和更差的预后,与在线数据库的分析结果基本一致,提示MGAT3可作为提示胃癌患者预后的指标。
MGAT3基因编码GnT-Ⅲ,有人认为它是一种转移抑制因子,会影响细胞的黏附和迁移。研究[13]表明,MGAT3参与了多种肿瘤的EMT过程。在人肝细胞癌细胞中,TGF-β1可诱导GnTⅢ基因及其催化产物,引起 Smad3和Erk1/2磷酸化上调,进而影响其EMT过程。在肺癌中,miR-188-5p可调控MGAT3参与肿瘤的EMT及转移过程[14]。在宫颈癌中,MGAT3高表达增加E-钙黏蛋白表达,降低N-cadherin和β-catenin表达,参与宫颈癌细胞的转移[15]。在乳腺癌细胞中,MGAT3高表达也参与了细胞增殖迁移、EMT过程及AKT信号通路[16]。在所有IFN-γ耐药细胞中,MGAT3表达的下调与IFN-γ耐药相关,并与结直肠癌组织中IFNγRα的低表达高度相关[17]。MGAT3受miR-199a-5p负调控,受circ_0070934正调控,从而抑制支气管上皮细胞的EMT过程[22]。研究[23]表明,将MGAT3基因转染到具有高转移能力的B16小鼠黑色素瘤细胞中可抑制体内的肺转移,并在体外增加E-钙黏蛋白的糖基化。E-钙黏蛋白是一种钙依赖性细胞黏附分子,能维持细胞间黏附的稳定性和细胞极性。在肿瘤发生过程中,当E-钙黏蛋白表达减少或缺失时,会导致细胞间连接减少、形态改变,进而增加移动性。E-钙黏蛋白表达的丧失被认为是EMT最显著的特征,检测E-钙黏蛋白的表达状态是确定是否发生EMT的重要指标,也被认为是与患者生存率相关的预后因素[24]。间质标志蛋白(如VIM)的表达增加会改变细胞骨架结构,进一步促使细胞向更具移动性和侵袭性的方向转化[25]。基因相关性分析结果显示MGAT3与CDH1与VIM呈正相关,初步预测了MGAT3与胃癌EMT的相关性,这将是今后的研究内容之一。本研究结果显示ERBB2、MLH1、PMS2及MSH6与胃癌的分子分型密切相关,也影响胃癌患者的预后[26-27],MGAT3与ERBB2、MLH1、PMS2及MSH6的相关性进一步提示了MGAT3表达与胃癌的发生及患者预后的相关性。
总之,MGAT3在胃癌中的表达及其预测患者生存预后的功能具有一定的临床价值,也为胃癌的精准治疗提供了可能的分子标志物。
[参考文献]
[1]" "MATHIAS-MACHADOM C, DE JESUSV H F, J?魣COME A, et al. Claudin 18.2 as a new biomarker in gastric cancer-what should we know?[J]. Cancers, 2024, 16(3):679.
[2]" "YEOH K G, TAN P. Mapping the genomic diaspora of gastric cancer[J]. Nat Rev Cancer, 2022, 22(2):71-84.
[3]" "MIWAH E, SONG Y H, ALVAREZ R, et al. The bisecting GlcNAc in cell growth control and tumor progression[J]. Gly-coconj J, 2012, 29(8/9):609-618.
[4]" "ROSSI T, TEDALDI G, PETRACCI E, et al. E-cadherin downregulation and microRNAs in sporadic intestinal-type gastric cancer[J]. Int J Mol Sci, 2019, 20(18):4452.
[5]" "GYRFFY B. Integrated analysis of public datasets for the discovery and validation of survival-associated genes in solid tumors[J]. Innovation, 2024, 5(3):100625.
[6]" "YANGW J, ZHAOH P, YU Y, et al. Updates on global epidemiology, risk and prognostic factors of gastric cancer[J]. World J Gastroenterol, 2023, 29(16):2452-2468.
[7]" "CAI H Z, LI M, DENG R Y, et al. Advances in molecular biomarkers research and clinical application progress for gastric cancer immunotherapy[J]. Biomark Res, 2022, 10(1):67.
[8]" "ZANGY S, DAI C, XU X M, et al. Comprehensive analysis of potential immunotherapy genomic biomarkers in 1000 Chinese patients with cancer[J]. Cancer Med, 2019, 8(10):4699-4708.
[9]" "VARKI A. Biological roles of glycans[J]. Glycobiology, 2017, 27(1):3-49.
[10]" "张鑫, 庞星辰, 李想. 骨髓基质细胞中MGAT3催化的平分型N-糖链对血液细胞黏附和迁移的影响[J]. 生物学杂志, 2018, 35(5):28-32.
[11]" "HASHIMOTO Y, KAWADE H, BAO W X, et al. The K346T mutant of GnT-III bearing weak in vitro and potent intracellular activity[J]. Biochim Biophys Acta Gen Subj, 2024, 1868(9):130663.
[12]" "MIYOSHI E, UOZUMI N, NODA K, et al. Expression of alpha1-6 fucosyltransferase in rat tissues and human cancer cell lines[J]. Int J Cancer, 1997, 72(6):1117-1121.
[13]" "MO C J, LIU T H, ZHANG S, et al. Reduced N-acetylglucosaminyltransferase III expression via Smad3 and Erk signaling in TGF-β1-induced HCC EMT model[J]. Discov Med, 2017, 23(124):7-17.
[14]" "NIU H Y, QU A N, GUAN C Y. Suppression of MGAT3 expression and the epithelial-mesenchymal transition of lung cancer cells by miR-188-5p[J]. Biomed J, 2021, 44(6):678-685.
[15]" "YOU X W, WANG Y, MENG J Y, et al. Exosomal miR-663b exposed to TGF-β1 promotes cervical cancer metastasis and epithelial-mesenchymal transition by targeting MGAT3[J]. Oncol Rep, 2021, 45(4):12.
[16]" "TAN Z Q, WANG C X, LI X, et al. Bisecting N-acetylglucosamine structures inhibit hypoxia-induced epithelial-mesenchymal transition in breast cancer cells[J]. Front Physiol, 2018, 9:210.
[17]" "KRUG J, RODRIAN G, PETTER K, et al. N-glycosylation regulates intrinsic IFN-γ resistance in colorectal cancer: implications for immunotherapy[J]. Gastroenterology, 2023, 164(3):392-406.e5.
[18]" "MACKEA J, PACHIKOVA N, DIVITAT E, et al. Targeting the ATF6-mediated ER stress response and autophagy blocks integrin-driven prostate cancer progression[J]. Mol Cancer Res, 2023, 21(9):958-974.
[19]" "王琦, 陈凯, 刘鑫鑫, 等. 微小RNA-324-5p在胰腺癌中的表达及对胰腺癌细胞增殖和迁移能力的影响[J]. 中华肝胆外科杂志, 2021, 27(1):66-71.
[20]" "KHANF H, PANDIAN V, RAMRAJ S, et al. Acquired genetic alterations in tumor cells dictate the development of high-risk neuroblastoma and clinical outcomes[J]. BMC Cancer, 2015, 15:514.
[21]" "TANIGUCHI N, KIZUKA Y. Glycans and cancer: role of N-glycans in cancer biomarker, progression and metastasis, and therapeutics[J]. Adv Cancer Res, 2015, 126:11-51.
[22]" "DING Z Q, XIAO X R, FAN L, et al. Circ_0070934 promotes MGAT3 expression and inhibits epithelial-mesenchymal transition in bronchial epithelial cells by sponging miR-199a-5p[J]. Allergy Asthma Clin Immunol, 2024, 20(1):23.
[23]" "YOSHIMURA M, NISHIKAWA A, IHARA Y, et al. Suppression of lung metastasis of B16 mouse melanoma by N-acetylglucosaminyltransferaseⅢ gene transfection[J]. Proc Natl Acad Sci U S A, 1995, 92(19):8754-8758.
[24]" "RUBTSOVAS N, ZHITNYAKI Y, GLOUSHANKOVAN A. Dual role of E-cadherin in cancer cells[J]. Tissue Barriers, 2022, 10(4):2005420.
[25]" "VAN LOON K, VAN BREEST SMALLENBURG M E, HUIJBERS E J M, et al. Extracellular vimentin as a versatile immune suppressive protein in cancer[J]. Biochim Biophys Acta Rev Cancer, 2023, 1878(6):188985.
[26]" "张迎秋, 刘书言, 刘晗. 受体酪氨酸激酶ErbB2靶向治疗策略和内吞降解调控的研究进展[J]. 中国科学: 生命科学, 2021, 51(12):1668-1680.
[27]" "郝美玲, 张秀芬, 李子鑫, 等. 胃癌组织中MLH1, MSH2, MSH6和PMS2表达及与临床病理特征和预后的相关性分析[J]. 现代检验医学杂志, 2023, 38(2):48-51, 62.
[收稿日期] 2024-10-19

