短小芽孢杆菌对羔羊肠道炎症和屏障功能的影响
焦帅 付域泽 崔凯 张吉贤 王杰 毕研亮 刁其玉 张建新 张乃锋
(1. 中国农业科学院饲料研究所 农业农村部饲料生物技术重点实验室,北京 100081;2. 山西农业大学动物科学学院,太谷 030801)
新生羔羊在脱离母体后,面临着众多挑战,主要是营养水平、环境条件和微生物的改变,这些改变极易造成羔羊腹泻。腹泻发病率最高时期是羔羊出生后的15 d之内[1]。羔羊早期腹泻影响其生长发育,对生产性能和肠道健康产生不利影响,轻则生长缓慢,重则死亡。对于集约化养殖场来说,初生羔羊腹泻是致死的重要原因之一,给养殖场带来重大经济损失。因此,预防初生羔羊腹泻是目前需要解决的难题。肠道微生物群和宿主健康之间的关系引发了人们对添加益生菌来防治动物疾病的关注。由于芽孢杆菌能形成孢子,较其它细菌来说更有利于在胃肠道环境中存活[2],且方便储存和运输[3],因此芽孢杆菌常被用作人类和多种动物的益生菌补充剂[4]。短小芽孢杆菌是一类需氧或兼性厌氧的革兰氏阳性菌,参与生物夺氧,维持胃肠道厌氧环境[5];促进动物肠道和机能的成熟;分泌抗菌素、抗菌肽和抗菌蛋白等多种抗菌物质[6]。
前人研究表明,添加短小芽孢杆菌可增强肉鸡免疫力,调节肠道菌群,改善肠道形态结构,提高肉鸡稳定性[7-8]。其次,短小芽孢杆菌在提高水生动物生长、免疫和抗病力方面具有很大潜力[9-10]。Zhang等[11]通过探究短小芽孢杆菌对断奶金堂黑山羊瘤胃和肠道形态及微生物区系的影响发现,其对瘤胃和小肠发育有促进作用,并且通过增加肠道有益细菌的丰度来调节微生物群落,以促进营养代谢和健康状况。但短小芽孢杆菌能否通过改善肠道健康缓解羔羊腹泻还未有研究。本试验假设添加适当剂量的短小芽孢杆菌可以缓解肠道炎症反应、增强肠道屏障功能,最终缓解羔羊腹泻。本研究通过在代乳粉中添加短小芽孢杆菌,研究其对新生羔羊生长性能、腹泻、血清指标、结肠组织形态、炎症细胞因子和紧密连接蛋白含量的影响,为短小芽孢杆菌在反刍动物中的应用提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种 试验所用短小芽孢杆菌为实验室保存在中国普通微生物菌种保藏管理中心的一株专利菌,名为短小芽孢杆菌315,保藏号编号为CGMCC NO.8878。将菌液扩增之后放于4℃冰箱保存,并测定其活菌数为1×108CFU/mL,用于后续试验。
1.1.2 试剂 血清谷丙转氨酶、谷草转氨酶、二胺氧化酶和D-乳酸试剂盒,炎症细胞因子和紧密连接蛋白ELISA检测试剂盒均购自北京金海科隅生物科技发展有限公司,生理盐水、苏木精、福尔马林等均购自系统平台。
1.1.3 仪器 科华ZY KHB-1280全自动生化仪(上海科华生物工程股份有限公司),BA210Digital数码三目显微摄像系统(厦门麦克奥迪实业集团有限公司),ST-360酶标仪(上海科华生物工程股份有限公司)。
1.2 方法
1.2.1 试验设计 选用36只初生重3 kg左右的1日龄萨能奶山羊公羔,采用单因素随机设计,分为4组,每组9个重复,每重复1只羔羊。4组分别为CON组(无菌液,饲喂10 mL生理盐水),BP1组(饲喂1 mL菌液,9 mL生理盐水),BP5组(饲喂5 mL菌液,5 mL生理盐水),BP10组(饲喂10 mL菌液,无生理盐水)。羔羊经过养殖场出生保健程序,在1日龄即开始灌服菌液,每天灌服一次,连续灌服14 d。本研究经中国农业科学院饲料研究所动物伦理委员会批准(IFR-CAAS-20220822),实验过程中实施了人道的动物护理和处理程序。
1.2.2 饲养管理 试验前对圈舍进行清洗和消毒,羔羊出生后即与母羊分离,在试验期的14 d,前3 d饲喂初乳,之后饲喂代乳粉,代乳粉营养水平见表1。短小芽孢杆菌菌液(以及生理盐水)混在50 mL初乳(存放于冰箱中,饲喂时需加热)或代乳粉中使用奶瓶灌服,饲喂时初乳或代乳粉温度保持在42℃,确保50 mL初乳或代乳粉饲喂完后,让羔羊自由采食(不限量)。初乳或代乳粉每天饲喂3次,饲喂时间为上午8点、下午2点和晚上8点,其中第一次饲喂时添加菌液,而后二次不添加。每天消毒打扫卫生,圈舍温度保持在20-30℃。羔羊保健程序按羊场日常管理进行。
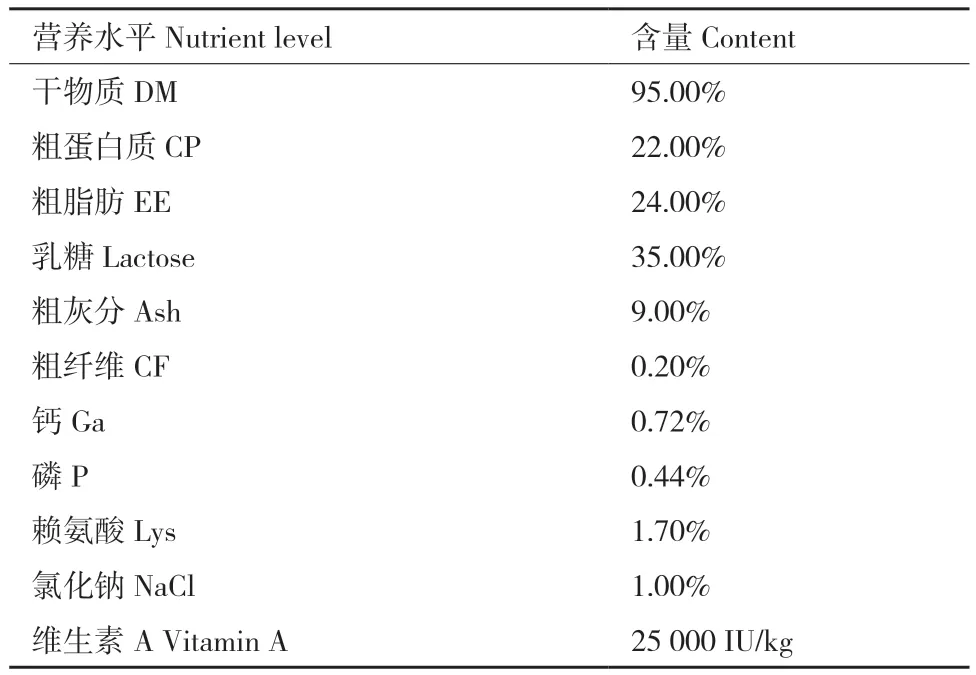
表1 代乳粉营养水平Table 1 Nutrient levels of milk replacer
1.2.3 样品采集与指标检测
1.2.3.1 生长性能及腹泻情况 在试验开始第1天和第15天早上对羔羊进行称重,并且每天记录其采食量,用以计算平均日增重、平均日采食量和料重比。试验期间每天下午观察羔羊腹泻和健康状况,并对其粪便进行评分。采用1-4分制进行粪便评分[12],粪便正常、干燥成型计1分,粪便柔软呈布丁状记2分,粪便流动呈糊状记3分,粪便呈液体状记4分,粪便评分≥2记为1次腹泻。粪便评分=粪便评分总和/(试验天数×羔羊数)[13],腹泻频率=(腹泻羔羊数×腹泻天数)/(总羔羊数×试验天数)×100%[11]。
1.2.3.2 血清指标 正饲期第14天,每组随机选取6只羔羊,采用颈静脉采血法采集10 mL血液,3 000 r/min离心15 min,将血清分装于1.5 mL离心管中,-20℃保存备用。采用生化法测定血清中谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、二胺氧化酶(diamine oxidase, DAO)和D-乳酸(D-lactase, LD)的含量。
1.2.3.3 结肠组织形态 正饲期第15天,每组随机选取6只羔羊屠宰,屠宰后从空肠和结肠中段剪取2 cm长的肠环,用生理盐水洗去肠环中的内容物,之后将肠段组织置于装满10%福尔马林的10 mL离心管中,保证肠段完全浸没在福尔马林中,用来切片观察肠道炎症细胞。固定组织并使用全自动脱水机进行脱水,使用石蜡进行包埋,切片,使用苏木精和伊红染色,最后用中性树胶封固。采用显微摄像系统对切片进行图像采集,每张切片先于低倍镜下观察全部组织,选择要观察的区域采集图片,将采集到的图片导入Motic Images Advanced 3.2,选择工具栏里的测量选项,调整物镜的倍数(4×)及测量数据的单位(μm),选择折线和直线工具测量所需数据。测定指标包括隐窝深度、黏膜厚度和肌层厚度。
1.2.3.4 炎症细胞浸润 每张切片先于低倍镜下观察全部组织,选择要观察的区域采集400倍镜下炎症细胞(中性粒细胞、淋巴细胞和巨噬细胞)的图片,进行计数。
1.2.3.5 炎症细胞因子和紧密连接蛋白含量 屠宰后取空肠和结肠中段,纵向剖开肠段,用生理盐水冲洗掉肠道内容物,之后用载玻片刮取并收集黏膜至2 mL冻存管中,置于液氮中,后续放于-80℃冰箱保存备用。采用酶联免疫法测定黏膜中白细胞介素1β(interleukin-1β, IL-1β)、IL-6、IL-10、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、转化生长因子β(transforming growth factor-β, TGF-β)、γ干扰素(interferon-γ, IFN-γ)、过氧化物酶体增殖物激活受体γ(peroxisome proliferater-activated receptor gamma, PPARγ)、总蛋白(total protein, TP)、黏蛋白2(mucoprotein2, MUC2)、闭合蛋白1(claudin-1)、闭合蛋白4(claudin-4)、咬合蛋白(occludin)、闭合小环蛋白1(zonula occludens-1,ZO-1)的含量,黏膜样品在室温解冻后,加入适量的生理盐水匀浆,3 000 r/min离心10 min取上清。使用ELISA检测试剂盒进行提取,之后使用ST-360酶标仪上机检测。
1.2.4 数据分析 试验数据采用SPSS26.0软件进行单因素方差分析,差异显著时采用Duncan氏法进行多重比较,并采用线性和二次回归分析饲粮中短小芽孢杆菌的剂量效应。P < 0.05为差异显著,0.05 ≤P < 0.10为有变化趋势。
2 结果
2.1 短小芽孢杆菌对生长性能和腹泻的影响
由表2可知,试验所用羔羊初始体重无显著差异,符合试验设计要求。饲喂短小芽孢杆菌对羔羊末重、平均日增重、平均日采食和料重比均无显著影响(P > 0.05)。随着短小芽孢杆菌添加水平的增加,羔羊粪便评分和腹泻频率呈二次曲线变化;与对照组相比,BP1组、BP5组、BP10组粪便评分和腹泻频率显著降低(P < 0.05)。
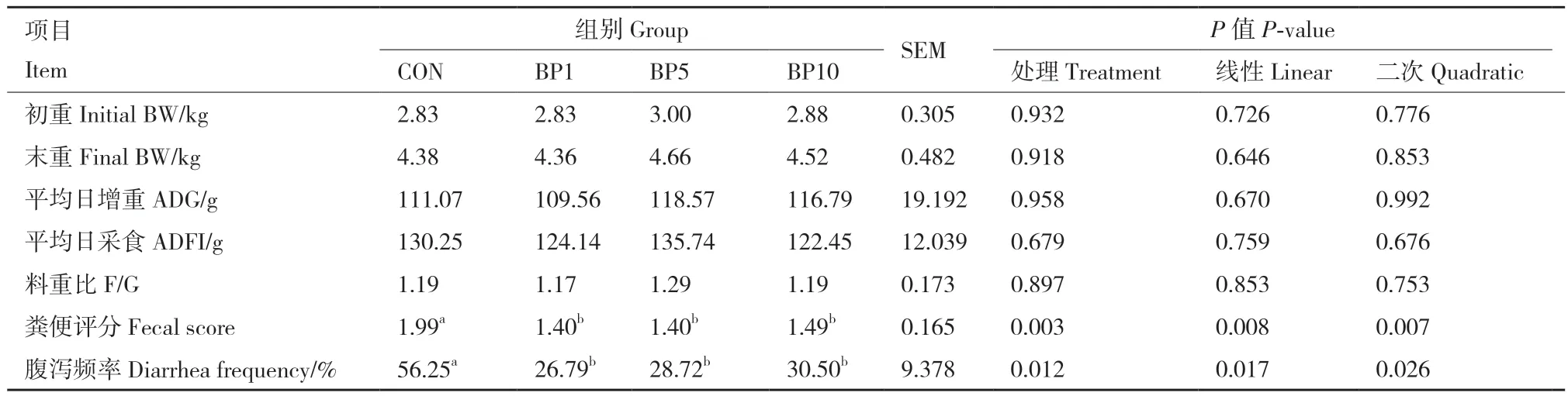
表2 短小芽孢杆菌对羔羊生长性能和腹泻的影响Table 2 Effects of B. pumilus on the growth performance and diarrhea of goat kids
2.2 短小芽孢杆菌对血清生化指标的影响
由表3可知,血清中AST和D-乳酸含量随着短小芽孢杆菌添加水平的增加呈现二次曲线变化(P< 0.05),BP1组AST含量显著低于对照组(P < 0.05),DAO含量显著低于对照组和BP5组(P < 0.05)。与对照组相比,BP1组、BP5组、BP10组均显著降低了血清中D-乳酸含量(P < 0.05)。添加短小芽孢杆菌对ALT含量无显著影响(P > 0.05)。
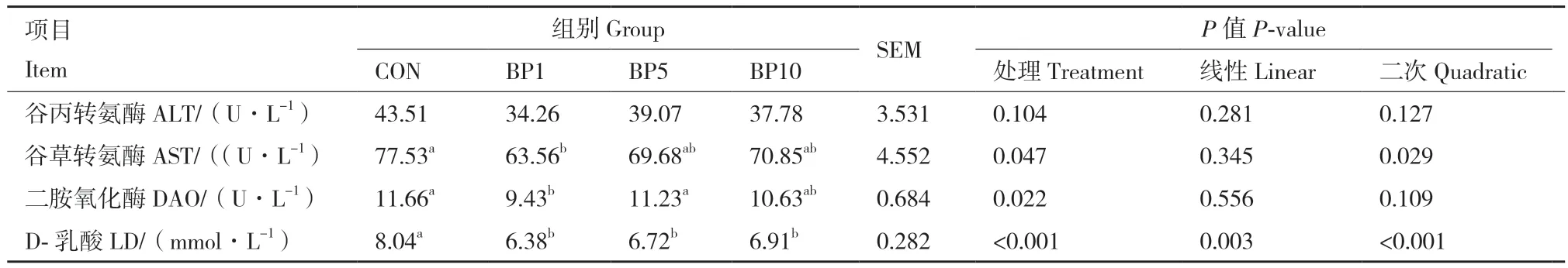
表3 短小芽孢杆菌对羔羊血清生化指标的影响Table 3 Effects of B. pumilus on the serum biochemical indices of goat kids
2.3 短小芽孢杆菌对肠道炎症细胞因子的影响
由表4可知,随着饲粮中短小芽孢杆菌添加水平的增加,结肠中IL-1β、IL-6、IL-10、TNF-α、TGF-β、IFN-γ、PPARγ含量呈现二次曲线变化(P <0.05)。与对照组相比,BP1组、BP5组和BP10组均显著降低了IL-1β、IL-6、TNF-α含量(P < 0.05),显著增加了IL-10、TGF-β、IFN-γ、PPARγ的含量(P< 0.05)。且BP1组、BP5组、BP10组组间无显著差异(P > 0.05)。
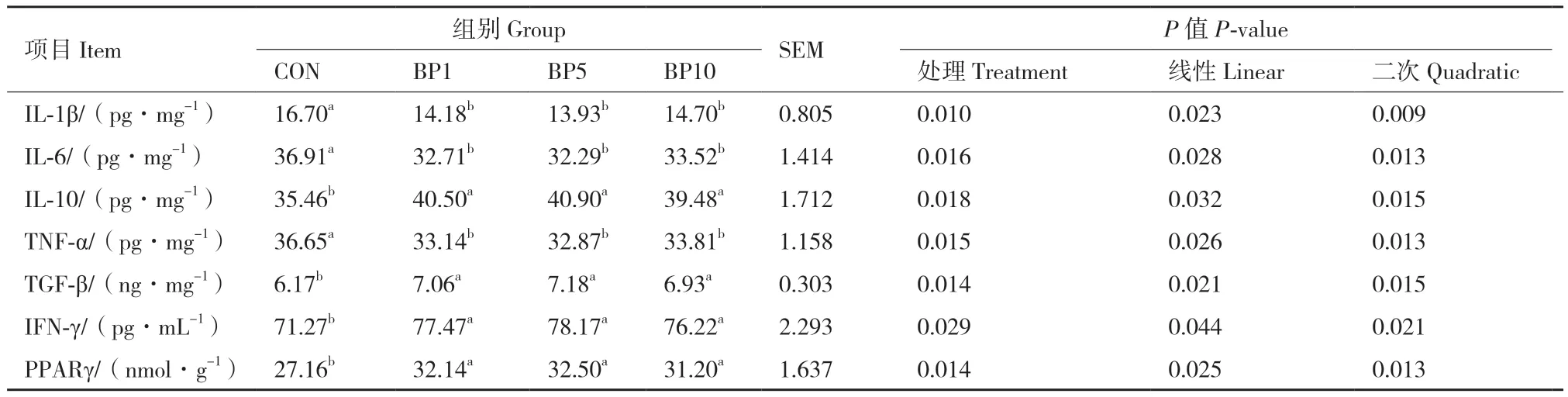
表4 短小芽孢杆菌对炎症细胞因子的影响Table 4 Effects of B. pumilus on inflammatory factors
2.4 短小芽孢杆菌对炎症细胞浸润的影响
随着短小芽孢杆菌添加水平的增加,视野下中性粒细胞数量呈线性降低(P < 0.05,表5),饲粮中添加短小芽孢杆菌对结肠中性粒细胞、淋巴细胞和巨噬细胞数量无显著影响(P > 0.05),但与对照组相比,BP1组、BP5组和BP10组中性粒细胞数量均降低。短小芽孢杆菌对结肠炎性细胞浸润的影响见图1,对照组中可见胞质呈淡红色,细胞核呈杆状或分叶状的中性粒细胞明显多于试验组,组织病理改变程度较严重,试验组结肠组织病理改变程度相对较轻。
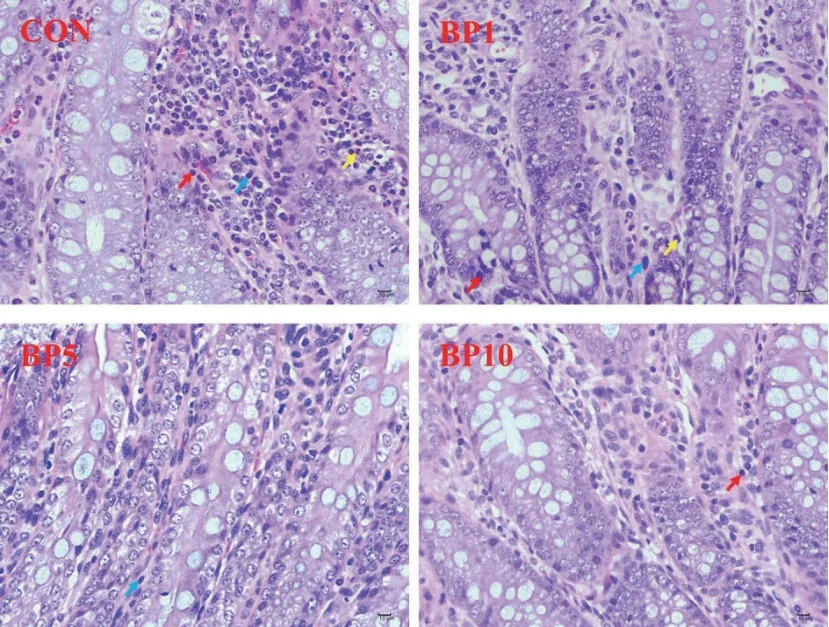
图1 短小芽孢杆菌对羔羊结肠上皮炎性细胞浸润的影响(HE染色,400×;中性粒细胞(↑)淋巴细胞(↑)巨噬细胞(↑))Fig. 1 Effects of B. pumilus on inflammatory cell infiltration in the colonic epithelium of goat kids(hematoxylin-eosin staining, 400×; neutrophil(↑), lymphocyte(↑), macrophages(↑))
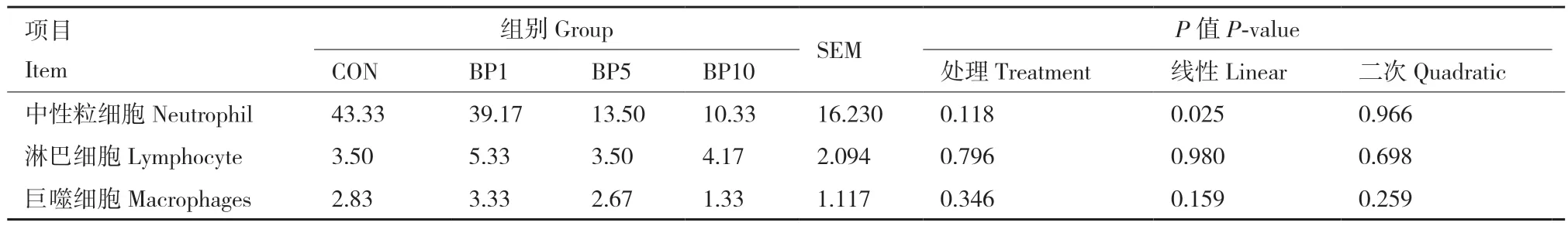
表5 短小芽孢杆菌对炎症细胞数量的影响Table 5 Effects of B. pumilus on the number of inflammatory cells
2.5 短小芽孢杆菌对结肠组织形态的影响
随着短小芽孢杆菌添加水平的增加,结肠肌层厚度呈二次曲线变化(P < 0.05,表6)。与对照组相比,BP1组显著增加了结肠肌层厚度(P < 0.05)。饲粮中添加短小芽孢杆菌对结肠隐窝深度、黏膜厚度以及杯状细胞数量无显著影响。图2为HE染色后在显微摄像系统中采集的40倍下结肠形态的图片。
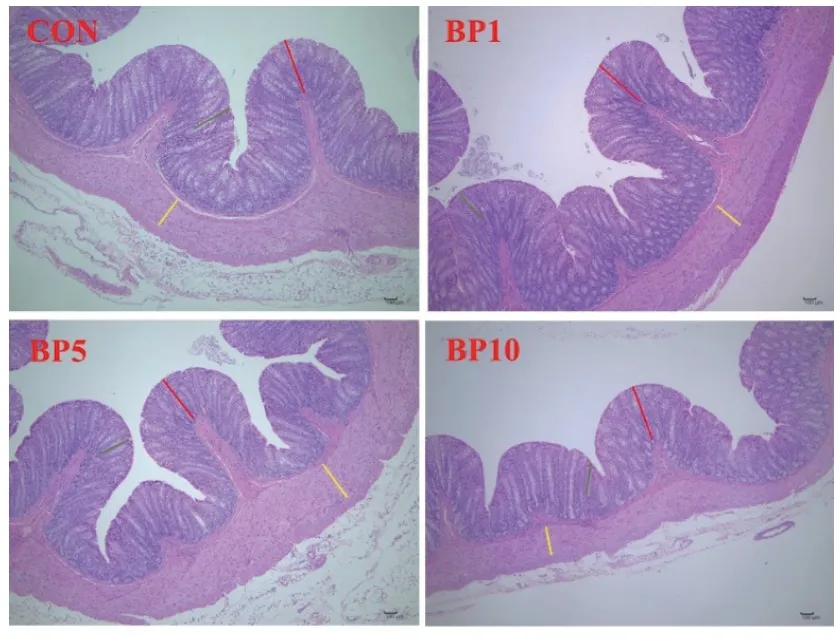
图2 羔羊结肠上皮组织形态结构(HE染色,40×;隐窝深度(绿色),黏膜厚度(红色),肌层厚度(黄色))Fig. 2 Colonic morphology and structure of goat kids(hematoxylin-eosin staining, 40×;crypt depth(green),mucosal thickness(red),and muscular thickness(yellow))
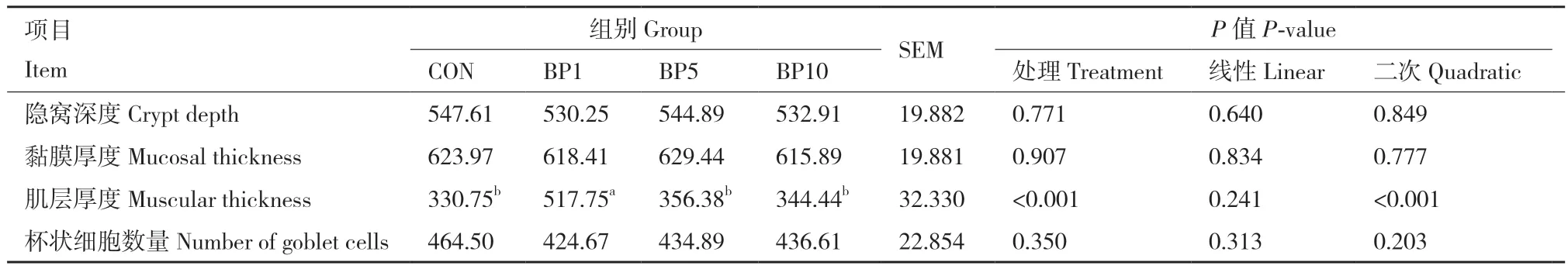
表6 短小芽孢杆菌对结肠组织形态的影响Table 6 Effects of B. pumilus on colonic morphology μm
2.6 短小芽孢杆菌对结肠紧密连接蛋白的影响
由表7可知,饲粮中添加短小芽孢杆菌对结肠总蛋白含量无显著影响(P > 0.05)。随着饲粮中短小芽孢杆菌添加水平的增加,MUC2、Claudin-1、Claudin-4、Occludin、ZO-1蛋白含量呈现二次曲线变化(P < 0.05)。与对照组相比,BP1组、BP5组和BP10组均显著提高了结肠黏膜中MUC2、Claudin-1、Claudin-4、Occludin和ZO-1的含量(P < 0.05)。且BP1组、BP5组、BP10组组间无显著差异(P > 0.05)。
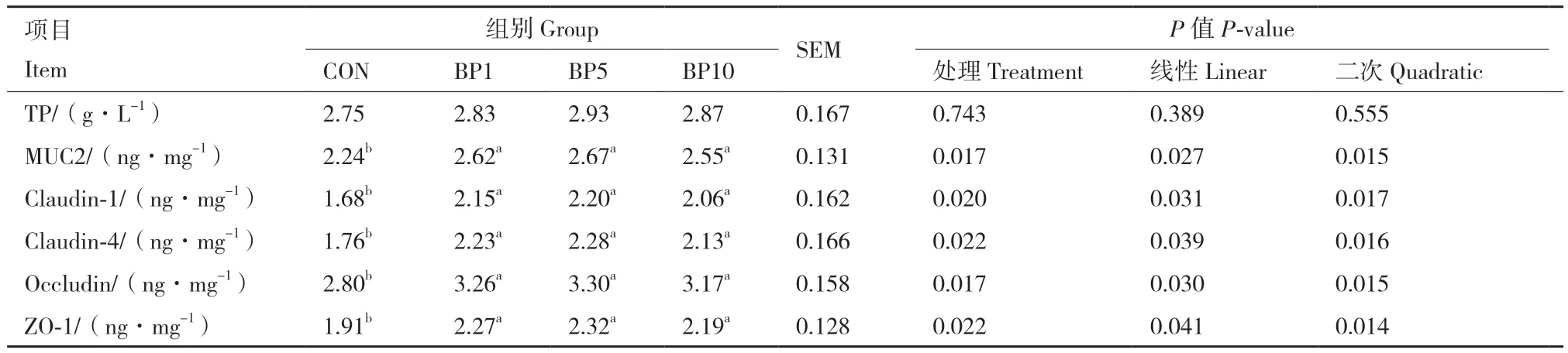
表7 短小芽孢杆菌对结肠紧密连接蛋白的影响Table 7 Effects of B. pumilus on colonic tight junction protein
3 讨论
在畜牧养殖中,新生羔羊腹泻是常见的一种疾病。受腹泻的影响,羔羊早期生长发育受到影响,对日后的生产性能以及肠道健康造成不可逆的危害,因此,预防初生羔羊腹泻,是当前需要解决的一大难题。本研究在羔羊一出生就饲喂短小芽孢杆菌发现,在15 d内显著降低了羔羊的粪便评分和腹泻频率,而肠道炎症反应过度、屏障功能障碍是引起羔羊腹泻的主要内因。进一步通过对血清相关指标以及炎性细胞因子和炎性细胞浸润的探究发现,对炎症反应有一定缓解作用。除此之外,短小芽孢杆菌还增加了结肠肌层厚度和紧密连接蛋白的含量,增强了羔羊结肠的物理屏障和化学屏障。但在本试验中,短小芽孢杆菌对羔羊的日增重、日采食量和料重比无显著影响。Truong等[14]研究表明添加解淀粉芽孢杆菌54A和短小芽孢杆菌47B的混合益生菌,改善了条纹鲶鱼的健康状况和生长性能。黄坤鹏[15]研究表明短小芽孢杆菌SE5可以促进石斑鱼生长,提高其非特异性免疫功能和存活率,调节和改善肠道菌群平衡。在反刍动物的研究中,短小芽孢杆菌fsznc-09通过改善瘤胃和肠道微生物区系来促进断奶金堂黑山羊生长和健康[11]。在不同动物的不同时期饲喂不同类型的菌株[16],其产生的效果不尽相同,这可能是生长性能出现差异的原因。与本试验设计不同,Zhang等[11]未设置添加剂量梯度,添加量为1×109CFU/mL,每2 d饲喂一次。本试验中不同短小芽孢杆菌添加剂量之间并没有呈现差异性,需要后续试验进一步调整添加剂量梯度,阐明适宜的添加剂量。
动物机体组织器官发生损伤或病变,血清生化指标也会相应改变。ALT和AST主要参与肝脏的物质代谢,当肝脏出现炎症时,血清中AST和ALT含量会有所上升[17]。本试验中添加短小芽孢杆菌降低了AST含量,说明其具有缓解肝脏炎症的潜力。IL-10作为公认的抗炎细胞因子,在调节肠道稳态、抑制炎症介质释放、促进自然免疫和特异性免疫等方面发挥重要作用[18]。先前的研究表明,缺乏IL-10可能会导致肠道炎症和慢性肠道炎症[19]。IL-1β、IL-6和TNF-α是最重要的促炎细胞因子,在炎症的发生和发展中起关键作用[18]。细胞因子的过度表达可导致不受控制的全身炎症,并导致感染性休克和坏死性小肠结肠炎。越来越多的证据表明,益生菌在肠道中定植,有助于形成抗菌环境,减少促炎细胞因子的产生。有报道称,芽孢杆菌及其代谢产物可激活NF-κB信号和NLRP3炎症体,并抑制IL-1β的分泌[20-21]。此外,肉仔鸡空肠和回肠黏膜中IL-1β、IL-6和TNF-α水平随着饲粮中解淀粉芽孢杆菌CECT 5940添加量的增加而降低[22]。我们目前的研究也得到了类似的结果,其中补充短小芽孢杆菌降低了IL-1β、IL-6、TNF-α的水平,并增加了IL-10的水平。这可能的原因是活化的PPAR-γ介导抑制细胞炎症因子TNF-α、IL-1β和IL-6的生成,产生抗炎症作用。TGF-β可以通过抑制巨噬细胞炎症因子的产生,进而减轻炎症反应造成的肠道黏膜损伤[23]。本试验中添加短小芽孢杆菌增加了IFN-γ含量,IFN-γ的异常产生与自身免疫和肠道菌群的改变有关。IFN-γ虽然是一种对抗许多致病微生物感染的有效分子,但其过度激活会引起组织损伤、坏死和炎症[24]。肠道炎症最具代表性的组织学特征之一为活化的中性粒细胞浸润[25]。本试验HE染色的结果表明,添加短小芽孢杆菌降低了炎性细胞浸润,减轻了肠道病理改变程度,与肠道炎症细胞因子变化相一致。综上所述,短小芽孢杆菌可减轻炎症反应,对羔羊肠道健康有促进作用。
拥有完整的肠道屏障是机体维持正常功能和健康的基础,肠道屏障一旦被破坏,就无法阻止病原体和内毒素进入血液和器官[26]。血清中DAO和LD含量是衡量肠道通透性的重要指标。本研究中添加短小芽孢杆菌使得血清中DAO和LD含量降低,说明DAO和LD难以通过肠道黏膜屏障进入外周血液中,因此肠道的通透性降低。肠道形态学的完整通常被认为是一种重要的机械防御屏障,肠道绒毛高度的降低和隐窝深度的增加与肠道屏障功能受损有关[27]。覆盖肠道的黏膜层由整个胃肠道的杯状细胞分泌,本研究中添加短小芽孢杆菌增加了肌层厚度,可能是由于短小芽孢杆菌改善了肠道微生物区系。其次,肌层厚度和蠕动速率成正比,理论上应增加饲料的消化率,对生长性能有一定改善作用,但本试验中日采食量并没有提高,可能与羔羊日龄太小和饲喂时间太短有关,这仍需我们进一步探究。完整的肠道肠黏膜屏障由单层柱状上皮细胞和上皮细胞之间的紧密连接组成,紧密连接由40种不同的蛋白组成,主要为跨膜蛋白(如claudins和occludins)和辅助蛋白(zonula occludens, ZOs),这些主要的整合膜蛋白通过与肌动蛋白细胞骨架结合,维持肠道屏障的完成,调节肠道通透性[28]。本试验中,Claudin-1、Claudin-4、Occludin和ZO-1的含量增加,类似地,Sheng等[29]发现蜡样芽孢杆菌通过上调紧密连接蛋白表达来减少上皮屏障损伤。在鼠模型中,应激状态下释放促肾上腺皮质激素释放因子激活神经元和肥大细胞促进杯状细胞MUC2分泌,可以说这是肠道应对应激的一种保护机制[30]。而且有研究表明,内层黏液MUC2分泌不足或结构改变可能促进结肠炎的发生,Lu等[31]发现MUC2缺陷导致4周龄小鼠自发炎症反应,导致肠上皮屏障功能的降低和细胞增殖的减少,因此,本试验中添加短小芽孢杆菌增加了MUC2含量,对肠道健康可能产生有益作用。综上,添加短小芽孢杆菌降低了肠道通透性,增强了肠道屏障功能。
4 结论
本研究结果证实了短小芽孢杆菌可通过增强肠道屏障功能缓解羔羊腹泻。本试验条件下,初生羔羊饲喂短小芽孢杆菌可以降低羔羊粪便评分和腹泻频率,改善结肠组织形态,调节炎性细胞因子含量及相关血清指标,增加结肠紧密连接蛋白含量,减少组织炎性细胞浸润,但未能发现其对生长性能有显著影响。