共生微生物对仔猪肠道发育、代谢和线粒体功能的影响
张进威 吴元霞 孙静 李晓开 陆路 李周权葛良鹏
(1. 重庆市畜牧科学院,重庆 402460;2. 农业农村部养猪科学重点实验室 养猪科学重庆市重点实验室,重庆 402460;3. 国家生猪技术创新中心,重庆 402460;4. 西南大学动物科学技术学院生物饲料与分子营养实验室,重庆 400715;5. 四川农业大学动物科技学院,成都 611130)
在漫长进化过程中,部分微生物定居于其他生物体,逐渐形成复杂多样的种群并伴随宿主一生,被称为共生微生物(commensal microbiota)。共生微生物定居在宿主多个解剖学部位,在种类和丰度上存在巨大差异,表现出部位特异的微生物-宿主互作模式[1]。线粒体是真核细胞的“能量工厂”,可通过氧化磷酸化合成ATP,同时还参与细胞钙离子平衡、凋亡、炎性反应等生物学过程[2]。一直以来,线粒体被认为是祖先细菌在真核细胞内共生而形成的,在进化上与α-变形菌有共同起源,尤其是细胞色素氧化酶与细菌高度同源,说明线粒体与微生物之间存在特殊的印记和纽带[3]。
线粒体是微生物与宿主细胞之间的重要联系,营养代谢是微生物和线粒体共有的功能[4]。近年来研究发现,共生微生物产生的代谢物会影响线粒体功能和生物发生[5]。例如,共生微生物直接或通过短链脂肪酸(short-chain fatty acids, SCFAs)、次级胆汁酸、H2S等代谢产物间接影响线粒体能量代谢、活性氧(reactive oxygen species, ROS)产生和细胞免疫反应[6]。此外,线粒体DNA遗传变异[7]、线粒体功能(如氧化还原平衡[8]、线粒体ROS[9])紊乱、线粒体动力相关蛋白活性变化[10]等也会影响肠道共生微生物组成,表明肠道共生微生物与宿主细胞线粒体存在相互影响的过程。
线粒体是哺乳动物细胞中唯一具有微生物起源的细胞器,也被认为是微生物调控宿主细胞的重要靶点[11]。无菌(germ-free, GF)猪是对无特定病原、外观无异常的供体母猪进行无菌剖腹产,仔猪全程饲养于无菌环境,获得的不含任何活的微生物的特殊用途猪,GF猪作为模型可排除背景微生物干扰,获得高重复高敏感的研究结果[12]。无特定病原(specific pathogen-free, SPF)猪是从出生到育成均无特定病原体存在的健康猪,是研究共生微生物的标准实验动物。本研究利用GF猪和SPF猪为模型,研究共生微生物对宿主肠道形态、代谢、基因表达及线粒体功能的影响,以期为“微生物-宿主互作”对仔猪肠道健康的调控研究奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 试验动物 选择无特定病原(GB/T 22914-2008中11种病原均为阴性)、外观无异常、饲养管理良好的巴马母猪作为供体,预产期前一天经无菌剖腹产获得新生仔猪。同批次仔猪随机分为两组,一组饲养在无菌环境的饲养隔离器中,作为GF组(n = 3);另一组(n = 3)饲喂在SPF环境的饲养隔离器中,作为SPF组。所有仔猪给予相同饲养条件,自由采食和饮水,室温22-28℃,湿度40%-70%,0-4周饲喂灭菌奶(60Co辐照灭菌),5-6周饲喂灭菌固体饲料,试验期为42 d。饲养期间,每周对GF组的猪只、饮水、奶粉、隔离器等进行微生物监测(参照孙静等[13]方法执行),微生物监测结果参考文献[14]。试验经重庆市畜牧科学院实验动物伦理委员会批准(XKY-20210606),在重庆市畜牧科学院国家现代畜牧业示范区试验用猪工程中心进行。
1.1.2 主要试剂 HE染色试剂盒(G1120)购自北京索莱宝生物科技有限公司;Anti-Prohibitin抗体(线粒体标记物)购自Abcam公司(ab28172);HRP标记山羊抗兔IgG(GB23303)购自武汉塞维尔公司;DAB试剂盒(ZLI-9018)购自北京中杉金桥生物有限公司;苏木素染液(LM10N13)购自北京百灵威科技有限公司;柠檬酸盐抗原修复液(ZLI-9065)购自北京中杉金桥生物技术有限公司;通用型RNA小量提取试剂盒(R4130-03)购自广州美基生物科技有限公司;PrimeScriptTMRT reagent Kit with gDNA(RR037A)、TB Green® Premix Ex TaqTMII(RR820A)购自Takara;甲醇(A456-4)、乙腈(A955-4)、甲酸(A117-50)购自Fisher Scientific;Kairos氨基酸试剂盒(176004379)购自Sigma公司。
1.2 方法
1.2.1 肠道形态结构 试验期第42天,将GF组和SPF组仔猪进行屠宰。取回肠、结肠各3 cm样品,经生理盐水冲洗、福尔马林浸泡保存;再经固定、脱水、石蜡包埋、切片,按照HE染色试剂盒说明书进行染色。染色后的切片通过镜检观察肠道形态结构,使用Olympus BX51图像采集系统采集图像,图片使用Image J软件进行绒毛高度、隐窝深度及黏膜层厚度的测定[15],并对比组间差异。
1.2.2 氨基酸和短链脂肪酸含量测定 氨基酸和短链脂肪酸含量测定委托北京荷欣科技有限公司完成。采用液质联用(LC-MS)方法进行测定,以液相色谱作为分离系统,质谱为检测系统,样品在质谱部分和流动相分离,被离子化后,经质谱的质量分析器将离子碎片按荷质比分开,经检测器得到质谱图。
回肠、结肠、肝脏和血清经过甲醇、甲酸和AccQ Tag衍生试剂(美国Kairos氨基酸试剂盒)等试剂处理后得到待测上清液;采用梯度稀释法,配制不同浓度氨基酸标准品,加入等体积同位素内标,混匀后待测;将待测上清和标准品在Waters ACQUITY UPLC I-CLASS超高效液相色谱进行色谱分离(色谱柱:Waters UPLC HSS T3;流动相:A相为0.1%甲酸、B相为乙腈;流速:0.5 mL/min;进样量:5.0 μL;柱温:50℃),采用Waters XEVO TQ-S串联四级杆质谱系统进行质谱分析(正离子离子源电压1.5 kV、锥孔电压20 V;去溶剂温度600℃,去溶剂气体流速1 000 L/h;锥孔气体流速10 L/h)。利用MassLynx定量软件计算峰面积,通过标准曲线法得到氨基酸的定量结果。
回肠、结肠、肝脏和血清经甲醇、丙酸同位素内标及3-硝基苯肼等试剂处理后得到待测上清;配制不同浓度短链脂肪酸标准品;将待测上清和标准品在Waters ACQUITY UPLC I-CLASS超高效液相色谱进行色谱分离(色谱柱:Waters UPLC BEH C8;流动相:A相为0.01%甲酸、B相为甲醇∶异丙醇 = 8∶2;流速:0.3 mL/min;进样量:5.0 μL;柱温:45℃);采用Waters XEVO TQ-S Micro串联四级杆质谱系统进行质谱分析(离子源电压3.0 kV、温度150℃;去溶剂化温度450℃、去溶剂化气体流速1 000 L/h;锥孔气体流速10 L/h);采用TargetLynx定量软件计算峰面积,采用标准曲线法获取短链脂肪酸的定量结果。
1.2.3 线粒体含量测定 回肠和结肠线粒体含量采用免疫组化方法进行测定,样品经固定、脱水、石蜡包埋、组织切片等过程;然后将切片在柠檬酸盐抗原修复液中进行抗原修复;3%的H2O2去离子水阻断内源性过氧化酶;加入山羊血清工作液对组织进行封闭;加入一抗(Anti-Prohibitin抗体)稀释液,4℃过夜;二抗(HRP标记山羊抗兔IgG)孵育,在室温下孵育30 min;应用DAB溶液显色;复染细胞核、脱水封片;最后切片在显微镜下进行镜检观察并采集图片,图片使用Image J软件测定光密度(optical density, OD)[16-17],将图片拖拽到Image J软件中,在Image-Type中将图片调整为8 bit,然后在Analyze-Calibrate的function选中Uncalibrated OD将图片灰度调整为OD值,在Analyze-Set measurements选定Area、Integrated density、Area fraction和Limit to threshold参数,在Image-Adjust-Threshold进行面积选中,最后在Analyze-measure进行测定,得出Area和IntDen数据,计算平均光密度值(Area/IntDen),两组数据进行统计分析。
1.2.4 RNA-seq分析
1.2.4.1 总RNA提取 将肝脏、回肠和结肠组织置于盛有液氮的研钵中充分研磨,使用通用型RNA小量提取试剂盒提取总RNA,使用NanoDrop 2000分光光度计检测RNA浓度和质量,质检合格的RNA样品用于建库和测序。
1.2.4.2 文库构建及测序 取约3 μg 总RNA样品用于文库构建。按照Epicentre Ribo-zeroTM rRNA Removal Kit试剂盒说明书步骤去除核糖体RNA(rRNA),随后用乙醇沉淀法清洗无rRNA样品。按照NEBNext® UltraTM Directional RNA Library Prep Kit试剂盒说明书步骤构建RNA-seq测序文库。文库构建完成后,通过Qubit 2.0进行初步定量,稀释文库,随后用Agilent 2100对文库的插入片段大小进行检测,插入片段符合预期后,使用q-PCR方法对文库的有效浓度进行准确定量。文库质检合格后,委托北京诺禾致源科技股份有限公司使用Illumina Hiseq2500高通量测序平台在PE150模式下进行测序。所有下机数据已经上传至组学原始数据归档库(genome sequence archive, GSA, https://ngdc.cncb.ac.cn/gsa/),登录号为CRA011035。
1.2.4.3 差异基因分析 原始数据(raw data)通过cutadapt2.0软件进行过滤处理,过滤条件为:去掉含有超过10%的N(测序仪未识别的碱基)、比对到接头序列超过10个碱基(base pair,bp)、碱基错配率达到10%或者包含超过50%的碱基质量评分都在5分以下的序列,过滤后得到高质量测序数据(clean data)。通过kallisto软件(v0.44.0)对基因表达量进行定量,计算每个样本TPM值(每千个碱基的转录每百万映射读取的转录本,至少在一个组织的所有重复中TPM > 1的mRNA被认为表达)。通过edge R(v 3.10)计算差异基因[18],校正P<0.05和|log2(FoldChange)|>1视为差异基因。
1.2.4.4 基因功能富集分析 使用Metascape网站(https://metascape.org/gp/index.html#/main/step1)对差异表达基因进行基因本体论(gene ontology, GO)和京都基因与基因组百科全书(KEGG)功能富集分析[19]。
1.2.4.5 线粒体基因集分析 线粒体功能相关基因集从MitoCarta3.0 MitoPathways数据库中下载,包括线粒体功能相关基因(电子呼吸传递链、钙离子稳态、氨基酸代谢、脂质代谢、碳水化合物代谢等)[20]。这些基因通常来自基于人的研究,本研究使用人与猪一对一同源基因,通过热图展示这些基因的表达变化。
1.2.5 实时荧光定量(RT-qPCR)检测
1.2.5.1 引物设计 首先在NCBI(https://www.ncbi.nlm.nih.gov)中查找并下载目的基因序列,使用在线Primer3.0进行引物设计,并在NCBI Primer Blast进行特异性分析。筛选特异性高的引物序列送到苏州金唯智公司合成。试验中所有目的基因引物信息如表1,其中GAPDH为内参基因。
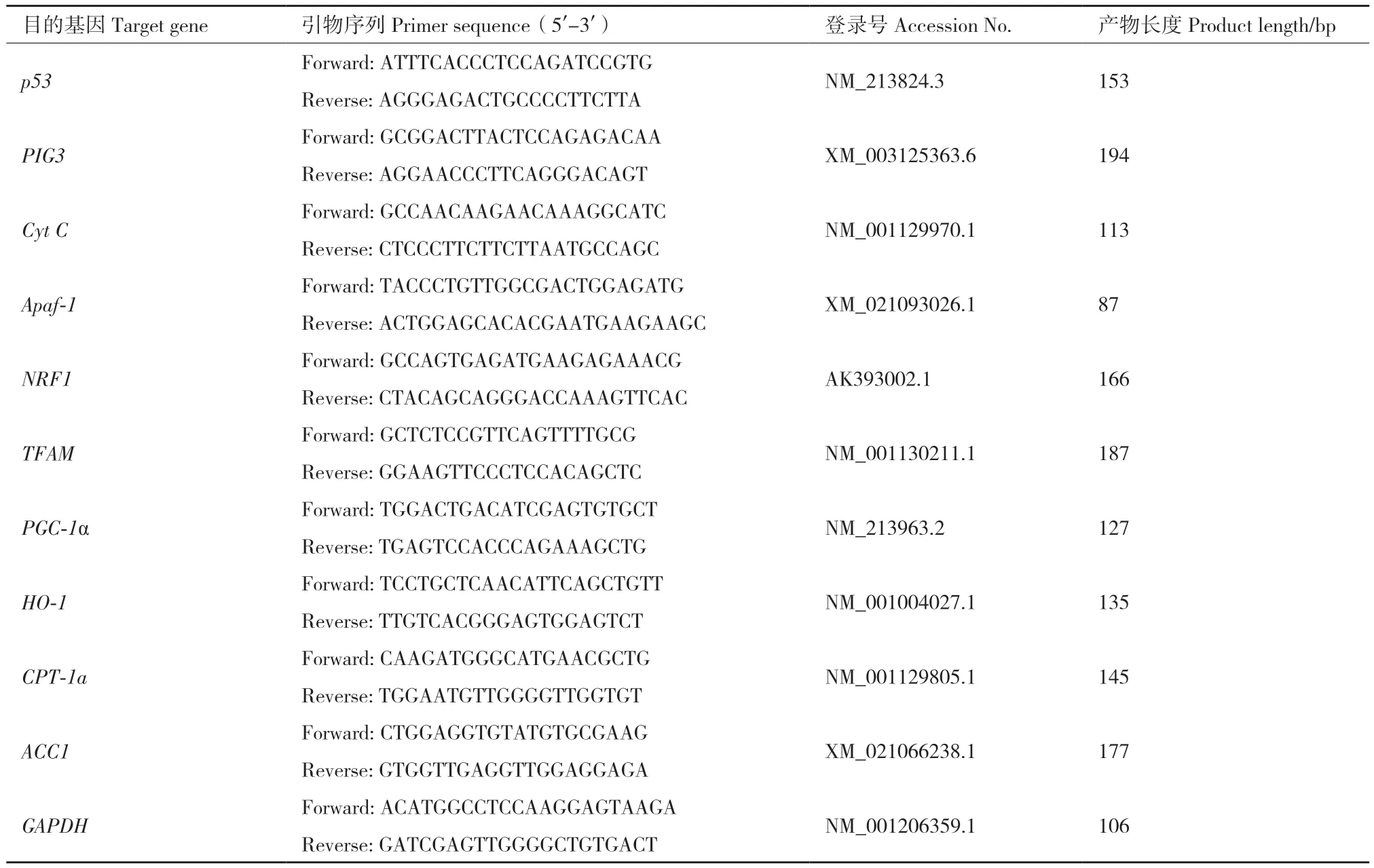
表1 RT-qPCR引物序列Table 1 Primer sequences used for RT-qPCR
1.2.5.2 RT-qPCR荧光定量 按照PrimeScriptTMRT Reagent Kit with gDNA Eraser说明书对总RNA进行反转录,获得cDNA,并以此为模板采用实时荧光定量PCR方法(TB Green® Premix Ex Taq II反应体系)测定各基因mRNA表达水平,每个反应3个技术重复。扩增程序设计为:95℃(预变性),30 s;95℃(变性),5 s;60℃(退火),34 s,40个循环。
1.2.6 统计分析 采用2-ΔΔCt方法计算GF猪和SPF猪各样品中的基因相对表达量,ΔCt=Ct目标基因-CtGAPDH,ΔΔCt=ΔCtSPF组织-ΔCtGF组织。试验数据采用SPSS18.0软件进行数据分析,使用GraphPad Prism 8.0.2软件进行图片绘制,试验结果以“平均值±标准差”表示,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果
2.1 共生微生物对仔猪肠道形态结构的影响
由图1 HE染色结果可知,GF-回肠、GF-结肠、SPF-回肠和SPF-结肠的形态结构完整性良好,肠道绒毛和隐窝均保持着正常形态结构。测定肠道绒毛高度、隐窝深度和黏膜层厚度,结果显示(图1-A-F),GF仔猪和SPF仔猪回肠绒毛高度无显著差异,但SPF仔猪绒毛高度在数值上高于GF仔猪,SPF仔猪回肠黏膜层厚度显著高于GF仔猪(P < 0.01);SPF仔猪和GF仔猪结肠绒毛高度无显著差异,SPF仔猪隐窝深度显著低于GF仔猪(P < 0.01),黏膜层厚度呈现高于GF仔猪的趋势。以上结果表明共生微生物有助于肠道形态结构发育。

图1 共生微生物对肠道绒毛高度、隐窝深度及黏膜层厚度的影响Fig. 1 Effects of commensal microbiota on intestinal villus height, crypt depth, and mucosal thickness
2.2 共生微生物对短链脂肪酸含量的影响
由图2可知,SPF仔猪和GF仔猪回肠短链脂肪酸中的乙酸、丙酸、异丁酸、丁酸、戊酸和已酸含量无显著差异(图2-A),但SPF仔猪回肠已酸含量有降低的趋势;SPF仔猪结肠的丙酸、戊酸含量分别比GF仔猪高4317.77%和3883.32%(P < 0.05),SPF仔猪结肠乙酸和丁酸呈现高于GF仔猪的趋势,其余指标无显著差异(图2-B);SPF仔猪肝脏已酸含量低于GF仔猪39.59%(P < 0.05),SPF仔猪肝脏丁酸含量呈现高于GF仔猪的趋势,其余指标无显著性影响(图2-C);血清中短链脂肪酸指标无显著性影响(图2-D)。以上结果表明共生微生物对结肠短链脂肪酸含量影响较大,特别是乙酸、丙酸和丁酸含量。
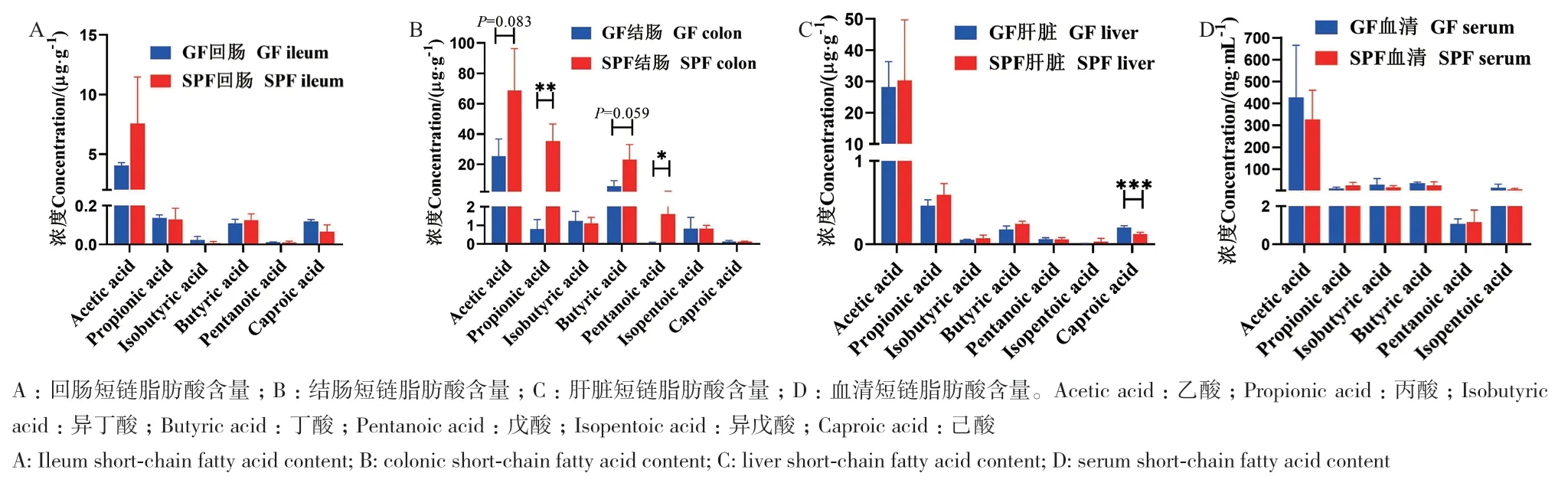
图2 共生微生物对仔猪短链脂肪酸含量的影响Fig. 2 Effects of commensal microbiota on the contents of short-chain fatty acids in piglets
2.3 共生微生物对氨基酸含量的影响
由图3可知,GF仔猪和SPF仔猪回肠的必需氨基酸和非必需氨基酸含量无显著影响(图3-A-B);SPF仔猪结肠精氨酸(Arg)和谷氨酸(Glu)含量分别低于GF仔猪79.78%和20.46%(P < 0.05),其余氨基酸无明显影响(图3-C-D);SPF仔猪肝脏必需氨基酸含量显著低于GF仔猪(P < 0.05),SPF仔猪肝脏精氨酸(Arg)、天冬氨酸(Asp)和谷氨酰胺(Gln)含量分别低于GF仔猪70.03%、71.51%和52.34%(P < 0.05),其余指标无显著差异(图3-E-F);SPF仔猪血清甲硫氨酸(Met)、甘氨酸(Gly)和丙氨酸(Ala)含量显著高于GF仔猪(P < 0.05),其余指标无显著差异(图3-G-H)。以上结果表明共生微生物主要促进肝脏氨基酸的代谢,而对回肠、结肠和血清氨基酸含量无明显影响。

图3 共生微生物对仔猪氨基酸含量的影响Fig. 3 Effects of commensal microbiota on the amino acid contents in piglets
2.4 共生微生物对肠道线粒体含量的影响
由回肠和结肠线粒体免疫组化结果可知(图4),两组间回肠组织线粒体数量无显著差异;SPF仔猪结肠线粒体数量显著高于GF仔猪(P < 0.05)。以上结果表明共生微生物影响结肠细胞线粒体含量。
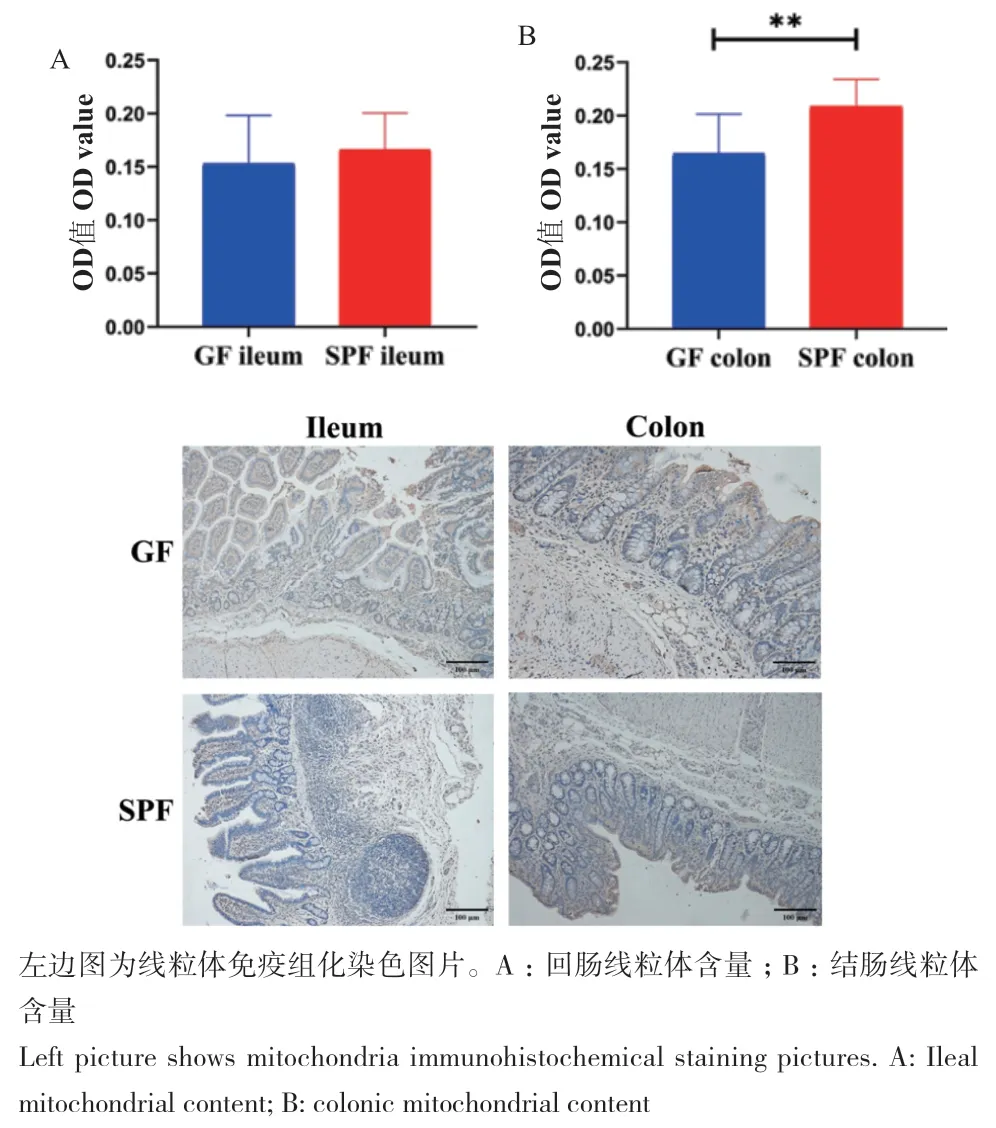
图4 共生微生物对仔猪回肠和结肠线粒体含量的影响Fig. 4 Effects of commensal microbiota on the mitochondrial contents in the ileum and colon of piglets
2.5 共生微生物对回肠、结肠和肝脏基因表达的影响
基因表达相关性分析显示,组织内的相关系数为0.93-0.98;组织间的相关系数为0.1-0.7(图5-A)。基因表达的层次聚类分析显示,所有样本先按照组织类型分类,再按照处理效应聚类(图5-B)。差异基因分析显示(图5-C, D),GF仔猪和SPF仔猪的回肠差异基因为114个(上调83个,下调31个),结肠差异基因为101个(上调49个,下调52个),肝脏差异基因为123个(上调67个,下调56个)(图5-E-G),以上结果表明共生微生物影响仔猪肝脏、回肠和结肠的整体基因表达模式。
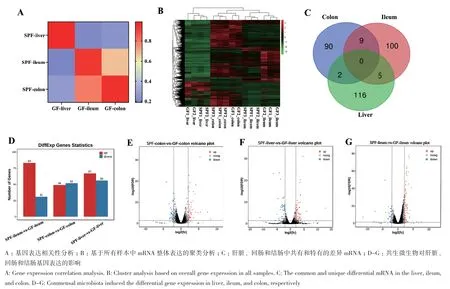
图5 共生微生物对回肠、结肠和肝脏基因表达量的影响Fig. 5 Effects of commensal microbiota on the gene expressions in ileum, colon, and liver
组织差异基因进行功能富集发现(图6),肝脏的差异基因主要参与能量代谢过程,回肠和结肠的差异基因主要参与能量代谢和免疫反应过程,表明共生微生物影响肠道组织和肝脏的能量代谢和免疫反应等生物学过程。
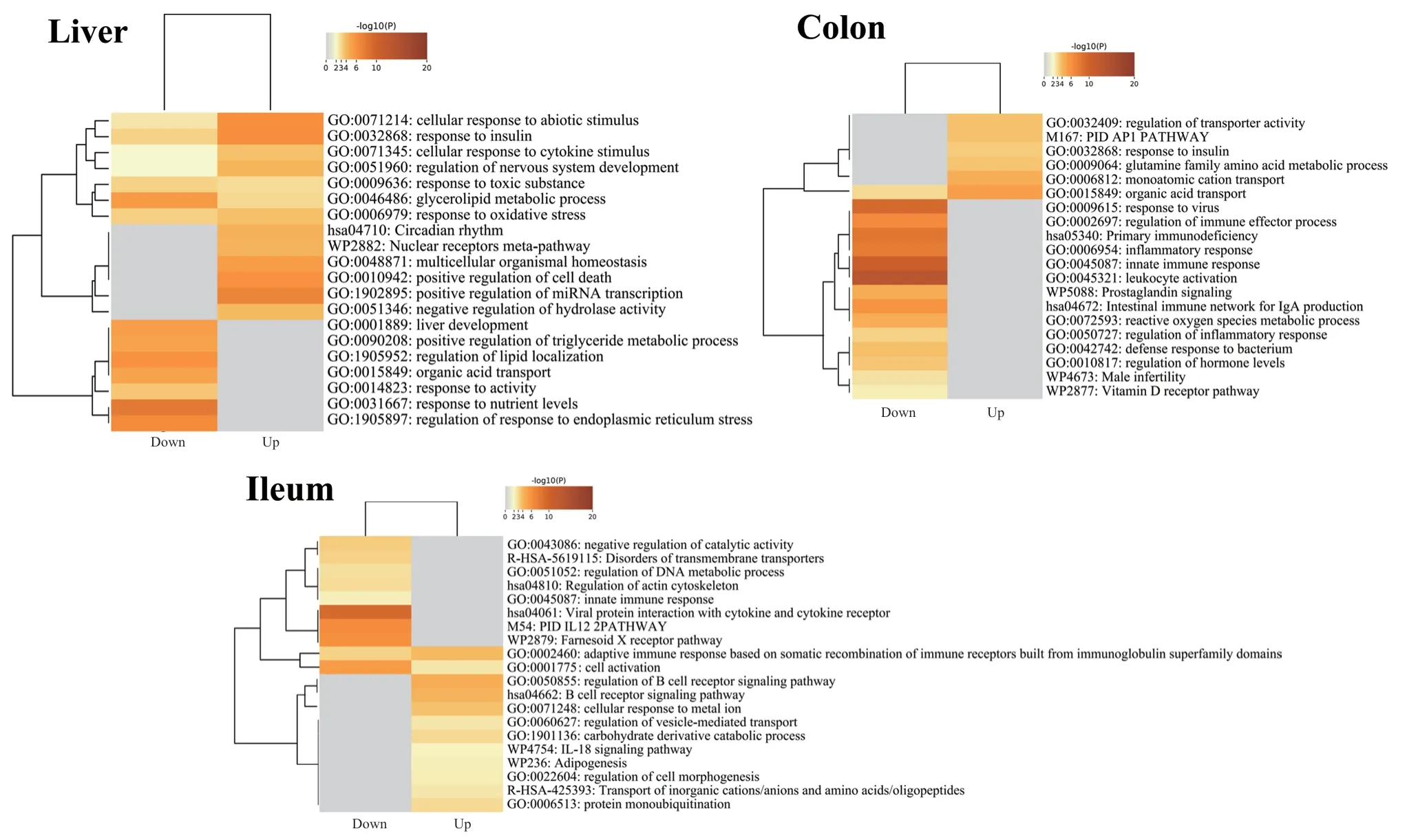
图6 回肠、结肠和肝脏差异基因功能富集分析Fig. 6 Results of functional enrichment analysis of differential genes in the ileum, colon, and liver
2.6 共生微生物对线粒体功能相关基因表达的影响
线粒体功能相关基因集分析结果显示,与GF仔猪相比,SPF仔猪回肠线粒体的氧化磷酸化过程显著上调(P < 0.05),蛋白质摄取和运输过程显著下调(P < 0.05),氨基酸代谢、脂质代谢和碳水化合物代谢过程显著上调(P < 0.05),钙离子平衡受到调控(图7)。SPF仔猪结肠的氧化磷酸化过程受到显著影响,其中ND1、ND4L和ND4显著上调(P < 0.05),ATP6、ATP5PF、COX19、NDUFA4、CYTB、ND6和ND3显著下调(P < 0.05);参与钙离子平衡的MICU3和MCU显著上调(P < 0.05),SMDT1基因显著下调(P < 0.05);参与核酸代谢过程的AK3显著上调(P < 0.05),参与细胞凋亡的MSRB2显著性下调(P < 0.05)(图7)。在SPF仔猪肝脏中,参与钙离子平衡过程的MICU1显著下调,参与脂质代谢过程的ACAA2显著上调(图7)。
2.7 共生微生物对线粒体介导的脂质氧化、氧化应激和细胞凋亡过程的影响
选择线粒体功能相关基因进行组织定量分析,结果显示,与GF仔猪相比,SPF仔猪肝脏PIG3表达显著上调(P < 0.05),PGC-1α表达显著下调(P< 0.05,图8-A-C);SPF仔猪回肠的脂质氧化过程中ACC1基因显著上调(P < 0.05),CPT-1α表达量呈现升高趋势(图8-D),细胞凋亡途径的APAF-1、PIG3、CytC和p53显著上调(图8-E),抗氧化系统中NRF1、HO-1和TFAM均显著上调(P < 0.05,图8-F)。SPF仔猪结肠脂质氧化过程中ACC1基因显著下调(P < 0.05,图8-G),细胞凋亡相关基因无显著差异(图8-H),抗氧化系统中NRF1基因显著下调(P < 0.05,图8-I)。SPF仔猪肝脏PIG3表达显著上调(P < 0.05),PGC-1α表达显著下调(P < 0.05,图8-A-C)。
3 讨论
3.1 共生微生物对仔猪肠道形态结构的影响
肠道是营养物质消化吸收的重要场所,也是进行肠道黏膜免疫和微生物防御的重要器官,其结构和功能与共生微生物息息相关。共生微生物对宿主的生长发育起着至关重要作用。肠道绒毛高度和隐窝深度是反映肠道健康重要指标,肠道绒毛增加了营养物质吸收面积,其表面含有多种可水解碳水化合物和蛋白质的消化酶[21],对营养物质的消化吸收和代谢具有重要影响[22],而隐窝深度决定了肠道上皮细胞的更新速度[23],当隐窝变浅时,肠道上皮更新速度变慢,上皮细胞成熟率上升,细胞的分泌功能增加。在本研究中,SPF仔猪结肠隐窝深度显著低于GF仔猪,表明共生微生物改善了黏膜层的结构,这与Du等[24]研究结果一致。由此可知,共生微生物促进仔猪肠道形态结构发育。
3.2 共生微生物影响仔猪营养物质代谢
仔猪的肠道形态结构与能量代谢有关,因此,我们进一步测定回肠、结肠、肝脏和血清中的营养代谢物含量变化,靶向分析共生微生物对小肠、大肠和外周组织部位营养代谢物的影响。SPF仔猪结肠短链脂肪酸显著高于GF仔猪,而回肠和血清中短链脂肪酸无显著性差异,肝脏中短链脂肪酸差异较小,表明了共生微生物有助于结肠短链脂肪酸吸收与代谢,其主要原因是共生微生物可以将哺乳动物难以消化的碳水化合物发酵产生短链脂肪酸,而结肠和肝脏是短链脂肪酸吸收代谢的重要场所[25]。氨基酸是营养素中重要的组成部分之一,不仅支持胃肠道中细菌的生长和存活[26],而且参与调节生物体的能量和蛋白质稳态[27-28]。小肠是吸收氨基酸的主要场所,而结肠中氨基酸通常是被微生物代谢成氨、短链脂肪酸或支链脂肪酸,再被吸收到宿主体内[29]。本研究发现,SPF仔猪肝脏中氨基酸含量显著低于GF仔猪,SPF仔猪结肠氨基酸含量(精氨酸和谷氨酸)低于GF仔猪,血清和回肠中无显著差异,这提示共生微生物可能将结肠中的氨基酸代谢成短链脂肪酸,从而影响肝脏氨基酸含量。
3.3 共生微生物或其代谢物对线粒体功能的影响
线粒体不仅是细胞的能量转换站,而且广泛参与细胞钙离子平衡、凋亡、炎性反应及肠道稳态等生物学进程。线粒体是哺乳动物细胞中唯一具有微生物起源的细胞器,且许多研究认为线粒体是共生微生物调控宿主细胞的重要靶点[11]。肠道细胞是与共生微生物物理距离最近的场所,肠道和肝脏是机体能量代谢的主要场所。因此,本研究通过检测回肠、结肠和肝脏的氨基酸和短链脂肪酸及基因表达等指标,探究共生微生物对仔猪肠道细胞线粒体功能的影响。
本研究发现,SPF仔猪结肠中短链脂肪酸含量(乙酸、丙酸和丁酸)显著增加;SPF仔猪结肠线粒体的氧化磷酸化过程受到显著影响,特别是复合体I亚基。先前已有研究报道,短链脂肪酸(丁酸)促进线粒体的氧化磷酸化过程[8],这表明了共生微生物产生的短链脂肪酸促进了肠道细胞线粒体的氧化磷酸化过程。线粒体的氧化磷酸化高度耗氧,较高的氧化磷酸化会引起结肠局部缺氧,促进共生微生物定植,维护肠道稳态及健康[8]。因此,共生微生物通过影响线粒体氧化磷酸化,从而调控共生微生物与宿主之间的动态平衡。
线粒体基因集分析发现,SPF仔猪肝脏、回肠和结肠的钙离子单向转运蛋白相关基因均受到调控,而MCU、MICU1和MICU3是参与线粒体钙离子单向转运的关键基因[30],调控线粒体钙离子吸收,这表明共生微生物通过调控钙离子吸收关键基因来调控线粒体基质的钙离子平衡。SPF回肠中MCU基因显著上调,暗示回肠线粒体基质钙离子浓度增加。线粒体钙离子浓度持续或过量诱导线粒体通透性转换孔(mitochondrial permeablity transition pore, mPTP)打开,导致线粒体肿胀、细胞色素C释放和细胞凋亡诱发的细胞死亡[31];SPF仔猪回肠APAF-1、PIG3、CytC和p53基因显著上调,回肠细胞发生凋亡,这表明共生微生物可能通过调控线粒体基质钙离子浓度影响回肠线粒体途径诱发的细胞凋亡。
此外,SPF和GF仔猪回肠、结肠和肝脏存在许多特有的差异基因,回肠和结肠共有的差异基因较多,这反映了共生微生物对宿主影响的组织特异性[32]。差异基因功能分析发现,回肠、结肠和肝脏中差异基因主要参与能量代谢和免疫相关通路,例如:SPF仔猪肝脏甘油脂代谢过程(GO:0046486)上调,结肠谷氨酰胺家族氨基酸代谢过程(GO:0009064)以及回肠碳水化合物衍生物的分解代谢过程(GO:1901136)上调,这体现了共生微生物对仔猪组织能量代谢的直接调控作用[32]。SPF仔猪肝脏和回肠ACAA2(参与线粒体脂质代谢的关键基因[33])上调,表明共生微生物可能通过影响ACAA2表达,来调节肝脏脂质代谢过程。SPF仔猪回肠氨基酸代谢相关基因(MAOB,OTC和SLC25A15)显著上调,这表明共生微生物促进线粒体氨基酸代谢。
4 结论
共生微生物影响仔猪肠道形态结构和发育,促进仔猪营养物质的吸收与代谢。共生微生物通过调控肠道细胞线粒体的氧化磷酸化、钙离子平衡及物质代谢等生物学过程,从而调节肠道发育和代谢,最终影响仔猪肠道稳态和健康。