薄荷茉莉酸受体McCOI1a基因的克隆与表达模式分析
唐伟林 康琴 汪霞 谌明洋 孙欣江 王棵 侯凯 吴卫 徐东北
(1. 四川农业大学农学院,成都 611100;2. 四川农业大学草业科技学院,成都 611100)
薄荷(Mentha canadensis L.)是唇形科(Lamiaceae)薄荷属(Mentha)多年生草本植物,是我国常用中药材之一,薄荷叶中含有挥发性成分,俗称“精油”,是其主要的药用活性成分,而以其干燥的地上部分入药,具有清利头目、宣散风热、透疹等功效[1]。同时,薄荷也是一种具有特种经济价值的芳香作物,常用作景观绿化植物,亦是食品添加剂、化妆品、香料等工业的重要原材料。目前,干旱、金属离子、高盐等非生物胁迫严重制约薄荷属植物的产量和品质[2-4],由于薄荷缺乏基因组信息,以及抗逆基因资源的挖掘与功能研究匮乏,导致薄荷相关的分子生物学研究进展缓慢,而利用基因工程手段对薄荷进行种质改良尚处于起步阶段。因此深入了解薄荷抗逆性建成的分子机制,挖掘出改良薄荷抗性与品质的候选基因显得尤为重要。
茉莉酸(jasmonic acid, JA)是一种重要的植物生长调节剂,在植物的生长发育、逆境抵抗和次生代谢产物合成与调控中具有重要作用[5]。拟南芥(Arabidopsis thaliana)中JA信号转导模式的研究已较为清楚,JA受体AtCOI1(coronatine insensitive 1)是SKIP1/CULLIN/F-box(SCFCOI1)复合物的重要组成成员,其特征是含有保守的F-box结构域和亮氨酸富集的重复(leucine-riched repeat, LRR)序列,并且COI1蛋白具有茉莉酸-异亮氨酸(jaisoleucine, JA-Ile)共轭物结合活性和E3泛素连接酶活性[6]。植物受到外界非生物胁迫刺激后体内产生的JA与Ile结合形成具有生物活性的JA-Ile,JA-Ile被COI1识别并结合,促进COI1和JA信号抑制子JAZ(jasmonate ZIM-domain, JAZ)蛋白之间的相互作用,导致JAZ蛋白被泛素化后进入26S蛋白酶体降解,随后释放出多种不同类型的转录因子(包括MYC2、MYB、NAC、WRKY等)以调节下游基因表达[7],表明COI1蛋白在JA信号起始中发挥着关键作用。
研究表明,拟南芥AtCOI1基因突变体coi1中JA诱导的基因几乎不表达,并表现出雄性不育、根的生长对JA处理不敏感以及对病虫害的抗性降低[8],水稻(Oryza sativa)稻纵卷叶螟浸染显著诱导OsCOI1上调表达,沉默OsCOI1降低了水稻对稻纵卷叶螟的抗性[9],而敲除水稻OsCOI1b延迟了黑暗诱导的叶片衰老[10]。小麦(Triticum aestivum)中鉴定到8个候选COI1基因,并且它们受高盐、干旱、低温诱导表达[11],沉默玉米(Zea mays)ZmCOI2a和ZmCOI2b降低了配子体育性[12]。甘蔗(Saccharum spontaneum)中鉴定到31个候选COI1基因,其中21个ShCOI1基因受干旱、低温诱导表达[13]。另外,AtCOI1介导JA诱导的花青素合成基因DFR的表达,调节花青素的积累[14]。在青蒿(Artemisia annua)[15]、丹参(Salvia miltiorrhiza)[16]、长春花(Catharanthus roseus)[17]、烟草(Nicotiana tabacum)[18]中分别克隆得到了候选COI1基因,并且它们可能分别参与JA诱导的青蒿素、丹参酮、生物碱等的合成过程,上述结果表明COI1基因在植物抗性改良和有效活性成分合成调控中的巨大作用。目前,薄荷属植物COI1基因的研究很少,导致我们对薄荷中JA信号的转导模式和机制了解较为匮乏。Xu等[19]前期在薄荷中鉴定得到一个McCOI1a基因,该基因与JA信号的抑制子JAZ蛋白在酵母中以冠菌素依赖的方式互作,但对其在非生物胁迫响应方面的研究鲜有报道。
本研究基于课题组从薄荷中克隆得到的JA受体McCOI1a基因,通过生物信息学方法对McCOI1a基因的理化性质和蛋白特征进行分析,并明确其亚细胞定位情况,同时利用RT-qPCR技术分析该基因在薄荷不同组织、不同叶序以及干旱、盐、金属离子等非生物胁迫条件下的表达,探究McCOI1a与薄荷JA信号转导、器官发育、逆境响应之间的关系,为今后进行薄荷分子育种提供科学依据。同时为探究不同植物体内茉莉酸信号受体蛋白COI1的功能奠定基础。
1 材料与方法
1.1 材料
试验材料是2015版《中国药典》在录薄荷,采自陕西渭南,由四川农业大学农学院特用植物生产学系徐东北副教授提供。薄荷、本氏烟草(Nicotiana benthamiana)种植于光照培养箱,23℃,光照16 h/黑暗8 h;亚细胞定位所用材料为5周龄本氏烟草;薄荷不同组织、不同叶序材料分别采自生殖生长期(2月龄)和营养生长期薄荷(5周龄);胁迫处理材料为长势一致的水培薄荷幼苗。
1.2 方法
1.2.1 薄荷McCOI1a基因鉴定 从国家生物技术信息中心下载薄荷转录组数据(SRP132644),利用BioEdit软件建立本地蛋白数据库,从TAIR(https://www.arabidopsis.org/)网站下载拟南芥AtCOI1蛋白序列。采用本地BLASTP法进行序列检索与比对,筛选具有F-box以及LRR保守结构域的候选基因序列。同时,利用SMART在线网站(http://smart.emblheidelberg.de/)验证候选序列中含有的COI1蛋白保守结构域,鉴定得到薄荷McCOI1a基因。
1.2.2 薄荷McCOI1a基因克隆与测序验证 收集2周龄的薄荷幼嫩叶片,液氮冷冻后研磨成粉末,根据天根RNAprep Pure多糖多酚植物总RNA提取试剂盒(DP441)所述步骤提取叶片总RNA。基因克隆和RT-qPCR的cDNA第一链合成均采用HiScript II 1st Strand cDNA Synthesis Kit(+gDNA wiper)(R212,vazyme)。基于McCOI1a基因编码序列,利用DNAMAN软件设计基因全长扩增引物(McCOI1a-F:5'-ATGGAGGATGGTGGGAAATC-3'; McCOI1a-R:5'-TCAAGCATTAAGGAGAAAAG-3')扩增McCOI1a,PCR扩增体系如下:1 μL 5×cDNA模板、F和R引物各0.5 μL、5 μL 5×PrimeSTAR DNA聚合酶缓冲液、2 μL PrimeSTAR® DNA聚合酶、16 μL ddH2O,总体积25 μL。PCR扩增程序如下:95℃ 10 min;95℃15 s,55℃ 20 s,72℃ 2 min(1 kb/min),34个循环;72℃ 10 min,4℃ 1 min。PCR产物经1%琼脂糖凝胶电泳进行鉴定分离,按照博迈德(Biomed)DNA胶回收试剂盒(DH103-01)所述步骤回收McCOI1a基因的PCR产物,Nandrop2000测定PCR产物浓度备用。根据北京擎科生物技术有限公司的pClone007 Blunt Vector Kit(TSV-007B)所述步骤,将PCR产物与pClone007载体连接,连接产物转化大肠杆菌感受态DH5α,挑取单克隆进行液体培养后,利用菌液PCR对重组子进行鉴定,将含有目的片段的阳性菌液送至北京擎科生物技术有限公司进行测序,确认McCOI1a基因[19]序列的正确性。
1.2.3 薄荷McCOI1a基因生物信息学分析 将拼接的序列进行生物信息学分析,使用ExPASy网站(http://us.expasy)预测McCOI1a蛋白的序列特征和理化性质,获得蛋白的稳定性指数、蛋白理论等电点(pI)和分子量(MW)等信息。使用SignalP-6.0工具预测候选McCOI1a蛋白的信号肽。使用SOPMA网站和SWISS-MODEL(https://swissmodel.expasy.org)基于McCOI1a的氨基酸序列分析蛋白二级结构和3D结构。根据McCOI1a的氨基酸序列,在NCBI网站(https://www.ncbi.nlm.nih.gov/)进行BLASTP同源比对,下载同源基因的氨基酸序列,使用DNAMAN6.0软件对McCOI1a及其同源蛋白进行多重序列比对,分析氨基酸序列相似性。使用MEME(https://memesuite.org/meme/)在线工具,分析McCOI1a及其同源蛋白保守结构域组成、位置及结构域内每个位点上的保守氨基酸的频率。从Phytozome v13(https://phytozome-next.jgi.doe.gov/)数据库中下载拟南芥(A. thaliana)、水稻(O. sativa)、番茄(Solanum lycopersicum)、芝麻(Sesamum indicum)、大豆(Glycine max)、葡萄(Vitis vinifera)、长春花(C. roseus)、丹参(S. miltiorrhiza)、碧桃(Prunus persica)、苜蓿(Medicago truncatula)、甜樱桃(Prunus avium)、甘薯(Ipomoea batatas)、甘蓝型油菜(Brassica napus)、野茶树(Camellia sinensis)、橡胶树(H. brasiliensis)的COI1蛋白序列。使用MEGA5.0软件,采用邻接法(neighbor-joining method, NJ)构建系统进化树,利用iTOL网站(https://itol.embl.de/)对发育树进行美化。
1.2.4 薄荷McCOI1a-GFP融合载体构建及蛋白亚细胞定位分析 根据同源重组原理,设计McCOI1a编码序列的同源重组PCR扩增引物(McCOI1a-G-F:5'-ACTCTTGACCATGGTAGATCTGATGGAGGATGGTGGG AAAT-3';McCOI1a-G-R: 5'-TCTTCTCCTTTACTAGT AGCATTAAGGAGAAAAG-3'),下游引物去掉终止密码子,以pClone007-McCOI1a质粒为模板进行PCR扩增,反应体系如下:2×ApexHF FS PCR Master Mix 12.5 μL、F和R引物各0.5 μL、模板质粒1 μL、ddH2O 10.5 μL;PCR程序如下:94℃ 5 min;95℃15 s,50℃ 20 s,72℃ 45 s(1 kb/5 s),34个循环;72℃ 10 min,4℃ 1 min。pCAMBIA1302-GFP(green fluorescent protein)载体经Bgl II和Spe I双酶切,酶切体系:10×CutoneTM buffer 3 μL、Bgl II和Spe I各3 μL、质粒3 μg,补水至30 μL。PCR产物和载体酶切产物经琼脂糖凝胶电泳分离,胶回收备用。根据CloneExpress® II One Step Cloning Kit(C112, vazyme)的操作说明,将PCR产物连接至pCAMBIA1302GFP载体上,连接产物转化大肠杆菌感受态DH5α,PCR鉴定阳性菌液送北京擎科生物技术有限公司测序验证。
将正确的重组载体pCAMBIA1302-McCOI1a-GFP(McCOI1a-GFP)、空载体pCAMBIA1302GFP(GFP)以及课题组保存的核定位marker载体PHB-SV40-mcherry(SV40-mcherry)分别通过冻融法转化农杆菌菌株GV3101。参照Ma等[20]烟草注射方法,将携带McCOI1a-GFP、GFP空载体的GV3101重悬液分别与含有SV40-mcherry的GV3101重悬液以1∶1比例混和均匀后,将重悬液注射到5周龄的本氏烟草的叶片中,烟草置于黑暗条件16 h,随后正常培养2 d,使用激光共聚焦荧光显微镜检测GFP信号,每个组合实验重复3次。
1.2.5 McCOI1a基因的表达分析 取正常生长2个月并且长势一致的薄荷植株9株,将3株薄荷相同位置处的不同组织,包括:根、茎、嫩叶、老叶、花、蕾、茎尖分别混合取样,液氮速冻,-80℃保存备用。另外,挑选生长一致的薄荷幼苗摘取地上部进行水培,待根系生长茂盛(约3周)时,选取长势一致的薄荷植株,用吸水纸快速将根部水分擦干,分别置于150 μmol/L NaCl、100 μmol/L AlCl3、100 μmol/L CuCl2、100 μmol/L CdCl2、100 μmol/L methyl jasmonate(MeJA)水溶液中进行处理。将表面水分吸干的薄荷置于干燥的滤纸上进行干旱处理,在处理后的 0、1、3、6、12、24 h将叶片、根分别取样,液氮速冻-80℃保存备用,上述每个处理设置3个生物学重复。总RNA提取及反转录方法参照1.2.2所述。
根据McCOI1a基因序列,利用DNAMAN软件设计基因特异引物(qMcCOI1a-F: 5'-CCGATGAAGGACTGTTGGAG-3';qMcCOI1a-R: 5'-CTCGATGGAATCAGCTCAATG-3')。以薄荷β-actin为内参基因,设计内参引物(β-actin-F: 5'-CCAGGAATTGCTGATAGGATGAG-3';β-actin-R: 5'-GCGCCACCACCTTAATCTTC-3')。利用伯乐(Bio-rad)CFX96TM qPCR仪进行荧光定量试验。PCR反应体系如下:2×SYBR Green Pro Taq HS Premix 10 μL、F和R引物各0.5 μL、10×cDNA模板2 μL、ddH2O 7 μL。PCR程序如下:95℃ 3 min;95℃ 15 s,60℃ 30 s,40个循环,每个样品3个重复。采用2-ΔΔCt法计算McCOI1a的相对mRNA表达量,并利用IBM SPSS Statistics 26软件进行显著性分析。
2 结果
2.1 薄荷McCOI1a基因克隆与编码蛋白的氨基酸序列分析
以薄荷cDNA为模板,通过RT-PCR实验获得了目的基因McCOI1a,该基因全长编码序列1 842 bp,编码613个氨基酸(图1-A-a)。利用NCBI中的CD(conserved domain)search对McCOI1a的保守结构域进行预测,结果显示McCOI1a蛋白的第20-61氨基酸为F-box结构域,第80-126氨基酸为TIR1结构域,是LRR区域的特定单元,第118-241和310-460氨基酸为AMN1结构域,该结构域共含13条LRR序列(图1-A-b, c)。采用在线网站ExPASy的ProtParam功能对McCOI1a蛋白理化性质进行分析,结果表明McCOI1a蛋白的MW为68.9 kD,pI为5.93,负电荷的残基数为77个,正电荷的残基数为70个,不稳定指数47.82(>40),表明该蛋白属于不稳定类。使用ProtScale功能分析表明McCOI1a为亲水性蛋白。信号肽(SignalP-6.0)预测结果表明McCOI1a无信号肽。

图1 薄荷McCOI1a编码基因及其蛋白结构分析Fig. 1 McCOI1a gene and its protein structure analysis in M. canadensis
采用SOPMA工具分析McCOI1a蛋白二级结构,结果显示二级结构中α-螺旋占48.61%,β-转角占4.73%,延伸链占15.33%,随机卷曲占31.32%(图1-B)。采用SWISS-MODEL预测McCOI1a蛋白3D结构,结果显示McCOI1a蛋白与模板序列(3ogl.1.B coronatine-insensitive protein 1)的同一性为69.44%,全局模型质量估计(GMQE)为0.8,α-螺旋为主要结构(图1-C)。同时,与二级结构预测结果一致,其中红色为蛋白的配体(N-{(1R, 2S)-3-oxo-2-[(2Z)-pent-2-en-1-yl]}环乙酰基-L-异亮氨酸,7JA),7JA与模板蛋白的氨基酸残基通过氢键或其他作用力相结合,这些氨基酸残基一部分在TIR1结构域中,一部分在富亮氨酸重复序列中,都属于保守氨基酸残基。
2.2 薄荷McCOI1a蛋白的多序列对比及进化树分析
为分析McCOI1a与其同源蛋白的氨基酸相似性,利用DNAMAN软件进行氨基酸序列比对,结果如图2所示,McCOI1a与AtCOI1(NP_565919.1)、OsCOI1a(XP_015621119.1)、OsCOI1b(XP_0156398-70.1)、OsCOI2(XP_015632448.1)、SiCOI1(XP_011076735.1)、SmCOI1(ARB15806.1)、VvCOI1(AFF57759.1)、SlCOI1(NP_001234464.1)、PaCOI1(XP_021832998.1)、PpCOI1(XP_007220435.1)、IbCOI1-1(AMS24678.1)、IbCOI1-2(AMS24679.1)、CrCOI1(ALI87034.1)、CsCOI1(ANB66331.1)、Hb-COI1(ABV72393.1)、GmCOI1(NP_001238590.1)、MtCOI1(XP_003616569.2)的相似度较高,都具有高度保守的F-box和LRR结构域,并且与丹参Sm-COI1的蛋白同源性最高,为88.69%。利用MEME网站对McCOI1a及其同源蛋白的保守基序进行分析发现,除丹参SmCOI1、水稻OsCOI2、甘薯Ib-COI1-1含有Motif 15外,所有蛋白都具有14个保守的Motifs,其中,Motif 7是保守的F-box基序,Motif 1是TIR1结构域。Motif 2-6、Motif 8-14为富亮氨酸重复序列,保守基序中亮氨酸的频率最高(图3)。进化树分析表明,McCOI1a与同为唇形科的SmCOI1蛋白聚为一支,同源性最高(图4),推测McCOI1a可能是薄荷中感受JA信号的受体蛋白。

图2 McCOI1a与其同源蛋白的氨基酸序列对比Fig. 2 Amino acid sequence comparison of McCOI1a and its homologous proteins
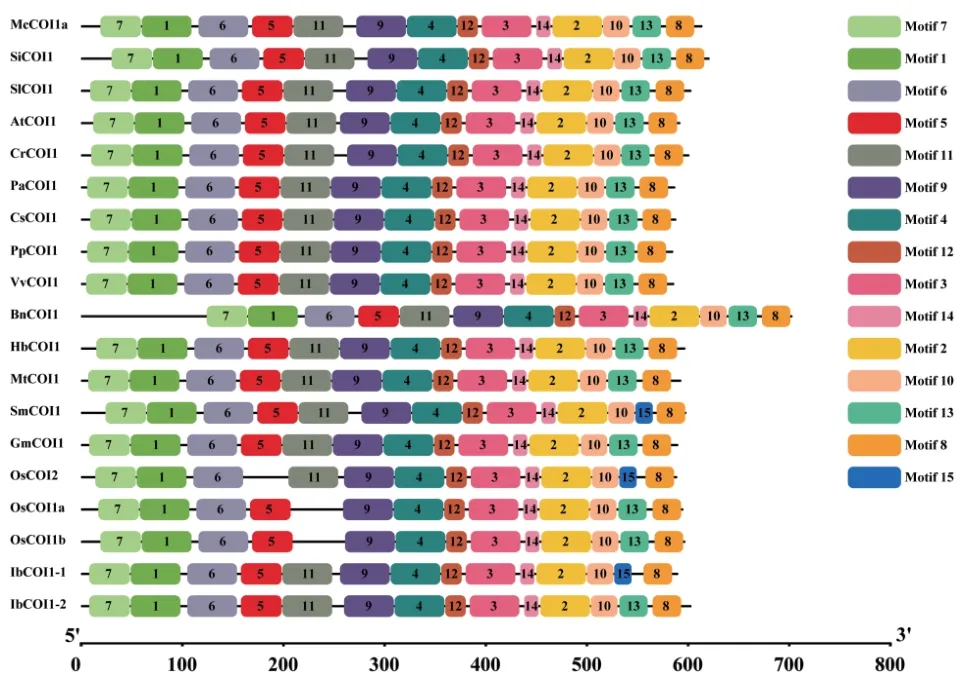
图3 McCOI1a与其同源蛋白保守基序分析Fig. 3 Analysis of conserved motifs of McCOI1a and its homologous proteins
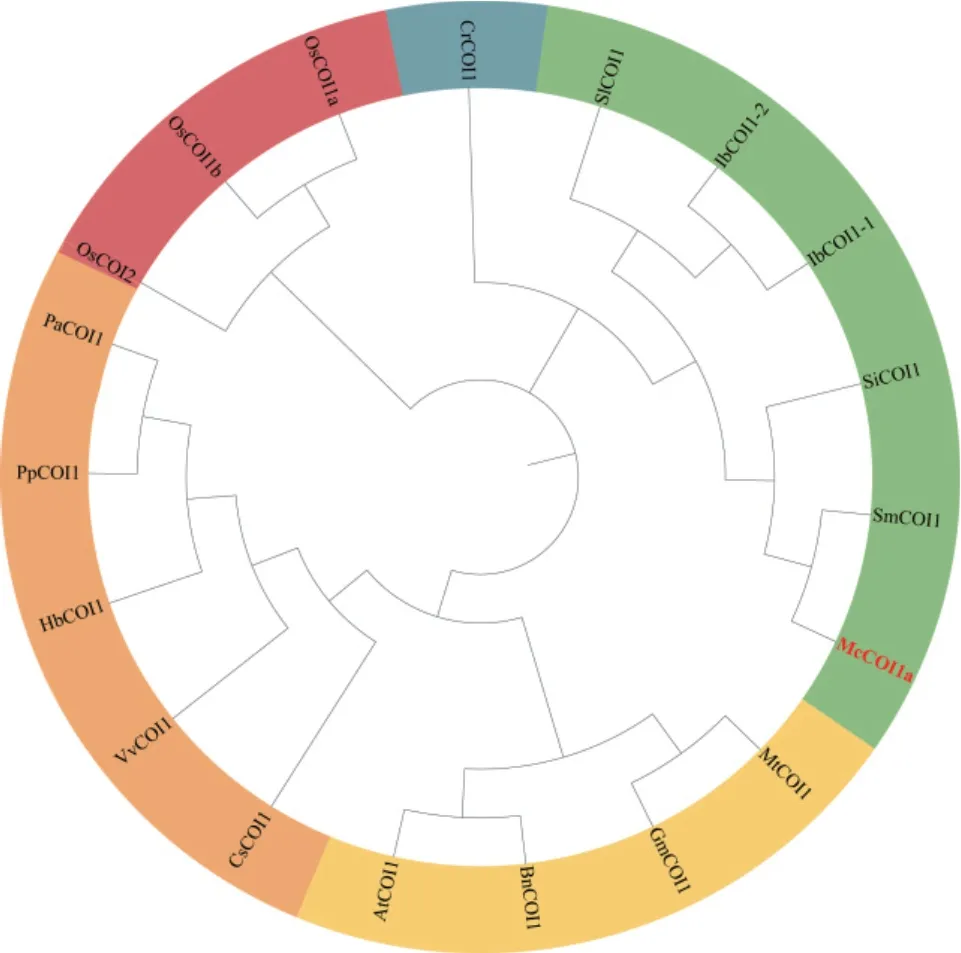
图4 薄荷与其它物种中COI1蛋白进化树分析Fig. 4 Phylogenetic analysis of COI1 proteins from M.canadensis and other species
2.3 薄荷McCOI1a-GFP融合蛋白亚细胞定位分析
将去除终止密码子的McCOI1a基因构建至pCAMBIA1302GFP载体上,形成融合表达载体McCOI1a-GFP。将GFP空、McCOI1a-GFP、核定位载体SV40-mcherry分别转化农杆菌GV3101,随后将含有不同载体的农杆菌重悬液等比例混合后,通过农杆菌介导的瞬时注射法在烟草叶片中进行瞬时表达。结果如图5所示,含GFP空载体的烟草叶片细胞在细胞核、细胞膜、细胞质中均观察到绿色荧光信号,与对照GFP相比,含有McCOI1a-GFP融合载体的烟草叶片细胞仅在细胞核中检测到绿色荧光信号,且与细胞核定位蛋白的红色荧光重叠,表明McCOI1a蛋白定位于细胞核中。
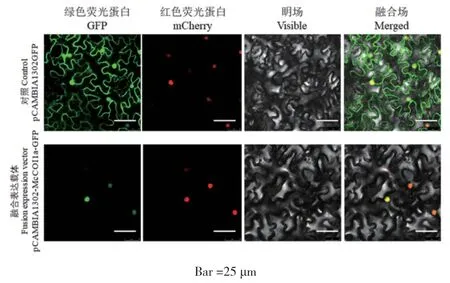
图5 McCOI1a亚细胞定位结果Fig. 5 Subcellular localization results of McCOI1a
2.4 McCOI1a在不同组织、叶序中的表达模式分析
利用RT-qPCR实验分析McCOI1a在薄荷不同组织以及不同叶序中的表达情况。结果显示,McCOI1a在薄荷的根、茎、幼叶、老叶、花、蕾、茎尖中广泛表达,并且在根中表达量最高,茎中表达量最低(图6-A)。同时,薄荷McCOI1a在不同部位的叶片(叶1-叶8)中均有表达,并且,从薄荷的上部叶到底部叶,McCOI1a表达呈逐渐上升的趋势(图6-B),推测McCOI1a可能在薄荷的叶片发育中具有调控作用。

图6 McCOI1a在薄荷不同组织及叶序中的表达分析Fig. 6 Expression analysis of McCOI1a gene in different tissues and phyllotaxis of M. canadensis
2.5 McCOI1a在茉莉酸和不同胁迫处理下的表达模式分析
将薄荷进行外源激素MeJA、干旱、NaCl、AlCl3、CdCl2、CuCl2处理,利用RT-qPCR分析McCOI1a在薄荷叶片和根中的表达情况。结果显示,在MeJA处理下,McCOI1a在叶中的相对表达量在1 h下降,随后在处理的各时间点呈上调的趋势,在12 h表达量最高(图7-A),而在根中,McCOI1a的表达整体呈下降趋势,在1 h表达最低(图8-A)。在干旱和AlCl3胁迫处理下,McCOI1a的相对表达量在叶中整体呈逐渐上升的趋势,在24 h表达量达到最高,分别是对照0 h的3倍和1 206倍(图7-B,7-D)。在根中,McCOI1a的表达整体呈下降的趋势,分别在12 h和6 h表达最低(图8-B, 8-D)。在NaCl处理3 h后,McCOI1a的相对表达量在叶中显著上调,整体呈先上升后下降的趋势,在12 h表达量达到最高,是对照0 h的4倍(图7-C)。在根中,McCOI1a的表达整体呈下降的趋势,在1 h表达量达到最低(图8-C)。在CdCl2胁迫处理下,McCOI1a的相对表达量在叶中整体呈先上升后下降的趋势,在12 h表达量达到最高,是对照0 h的4倍(图7-E)。在根中,McCOI1a的表达整体呈逐渐下降的趋势,在24 h表达量最低(图8-E)。在CuCl2胁迫处理下,McCOI1a的相对表达量在处理的各时间点的叶中显著上调表达,并呈先升高,再下降,再升高的变化趋势,在24 h表达量达到最高,为对照0 h的5倍(图7-F)。在根中,McCOI1a的表达在处理1 h和3 h显著下调,12 h显著上调,其余时间点与对照0 h相比,表达差异不显著(图8-F)。结果表明,McCOI1a基因对MeJA、干旱、NaCl、AlCl3、CdCl2、CuCl2胁迫处理均有响应。
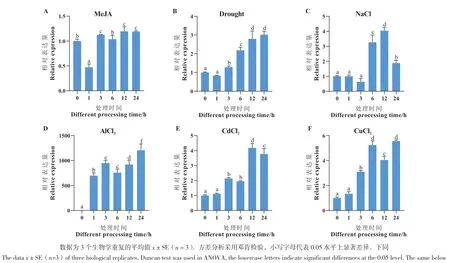
图7 茉莉酸和非生物胁迫处理下薄荷McCOI1a基因在叶片中的表达分析Fig. 7 Expression analysis of McCOI1a in the leaves of M. canadensis under MeJA and abiotic stress treatments
3 讨论
茉莉酸受体COI1蛋白是植物起始JA信号的关键[21-22]。目前,COI1基因已相继在拟南芥[8]、水稻[23]、小麦[11]、橡胶树[24]、丹参[16]、长春花[17]等物种中被克隆。本研究从薄荷中克隆得到一条完整的COI1基因,命名为McCOI1a。氨基酸序列分析发现,McCOI1a具有典型的F-box和LRR保守结构域,并且,蛋白序列中与7JA配体相结合的氨基酸残基高度保守,这与其它植物COI蛋白的结构特征一致[6],表明McCOI1a可能是薄荷中JA的潜在受体蛋白,在JA信号感知中发挥重要作用。氨基酸相似性以及进化分析发现,McCOI1a与同科双子叶植物丹参SmCOI1的同源性最好,亲缘关系近,与水稻OsCOIs的同源性较低,亲缘关系较远,推测COI1基因的进化关系在单子叶植物和双子叶植物之间有明显的差异。另外,细胞核内的信号转导对于改变下游基因的表达,增强植物的适应性至关重要[25],前期研究结果表明,COI1蛋白具有核定位能力,本研究的亚细胞定位结果显示McCOI1a蛋白定位于细胞核,暗示McCOI1a可能在细胞核内应答JA信号,调节JA介导的下游基因表达。前期研究表明,灯盏花[26]、水稻[27]、唐菖蒲[28]等不同植物的COI1基因在根、茎、叶和花等不同组织中均有表达,但不同物种间COI1基因在不同组织中的表达有所差异,本研究中薄荷McCOI1a在不同组织中均有表达,而在根中的表达量最高,茎中的表达最低,表明不同植物或同一植物的不同组织中COI1基因的功能可能存在一定差异。
研究发现,JA在促进叶片衰老中具有重要作用,在拟南芥中,JA通过AtCOI1依赖的方式抑制Rubisco活化酶(RCA)的表达和蛋白丰度促进叶片衰老[29],而水稻OsCOI1a和OsCOI1b、番茄SlCOI1都是促进叶片衰老所必需的重要调节因子[10,30]。本研究中,MeJA处理诱导McCOI1a在叶片中上调表达,并且McCOI1a的表达随着叶片的衰老(从上部叶到下部叶)呈逐渐上升的趋势,上述研究表明不同物种中COI1蛋白在叶片衰老中的调节功能具有一定的保守性,而薄荷中JA调节叶片衰老可能依赖McCOI1a蛋白。另外,JA诱导不同植物中COI1基因差异表达,在沉香(Aquilaria sinensis)中,AsCOI1快速响应MeJA处理,其转录水平最高可上调约50倍[31],在黄花蒿和甘蔗中,MeJA诱导AaCOI1、ShCOI1s基因的表达,但COI1基因表达受JA诱导上调程度较低[13,32]。本研究中,与黄花蒿和甘蔗相似,MeJA诱导薄荷McCOI1a基因表达,且表达上调程度较低,表明不同物种中JA调控COI1基因的表达具有一定的差异。
前人研究表明JA介导的植物对逆境的耐受能力依赖COI1基因。如在盐胁迫条件下,突变AtCOI1抑制了MeJA处理诱导的气孔闭合[33],干旱条件下,MeJA诱导的气孔闭合同样依赖COI1介导的JA响应[34-35]。此外,盐胁迫处理下,拟南芥JAZ基因在根部上调表达依赖于COI1,并且JAZ基因以COI1依赖的方式抑制根的伸长[36]。另外,铝胁迫处理诱导根尖中AtCOI1上调表达,而突变AtCOI1基因减轻了铝胁迫处理诱导的根系生长抑制[37]。在小麦中,低温、高盐、干旱诱导TaCOI1s基因上调表达[24]。在甘蔗中,ShCOI1s受干旱、低温处理诱导表达[13],表明COI1基因表达水平的改变对植物抵抗非生物胁迫的抗性具有重要调控作用。与之前的研究结果相似,干旱、NaCl、AlCl3处理诱导薄荷McCOI1a基因差异表达,表明McCOI1a基因在薄荷抵抗逆境胁迫中发挥重要作用。值得注意的是,McCOI1a在叶片中上调表达,在根中下调表达,暗示McCOI1a在薄荷的不同组织中发挥的功能不同。前期研究发现,JA处理通过提高活性氧清除系统中抗氧化物酶的活性来增强对植物外源镉和铜的抗性[38-39],本研究发现CdCl2、CuCl2处理显著诱导薄荷叶片和根中McCOI1a基因的表达,表明McCOI1a可能同样参与薄荷中镉和铜胁迫的调控,但有关McCOI1a具体的功能和机制还有待于进一步研究。
4 结论
从薄荷中克隆得到McCOI1a基因,序列全长1 842 bp,编码613个氨基酸,具有F-box和LRR保守结构域,与其他植物中COI蛋白的结构特征相似;McCOI1a蛋白定位于细胞核,McCOI1a在根中的表达量最高,在薄荷营养生长期的叶序中表达呈上升的趋势;McCOI1a基因在薄荷的叶片和根中对MeJA、干旱、NaCl、AlCl3、CdCl2、CuCl2均有响应,其中在AlCl3处理的叶片中上调最明显,最高可达到1 206倍,表明McCOI1a可能在调控薄荷发育和应答非生物胁迫中发挥重要作用。