基于网络药理学和分子对接探究祖卡木颗粒治疗支气管哮喘的作用机制
候艳敏,徐 梅,张丽娟,李俞瑶,周文欣,王航宇,王金辉,3,刘 冬,张 珂
(1.石河子大学药学院/新疆植物药资源利用教育部重点实验室,2. 石河子大学医学院第一附属医院,新疆 石河子 832002;3. 哈尔滨医科大学药学院,黑龙江 哈尔滨 150081)
近年来,以气管哮喘为代表的各种呼吸系统疾病,随着全球气候变化和环境污染的影响,发病率呈明显上升趋势,给人们的身体健康和生命安全带来了重大威胁[1]。支气管哮喘,简称哮喘,常表现为气道慢性炎症,是一种异质性疾病。这类慢性炎症与气道高反应性相关[2],并伴有可逆的气流受限,会反复出现如喘息、气短、胸闷、咳嗽等症状。支气管哮喘如果没有及时进行诊治,随着病程的延长可产生气道不可逆性缩窄和气道重塑[3],因此,明确其发病的机制,寻找有效的治疗方法和研制出有效的药物对哮喘的防治有着十分重要的现实意义和较高的经济价值。
祖卡木颗粒(zukamu granules,ZKMG)中主要含有山柰、睡莲花、破布木果、薄荷、大枣、洋甘菊、甘草、蜀葵子、大黄、罂粟壳,具有调节异常气质,清热,发汗,通窍等功效,可用于治疗感冒咳嗽,发热无汗,咽喉肿痛等病症。现如今,对ZKMG的研究显示,ZKMG具有解热、镇痛抗炎的作用,但是对其具体的作用机制报道较少[4]。
大量研究证明,中药能够改善哮喘发生的各个环节,如缓解气道炎性反应[5]。近年来,网络药理学逐渐成为中药研究领域中最常用的方法之一,这个概念最早是2007年由Andrew L Hopkins提出[6]。网络药理学是建立在高通量组学数据分析、计算机虚拟计算和网络数据库检索的基础上,侧重于生物学,生物网络的构建和分析,揭示药物的有效性,毒性和代谢特征[7]。它的出现终结了“一个药物、一个靶标、一种疾病”为主导的药物研发模式,开启了多靶点与多种疾病间复杂网状关系的新型研究模式。本研究采用网络药理学方法系统分析ZKMG抗支气管哮喘的作用机制,并通过体内实验进行验证。
1 实验材料
1.1 实验动物新疆医科大学实验动物中心提供SPF级健康BALB/c雌性小鼠60只,体质量(18~22)g,实验动物生产许可证号:SCXK(新)2018-0001。给予实验鼠正常光照,自由饮食饮水,适应性饲养1周后进行实验安排,动物实验经石河子大学医学院第一附属医院实验动物伦理委员会批准。
1.2 主要试剂卵清蛋白(ovalbumin,OVA)(北京索莱宝科技有限公司,批号912E054),地塞米松磷酸钠注射液(天津金耀药业有限公司,批号51705171),MDA测试盒,T-SOD测试盒,NO测试盒,GSH-Px测试盒,BCA总蛋白定量测定试剂盒,快速瑞氏-姬姆萨染色试剂盒(南京建成生物工程研究所,批号20210609、20210508、20210511、20210518、20210528、20170923),蛋白裂解液(RIPA)、苯甲基磺酰氟(PMSF)(北京索莱宝科技有限公司,货号:R0010、P8340),特超敏ECL化学发光试剂盒(碧云天生物技术有限公司,货号:P0018A),小鼠IL-17A、IL-23 ELISA试剂盒(杭州联科生物技术有限公司,货号A21710141、A22310216),IκBα抗体、NF-κB p65抗体(武汉博士德生物有限公司,货号:BM3932、BA0610),Phospho-IκBα抗体(Cell Signaling Technology公司,批号9246S),一抗:ERK1/2 、p-ERK1/2、p38、p-p38(博士德生物工程有限公司 BM4326、BM5446、PB9290),β-actin抗体、山羊抗兔、山羊抗小鼠(北京中杉金桥生物技术有限公司,货号:16A00205、ZB-2301、ZB-0312)。
1.3 主要仪器Thermo 3001全自动酶标仪(美国Thermo公司),超声雾化器(NB-150U,德国欧姆龙),GT200球磨仪(上海净信实业发展有限公司),TGL-16B离心机(上海安亭科学仪器厂制造),DYCZ-24DN电泳仪(北京六一生物科技有限公司),Axio Imager A2蔡司正置荧光显微镜(北京博瑞斯科技有限公司),UVP凝胶成像仪(美国UVP公司),LEGEND MICRO 21R高速冷冻离心机(赛默飞世尔科技有限公司),DB-09型石蜡包埋机(湖北德力森科技有限公司),石蜡切片机(北京盛科信德科技有限公司)。
2 实验方法
2.1 活性化合物筛选及建立目标数据库以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为条件,通过TCMSP数据库检索祖卡木颗粒中10种中药的化学成分,筛选化学成分及相应的蛋白靶点,并通过参考文献进行补充。将化学成分的SMILES号导入SwissADME数据库中,将GI absorption-High, Druglikeness有2个Yes作为化合物筛选条件,筛选后的化合物利用TCMSP数据库和SwisstargetPrediction数据库进行靶标预测。在GeneCards数据库,输入“bronchial asthma”,得到疾病靶点,将疾病靶点和成分预测靶点通过Venny将这两部分相交,得到关键靶点。
2.2 构建药物-组分-靶点网络图和蛋白-蛋白交互作用网络将通过筛选的化合物以及关键靶点的数据导入Cytoscape(3.8.1版本)进行数据可视化,构建了药物-成分-靶点网络。在STRING数据库中导入基因靶标,Cytoscape中优化蛋白-蛋白交互作用网络。
2.3 基因本体富集分析(GO)与京都基因和基因组百科全书通路富集分析(KEGG)利用Metascap平台对交集靶点进行GO与KEGG富集分析,筛选条件P<0.01,利用微生信在线工具对富集结果进行可视化。
2.4 分子对接选择PPI网络中的核心靶点与药物的核心成分进行分子对接,通过PubChem数据库获得核心成分的3D结构,保存为MOL2格式。大分子靶蛋白的PDB格式文件通过PDB数据库下载。分子活性位点对接借助Discovery studio 4.5软件进行。
2.5 模型的建立及给药将60只雌性BALB/c小鼠随机分为6组,每组10只,分为正常组(Control)、OVA组(5 mg·kg-1),祖卡木颗粒低、中、高剂量组(ZKM-L:1.6 g·kg-1,ZKM-M:4.8 g·kg-1,ZKM-H:14.4 g·kg-1)和地塞米松阳性对照组(DEX,2 mg·kg-1)。
小鼠适应性饲养1周即开始造模,在d 1和d 4时,正常组腹腔注射生理盐水,其余5组腹腔注射OVA致敏液(0.5 g·L-1,OVA干粉100 mg,2 mg氢氧化铝,200 mL生理盐水)进行致敏,造模成功后,在d 21~34,进行实验干预,每天对正常组以及OVA模型组用生理盐水进行灌胃,ZKM(L,M,H)组的小鼠用不同浓度祖卡木颗粒进行灌胃给药治疗,DEX组进行腹腔注射地塞米松(2 mg·kg-1)进行治疗。在d 27~34,对OVA组、ZKM-L、ZKM-M、ZKM-H以及DEX组用超声雾化器对小鼠进行1% OVA(OVA 500 mg溶于50 mL生理盐水,现用现配)雾化刺激,每天30 min,正常组的小鼠采用100 mL生理盐水进行雾化激发。在末次OVA激发24 h后,对小鼠进行摘眼球取血,血样置于4 ℃,5 000 r·min-1离心10 min,取上清液,-80 ℃储存备用。取部分小鼠肺组织灌注1 mL生理盐水,连续灌注3次,回收率约70%~80%,得肺泡灌洗液(BALF)。每组取部分小鼠左下叶肺固定于10%的福尔马林溶液中,用于后续的病理学观察,其余肺组织采集称质量后置于-80 ℃保存,待进一步检测。肺系数计算方法:肺系数=肺质量/体质量×100%。
2.6 肺泡灌洗液(BALF)细胞分类计数及染色将采集到的BALF放入EP管中,4 ℃低温条件下3 000 r·min-1离心10 min后取下层沉淀物进行细胞分类计数和瑞氏-姬姆萨染色,在光学显微镜下区分不同细胞。
2.7 肺组织病理学观察将肺组织固定在10%甲醛中24 h后,进行梯度乙醇脱水,石蜡包埋、切片,对肺组织病理切片进行苏木精-伊红染色和三色染色,高倍光学显微镜观察各组织的病理学变化。
2.8 小鼠血清中IL-17A以及IL-23的含量取小鼠血清进行IL-17A以及IL-23的含量检测,具体实验操作按ELISA试剂盒说明书中的方法进行。
2.9 测定MDA、NO的含量以及T-SOD和GSH-Px的活力将小鼠肺组织,用冷0.9%生理盐水制成10%的组织匀浆,4 ℃,3 500 r·min-1,离心10 min,取上清用于MDA、NO、T-SOD和GSH-Px含量及活性的检测,具体操作按照试剂盒说明书进行。
2.10 Western blot用RIPA裂解缓冲液从肺组织中提取总蛋白,根据核蛋白提取试剂盒说明从肺组织中提取核蛋白。蛋白浓度按照BCA蛋白检测试剂盒进行测定。通过凝胶电泳将等量的蛋白质样品分离,并将其转移到PVDF膜上。用5%封闭液封闭后,将膜与一抗进行孵育,4 ℃下过夜。用TBST洗涤4次后,与山羊抗小鼠/兔二抗室温孵育1.5 h。然后用TBST洗涤4次,用增强化学发光试剂形成膜上的蛋白条带。用Image-Pro Plus 6.0软件检测蛋白条带的灰度值,用靶带与β-actin的比值进行半定量分析。

3 结果
3.1 药物活性成分、靶点的筛选利用TCMSP数据库以及多种开源数据库对祖卡木颗粒中10种中药的化学成分进行检索归纳,经过OB、DL筛选后,最终获得194种活性成分,剔除重复靶点后,最终共获得靶点326个。
3.2 祖卡木颗粒与支气管哮喘靶点交集在GeneCards数据库中检索“Bronchial asthma”,去掉疾病靶点的重复值并进行整合,共计得到靶点1 577个。借助Venny2.1工具绘制Venn,得到交集靶点176个,结果见Fig 1A。
3.3 “药物-成分-靶点”网络的构建将上述交集靶点和相对应的成分信息文件导入Cytoscape,构建活性成分-靶点网络。网络中有边(edge)1 722条,节点(node)378个,节点的大小,表示在网络中的重要性。
3.4 蛋白质相互作用网络(PPI)的分析为了探讨祖卡木颗粒治疗哮喘的分子机制,构建PPI网络。该PPI网络由176个节点和2 464个边组成。对该网络拓扑参数进行分析,得出靶基因的平均度值为28.5,度值越大,节点大小越大,对应的重要程度越高。
3.5 祖卡木颗粒治疗支气管哮喘核心靶点获取将PPI网络导入Cytoscape中,借助“CytoNCA”插件计算出节点交互关系的DC、BC、CC、LAC等值,以中位数为标准逐步筛选核心靶点。得到36个核心靶点,其中包括肿瘤坏死因子(TNF)、白蛋白(ALB)、血管内皮生长因子A(VEGFA)、肿瘤蛋白P53(TP53)、表皮生长因子受体(EGFR)等与支气管哮喘有关的核心靶点。
3.6 GO富集分析及KEGG通路富集分析采用Metascape对核心靶点进行功能与通路的富集分析,并进行结果可视化,共富集到生物学过程883条,细胞组分40条,分子功能64条,通过P值筛选排名前20的条目绘图。KEGG通路富集条目133条,结合靶点富集数及Count值筛选条目进行分析并作图。气泡大小代表基因靶点富集数,气泡颜色由绿逐渐转红表明其显著性越强。主要涉及蛋白质多糖与癌症通路、PI3K-Akt信号通路、MAPK信号通路等,结果见Fig 1B,C。
3.7 分子对接结果选择PPI网络中排名前6的靶点以及排名前10的关键成分进行分子对接。根据PPI网络分析,将槲皮素、山奈酚、木犀草素、豆甾醇、柚皮素、原阿片碱、异鼠李素、芦荟大黄素、芹菜素以及7-甲氧素-2-甲基异黄酮作为关键成分,TNF、ALB、VEGFA、TP53、EGFR、SRC作为靶点,进行分子对接,选择Discovery studio 4.5软件评分靠前的结果进行可视化展示,具体结果见Tab 1。
3.8 祖卡木颗粒对哮喘小鼠肺系数的影响小鼠肺湿重与正常组相比较,OVA模型组(P<0.01)差异有统计学意义,与模型组相比较,ZKM-H(P<0.05)与DEX(P<0.05)差异均有统计学意义。由结果提示OVA模型组小鼠肺湿重增大,出现一定程度的水肿,通过给药后小鼠肺湿重有所降低。其中剂量组ZKM-H效果较为明显(P<0.05),结果如Fig 2所示。
3.9 哮喘小鼠肺泡灌洗液细胞计数及染色为了进一步研究ZKMG对OVA诱导的哮喘小鼠的作用,对小鼠肺泡灌洗液中的总细胞数和各类细胞进行计数,如Fig 3,4所示,相较于正常组,模型组的总细胞数以及各类炎症细胞数均明显增加。相较于模型组,3个剂量组与阳性药组的总细胞数、单核细胞、淋巴细胞和嗜中性粒细胞的数量均明显减少。
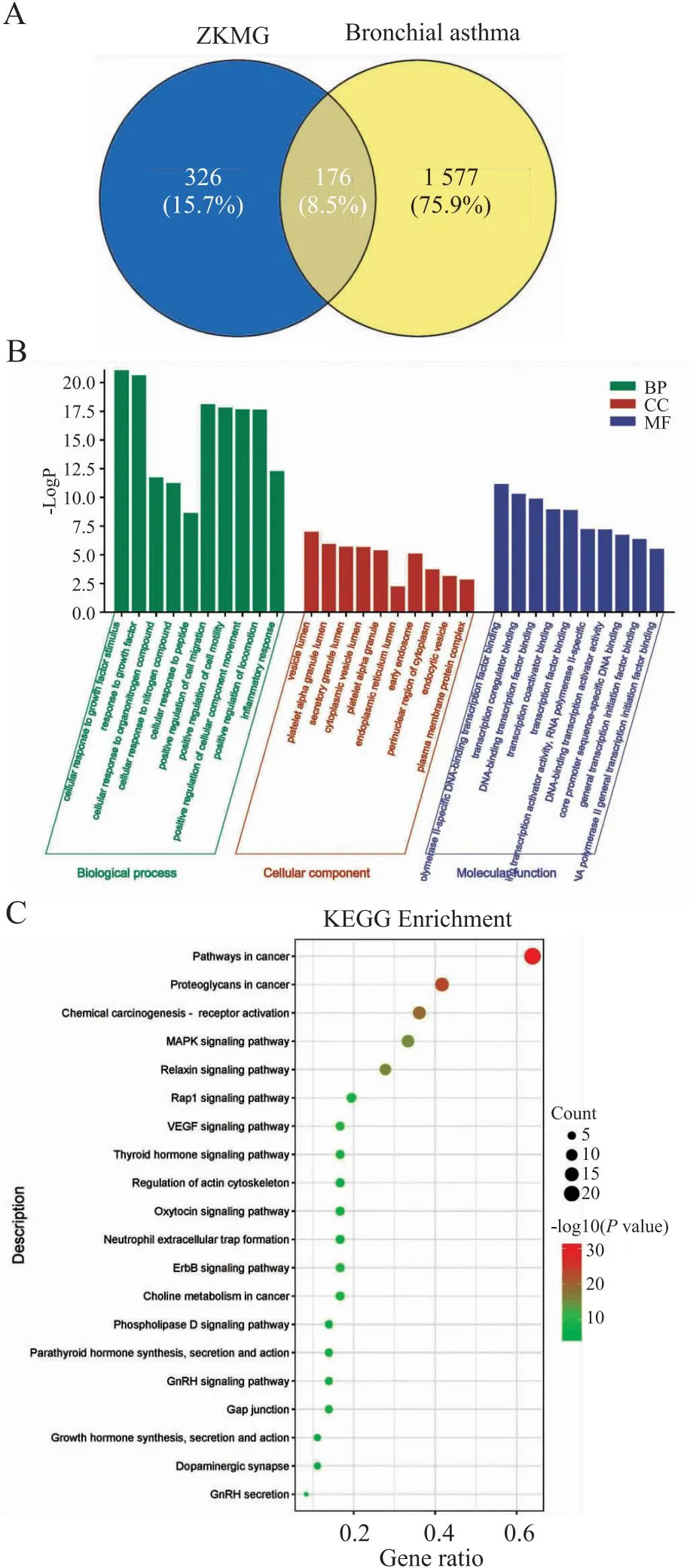
Fig 1 Network pharmacology

Tab 1 Molecular docking software score

Fig 2 Lung wet weight and lung coefficient in asthmatic mice n=8)
3.10 祖卡木颗粒对哮喘小鼠肺组织病理形态的影响通过HE染色与Masson染色进一步评估祖卡木颗粒的抗哮喘作用。由Fig 5结果显示,与正常组相比,模型组的肺组织中,细胞排列紊乱,并伴随大量炎性细胞浸润。与模型组相比,ZKMG剂量组和阳性药组表现出明显的抗哮喘作用,减轻肺部炎症现象,肺部细胞排列也趋于正常化。
Fig 3 Cell Richter-Jimsa staining in alveolar lavage fluid of each group
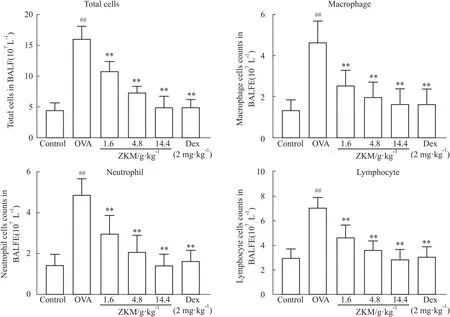
Fig 4 Cell counts in alveolar lavage fluid of each group n=8)
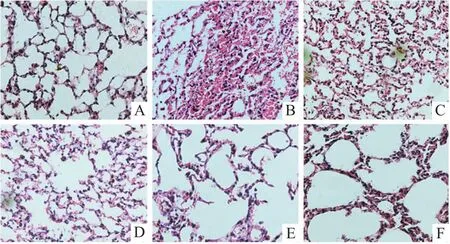
Fig 5 HE staining of lung tissues of asthmatic mice (400×)
由Fig 6结果显示,哮喘模型组小鼠相对于空白对照组小鼠,肺组织纤维化明显,而ZKMG干预组小鼠肺纤维化程度明显改善。
3.11 ZKMG对哮喘小鼠肺组织中NO,T-SOD,GSH-Px以及MDA的影响为了解ZKMG对哮喘的影响是否参与氧化应激过程,本研究对小鼠肺组织中的NO、T-SOD、GSH-Px以及MDA进行含量检测,结果如Fig 7,与正常组相比,OVA模型组肺组织中MDA和NO含量明显增加(P<0.01),T-SOD和GSH-Px活性明显降低(P<0.01)。与OVA组比较,ZKM剂量组和DEX组肺组织中MDA和NO的含量相对降低(P<0.05或P<0.01),T-SOD和GSH-Px的活性明显升高(P<0.05或P<0.01)。提示,ZKMG可以增加抗氧化剂活性物质的含量,并有助于缓解OVA诱发的哮喘。
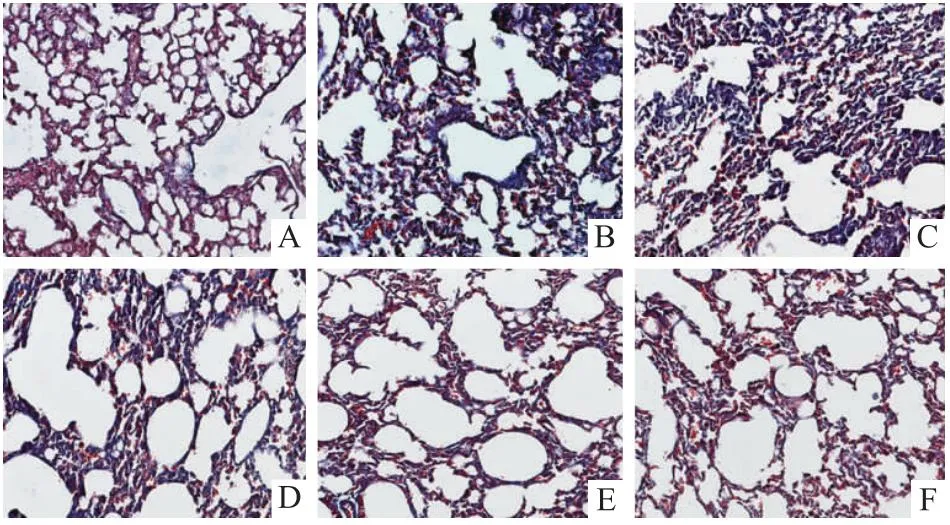
Fig 6 Masson staining of lung tissue in asthmatic mice (400×)
3.12 ZKMG对哮喘小鼠血清中IL-17A与IL-23的影响检测血清中IL-17A与IL-23细胞因子的表达水平,以探讨ZKMG对哮喘炎性介质的影响。结果Fig 8,与正常组相比,OVA诱导哮喘模型的IL-17A与IL-23细胞因子在血清中的表达明显增加(P<0.05);与OVA模型组相比,ZKM剂量组和DEX组中IL-17A与IL-23的表达水平明显降低(P<0.05),并且呈明显的剂量依赖性。这表明ZKMG可以抑制OVA诱发的哮喘小鼠的血清中IL-17A与IL-23的表达。

Fig 7 MDA, NO content, T-SOD and GSH Px activity in lung tissue in serum of asthmatic mice n=8)
3.13 ZKMG对哮喘模型小鼠肺组织中NF-κBp65、IκB-α、p-IκB-α蛋白以及MAPK通路相关蛋白表达的影响网络药理富集分析结果表明,ZKMG治疗支气管哮喘的机制可能与TNF、VEGFA和ALB有关,它们在炎症反应中发挥作用。与OVA组相比,ZKMG抑制了NF-κB p65蛋白的过度表达,抑制了IκBα蛋白的磷酸化。此外,在炎症反应中,MAPK通路也扮演着重要的角色。因此,我们分析了磷酸化的ERK1/2和磷酸化的p38的水平。如Fig 9所示,OVA组明显增加了p-ERK1/2和p-p38的表达,在ZKMG处理后,这些表达均减少。
4 讨论
哮喘是世界上最常见的慢性病,哮喘的发病机制有几种,现阶段最被大家认可的哮喘发病机制是气道免疫-炎症机制[8-10],当外源性的刺激源通过各种途经进入到体内,被抗原递呈细胞内吞并激活T细胞。激活的T细胞产生白介素激活B淋巴细胞,从而合成特异性IgE。刺激源如果再次进入体内,会与细胞表面的IgE结合,使细胞合成多种活性介质,导致平滑肌收缩,黏液分泌增多以及炎症细胞浸润,会出现反复喘息、气短、咳嗽、咳痰、喉间哮鸣音等[11]。如果哮喘不能及时进行治疗,气道炎症和反复发作的上皮损伤,会最终导致气道重塑。多种炎性因子、多种炎性介质均参与了气道重构的形成。故哮喘是由多种炎性细胞和炎性因子参与的气道慢性炎症性疾病。
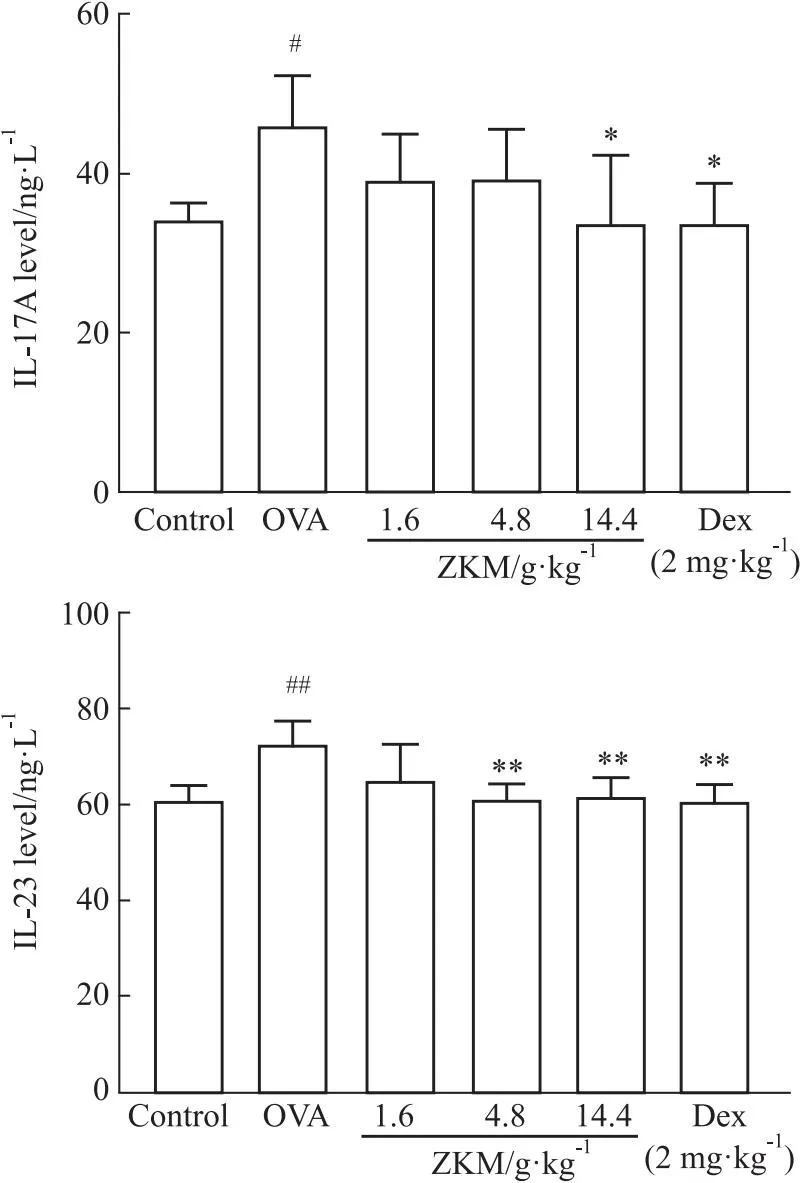
Fig 8 IL-17A and IL-23 content in serum of
中药是我国几千年来的瑰宝,在疾病防治中具有多成分、多靶点、多途径的特点。近年来,随着系统生物学、人工智能、多向药理学以及其他技术的快速发展,网络药理学也应运而生[12]。网络药理学可以根据中药中的成分,运用多种数据库,快速筛选出潜在靶点,预测作用机制,系统性地分析药物-成分-疾病-靶点的相互作用[13]。本研究通过网络药理学预测了ZKMG治疗支气管哮喘的可能性,并通过体内实验验证了其有效性。
ZKMG在维吾尔医药中,是治疗感冒的首选药方,具有调节异常气质,清热,发汗,通窍等功效。大量临床应用表明,ZKMG对于上呼吸道感染,具有疗效好,见效快,无毒副作用,且适用于不同年龄阶段感冒患者的特点。不断有研究证明,ZKMG具有解热、镇痛和抗炎的作用,但是对其具体的作用机制报道较少。基于ZKMG的抗炎作用,我们希望发现其对支气管哮喘的治疗潜力,并开发其新的临床应用价值。
通过网络药理学以及分子对接结果分析,我们发现TNF、ALB、VEGFA是ZKMG中活性化合物治疗支气管哮喘的关键靶点。肿瘤坏死因子TNF分为TNF-α和TNF-β两类,TNF-α是介导炎症和免疫调节反应的重要因子,TNF-β可以通过上调血管内皮细胞表面黏附分子的表达,激活巨噬细胞,从而促进炎症反应[14]。ALB,又称白蛋白,分布于组织和体液中,在组织损伤或炎症发生时,ALB分解代谢会增加,其浓度会降低。血管内皮生长因子A(VEGFA)属于VEGF家族,由多种细胞分泌,而VEGF是已知的最强血管通透剂,在支气管炎性反应和支气管重塑过程中起着重要的作用[15]。通过GO和KEGG富集分析,我们推测ZKMG抗支气管哮喘的机制可能是通过NF-κB信号通路、MAPK等通路实现,因此,我们设计了相应的实验来验证ZKMG抗支气管哮喘的作用。
哮喘患者由于支气管气道中中性粒细胞的积聚而表现出氧化应激增强,超氧化物歧化酶活性降低会造成气道高反应以及气流阻塞,有研究数据表明,哮喘患者呼出的NO浓度高于正常受试者。NO水平的升高和氧化应激的增强可能导致强过氧亚硝酸根的形成,从而导致支气管气道中的蛋白质亚硝基化,最终导致气道炎症[16]。在本研究中,ZKMG治疗降低了OVA诱导的哮喘小鼠肺组织中NO和MDA的水平,增高T-SOD和GSH-Px的活力值,提示ZKMG可以通过降低氧化应激改善气道高反应性。
IL-17A是由Th17细胞分泌,可作用于上皮细胞,通过激活核因子-κB (NF-κB)、MAPK等信号通路促进炎症因子与趋化因子的表达[17]。IL-23可以促进Th17的扩增与稳定,IL23的含量可作为评价哮喘严重程度及气流受限的参考标志[18]。在本研究中,经ZKMG治疗后,哮喘小鼠肺泡灌洗液中的炎性细胞数量减少,血清中IL-17A与IL-23的含量降低,肺组织炎性细胞浸润以及胶原沉积现象得到改善。Western blot结果显示,ZKMG可以通过调控NF-κBp65/MAPK通路相关蛋白表达达到抗支气管哮喘的目的。
5 结论
本研究利用网络药理学以及分子对接研究ZKMG对支气管哮喘的物质基础以及可能的作用机制,在体内实验中验证了ZKMG治疗支气管哮喘的可能性,为ZKMG新的临床应用提供了科学依据。