电化学计算型选择题归类例析
边永平
(河北省丰宁满族自治县第一中学,河北 承德 068350)
电化学包括原电池、电解和电镀三部分,涉及原电池原理和电解原理,实质是氧化还原反应这部分理论知识的应用和深化.而有关电化学的计算,其核心依据则是得失电子守恒原理的应用.现将有关电化学知识的计算型选择题进行归类,并举例分析.
1 由原电池的电极反应求电子转移数
例1 氢氧燃料电池具有非常突出的优点:可以把化学能直接转化为电能,而不需经过热能这种中间能量形式,氢氧燃料电池目前广泛应用于航天领域以及潜艇中.其电极反应为:


所生成物中的水可供饮用,现欲制得常温下1LH2O,则电池内部电子转移数约为( ).
A.8.9×10-3mol B.4.5×10-2mol
C.1.1×102mol D.1.6×102mol

2 求消耗原电池内电解质的物质的量
例2铅蓄电池放电时,电极反应为:

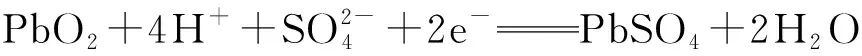
若使用铅蓄电池作电源,电解饱和食盐水,若制0.005 mol Cl2,消耗的H2SO4的物质的量至少是( ).
A.0.0025 mol B.0.005 mol
C.0.01 mol D.0.02 mol
解析本题考查了铅蓄电池的总反应及电解饱和食盐水的计算知识,电解过程中,两个装置转移的电子存在守恒关系,依据这一点可以计算.

3 串联电路条件下的电解计算
例3有三个电解槽,分别装有熔融态的氯化钠、氯化镁及氯化铝,现将上述三个电解槽串连,电解一段时间后,析出钠、镁、铝的物质的量之比为( ).
A.1∶1∶1 B.3∶2∶1 C.2∶3∶6 D.6∶3∶2
解析由于是串联电路,则相同时间内通过的电量相等,根据各阳离子的电荷数可确定析出钠、镁、铝的物质的量之比为6∶3∶2,答案为D.
4 求某一元素的相对原子质量
例4烧杯中放有金属M的硝酸盐M(NO3)x的水溶液,用石墨电极进行电解,当阴极质量增加ag时,在阳极上放出bL O2(标准状况),则金属M的相对原子质量为( ).
A.22.4ax/bB.11.2ax/b
C.5.6ax/bD.2.5ax/b
解析设金属M的相对原子质量为M0,化合价为+x,依关系式:

4 mol 22.4 L
可列出:ax/M0=4b/22.4,得M0=5.6ax/b,即选C.
5 确定电解后的状态
例5现有1 L NaOH溶液,质量分数为5.2%,密度为1.06 g·cm-3,用铂电极进行电解,电解过程中,当溶液中的NaOH的质量分数改变了1.0%时,停止电解,则此时表1中溶液中应存在的数据关系是( ).
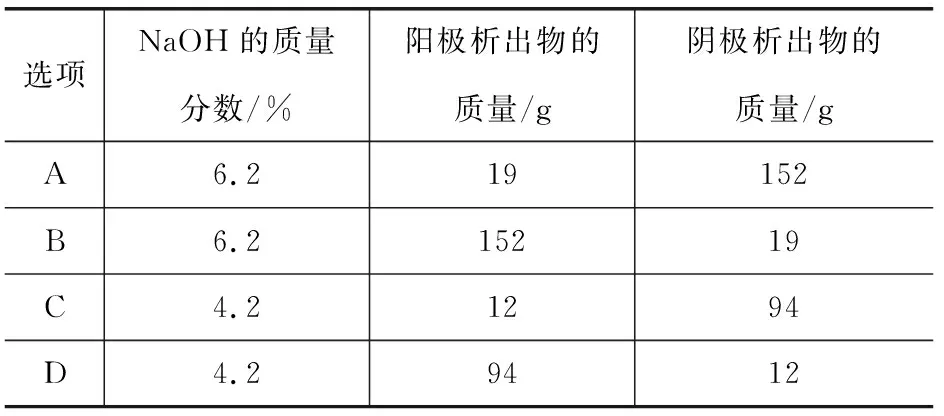
表1 电解数据
解析电解NaOH溶液实质为电解水,阳极产物为O2,阴极产物为H2,电极反应为:


据此分析:电解后NaOH溶液中溶剂减少,浓度将增大,阴极产物(H2)质量要小于阳极产物(O2)的质量,即选B[1].
6 求电解液的物质的量浓度
例6 现有100 mL HNO3与AgNO3的混合液,用铂电极电解,通电一段时间后,两极上均产生2.24 L气体(标准状况),通过计算分析,原混合液中Ag+的物质的量浓度c(Ag+)为( ).
A.1 mol /L B.2 mol /L
C.2.5 mol /L D.3 mol /L

7 求电解后所得溶液的质量分数
例7 在25 ℃时,将两个铂电极插入一定质量的硫酸钠饱和溶液中进行电解.通电一段时间后,阴极上逸出amol气体,同时有wg Na2SO4·10H2O晶体析出.若温度不变,剩余溶液中溶质的质量分数为( ).
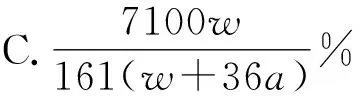
解析电解时发生的总反应为:
当阴极上逸出amol H2时,水被电解了amol,根据溶解度知识,不难计算出答案为D.
变式将例2中“两个铂电极”改为“两个铜电极”,则答案为( ).
解析此时阳极为铜,可视为活性金属,故电极反应为:


电极总反应式为:
当阴极上逸出了amol H2时,水被电解了2amol,则答案为C.
评注两题仅一字之差,但思维的出发点不同,本题中学生容易定势在“用惰性电极电解Na2SO4溶液,实质是电解水”这一思维模式中,从而错选D[2].
8 由电解后溶液pH的变化求析出金属的质量
例8现有500 mL AgNO3溶液,用两支石墨电极进行电解,当溶液的pH从6.0降低到3.0时(设电解时阴极没有H2析出,且电解后溶液体积仍看成500 mL),电极上应析出银的质量为( ).
A.27 mg B.54 mg C.108 mg D.216 mg
解析阴极的电极反应为:

阳极的电极反应为:

再依:OH--H+得出关系式:
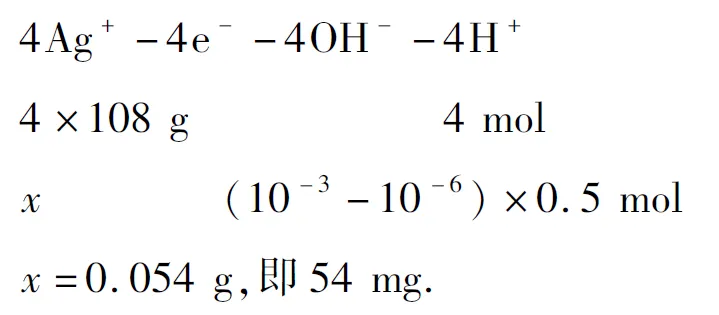
故选择B.
9 电解过程中调换电源的正负极
例9用惰性电极电解2 L 1 mol/L的CuSO4溶液,在电路中通过0.5 mol电子后,调换正负极,电路中又通过1 mol电子,此时溶液中c(H+)是(假设电解后溶液体积不变)( ).
A.1.5 mol/L B.0.75 mol/L
C.0.5 mol/L D.3 mol/L

10 推算阿伏加德罗常数
例10 小明同学在学习了电解知识以后,尝试采用电解的方法,根据电极上析出物质的质量来进一步推算出阿伏加德罗常数.若采用石墨电极电解CuCl2溶液,电流强度为I安培,通电时间为t秒,精确测得电极上析出铜的质量为m克,则阿伏加德罗常数的表达式为( ).
A.2×1020It/mB.It/m
C.2×1020ItD.m/2×1020×It
解析由关系式:
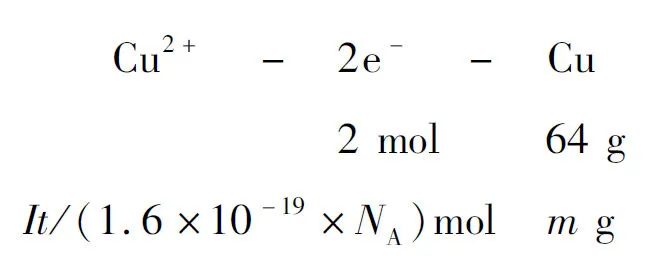
得出:NA=2×1020It/m.
即选择A.
11 求离子交换膜两侧电解液的质量变化
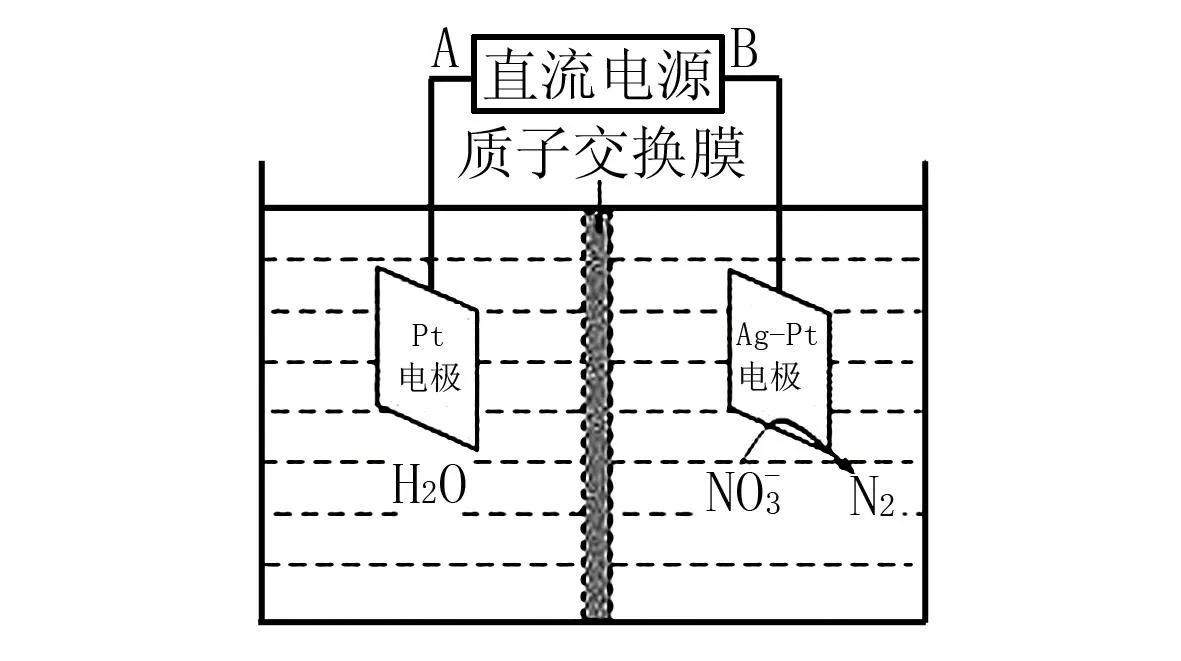
图1 电化学降解
A.18 g B.14.4 g C.3.6 g D.2 g
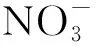

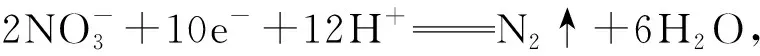
故两侧电解液质量变化的差值为18 g-3.6 g=14.4 g,即选择B.
12 结束语
综上,笔者根据对近几年高考题的分析,结合教材中的重难点知识,对电化学计算型选择题进行归类并详解,以期能够帮助同学们在考试中对此类题目志在必得.

