儿童肝移植后淋巴组织增殖性疾病合并EB病毒相关平滑肌肿瘤1例及文献复习
王超然,孙丽莹,杨吉刚
(1.首都医科大学附属北京友谊医院核医学科,2.肝移植中心,北京 100050)
移植后淋巴组织增殖性疾病(post-transplant lymphoproliferative disorder, PTLD)是由一组异质性淋巴细胞增殖性疾病组成的器官移植后严重并发症。EB病毒相关平滑肌肿瘤(EB virus-associated smooth muscle tumor, EBV-SMT)是与EB病毒感染相关的罕见肿瘤。本研究报道1例经病理证实的儿童肝移植后PTLD合并EBV-SMT的18F-FDG PET/CT表现。
1 病例资料
患儿男,3岁,家长发现其颈部多发无痛性结节伴腹泻8个月,外院诊断“EB病毒感染”并予更昔洛韦治疗后无缓解;3年前因“先天性胆道闭锁”接受原位肝移植术,之后口服他克莫司。查体:双侧颈部扪及多发黄豆大淋巴结。实验室检查:外周血CD4+T细胞计数34.41,他克莫司血药浓度8.4 ng/ml,外周血单个核细胞EB病毒DNA定量每毫升278 974.00拷贝。18F-FDG PET/CT:于双侧颈部、锁骨上区及肠系膜区见多发大小不等淋巴结摄取FDG增高,最大标准摄取值(maximum standard uptake value, SUVmax)1.70~5.94;回盲部肠壁增厚,FDG摄取增高,SUVmax3.71;移植肝S3内0.63 cm×0.90 cm小片状稍低密度影,未见摄取增高(图1A)。影像学诊断:PTLD。行颈淋巴结切除活检术;病理:光镜下见淋巴组织增生(图1B);免疫组织化学显示CD21(FDC网+)、CD20(B细胞+)、CD3(T细胞+),Ki-67、CD10、Bcl-6(生发中心+),Bcl-2(非生发中心+),CD30(-);EB病毒编码小RNA原位杂交(EBER)(+);诊断为PTLD。于超声引导下行移植肝S3占位经皮细针穿刺活检;病理:光镜下见梭形细胞肿瘤;免疫组化显示Acting、EBNA2(+),Bcl-2、C-Myc、LMO-2(部分+),Des、S-100、CD3、CD10、CD20、CD21(-);EBER(+)(图1C);诊断为EBV-SMT。临床诊断:PTLD合并EBV-SMT。减低他克莫司剂量并予利妥昔单抗治疗2个月,外周血CD4+T细胞计数56.64,他克莫司血药浓度为4.3 ng/ml;复查18F-FDG PET/CT显示淋巴结较前缩小、 SUVmax0.43~2.91,回盲部病灶消失,移植肝S3低密度影扩大、FDG摄取稍高,SUVmax1.62,脾下极新发1.40 cm×1.11 cm低密度影,SUVmax2.00(图1D);诊断为PTLD缓解、EBV-SMT进展并脾脏转移。继续治2个月后再次复查18F-FDG PET/CT显示淋巴结较前增大,FDG摄取增高,SUVmax1.11~3.40;移植肝S3低密度FDG摄取较前增高,SUVmax2.82;脾增大,下极低密度影扩大,内新出现片状稍高密度影,FDG摄取不均匀增高,SUVmax3.61;脾上极新发1.72 cm×1.04 cm稍低密度影,FDG摄取增高,SUVmax3.86;左侧肱骨上段FDG摄取增高,SUVmax4.26(图1F);诊断为PTLD及EBV-SMT进展。再以利妥昔单抗及雷帕霉素治疗4个月;第4次18F-FDG PET/CT显示全身未见肿大或FDG摄取增高淋巴结;移植肝S3低密度FDG摄取较前减低,SUVmax1.94;脾增大,脾下极肿块扩大至5.28 cm×3.86 cm,密度减低,未见FDG摄取增高;脾上极稍低密度影扩大,FDG摄取较前增高,SUVmax3.53;脾周新发2.53 cm×2.32 cm软组织密度影,FDG摄取增高,SUVmax4.01;左侧肱骨上段病灶消失(图1F);诊断为PTLD缓解、EBV-SMT部分较前进展。行脾脏+肝脏占位切除术,术中见移植肝S3、脾脏及脾周数个肿瘤样占位,大者约5.00 cm×5.00 cm;术后病理结果同移植肝S3穿刺。术后诊断:EBV-SMT累及移植肝、脾及脾周。检查前患儿监护人知情同意,本研究通过医院伦理委员会审批。检查前患儿监护人知情同意,本研究通过医院伦理委员会审批(2022-P2-191-01)。
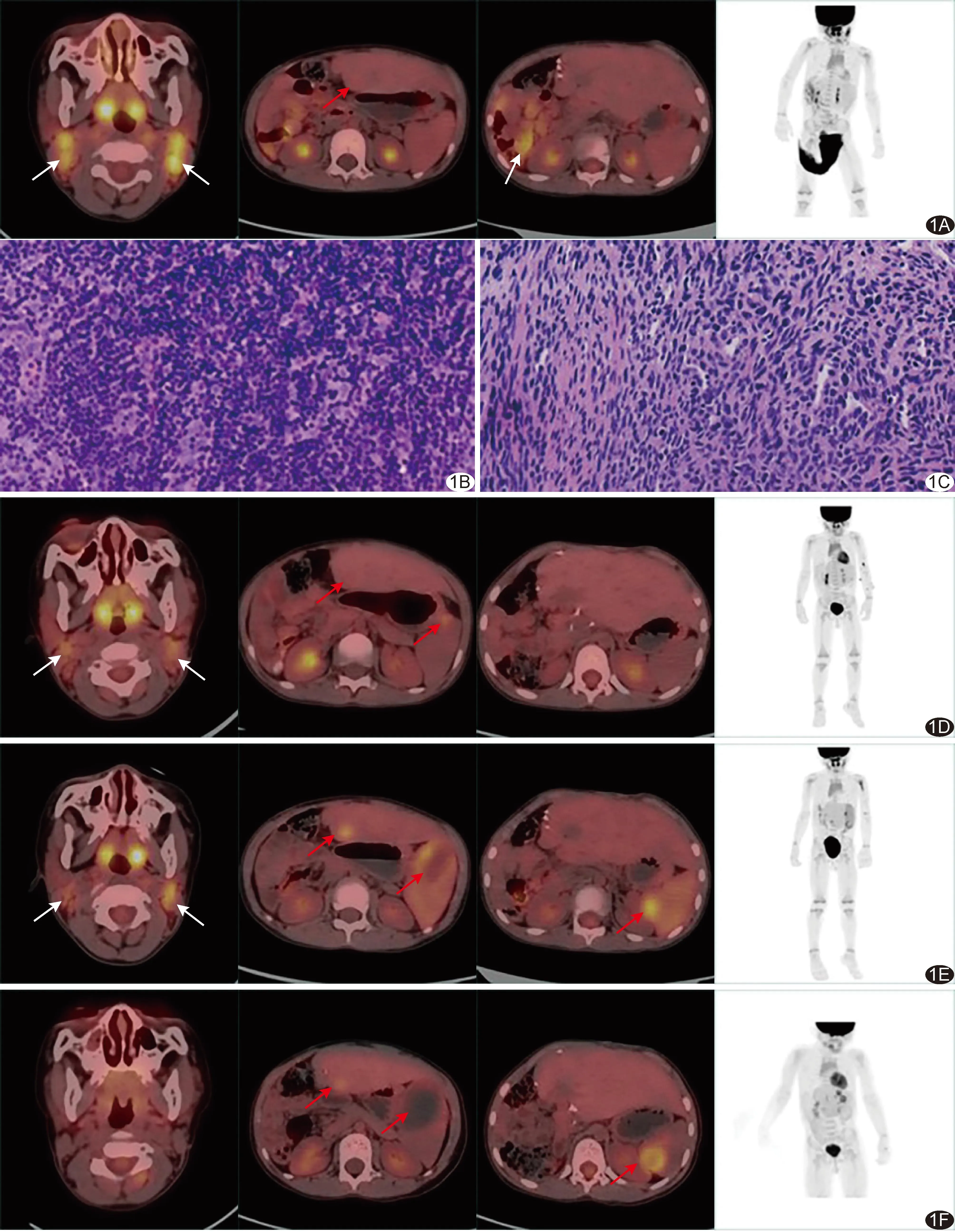
图1 儿童PTLD合并EBV-SMT 18F-FDG PET/CT及病理图 A.首次 18F-FDG PET/CT(从左至右依次为颈部层面融合图、移植肝S3与脾下极层面融合图、回盲部肠道与脾上极层面融合图及全身最大密度投影图) B.颈部淋巴结病理图(HE,×80); C.移植肝S3占位病理图(HE,×80); D~F.第2~4次18F-FDG PET/CT(与首次对应层面) (白箭示PTLD,红箭示EBV-SMT)
2 讨论
PTLD是儿童器官移植后最常见的恶性肿瘤,发病率1%~20%[1];器官移植后应用免疫抑制剂致T细胞功能受损及EB病毒感染致B细胞异常增殖为主要病因[2];18F-FDG PET/CT表现为脏器、淋巴结或骨髓FDG摄取增高[3]。EBV-SMT是来源于未定恶性潜能平滑肌细胞的罕见肿瘤,原因尚不明确,可能与免疫抑制状态下EB病毒进入平滑肌细胞有关[4];可分为HIV相关性、先天性免疫缺陷综合征相关性及移植术后相关性SMT,后者约占45%,且最好发于肝脏[5]。目前尚未见以18F-FDG PET/CT观察EBV-SMT的系统性研究。KHAN等[6]报道2例接受心脏移植的青年EBV-SMT患者,18F-FDG PET/CT显示1例胸腺、肺、肝脏、多发淋巴结、升结肠和骨髓中FDG摄取增高灶,另1例颅内PTLD治疗后肝内新发FDG摄取增高灶。GARG等[7]报道1例颅内原发EBV-SMT术后复查18F-FDG PET/CT出现肾上腺FDG高摄取软组织肿块,病理证实后者亦为EBV-SMT。上述研究结果提示,EBV-SMT与PTLD18F-FDG PET/CT表现相近,可能导致鉴别困难。本例有肝移植及EB病毒感染史,首次18F-FDG PET/CT见移植肝EBV-SMT病灶未见FDG摄取增高;淋巴结PTLD病灶及肠道FDG摄取增高,以PTLD治疗后病灶摄取减低,提示部分缓解;而治疗过程中移植肝EBV-SMT病灶扩大伴脾脏等多部位新发病灶FDG摄取增高,与PTLD病灶改变不一致。EBV-SMT瘤内除肿瘤细胞外,还存在数量不等的以T细胞为主的淋巴细胞浸润[8]。CHONG等[9]报道1例HIV相关性SMT患者接受抗逆转录病毒治疗后肿瘤体积及CD4+T细胞计数均缓慢增加。另外,有研究[10]显示,启动高效抗逆转录病毒疗法后,HIV感染者胸腺FDG摄取增高与CD4细胞数量增加相关;而他克莫司可抑制大鼠移植肝CD4+T细胞增殖[11]。本例接受首次18F-FDG PET/CT时他克莫司血药浓度较高而外周血CD4+T细胞计数较低;减低他克莫司剂量并予利妥昔单抗治疗后,他克莫司血药浓度降低、CD4+T细胞计数增高,此时复查18F-FDG PET/CT显示移植肝EBV-SMT FDG摄取增高,故不排除他克莫司治疗剂量影响EBV-SMT摄取FDG水平的可能。
综合文献回顾及本例表现,遇PTLD患者在治疗过程中出现非典型PTLD18F-FDG PET/CT表现时,需考虑EBV-SMT可能,必要时以病理学检查明确诊断。
利益冲突:全体作者声明无利益冲突。
作者贡献:王超然查阅文献、撰写和修改文章;孙丽莹指导;杨吉刚审阅文章。

