胎儿颅脑正中矢状位MRI脑桥生物学指标与孕周的相关性
侯伶秀,刘炳光,袁 鹰,廖伊梅,朱巧珍,郭洪波,谭 莹,温慧莹,严 芳,李胜利*
(1.南方医科大学第一临床医学院,广东 广州 510515;2.深圳妇幼保健院超声科,4.放射科,6.妇幼医学研究所,广东 深圳 518028;3.桂林医学院附属医院超声医学科,广西 桂林 541001;5.河源市人民医院超声科,广东 河源 517000)
脑桥介于中脑和延髓之间,是将感觉和运动信息自前脑传递至小脑的重要中转站,对维持人体功能具有重要作用[1]。脑桥易为脑干病变累及,也是脑皮质发育异常相关畸形常见部位[2-3]。既往研究[4]多通过分析脑桥弯曲度及形态学变化而评估其发育,如有学者[3,5]基于MRI测量脑桥面积、前后径、上下径、基底部面积及前后径以评估脑部发育。本研究观察胎儿颅脑正中矢状位MRI脑桥生物学指标与孕周的相关性。
1 资料与方法
1.1 研究对象 回顾性分析2018年6月—2023年6月于深圳市妇幼保健院因产前超声疑诊发育异常而接受MR检查的226胎正常胎儿(正常组),孕妇年龄22~47岁、平均(32.9±4.6)岁,孕周23~38周(根据孕妇末次月经或早孕期超声确定孕周)、平均(31.8±3.1)周。纳入标准:①胎儿产前超声及MR检查均未见明显中枢神经系统异常;②孕妇无中枢神经系统相关疾病。排除标准:①胎儿颅脑正中矢状位MRI显示结构不清;②基因检测显示异常;③合并感染。另选取产前超声检查与MRI结果一致的17胎孕24~33周中枢神经系统异常胎儿(异常组),含1胎脑桥小脑发育不全(pontocerebellar hypoplasia, PCH)、12胎胼胝体发育异常(dysplasia of the corpus callosum, DCC)及4胎小脑发育异常(cerebellar hypoplasia, CH)。本研究获院医学伦理委员会批准(SFYLS[2022]068)。检查前孕妇及家属均签署知情同意书。
1.2 仪器与方法 采用Philips Achieva 1.5T MR仪、16通道相控阵体线圈扫描胎儿。嘱孕妇仰卧、头先进,以二维快速稳态进动序列进行扫描;参数:TR 4.6 ms,TE 2.3 ms,层厚5 mm,层间距0,FA 90°,矩阵268×289;之后采集快速自旋回波T2WI,TR 2 000 ms,TE 100 ms,层厚5 mm,层间距0,FA 85°,矩阵288×236,NSA 2。
1.3 分析图像 由2名工作15年以上的影像科副主任医师以盲法阅片,采用湖南大学自主研发的ultrasoniclabel软件(分辨率为0.01 mm)放大于正中矢状位T2WI中测量脑桥生物学指标:①脑桥前后径(pons anteroposterior diameter, PAD),脑桥前缘最凸点至第四脑室底部中点之间的距离;②脑桥截面积(total pons area, TPA),沿脑桥轮廓手动勾画ROI,软件自动计算获得TPA;③脑桥基底部前后径(anteroposterior length, AP),脑桥基底部腹侧前缘中点至背侧中点之间的距离;④脑桥基底部上下径(cranio-caudal length, CC),脑桥基底部纵轴最长距离;⑤脑桥基底部截面积(basis pontis area, BPA),沿脑桥基底部椭圆形轮廓手动描绘ROI,软件自动获得BPA;⑥中脑脑桥角(pontine angle of midbrain, MAP),以脑桥与中脑的交汇点作为中心点、中脑腹侧前缘(距中心点约3 mm处)为另1点确定1条直线,以中心点为定点,向中脑-脑桥交界面做切线确定另1直线,以2条直线之间的夹角为MAP。以上参数均测量至少2次,取平均值进行统计。见图1。

图1 测量脑桥生物学指标示意图 A.颅脑正中矢状位MR T2WI; B.局部放大图示测量PAD(白线)和TPA(红色区域); C.局部放大图示测量AP及CC(白线)、BPA(红色区域); D.局部放大图示测量MAP
1.4 统计学分析 采用SPSS 23.0统计分析软件。以Kolmogorov Smirnov检验及直方图评估脑桥生物学指标的正态性,以±1.96s法描述不同孕周正常胎儿脑桥生物学指标的95%分布范围。随机抽取正常组50胎及异常组10胎胎儿,以Pearson相关分析判断2名医师测量脑桥生物学指标结果的一致性:r≤0.2为一致性较差,0.2
2 结果
2.1 一致性分析 2名医师测量PAD、TPA、AP、CC及BPA结果的一致性强(r均>0.956,P均<0.001),测量MAP结果的一致性较强(r=0.798,P<0.001)。
2.2 相关性分析 不同孕周正常组胎儿脑桥生物学指标分布情况见表1。正常组胎儿PAD、TPA、AP、CC及BPA均与孕周呈线性正相关(r=0.887、0.914、0.787、0.866、0.865,P均<0.001),拟合线性回归方程(P均<0.001)见表2;而MAP与孕周无明显相关(r=-0.23,P>0.05)。
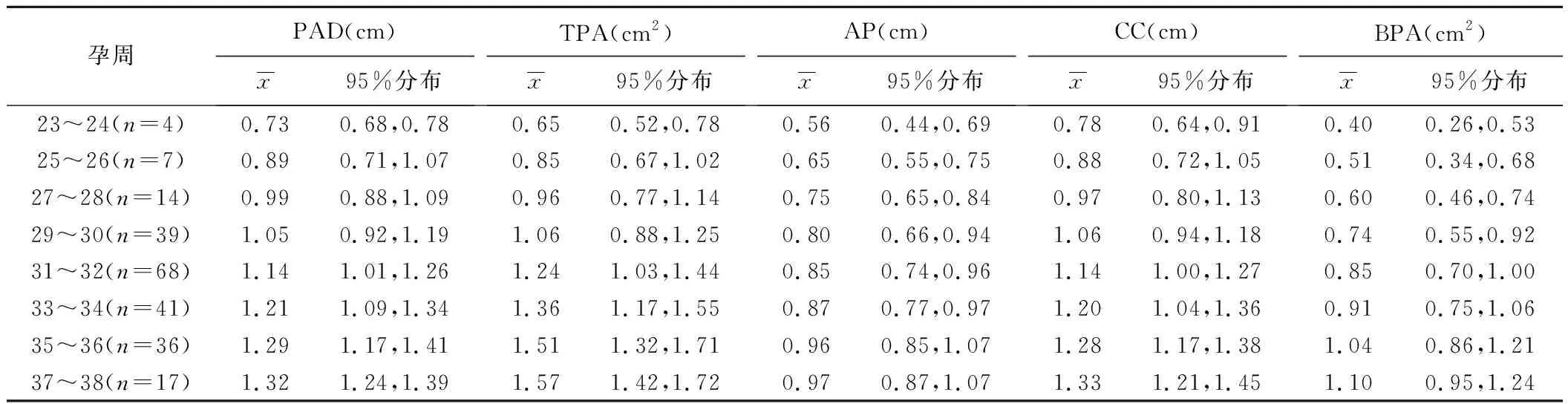
表1 不周孕周正常组胎儿脑桥生物学指标分布情况

表2 正常组胎儿脑桥生物学指标随孕周变化的线性回归方程
2.3 判断异常组胎儿脑桥发育 17胎中,8胎PAD异常, 8胎TPA异常,14胎AP、3胎CC、 11胎BPA异常。见表3及图2。

表3 17胎中枢神经系统异常胎儿脑桥生物学指标及妊娠结局

图2 异常组胎儿颅脑矢状位MRI A.序号15胎儿,孕33周,T2WI示胼胝体缺失(黑箭),脑桥(白箭)PAD(0.96 cm)、AP(0.69 cm)低于其95%分布范围; B.序号3胎儿,孕30周,T2WI示小脑发育不良(黄箭),脑桥(白箭)PAD(0.84 cm)、TPA(0.81 cm)、AP(0.52 cm)、BPA(0.43 cm)均低于其95%分布范围; C.序号17胎儿,孕25周,T2WI示胎儿小脑(黄箭)体积明显缩小,脑桥(白箭)明显发育不良,无法测量
3 讨论
脑桥分为腹侧宽阔膨隆的基底部和背侧的被盖部;基底部由大量桥横纤维和部分纵行纤维及脑桥核(ponti nucleus, PN)组成,发育更快、更突出[6],而被盖部主要由脑桥网状结构组成。PN位于脑桥基底部纵横纤维之间,是传递大脑皮质信息至小脑的重要中转站,且与上丘、下丘、脊髓、间脑等部位均有复杂纤维联系,对各类感觉信息具有整合作用[7]。脑桥基底部发出的脑桥小脑纤维向后外形成小脑中脚,与小脑发育密切相关[8]。胎儿期脑桥发育异常可致PCH、脑桥萎缩及脑桥被盖帽发育不良等,出现发育迟缓、痉挛、肌张力低下、呼吸衰竭及动眼肌功能障碍等临床表现[9]。
颅脑正中矢状位MRI能较完整地显示后脑和脑干,有利于观察间脑、中脑及脑桥与延髓的关系和测量脑桥相关参数。本研究2名医师测量PAD、TPA、AP、CC、BPA的一致性强,而受中脑腹侧前缘脑脊液模糊效应的干扰,测量MAP的一致性较强;颅脑正中矢状位MRI中,正常组孕23~38周胎儿脑桥PAD、TPA、AP、CC及BPA均随孕周增长而呈线性增长,与既往研究[3-5]结果基本一致,而MAP则与孕周无明显相关。正常胎儿脑桥发育特点:①BPA增长速度较快,孕37~38周时BPA为孕23~24周时BPA的2.75(1.10/0.40)倍,可能与基底部PN细胞数量显著增加有关;②CC始终大于AP,CC增长速度较AP快,表明脑桥基底部纵向发育较横向发育更有优势;③MAP相对稳定,不随孕周增加而改变,可作为评估脑桥发育的初步手段;④AP与BPA可较敏感地反映脑桥异常发育,能用于客观评价脑桥基底部膨隆缩小、变平或消失等形态特征,推荐以AP与BPA作为评估脑桥发育异常高危胎儿的参考指标。
PCH是一组常染色体隐性遗传病,具有小脑和脑桥发育不全和变异性萎缩的神经退行性变病理特征;MRI多表现为脑桥腹侧平直,与脑桥基底部神经元和横向交叉纤维缺失有关,但此表现并不能作为诊断PCH的标准[10-11]。胼胝体变薄亦是多种亚型PCH(如PCH9)的共同表现,与大脑半球白质减少有关[4]。胎儿PCH9可致严重神经退行性疾病,出生后可发生进行性小头畸形,严重者整体发育迟缓,患儿多早期死亡[12-13]。本研究17胎中枢神经系统异常胎儿均未合并其他系统明显畸形,试验性诊断发现AP异常频次最高而BPA次之,提示AP及BPA是评估脑桥异常的较敏感指标,而脑桥基底部发育影响整个脑桥发育。本组PCH胎儿脑桥明显受累、部分DCC及CH胎儿脑桥发育异常,原因在于脑桥和小脑为后脑的主要结构,二者关系密切,交叉的脑桥轴突和PN数量减少使脑桥体积减小,提示脑桥发育可能与小脑和胼胝体发育有关,胎儿期小脑及脑桥同时受累多预后较差[14]。临床遇CH及DCC胎儿时,需仔细观察脑桥发育有无异常。
综上,胎儿颅脑正中矢状位MRI所示脑桥生物学指标(PAD、TPA、AP、CC、BPA)与孕周均呈正相关,可用于评估胎儿脑桥发育。但本研究为单中心回顾性分析,且正常组不同孕周胎儿分布不均,而脑桥发育异常胎儿较少,有待后续进一步完善。
利益冲突:全体作者声明无利益冲突。
作者贡献:侯伶秀研究设计和实施、图像分析、数据处理和分析、撰写文章;刘炳光指导、图像分析、图像处理;袁鹰和廖伊梅经费支持、修改文章;朱巧珍、郭洪波、谭莹、温慧莹和严芳查阅文献、修改文章;李胜利指导、研究设计、审阅文章。

