超声微血管成像联合血管内皮生长因子诊断胎儿生长受限
田 捧,管秀娟,董孝贞,孟欣雨,张红彬,栗河舟
(郑州大学第三附属医院超声科,河南 郑州 450052)
胎盘是胎儿与母体交换营养物质的重要枢纽。血管内皮生长因子(vascular endothelial growth factor, VEGF)对胎盘形成早期血管发生、绒毛内脉管系统形成、维持血管稳定性和通透性具有重要作用,可促进母胎间营养物质交换[1-2]。胎盘绒毛血管发育异常可影响胎儿从母体吸收营养物质[3-4]而致胎儿生长受限(fetal growth restriction, FGR)并造成围产儿畸形、增加死亡率,还可能引发神经系统发育缺陷,增加其出生并成年后发生心血管及代谢性疾病的风险[5-6]。早期诊断FGR至关重要。微血管成像(microvascular flow imaging, MV-Flow)可显示胎盘微血管结构并对其进行定量评估。本研究观察MV-Flow联合孕妇血清VEGF表达水平诊断FGR的价值。
1 资料与方法
1.1 研究对象 前瞻性纳入2021年11月—2023年2月郑州大学第三附属医院经产前超声诊断为胎儿生长受限的87例单胎妊娠孕妇(FGR组),年龄19~44岁、平均(30.3±6.6)岁;孕次1~3次、中位1.5(1.0,2.0)次;超声检查孕周20~38周、平均(29.2±4.9)周;其中43例孕周<28周(<28周亚组)、44例孕周≥28周(≥28周亚组);均符合第9版《妇产科学》诊断FGR标准[7]:胎儿生长潜能受损,估测胎儿体质量小于同孕周第10百分位。纳入标准:①自然受孕,既往月经规律,末次月经准确,且能提供孕早期胎儿头臀径超声报告以供进一步核实孕周;②胎儿无结构畸形、染色体和基因等异常;③孕妇无高血压、糖尿病、心脏病等,无不良孕产史。同期纳入112名常规产前接受超声检查的单胎妊娠孕妇(对照组),年龄19~42岁、平均(29.8±5.2)岁;孕次1~3次、中位1.5(1.0,2.0)次;超声检查孕周20~39周、平均(30.1±5.4)周;其中55名孕周<28周、57名孕周≥28周。本研究经院伦理委员会批准(2023-145-01),检查前所有孕妇均签署知情同意书。
1.2 仪器与方法 采用Samsung HERAW10彩色多普勒超声诊断仪,频率2.0~9.0 MHz CA2-9A凸阵探头。嘱孕妇仰卧,由2名具有5年以上产科超声诊断经验的超声科医师系统筛查胎儿结构,排除结构畸形;于孕妇平静呼吸状态下采用MV-Flow技术以椭圆形描记方式自动描记胎盘上、中、下段ROI,测量微血管指数(microvascular index, MVI);每名医师测量2次,取均值作为最终结果。
1.3 测定VEGF 于超声检查次日清晨空腹采静脉血,以酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒(北京晶美生物工程有限公司)测定孕妇血清VEGF表达水平。于分娩后立即避开梗死及钙化灶切取胎盘中央母体面2 cm×2 cm×2 cm组织,采用蛋白质印迹法(Western blotting, WB),以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参,检测胎盘组织VEGF相对表达水平。
1.4 统计学分析 采用SPSS 26.0和 MedCalc 22.0统计分析软件。以±s表示符合正态分布的计量资料,组间行两独立样本的t检验;以中位数(上下四分位数)表示不符合正态分布的计量资料,组间行Mann-WhitneyU检验。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC)。以DeLong检验比较胎盘MVI、孕妇血清VEGF及二者联合诊断FGR的AUC差异。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 组间孕妇年龄(t=0.41,P=0.67)、孕次(Z=0.63,P=0.53)、超声检查时孕周(t=0.87,P=0.38)差异均无统计学意义。FGR组8例足月产、79例早产,11例自然分娩、76例接受剖宫产;对照组108名足月产、4名早产,75名自然分娩、37名接受剖宫产。FGR组胎儿中位出生孕周为32.0(30.0,34.0)周,对照组为39.0(38.0,39.0)周,前者小于后者(Z=-8.38,P<0.01);FGR组新生儿中位出生体质量为1 588.20(1 387.50,1 712.50)g,对照组为3250.00(3050.00,3462.50)g,前者小于后者(Z=-8.62,P<0.01)。
2.2 胎盘MVI FGR组2亚组胎盘MVI均低于对照组(P均<0.01),见表1及图1、2。
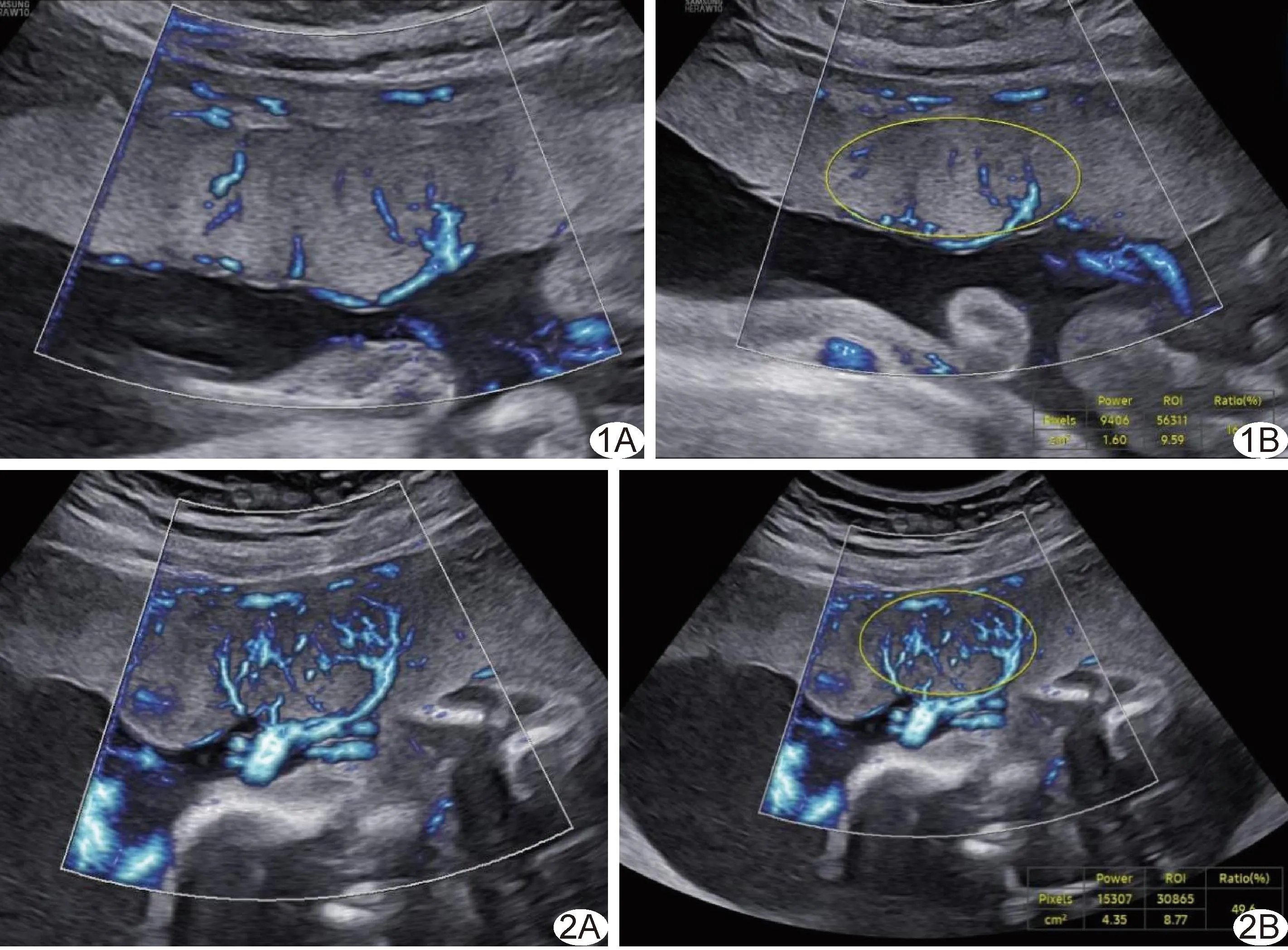
图1 FGR组孕25周胎儿 A、B.以MV-Flow技术测量胎盘微血流灌注显示MVI=16.7% 图2 对照组孕24周胎儿 A、B.以MV-Flow技术测量胎盘微血流灌注显示MVI=49.6%

表1 不同孕周FGR组与对照组胎盘MVI和孕妇血清VEGF表达水平比较
2.3 VEGF表达水平 FGR组2亚组孕妇血清VEGF表达水平均低于对照组(P均<0.01),见表1。FGR组胎盘组织VEGF相对表达量明显低于对照组(t=104.80,P<0.01),见图3。
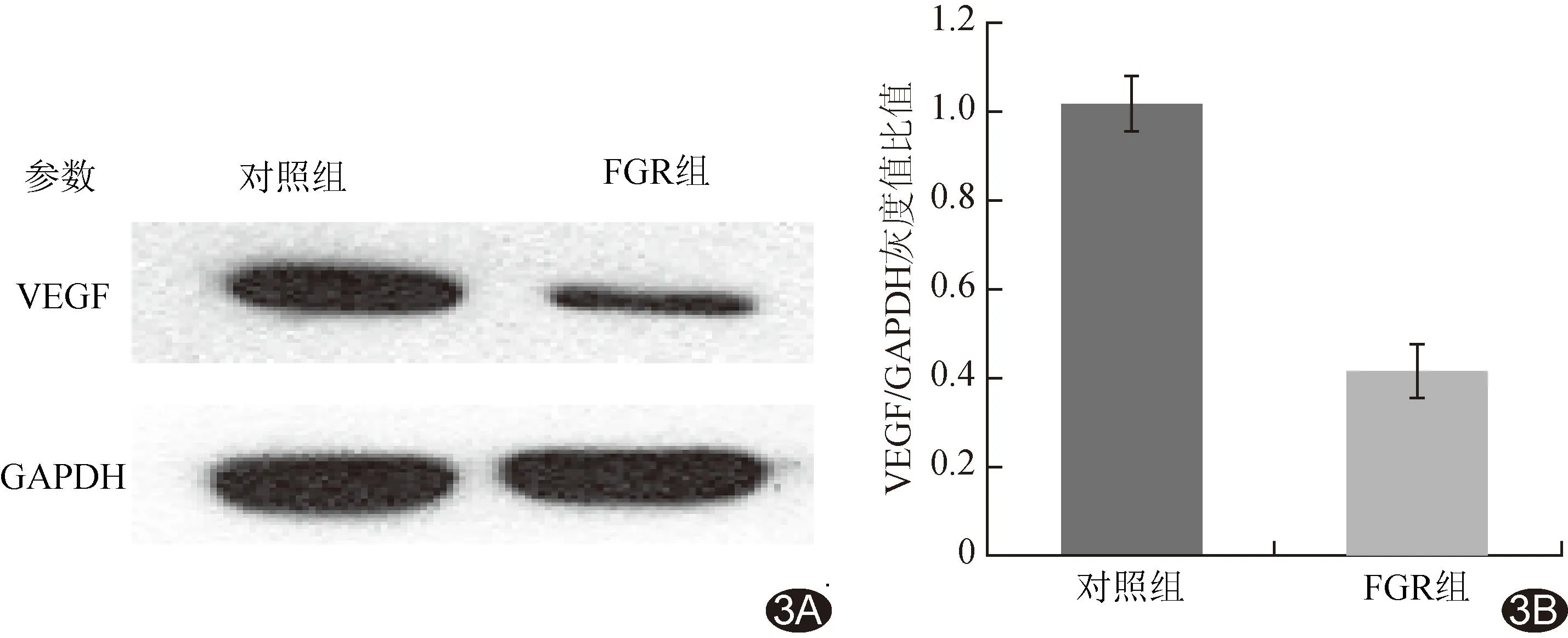
图3 WB法测量对照组与FGR组胎盘VEGF相对表达量 A.电泳图; B.柱状图
2.4 胎盘MVI、孕妇血清VEGF及二者联合诊断FGR 以胎盘MVI、母体血清VEGF及二者联合诊断<28周FGR的AUC分别为0.981、0.870和0.997,诊断≥28周FGR的AUC分别为0.991、0.867和0.993。在孕周<28周及≥28周亚组,以单一孕妇血清VEGF诊断FGR的AUC均低于胎盘MVI及孕妇血清VEGF联合胎盘MVI(<28周亚组:P=0.04、0.01;≥28周亚组:P=0.01、0.01),而后二者AUC均无统计学差异(<28周亚组:P=0.15;≥28周亚组:P=0.37)。见表2及图4。

图4 胎盘MVI、孕妇血清VEGF及二者联合诊断FGR的ROC曲线 A.<28周亚组; B.≥28周亚组
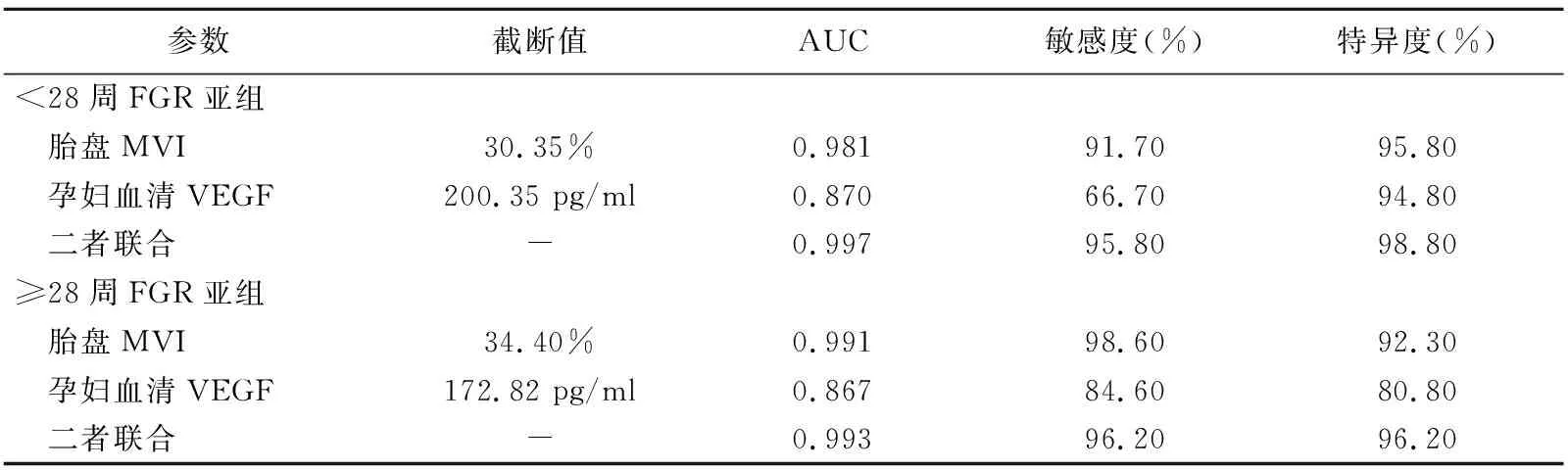
表2 胎盘MVI、孕妇血清VEGF及二者联合诊断FGR的效能
3 讨论
胎盘是联系胎儿与母体的重要器官,胎盘血流状态异常可致胎儿获取能量不足而生长受限[8]。多种细胞因子参与调控胎盘血管生成过程,VEGF是其中最有效的促血管生长因子,作用于胎盘血管内皮细胞上的相应受体,通过刺激内皮细胞迁移、生长而调控胎盘血管生成[9];VEGF表达异常可影响胎盘血管网发育障碍而使胎盘功能损伤。既往研究[10]显示,VEGF表达水平降低将使滋养细胞与新生血管减少,造成螺旋小动脉管腔变窄、胎盘血流量降低而致FGR。
MV-Flow技术基于时空相干原理显示组织或病变内的低速血流,可通过测量MVI显示ROI内血管分布及占比,进而量化评估多种器官内微血流灌注情况[11-12]。CHEN等[13]研究发现MV-Flow技术具有识别胎盘微血管的能力,可评估胎盘床微血管结构,用于监测正常及生长受限胎儿均具有较高可行性及临床价值。母体血清及胎盘组织中VEGF异常表达所致胎盘血管生成减少可在声像图中表现为胎盘微血管分布异常而致MVI测值出现异常。牛梓涵等[14]同样发现以MV-Flow技术所测MVI与FGR高度相关 。
本研究FGR组内2亚组胎盘MVI和孕妇血清VEGF表达水平均明显低于对照组,其低表达VEGF使胎盘血管生成减少,声像图显示血流信号分布稀疏且MVI低于对照组;分娩后针对胎盘中央母体面组织的检测结果进一步提示VEGF在FGR胎盘组织中低表达而致胎盘血管发育障碍,使胎盘供血供氧能力下降,影响营养物质在母胎间的转运。进一步分析显示,28周前2组孕妇血清VEGF表达水平均高于28周后;且相同孕周比较,FGR组孕妇血清VEGF表达水平始终低于对照组,由此可推测VEGF在不同时期具有不同作用:其于孕早期主要参与血管发生及绒毛脉管系统发育,而在孕中晚期则主要参与维持血管通透性及稳定性,以保证胎盘血流灌注。
综上所述,胎盘MVI和孕妇血清VEGF均可用于筛查FGR,而前者MVI更具价值。本研究的主要局限性:为单中心研究,样本量较小,未能根据孕周进行更细致的对比分析;ROC曲线分析显示孕妇血清VEGF诊断FGR的AUC低于胎盘MVI及二者联合,而后二者AUC差异无统计学意义,原因可能在于VEGF在不同孕期具有不同作用,有待未来扩大样本量进一步验证。
利益冲突:全体作者声明无利益冲突。
作者贡献:田捧查阅文献、研究设计和实施、 撰写和修改文章;管秀娟、董孝贞研究实施;孟欣雨图像处理、数据分析;张红彬统计分析;栗河舟指导、审阅文章、经费支持。

