临床及CT影像组学特征预测胃癌微卫星高度不稳定状态
詹鹏超,李莉明,吕东博,罗成龙,胡志伟,梁 盼,高剑波
(郑州大学第一附属医院放射科,河南 郑州 450052)
胃癌在我国的发病率和死亡率均位居癌症第三[1];多数患者就诊时已丧失接受根治性手术机会。免疫治疗可为晚期胃癌患者带来显著生存获益[2],但仅部分胃癌可对免疫治疗产生反应。微卫星高度不稳定(microsatellite instability-high, MSI-H)是评估抗程序性死亡受体1(programmed death-1, PD-1)用于免疫治疗胃癌效果的重要生物标志物,已有研究[3]证实MSI-H阳性胃癌客观缓解率和患者生存率明显优于阴性者。目前主要通过对经内镜活检或手术切除标本进行免疫组织化学或聚合酶链反应(polymerase chain reaction, PCR)分析评估MSI状态[4],有创、成本高且耗时。CT已广泛用于术前诊断胃癌及评估疗效[5]。影像组学可通过全面挖掘图像特征并与医疗大数据结合而定量描述肿瘤生物学特征[6-7],且CT影像组学特征与MSI状态具有一定相关性[8]。本研究构建临床-CT影像组学模型,观察其评估胃癌MSI-H状态的价值。
1 资料与方法
1.1 研究对象 回顾性分析2017年1月—2022年6月郑州大学第一附属医院150例胃癌患者,男115例、女35例,年龄27~83岁、中位年龄63.2(55.7,70.0)岁;30例MSI-H阳性、120例MSI-H阴性。按7∶3比例将患者分为训练集(n=105,MSI-H阳性21例、阴性 84例)和验证集(n=45,MSI-H阳性9例、阴性36例)。纳入标准:①经活检或手术病理确诊胃癌;②CT检查前未接受放射、化学治疗或其他抗肿瘤治疗。排除标准:①未接受多重荧光定量PCR检测;②CT图像质量不佳,无法准确评估肿瘤。记录患者年龄、性别、肿瘤位置,以及糖类抗原(carbohydrate antigen, CA)19-9、CA72-4及癌胚抗原(carcinoembryonic antigen, CEA);根据国际抗癌联盟及美国肿瘤联合会第8版胃癌TNM分期指南评估胃癌临床T分期和N分期。本研究获院伦理委员会批准(2021-KY-1070-002),检查前患者均知情同意。
1.2 评估MSI状态 采用多重荧光PCR结合毛细管电泳测序方法,以PCR对特定微卫星序列进行扩增,再测序比较肿瘤组织与非瘤组织微卫星序列长度,判断位点稳定状态;检测位点主要包括BAT-25、BAT-26、NR-21、NR-24及MONO-27,以2个及以上微卫星位点不稳定为MSI-H阳性,否则为阴性。
1.3 仪器与方法 采用GE Revolution CT机或Siemens Somatom Force CT机。嘱患者检查前禁食8~12 h,检查前5~10 min内饮用800~1 000 ml温水。嘱患者仰卧,行腹部平扫,管电压120 kVp,自动管电流(240~450 mA或100~250 mA),球管旋转时间0.6 s或0.5 s;之后经肘静脉以流率3.0~3.5 ml/s团注碘海醇(350 mgI/ml)1.5 ml/kg体质量,分别延迟 30、70 s获得动脉期和静脉期图像,层厚、层间距均为5 mm,并以标准算法重建图像。
测量轴位图像中肿瘤垂直于胃壁周缘的最长径(肿瘤最厚径,图1A)及其在最大截面上的最长径(图1B)。记录肿瘤强化方式和强化程度:以静脉期与平扫期CT值差值≥40 HU为明显强化,<40 HU为轻-中度强化)。
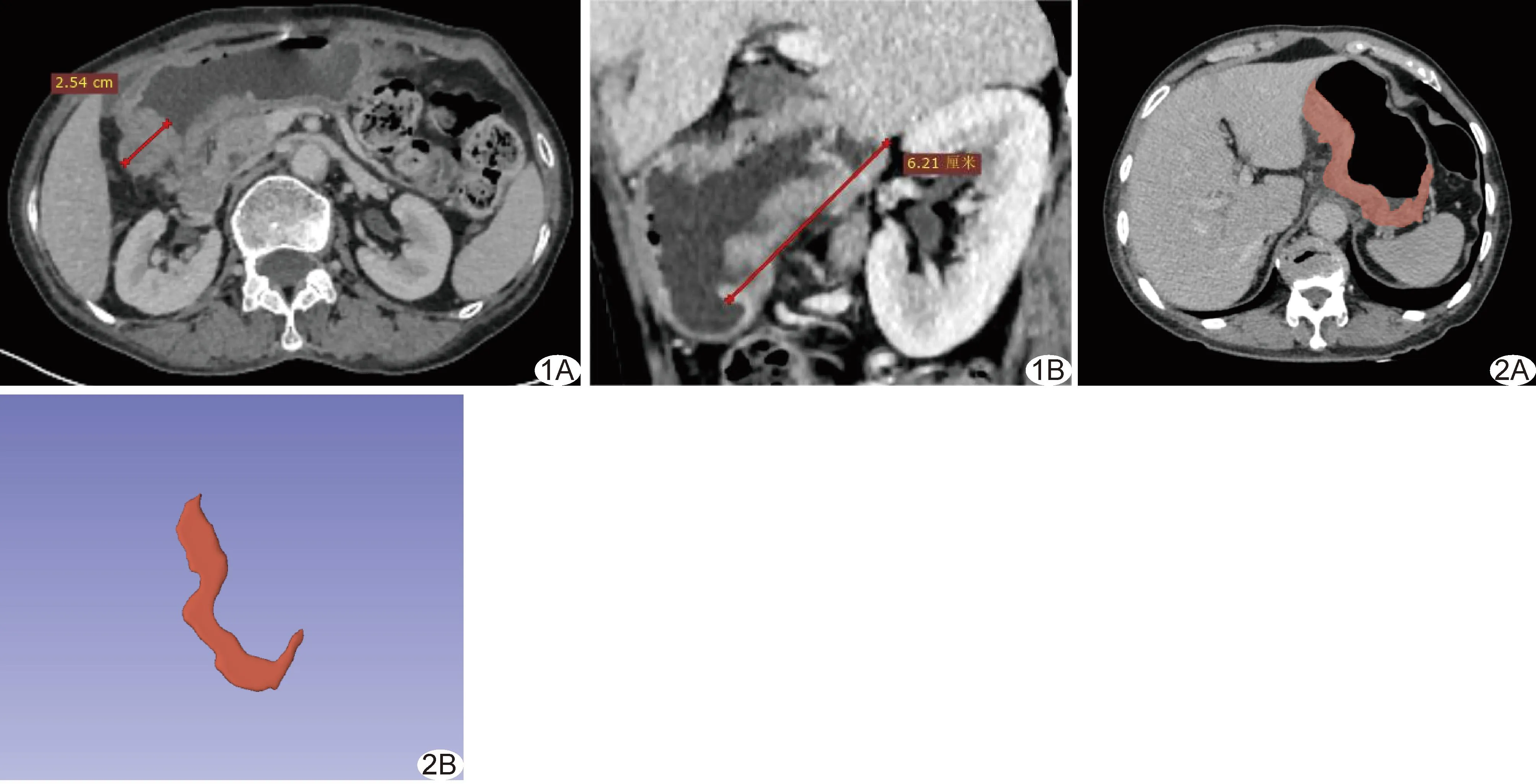
图1 测量胃癌径线示意图 A.基于腹部轴位图测量肿瘤最厚径(红线); B.基于肿瘤最大截面(本例为矢状面)测量肿瘤最长径(红线) 图2 勾画胃癌ROI示意图 A.手动于静脉期CT图中肿瘤最大横截面勾画ROI; B.融合后的3D ROI示意图
1.4 病灶分割和特征提取 将静脉期CT图像上传至图像开源处理软件3D Slicer 5.0.2(https://www.Slicer.org/)。随机选择30例,由2名具有5年以上腹部疾病诊断经验的放射科医师分别于肿瘤最大横截面及其相邻上、下层面沿肿瘤边缘逐层勾画并融合生成3D ROI图像(图2),提取其影像组学特征;计算2名医师提取结果的组内相关系数(intra-class correlation coefficient, ICC)。对其余20例由其中1名医师勾画ROI、另1名医师复核,意见不一时协商后重新分割。于每个ROI中提取851个影像组学特征,包括18个一阶特征、14个形状特征、75个纹理特征及744个小波特征。
1.5 筛选特征 以单因素分析将训练集和验证集中MSI-H阳性与阴性患者间差异均有统计学意义的临床及影像学特征作为预测因子;筛选影像学特征,保留观察者间ICC≥0.75者(即稳定特征),以最大相关最小冗余(max-relevance and min-redundancy, mRMR)算法进行筛选,采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法经过10折交叉验证选出具有低共线性的最优特征子集;构建影像组学标签,将加权系数相加,计算影像组学评分(Radscore)。
1.6 模型建立并评估其效能 针对训练集,采用logistic回归分析分别基于临床预测因子和Radscore构建临床模型、影像组学模型及二者联合的临床-影像组学列线图模型。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,以曲线下面积(area under the curve, AUC)及准确率等指标评估模型效能,并以DeLong检验比较AUC。绘制校准曲线,观察模型预测概率与真实概率的一致性;采用Hosmer-Lemeshow拟合优度检验评估模型是否存在过拟合;以绘制决策曲线评估模型能否带来临床净获益。
2 结果
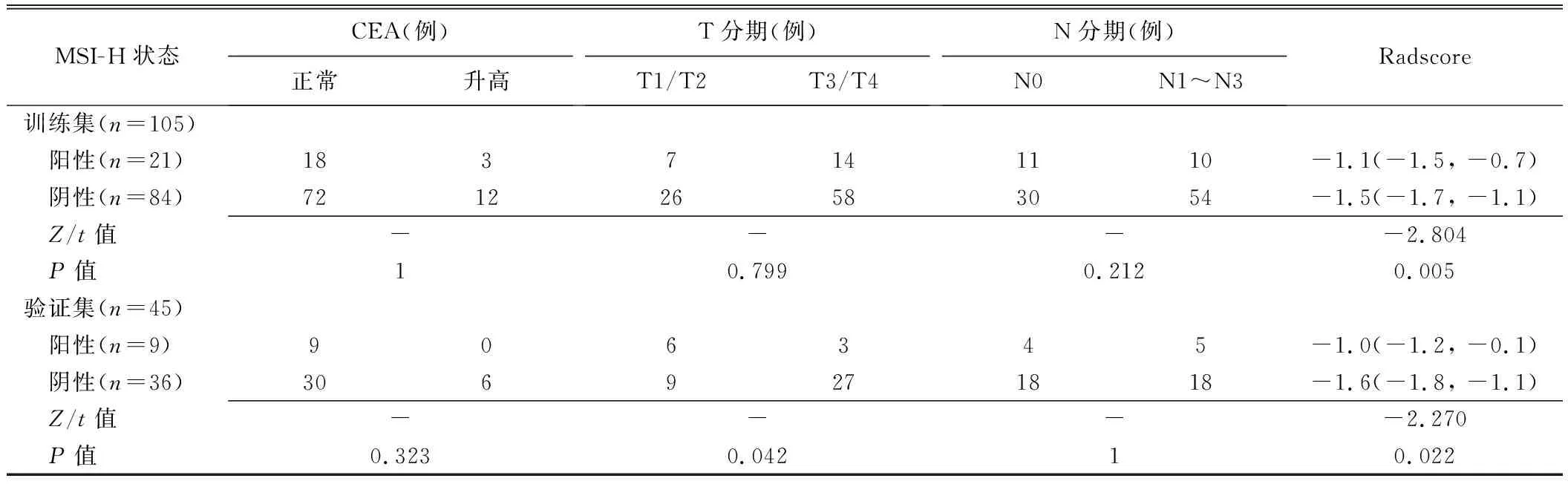
2.1 临床资料 训练集和验证集MSI-H阳性与阴性胃癌位置差异均有统计学意义(P均<0.05)。见表1。

表1 MSI-H阳性与阴性胃癌患者临床资料及病灶CT表现
续表
2.2 影像组学特征 最终选出5个最优特征并以之构建影像组学标签,包括3个纹理特征和2个小波特征(图3和表2)。训练集和验证集中,MSI-H阳性肿瘤的Radscore均高于阴性(P均<0.05),见表1。

表2 胃癌5个最优CT影像组学特征
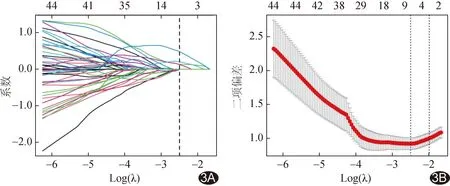
图3 筛选胃癌最优影像组学特征 A.以LASSO回归筛选胃癌影像组学特征; B.通过10折交叉验证确定调优参数λ,并得到5个非零系数特征
2.3 模型效能 分别基于肿瘤位置和Radscore建立临床模型和CT影像组学模型,以及临床-CT影像组学列线图模型(图4)。临床模型、CT影像组学模型及临床-CT影像组学联合模型评估训练集胃癌MSI-H状态的AUC分别0.760、0.799及0.864,在验证集分别为0.735、0.812及0.849;联合模型的AUC均大于2种单一模型(P均<0.05)。见表3和图5。
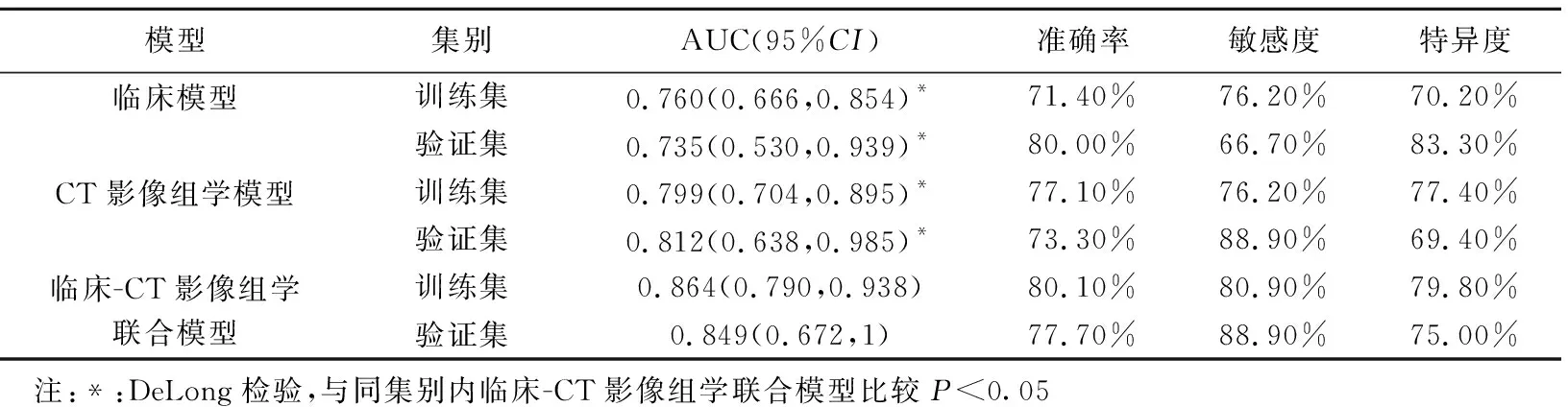
表3 各模型评估训练集和验证集胃癌MSI-H状态的效能
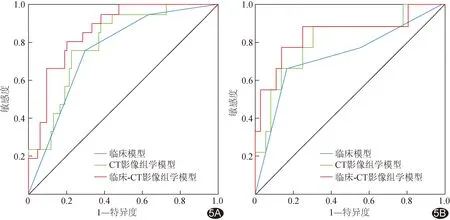
图5 临床、CT影像组学及临床-CT影像组学联合模型评估胃癌MSI-H状态的ROC曲线 A.训练集; B.验证集
Hosmer-Lemeshow拟合优度检验及校准曲线显示,临床-CT影像组学联合模型拟合良好(训练集P=0.815,验证集P=0.607),其预测结果与实际结果一致性良好;决策曲线显示联合模型可带来临床净获益(图6)。
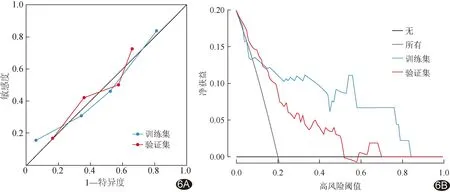
图6 临床-CT影像组学联合模型模型评估胃癌MSI-H状态的校准曲线(A)及决策曲线图(B)
3 讨论
为适应精准医疗的发展,胃癌分型正在从传统组织病理学向分子分型过渡。MSI分型对评估免疫治疗效果及预后具有重要价值,且国内外多项指南和共识均明确推荐对胃癌免疫治疗前先行MSI检测[9-10]。病理学评估MSI状态有创,且成本偏高;而基于CT的影像组学可定量挖掘肿瘤高通量特征,为无创评估MSI状态提供新的手段[11-12]。
本研究发现,MSI-H阳性与阴性胃癌位置不同,前者更好发于胃窦部,可能与不同部位暴露环境存在不同致癌物有关。既往研究[13-14]报道MSI-H型阳性胃癌多见于女性,且肿瘤最长径较大。本研究所见与之不符,可能与样本量差异有关。
影像组学用于预测肿瘤MSI状态前景广阔。PEI等[15]结合临床与CT影像组学特征构建的联合预测模型可有效区分MSI-H阳性与阴性结直肠癌,其在训练集和验证集中的AUC分别为0.74和0.77。LIANG等[16]构建的CT影像组学模型预测训练集与验证集胃癌MSI状态的AUC分别为0.823和 0.760。本研究结果显示,MSI-H阳性与阴性胃癌Radscore差异有统计学意义;临床-CT影像组学联合模型预测胃癌MSI-H状态的AUC在训练集和验证集分别为0.864和0.849,均高于单一模型,且高于上述研究[15-16];Hosmer-Lemeshow拟合优度检验、校准曲线和决策曲线显示联合模型拟合良好,可用于预测胃癌MSI-H状态,并带来临床净获益。
综上所述,临床-CT影像组学特征联合可有效预测胃癌MSI-H状态。本研究的主要局限性:①为单中心、回顾性研究;②样本量有限,且MSI-H阳性率偏低,导致样本分布不均;有待后续加以完善。
利益冲突:全体作者声明无利益冲突。
作者贡献:詹鹏超研究设计和实施、统计分析、撰写和修改文章;李莉明图像分析、数据分析;吕东博研究实施、图像处理;罗成龙、胡志伟图像处理;梁盼图像分析 、指导;高剑波图像分析、指导、经费支持。

