基于乳腺二维超声及自动乳腺容积扫描构建影像组学及列线图模型预测乳腺癌分子分型
周汇明,肖际东,刘梦涵,聂淼淼,戴美雪
(中南大学湘雅三医院超声科,湖南 长沙 410013)
乳腺癌可分为Luminal型与非Luminal型[1],术前精准预测乳腺癌分子分型具有重要临床意义[2-3]。影像组学可通过无创、定量分析医学图像特征而反映肿瘤内部情况[4-6]。本研究观察基于二维超声及自动乳腺容积扫描(automated breast volume scanner, ABVS)构建的影像组学模型及列线图模型预测乳腺癌分子分型的价值。
1 资料与方法
1.1 研究对象 回顾性分析2020年1月—2022年6月326例于中南大学湘雅三医院经病理证实的女性单发乳腺癌患者,年龄28~82岁、平均(50.8±9.8)岁,术前均接受乳腺超声及ABVS检查,临床及影像学资料完整;按8∶2比例将其分为训练集(n=260)与验证集(n=66),分别含Luminal亚组172例及非Luminal亚组88例,以及Luminal亚组44例及非Luminal亚组22例[7-9]。排除标准:①图像质量达不到诊断要求;②检查前接受乳腺手术、化疗或放射治疗(放疗);③合并其他恶性肿瘤。本研究经院伦理委员会批准(快I 22167)。
1.2 仪器与方法 采用Siemens Acuson S2000 ABVS超声仪,频率5.0~18.0 MHz 18L6HD探头及5.0~14.0 MHz 14L5BV探头,最大扫描容积15.4 cm×16.8 cm×6.0 cm。嘱患者仰卧,充分暴露双侧乳房;依次扫查双侧乳房正中位、外侧位及内侧位;将图像上传至数据处理系统并进行三维重建。由2名分别具有10年及18年超声诊断经验的医师(医师1、2)共同评估图像,记录肿瘤最大径、形态、边缘、内部回声、后方回声、生长方向,以及有无强回声晕(病灶周围由厚薄不均的强回声包绕)、汇聚征(病灶周围条索状中-高回声与条状低回声交错,向四周放射呈“星芒状”)、钙化、侵犯周围组织、血流信号及腋窝淋巴结转移等;意见不一致时由另1名具有20年超声诊断经验的主任医师决定。见图1。
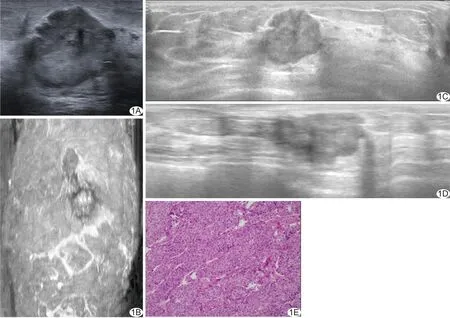
图1 患者女,54岁,左乳浸润性导管癌 A~D.二维声像图(A)及冠状面(B)、横切面(C)、矢状面(D)ABVS图示左乳内上象限11点方向低回声结节; E.病理图示肿瘤细胞呈巢团状排列,瘤细胞细胞质丰富,嗜酸性,核卵圆形,部分核异型,偶见核分裂象(HE,×100)
1.3 提取及筛选特征 将二维超声图像导入ITK-SNAP 3.8软件、ABVS图像导入3D Slicer 4.11软件,由医师1、2分别沿肿瘤边缘手动勾画ROI,提取其影像组学特征;以组内相关系数(intra-class correlation coefficient, ICC)评估观察者间一致性,保留ICC≥0.75的特征。采用Pyradiomics软件提取二维超声及ABVS图像的一阶特征、形状特征及纹理特征;以Z-Score法行标准化;采用Pearson相关系数评估各特征的相关性(对│r│>0.9者仅保留其一);利用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法及10折交叉验证筛选与乳腺癌分子分型相关的非零系数特征;基于影像组学特征系数线性加权计算影像组学评分。见图2。
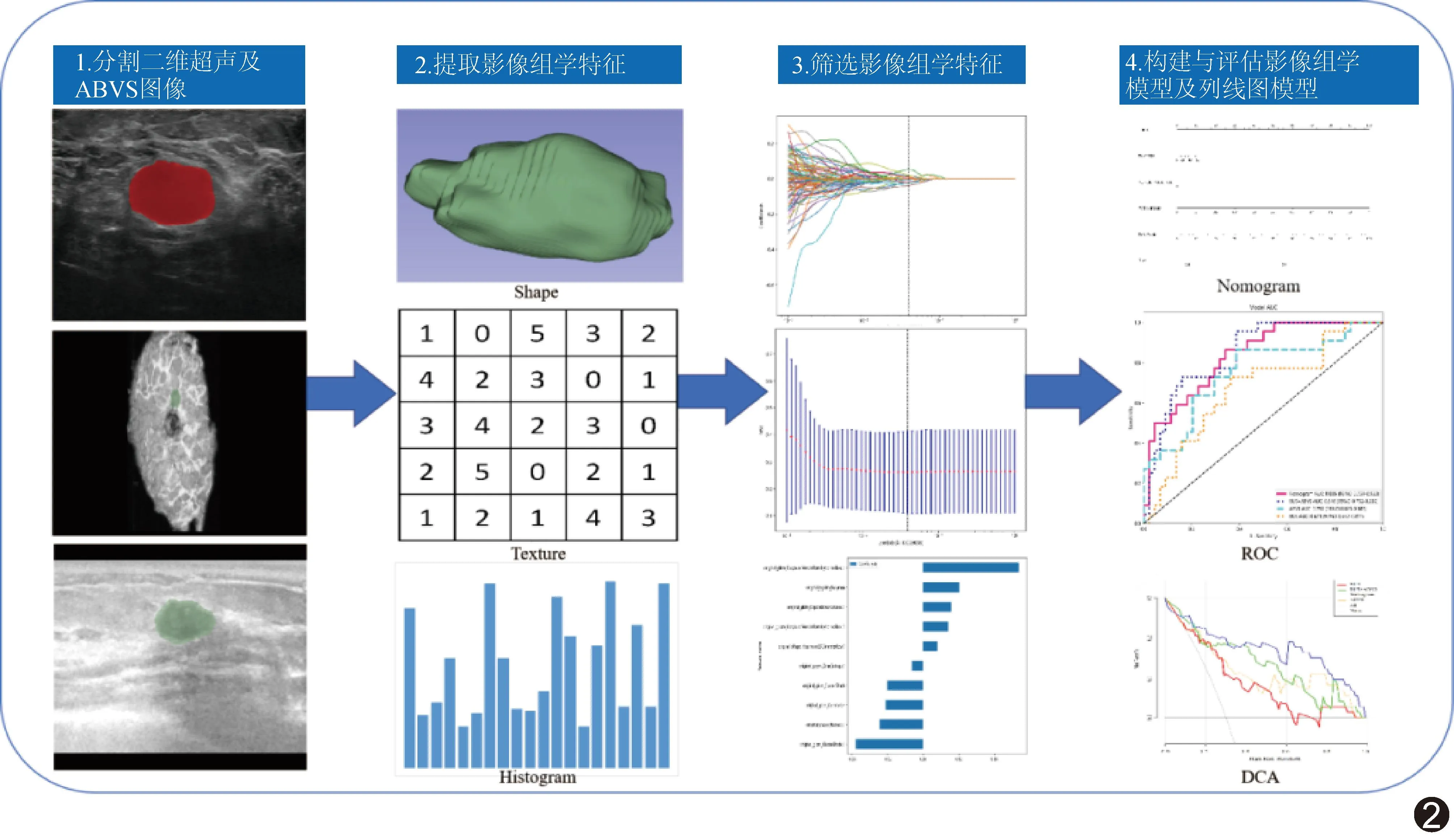
图2 研究流程示意图
1.4 构建模型 基于支持向量机(support vector machine, SVM)算法分别构建二维超声、ABVS及联合影像组学模型(采用前融合算法合并二维超声模型与ABVS模型),评估其预测乳腺癌分子分型的效能。采用单因素和多因素logistic回归分析筛选乳腺癌分子分型的独立预测因素,以之联合影像组学评分构建列线图模型。见图2。
1.5 统计学分析 采用Python 3.7.12及SPSS 25.0统计分析软件。以±s表示正态分布计量资料,行独立样本t检验;以中位数(上下四分位数)表示偏态分布计量资料,行Mann-WhitneyU检验。以χ2检验或Fisher精确概率法比较计数资料。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,评估各模型预测乳腺癌分子分型的效能;以DeLong检验比较各模型曲线下面积(area under the curve, AUC);以决策曲线分析(decision curve analysis, DCA)评估各模型的临床获益;以Hosmer-Lemeshow检验评价列线图的拟合优度。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料与超声特征 训练集、验证集内亚组间肿瘤最大径、形态、有无汇聚征及钙化差异均有统计学意义(P均<0.05),其余参数差异均无统计学意义(P均>0.05)。见表1。

表1 Luminal与非Luminal乳腺癌患者一般资料及超声所见
2.2 构建列线图模型 二维超声、ABVS及联合影像组学模型分别含2、12及10个与乳腺癌分子分型相关的非零系数特征。用于构建联合影像组学模型的10个特征中,3个源于二维超声、7个源于ABVS;其中2个形状特征分别为“original_shape_Flatness”和“original_shape_Maximum2DDiameterRow”, 8个纹理特征包括3个灰度共生矩阵(original_glcm_Cluster Shade、original_glcm_Correlation及original_glcm_ClusterShade)、2个灰度区域大小矩阵(original_glszm_Gray Level NonUniformity Normalized及original_glszm_Zone Entropy)及灰度游程长度矩阵(original_glrlm_Gray Level NonUniformity Normalized)、灰度相关矩阵(original_gldm_DependenceVariance)及邻域灰度差矩阵(original_gldm_Dependence Variance)特征各1个。
多因素logistic回归分析显示,肿瘤最大径及有无汇聚征均为乳腺癌分子分型的独立预测因素(P均<0.05);据此联合影像组学评分构建列线图模型。见表2及图3~5。
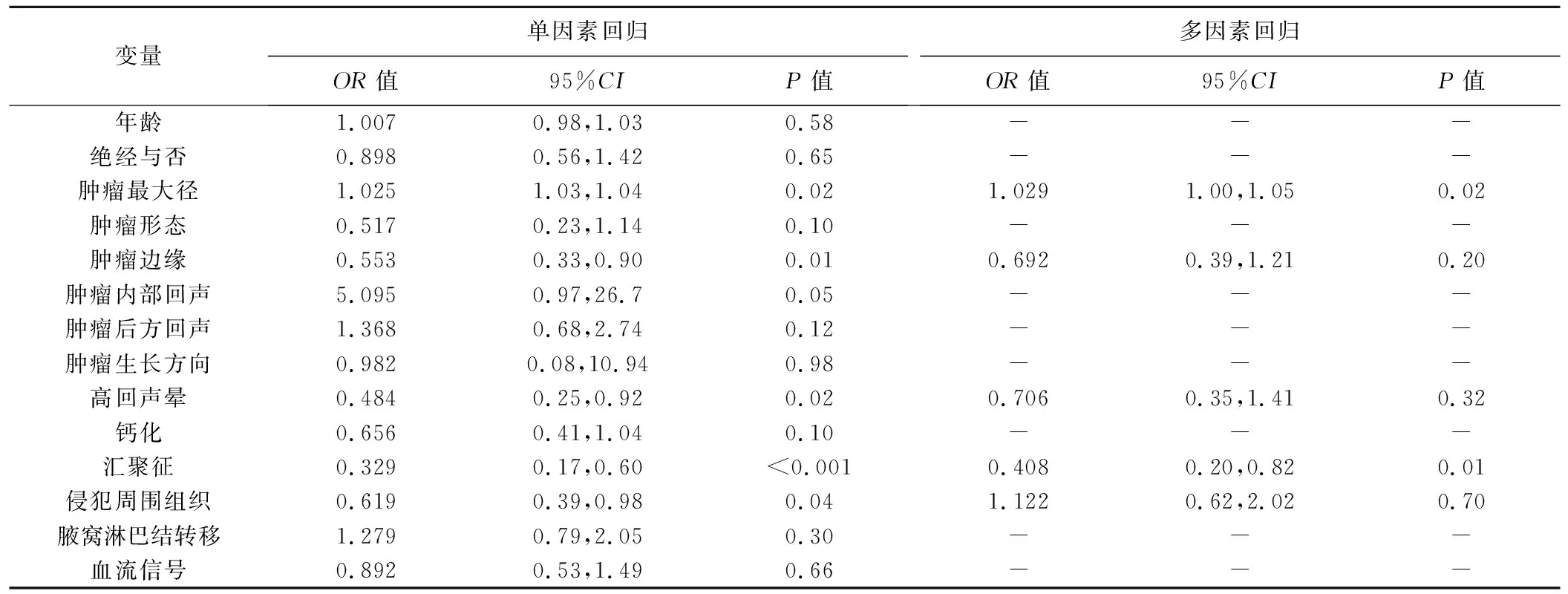
表2 logistic回归分析筛选患者乳腺癌分子分型的独立预测因素

图3 用于构建联合影像组学模型的10个影像组学特征的回归系数分布图 图4 用于构建影像组学模型的10个影像组学特征的Pearson相关系数热图(颜色由浅至深代表系数相应增大) 图5 以独立预测因素联合影像组学评分构建列线图
2.3 预测效能 二维超声模型、ABVS模型、联合影像组学模型及列线图模型预测训练集乳腺癌分子分型的AUC分别为0.64、0.86、0.88及0.89,预测验证集的AUC分别为0.67、0.75、0.84及0.83;各模型在训练集与验证集中AUC差异均无统计学意义(P均>0.05)。联合影像组学模型与列线图模型在验证集的AUC差异无统计学意义(P>0.05)且均高于二维超声模型及ABVS模型(P均<0.05),见表3和图6。列线图模型预测训练集和验证集乳腺癌分子分型的净收益均大于其他模型,见图7。Hosmer-Lemeshow检验结果显示,训练集和验证集中,列线图模型校正曲线均与理想曲线走行一致(P均>0.05),见图8。

表3 各模型预测训练集及验证集乳腺癌分子分型的效能

图6 各模型预测训练集(A)及验证集(B)乳腺癌分子分型的ROC曲线 图7 各模型于训练集(A)及验证集(B)中的决策曲线图 图8 列线图模型预测训练集(A)及验证集(B)乳腺癌分子分型的的校准曲线
3 讨论
已有多项研究基于乳腺肿瘤二维超声图像影像组学预测乳腺癌分子分型。GUO等[10]认为肿块内部回声为预测乳腺癌分子分型的最有效指标(AUC为0.738)。WU等[11]发现乳腺超声列线图模型及影像组学评分预测乳腺癌Luminal分型的AUC分别为0.786~0.828及0.767~0.832,差异无统计学意义。
利用ABVS可对乳腺进行连续多角度断层扫描,进而观察乳腺冠状面图像[12]。本研究结果显示,基于二维超声及ABVS构建的联合影像组学模型及列线图模型预测乳腺癌Luminal分型效能(验证集内AUC分别为0.84及0.83)均高于既往研究[10-11],提示乳腺冠状面图像可为术前预测乳腺癌分子分型提供重要信息;联合影像组学模型与列线图模型预测乳腺癌分子分型效能无明显差异(P>0.05),但列线图模型净收益更高,可能与样本量较小、肿瘤最大径和汇聚征对列线图影响有限有关。
本研究所获联合模型包含2个形状特征、8个纹理特征而无一阶特征,可能提示一阶特征与乳腺癌分子分型无明显相关;影像组学特征回归系数分布图提示不同分子分型乳腺癌之间纹理特征及形状特征有所差异,“original_glrlm_Gray Level Non Uniformity Normalized”和“original_glcm_Cluster Shade”权重系数较高,提示其与乳腺癌分子分型显著相关。
综上,基于二维超声及ABVS构建的联合影像组学模型及列线图模型均可有效预测乳腺癌分子分型。但本研究为单中心回顾性分析,样本量有限,手动勾画ROI可能存在一定误差,且缺乏外部数据验证,有待进一步完善。
利益冲突:全体作者声明无利益冲突。
作者贡献:周汇明研究设计、图像处理、数据分析、撰写文章及统计分析;肖际东指导、研究设计、审阅文章及经费支持;刘梦涵图像处理及查阅文献;聂淼淼及戴美雪数据分析、查阅文献及统计分析。

