多参数MRI随访观察遗传性痉挛性截瘫5型患者脊髓微结构改变
林晨琳,张 帆,李猛城,付 莹,刘 颖*
(1.福建医科大学附属第一医院医学影像科,3.神经内科 神经病学研究所 福建省分子神经病学重点实验室,福建 福州 350005; 2.福建医科大学附属第一医院滨海院区国家区域医疗中心医学影像科,福建 福州 350212)
遗传性痉挛性截瘫(hereditary spastic paraplegia, HSP)为具有高度遗传异质性的神经退行性病变,发病率为2/100 000~5/100 000[1]。遗传性痉挛性截瘫5型(hereditary spastic paraplegias type 5, SPG5)在已知HSP亚型中约占3.0%~7.9%,进展较缓慢,以脊髓萎缩与微结构损伤为重要特征[2-5]。本研究评估多参数MRI用于随访观察SPG5患者脊髓微结构改变的价值。
1 资料与方法
1.1 研究对象 前瞻性收集2019年8月—2020年1月福建医科大学附属第一医院11例SPG5患者,男8例、女3例,年龄14~50岁、中位年龄29岁;病程10~20年、中位病程14年;痉挛性截瘫评价量表(spastic paraplegia rating scale, SPRS)[6]评分11~25分、平均(16.64±7.07)分;均于颈胸段脊髓MR检查后1年完成第2次MR检查及SPRS评分。纳入标准:①经基因检测诊断SPG5;②接受颈胸段脊髓MR检查;③相关资料完整。排除标准:①合并其他神经系统疾病;②酗酒或药物滥用;③MR检查禁忌证;④MRI质量无法满足诊断要求。本研究经院伦理委员会批准[闽医大附一伦理医研(2019)194号];检查前患者均签署知情同意书。
1.2 仪器与方法 采用Siemens 3.0T Skyra MR仪、20通道头颈联合相控阵线圈。嘱患者仰卧、戴防噪声耳塞,行颈胸段脊髓扫描;行脊髓三维结构成像,基于三维快速自旋回波T2W(3D T2W sampling perfection with application optimized contrast using different flip angle evolutions, 3D T2W SPACE)及三维磁化准备快速梯度回波T1W序列(3D T1W imaging magnetization prepared rapid acquisition gradient echo, 3D T1W MPRAGE)采集C1~T9矢状位图像,3D T2W SPACE参数为TR 1 500 ms、TE 135 ms、ES 3.95 ms、FOV 250 mm×250 mm、体素0.4 mm×0.4 mm×0.8 mm、FA 140°、AV 1.4、TA 5 min 54 s,3D T1W MPRAGE参数为TR 2 300 ms、TE 3.43 ms、ES 8 ms、FOV 250 mm×250 mm、体素1.0 mm×1.0 mm×0.8 mm、FA 9°、AV 1、总时间5 min 21 s;行弥散张量成像(diffusion tensor imaging, DTI),基于自旋回波-平面回波成像(spin echo-echo planar imaging, SE-EPI)序列采集C2~T5轴位图像, TR 5 100 ms,TE 99 ms,FOV 129 mm×125 mm,体素1.0 mm×1.0 mm×4.0 mm,b值分别为0 s/mm2及800 s/mm2,20个扩散敏感梯度磁场方向,总时间6 min 24 s;行T1 mapping,基于三维T1W加权磁化准备2快速梯度回波序列(3D T1W magnetization prepared 2 rapid gradient echo, 3D T1-MP2RAGE)采集C2~T5轴位图像,TR 4.96 ms,TE 1.84 ms,FOV 200 mm×200 mm,FA 2°/15°,体素1.0 mm×1.0 mm×0.9 mm,总时间3 min 34 s。
1.3 图像分析 采用SCT(Spinal Cord Toolbox)4.01软件基于脊髓三维结构像提取C1~T9脊髓截面积(cross-sectional areas, CSA)、左右径及前后径;基于DTI及T1 mapping提取C2~T5脊髓白质、后索及左/右侧皮质脊髓束(corticospinal tract, CST)参数,包括各向异性分数(fractional anisotropy, FA)、平均弥散系数(mean diffusivity, MD)、轴向弥散系数(axial diffusivity, AD)、径向弥散系数(radial diffusivity, RD)及T1值。以SCT软件对首次与随访1年后的第2次MRI进行配准,由2名具有15年及以上工作经验的影像科医师对配准结果进行复核,不满意时进行手动配准。
1.4 统计学分析 采用SPSS 29.0统计分析软件。以Shapiro Wilk进行正态性检验,以±s表示符合正态分布的资料,行配对样本t检验。经多重比较的Bonferroni校正脊髓MRI参数。P<0.05为差异有统计学意义。
2 结果
11例SPG5第2次SPRS评分11~24分、平均(16.64±7.47)分,与首次SPRS评分差异无统计学意义(P>0.05)。相比首次颈胸段脊髓MRI,第2次MRI显示脊髓不同程度萎缩均有所加重,见图1。
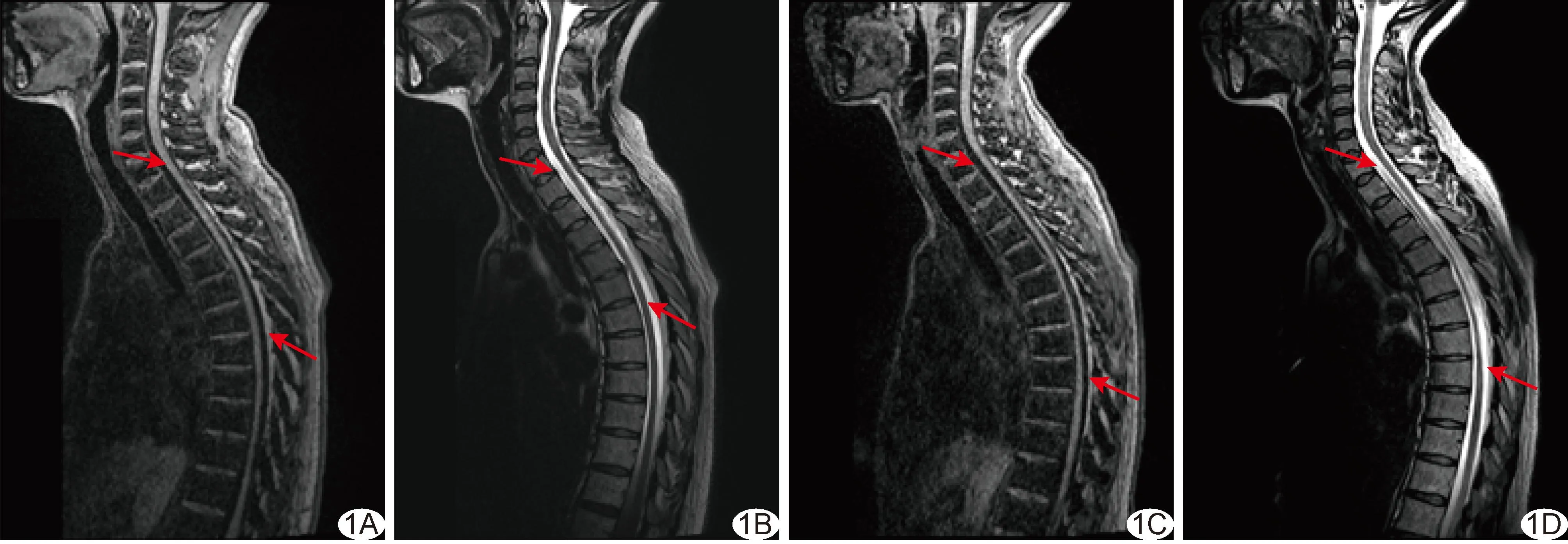
图1 患者女,SPG5,首次就诊年龄38岁 A、B.首次颈、胸段脊髓矢状位3D MPRAGE T1WI (A)及3D SPACE T2WI(B); C、D.随访1年后第2次颈、胸段脊髓矢状位3D MPRAGE T1WI(C)及3D SPACE T2WI(D)均见脊髓变细 (箭示病灶)
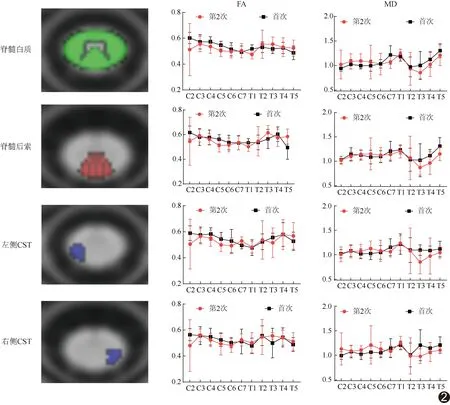
纳入首次与第2次MR DTI及T1 mapping均符合质控要求的椎体(表1)。首次与第2次MRI所示C4右侧CST AD差异有统计学意义(t=3.987,P<0.01),C4其余参数差异均无统计学意义(P均>0.05);其余椎体脊髓白质、后索、左/右侧CST的FA、MD、AD、RD及T1值,以及C1~T9椎体CSA、左右径及前后径差异均无统计学意义(P均>0.05)。见表2及图2。第2次MRI颈段脊髓白质、后索及CST的FA均低于、而RD均高于首次MRI(P均>0.05)。

表1 2次MR DTI及T1 Mapping均符合质控要求的椎体数量(个)
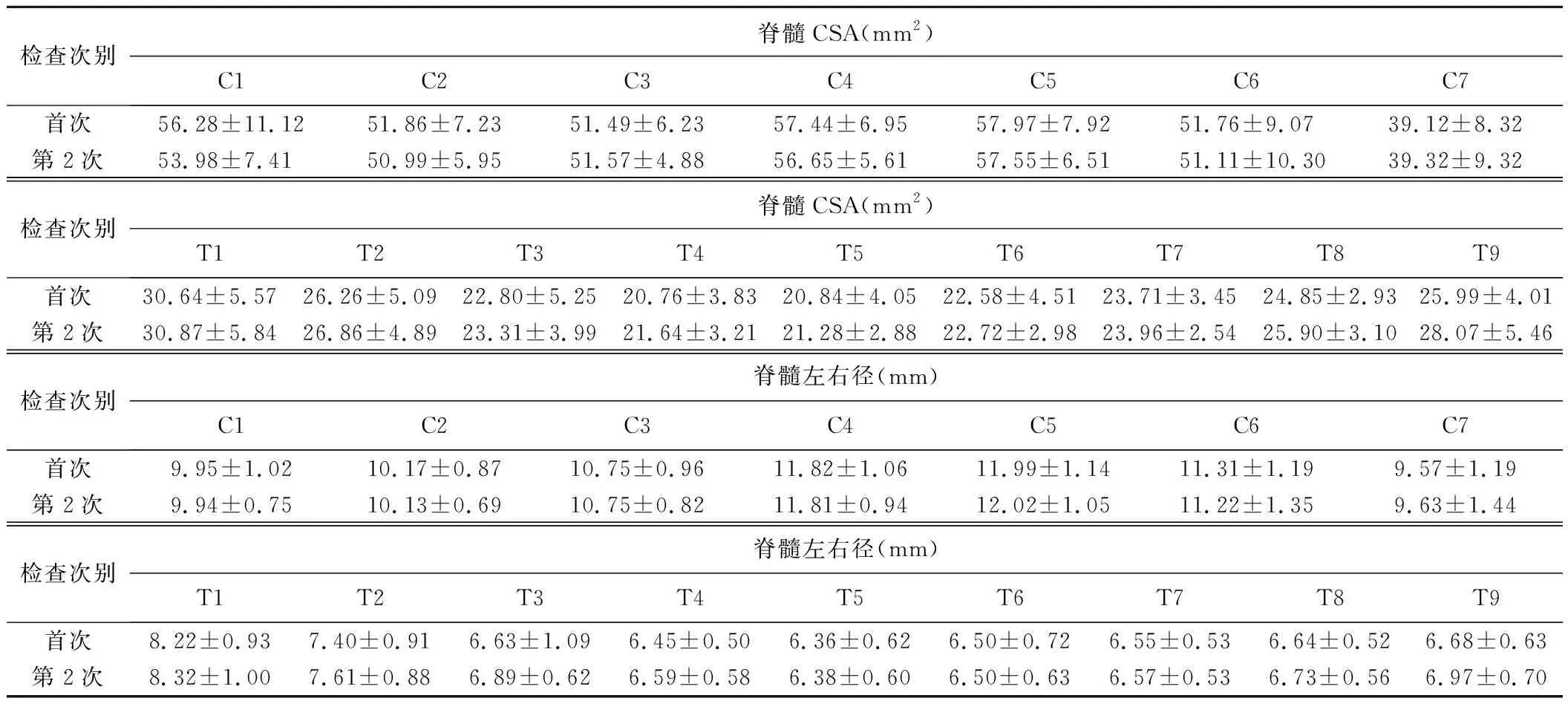
表2 11例SPG5患者2次颈胸段脊髓MR参数比较(n=11)
3 讨论
不同亚型HSP进展存在差异,临床多以患者行走能力及SPRS进行评估[8]。本组SPG5患者SPRS评分经随访1年无明显变化(P>0.05),与既往研究[9]结果相符。值得注意的是,尽管SPRS无显著差异,但SPG5所致神经退行性变仍在进展[4]。
SPG5可同时累及颅脑及脊髓。脊髓MRI较为敏感,常规颅脑MRI中SPG5多无白质信号异常,可能由于脊髓不编码CYP46A1基因、无法表达颅内主要胆固醇代谢酶而更易具有中枢神经系统毒性的27-羟基胆固醇(27-hydroxycholesterol, 27-OHC)蓄积而损伤CST并致脊髓萎缩[10-11]。本研究基于多参数MRI随访观察SPG5患者脊髓微结构改变,随访1年发现11例颈胸段脊髓MRI均见不同程度脊髓萎缩,但直接阅片并未显示脊髓结构存在明显变化。
脊髓DTI对HSP患者白质神经纤维微结构改变具有较高敏感度及特异度[12]; FA与MD反映白质完整性,AD可反映轴突损伤或丢失,RD代表髓鞘完整性、髓鞘形成及脱髓鞘程度的差异[13-14]。既往研究[4]报道,相比健康对照组,SPG5患者C2~T5脊髓白质、反映深感觉的脊髓后索及反映运动功能的CST均表现为FA降低而RD、MD及T1值升高。本研究纳入脊髓CSA、左右径及前后径观察首次MRI所示脊髓整体结构变化,并将基于DTI及T1 mapping获得的脊髓白质、后索及左/右CST等参数用于观察脊髓微结构变化,结果显示脊髓整体结构及微结构变化均不显著;但1年后第2次MRI显示颈段脊髓白质、后索及CST的FA均低于、而RD均高于首次,提示SPG5病情进展过程中可出现轴突密度、纤维数量及髓鞘厚度减少,这对SPG5患者颈段脊髓白质微纤维结构具有退行性变趋势的观点构成一定程度的支持;AD变化不明显与既往研究[4,15]结果相符,原因可能在于SPG5可致轴突破坏或清除,影响神经传导及水分子的纵向位移。有鉴于此,尽管本组C4右侧CST的AD存在显著差异(P<0.01),仍不足以说明AD存在纵向变化。本研究中2次MRI所获脊髓节段MD与T1值无增高或减低趋势,可能相比FA及RD,MD与T 1值对脊髓微结构改变的敏感度更差,或与SPG5患者脊髓白质损伤与修复同时存在有关[10,16]。
综上所述,多参数MRI可用于随访观察SPG5患者脊髓微结构变化。本研究主要的局限性:①为单中心回顾性分析,且样本量小;②随访时间较短;③脊髓MRI易受呼吸、心搏等的影响,使得部分脊髓节段无法满足评估要求[17];④随访期间患者运动、护理及治疗可能影响SPRS评分及MRI评估结果。扩大样本量、增加随访时间及频次,同时优化脊髓DTI序列为下一步研究方向。
利益冲突:全体作者声明无利益冲突。
作者贡献:林晨琳研究设计和实施、图像分析和处理、撰写文章;张帆、李猛城图像分析和处理、数据分析;付莹研究设计;刘颖研究设计、统计分析、修改和审阅文章、经费支持。

