脂多糖破坏血脑屏障与脓毒症相关脑病发生的研究进展
刘平川, 梅岚幸子, 彭逍遥, 杨粤凝综述, 罗钰鼎, 王 建审校
中枢神经系统(central nervous system,CNS)作为调节身体活动的最高部分,一直处于与周围环境显著不同的动态平衡环境中,而这主要取决于血脑屏障(blood-brain barrier,BBB)的功能和特征[1]。正是由于细胞旁途径和跨细胞途径维持屏障的低通透性,以及其他组成细胞的共同作用才使得CNS 所处的环境相对独立。除此之外,和其他组织相比CNS中白细胞(比如中性粒细胞、淋巴细胞)的浸润要少很多,正因如此CNS 在过去常常被认为是免疫豁免区域[2,3]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌的细胞壁成分,也称为内毒素,也造成是脓毒症产生的主要原因[4]。纯化的LPS 广泛用于构建脓毒症及其并发症的疾病模型[5]。近年研究表明,LPS可通过多种机制破坏BBB,而受损的BBB 不仅可以促进阿尔茨海默病(Alzheimer disease,AD)和多系统硬化症(multisystem sclerosis,MS)等疾病的发展,还可以导致脓毒症相关脑病(sepsis-associated encephalopathy,SAE)的出现[6,7]。脓毒症往往涉及到多个器官功能障碍,比如心脏、肝脏以及肾脏,因此常引起严重并发症,其中脓毒症所致的脑功能障碍是最常见和最严重的并发症之一,称之为SAE。目前SAE尚无统一的诊断标准,主要是依赖排除诊断。SAE患者一般无明确的CNS 感染证据,但临床存在明显的认知功能障碍与记忆力减退等症状,严重者表现为昏迷或谵妄[8]。
鉴于LPS 可通过多种机制破坏BBB 并影响其通透性,导致更严重的疾病,我们回顾了近年来的相关文献,并将从中心环节和其他间接环节两方面阐述LPS 对BBB 损伤的具体机制,并讨论该过程与SAE实验性治疗证据的联系。
1 中心环节
1.1 细胞旁途径 控制物质和细胞进出中枢神经系统是BBB 最重要的功能,特别是防止毒素和病原体进入。它保证了CNS在不同条件下的相对稳定性,这与BBB的屏障功能有关,具体反映在跨细胞途径和细胞旁途径的低通透性中。细胞旁途径的低通透性主要由紧密连接(tight junctions,TJs)决定,TJs主要包括密集分布的跨膜蛋白分子claudin(尤其是claudin-5)、occluding、tricellulins、junctional adhesion molecules 和细胞内支持蛋白(intracellular support protein),比如(zona occludens,ZO)[9]。由这些紧密连接蛋白形成的TJs主要位于脑内皮细胞之间,密封分子的细胞旁途径,从而大大减少极性溶质从血浆到脑细胞外液的渗透,并在维持BBB 完整性中起重要作用[10]。此外,由细胞间钙黏蛋白(比如血管内皮钙黏蛋白)和细胞内连环链蛋白形成的黏附连接(adherens junctions,AJs)将细胞连接在一起,是TJs形成的基础,也参与维持BBB 屏障功能的完整性[11]。
由Li 等[12]用荧光素钠(sodium fluorescein)评价BBB 的通透性,通过注射LPS 的体内实验发现LPS降低了ZO-1 的表达而导致BBB 通透性上升。与体内实验结果一致,在研究人员用跨内皮细胞电阻(transendothelial electrical resistance,TEER)反映人脑微血管内皮细胞(human brain microvascular endothelial cells,HBMECs)通透性的体外实验结果也显示LPS 使得ZO-1 表达下降进而出现通透性上升[12]。Wang 等[13]的研究发现注射LPS 可以提高BBB 的通透性,之后的细胞实验显示LPS 可以降低脑内皮细胞中Claudin-5 和ZO-1 的表达,并且抑制LPS 的这种效应与保护BBB 的通透性有关。Liu 等[14]在体内及体外实验均观察到LPS 所导致的TJs 蛋白下降与BBB 通透性的上升后,作为一种可以与多种抗氧化反应元件结合的抗氧化因子,激活的结合转录因子E2相关因子2(NF-E2-related factor 2,Nrf2)可在一定程度上逆转LPS 作用后的BBB 高通透性。加之Wang 等的实验中观察到Nrf2的类似效应,以及超氧化物歧化酶的降低,丙二醛的升高[13],上述两项研究提示氧化应激反应可能在LPS破坏BBB 的过程中也起到重要作用。综上所述,LPS 可通过诱导神经炎症与氧化应激影响TJs 蛋白的表达从而提高细胞旁途径通透性以及破坏BBB 的屏障功能。另外,有研究发现白介素-1β(interleukin-1β, IL-1β)、TNF-α(tumour necrosis factor-α)、NF-κB 和 HIF-1α 的过表达参与了LPS 破坏TJs 并影响BBB 通透性的过程[15]。综上所述,LPS 诱导的BBB 损伤可能抑制脑内皮细胞中Claudin-5 和ZO-1 的表达,诱导IL-1β,tumour necrosis factor-α、NF-κB、HIF-1α 过表达导致BBB 屏障功能损伤。然而,这些研究对于LPS 如何导致紧密连接相关蛋白表达变化的问题尚不能做机制方面的回答,但这也是目前研究亟待弥补的空白和未来研究需要努力的方向。
需要注意的是,Hu 等[16]观察到LPS 处理可导致细胞内ROS 积累和NF-κB 活化,从而导致促炎细胞因子的过度分泌和黏附分子的表达。当使用药物激活PI3K/Akt/Nrf2 通路时,可同时观察到NF-κB 炎症通路的抑制,表明LPS 诱导的炎症和氧化应激过程相互影响。Fock 和Cordaro 等[17,18]进一步研究表明,LPS 诱导的炎症和氧化应激均可能经过跨细胞途径或细胞旁途径介导BBB损伤。
1.2 跨细胞途径 关于BBB 对物质的跨细胞转运,人们普遍认为有4种物质转运途径[3]。(1)脂溶性物质和气体小分子的自由扩散;(2)一些不能自由扩散的极性分子由溶质载体运输[19];(3)通过ATP 结合盒转运体(ATP-binding cassette transporters,ABCs)消耗ATP,多种脂溶性物质可以从脑毛细血管内皮细胞和CNS 排泄到血液中,ABCs还可以去除代谢废物和有毒物质,因此它也被认为是CNS 的重要防御体系[20]。我们将探讨P-糖蛋白(P-glycoprotein,P-gp/ABCB1)在维持BBB 低通透性中的作用[21;(4)大分子的囊泡运输,也称为穿胞作用。值得注意的是,BBB 内皮细胞的囊泡转运率比大多数外周内皮细胞低,这可能与细胞膜小窝介导(caveolae-mediated)的穿胞作用受到抑制有关[22]。由于前两种途径的物质转运主要与细胞内和细胞外溶质的浓度差异有关,因此跨细胞途径的低通透性主要是与ABCs 的外排效应和低囊泡转运率有关。
P-gp 作为具有重要外排作用的糖蛋白,它的损伤或者说是表达降低可能会导致毒性物质不能及时透过BBB 排出CNS,因而出现相应的中毒症状。比如,在阿尔茨海默病和帕金森病等疾病中就发现有P-gp 活性的下降[23]。Imperio 等[24]利用LPS 对HBMECs 进行处理后发现P-gp 的表达和含量均有下降,进一步直接用IL-6 和TNF-α 等炎性因子进行处理也发现了类似的结果,而这样的结果提示LPS 可以通过影响内皮细胞上P-gp 的表达来影响BBB 的物质转运功能,并且该作用也与神经炎症有关。同样属于ABCs 的乳腺癌耐药蛋白(breast cancer resistance protein,BCRP/ABCG2)也是一种通过外排作用保护BBB 的重要蛋白,但有趣的是Imperio 等[24]的研究结果显示BCRP 对于LPS 的反应与P-gp 存在差异甚至相反。因此研究人员认为,P-gp 与BCRP 在细菌或病毒等感染情况下存在代偿性的关系,因此对BBB 上外排系统的进一步研究有助于帮助了解致病因子和药物在CNS 中的生物分布。Seo 等[25]为了更直接地反映P-gp 的外排作用,用LPS 对ABCB1 基因敲除小鼠与正常小鼠进行处理,结果显示ABCB1 基因敲除小鼠大脑中IL-6 和IL-1b 等炎性因子清除率明显下降。因此,P-gp 作为BBB 外排系统的重要组成元件主要是通过及时地排出外源性及内源性的神经毒性因子来维持BBB的跨细胞低通透性。
除了ABCs,在维持BBB 跨细胞途径的低通透性中起到重要作用的还有细胞膜小窝(caveolae)和与之相关的穿胞作用,并且小窝蛋白-1(caveolin-1)是小窝的主要成分,因此它的表达水平及活性也会对跨细胞的通透性造成影响[26,27]。Mollace 等[28]研究发现caveolin-1 活性的调节与Toll 样受体4(toll-like receptors, TLR4)有关,而LPS作为TLR4最重要的激活因子之一,因此LPS 有可能通过作用于TLR4 来影响caveolin-1 活性进而破坏BBB 屏障功能。于顾然等[29]通过牛血清白蛋白异硫氰酸荧光素来评估体外BBB 模型通透性,实验结果显示LPS 能够通过激活TLR4 并提高其表达来提高caveolin-1 的含量,导致内皮细胞穿胞作用效率明显上升,从而提高BBB 的通透性。有趣的是在Han 等[30]的研究中发现LPS 对caveolin-1的表达没有明显的影响,但会使caveolin-1的磷酸化程度增加,从而影响BBB 的通透性。因此LPS 除了调节caveolin-1的表达,还可以通过调节caveolin-1结构来影响BBB的屏障功能。
总的来说,LPS 主要通过调节以P-gp 为主要元件的ABCs 和caveolin-1 介导的穿胞作用来控制物质的转运以及保持BBB跨细胞途径的低通透性。
2 其他间接环节
BBB 主要是由血管内皮细胞及基质膜构成,同时还有覆盖在上面的周细胞和星形胶质细胞的终足所组成神经血管单元(neurovascular unit,NVU),来共同维持BBB 的功能[31-33]。另外,神经元和小胶质细胞作为NVU 的组成部分,也可以直接或间接地影响BBB 的发育和功能[34]。Pritchard 等[35]通过对LPS处理以单层HBMECs 作为血脑屏障NVU 的原始衍生模型,发现LPS 作用后模型整体的通透性得到上升并且修复功能明显下降。类似地,Gao 等[36]的实验结果也证明LPS 所引起的神经炎症能直接损伤血管内皮细胞并出现死亡,同时导致了BBB 的完整性被破坏。除了血管内皮细胞外,基质膜同样是BBB的基本结构,Du 等[37]的研究发现LPS 不仅能够通过作用于TLR4促进NF-κB的活化来引起神经炎症,同时还在体内和体外实验中均证明LPS通过TLR4/NFκB 在mRNA 和蛋白水平上提高基质金属蛋白酶-2(matrix matalloproteinases-2,MMP-2)和MMP-9 的表达。从而说明MMP-2/9可以直接水解BBB的基质膜影响BBB通透性以及破坏BBB的屏障功能[37]。
小胶质细胞作为脑组织中的免疫细胞,发挥着与巨噬细胞相似的功能,另外它作为NVU 的组成成分,在外界毒素破坏BBB 以及侵入脑组织过程中同样发挥着一定作用[38]。Jiang 等[39]发现LPS 所引起的神经炎症部分是由小胶质细胞介导的,具体表现为LPS 促进小胶质细胞向具有促炎作用的M1 表型极化并通过PPARγ/NF-κB 通路引起神经炎症,导致BBB 的内皮细胞活力下降以及TJs 蛋白含量下降等BBB 损伤的表现。星形胶质细胞NVU 的组成部分,它以终足附着在CNS 的毛细血管上,并分泌各种营养因子和细胞外基质蛋白[33]。Bock 等[40]进一步研究了星形胶质细胞是否参与到LPS破坏BBB 的过程中,他们发现LPS 所引起的神经炎症中的因子IL-6能够介导连接蛋白43 在星形胶质细胞的表达,而这与BBB 通透性增加显著相关。值得一提的是,在LPS 引起的神经炎症中星形胶质细胞还出现了明显增生,但这可能是因为直接组成BBB 结构的细胞终足没有明显变化,所以出现BBB 屏障功能依然被破坏的结果[40]。周细胞是BBB 空间结构上最接近血管内皮的细胞,LPS 可以诱导其细胞因子和趋化因子的显著释放,并且还可以释放含有细胞因子的微囊泡。除此之外,LPS 处理能诱导周细胞出现类似于小胶质细胞/巨噬细胞样的变形虫样和分枝状形状,而这可能有助于循环免疫细胞的浸润,因此脑周细胞不仅可能是CNS 疾病中BBB 保护的新靶点,而且由于其分泌能力,也可能是神经保护的新靶点[41]。
总的来说,血管内皮细胞及基质膜作为BBB 的基础成分,一旦其数量或者结构受到神经炎症的影响则会直接影响BBB的屏障功能,而小胶质细胞、星形胶质细胞和周细胞等组成NVU的细胞在LPS刺激后更多的起到一种承接和放大作用,对 BBB 结构及功能的影响部分或者全部是通过细胞旁途径与跨细胞途径等中心环节所阐述的过程所发挥的。
3 以BBB破坏为靶点的SAE干预研究
脓毒症是失调的全身炎症反应,最初的目的是消灭病原体或致病因素,但异常的炎症反应导致BBB 的破裂和神经元损伤,而这也导致临床症状的出现。研究显示在注射LPS 后,TNF-α 通过作用于TNFR1 后导致BBB 改变、中性粒细胞向脑部浸润,进而出现脑部炎症[42]。有临床研究表明,死于脓毒症的患者出现BBB 损伤,具体表现为TJs 蛋白缺失[43,44]。通过磁共振成像证实了脓毒症所导致的脑部损伤,同时认为BBB 通透性升高与不良预后密切相关[44]。在进行盲肠结扎穿刺的脓毒症病理小鼠模型中,也观察到BBB 结构被破坏以及通透性上升[45]。这些结果都提示我们BBB 屏障功能受损可作为SAE发生的始动环节并存在于脓毒症的整个发展阶段,导致各种细胞因子和白细胞浸润,以及神经元功能障碍以及凋亡,进而出现一系列神经精神症状,甚至伴有很高的死亡率。
关于SAE 发生的病理生理机制,目前广泛接受的观点有氧化应激、缺血缺氧、线粒体功能障碍等所引起的神经炎症,还有脑血流灌注受损、神经递质传递等因素[46]。我们首要明确的是BBB 的破坏不是导致神经组织损伤或者SAE 出现的直接原因,其被破坏的意义在于,在发生全身系统炎症时,有更多免疫细胞、炎症因子、神经毒素、补体以及病原体进入脑组织中并且激活脑部的免疫细胞,甚至组成BBB的NVU 也会受到影响并介导部分炎症、氧化应激等反应发生[47]。被激活的小胶质细胞会释放NO、细胞因子和活性氧,而这些物质会加重BBB 的功能障碍进而形成恶性循环,所以BBB 被破坏不仅是SAE 的原因,也可以是SAE的后果[48]。近年来,进行了许多关于BBB 破坏导致SAE 的干预性研究,接下来将从这几点论述。
3.1 细胞旁途径 Zhong 等[49]发现在SAE 小鼠模型中,JQ1 上调了occludin 和ZO-1 的表达,从而缓解了SAE相关症状,保护了BBB,并显著减少了神经元损伤。这种保护作用可能源于JQ1 对炎症小体诱导的依赖性典型焦亡通路和神经炎症的负性调节作用。因此,JQ1 显示出对SAE 的治疗前景。值得注意的是,该研究中JQ1 以DMSO 作为溶剂,在未来的研究中需要优化溶剂的选择,以减少溶剂对动物造成的潜在损害。
富氢盐水亦是一种有潜力的干预措施。在SAE大鼠模型中,富氢盐水处理可降低干预组的TNF-α和IL-1β 水平,并促进抗炎因子IL-10 的表达,减少LPS 诱导的线粒体ROS 释放,从而改善神经元损伤。然而,尚需进一步的研究来深入探究氢分子在SAE中的确切作用机制以及其临床应用的潜力[50]。
Pu团队[51]的研究发现司来吉兰可改善由LPS诱导的BBB损伤。司来吉兰处理增加了连接黏附分子(junctional adhesion molecules-A, JAM-A)的表达,并抑制TNF-α 和IL-1β 的产生。进一步的体外实验显示,LPS显著增加了bEnd.3内皮细胞的通透性,同时降低了JAM-A 的表达,两者均可通过给予司来吉兰而逆转。此外,司来吉兰还抑制了LPS 引发的NFκB/MLCK/p-MLC 信号通路的激活。综上所述,这项研究揭示了司来吉兰在血脑屏障功能障碍中的保护作用可能与抑制NF-κB/MLCK/p-MLC 信号通路的活化有关。这些发现为进一步研究司来吉兰的神经保护机制提供了基础。
Pu 的研究发现饲喂米氮平可显著改善SAE 相关的脑血管通透性并缓解炎症。此外,该研究发现在培养的脑内皮细胞中,米氮平改善了LPS 诱导的内皮细胞高渗透性和减轻炎症。米氮平还有助于逆转LPS 诱导下的内皮细胞中Nrf2 水平的降低。通过敲低Nrf2,米氮平对内皮通透性对LPS 的保护作用显著减弱。上述研究表明,Nrf2 在调控米氮平对内皮细胞的保护作用中扮演了关键角色。通过上调Nrf2 的表达,米氮平可能增强了脑内皮细胞的完整性,进而在SAE模型中发挥有益作用。然而,尚需进一步深入研究来阐明米氮平与Nrf2之间的具体关系及其在SAE治疗中的潜在临床应用前景[52]。
3.2 跨细胞途径 在LPS 诱导的SAE 中,Nrf2反应性表达增加,然而,这种表达增加并不足以维持氧化-抗氧化系统及炎症-抗炎系统的平衡。Chen等[53]对SAE小鼠的研究发现富氢盐水减弱了小胶质细胞由M1向M2表型的转化,抑制了TLR4/NF-κB通路的激活,并减少了大脑皮质中细胞因子的释放。值得注意的是,这种抗炎和神经保护作用在Nrf2基因缺失的小鼠中并不明显,表明氢分子的作用可能与Nrf2途径和TLR4/NF-κB通路有关,氢分子不仅与细胞旁途径发挥作用,还通过跨细胞途径发挥保护作用。
电针在实验性研究中亦是一种常用干预。研究发现,模拟电针通过下调海马的HMGB1/TLR4 和HMGB1/RAGE 信号传导,降低促炎因子水平,缓解小胶质细胞和星形胶质细胞的激活,从而减轻神经炎症介导的BBB损伤。这一发现为电针在SAE神经保护领域的应用提供了新的展望[54]。
3.3 其他间接环节 Zhong 等[55]发现HC067047可维持血脑屏障完整性,并在特定细胞类型中产生明显的保护效果。该物质处理能减轻LPS 诱导的内质网应激和氧化应激,从而预防NLRP3 炎症小体介导的焦亡,下调促炎因子IL-1β 和IL-18 的表达。此外,HC067047选择性地减弱了海马区神经细胞的焦亡,尤其是神经元、少突胶质细胞和小胶质细胞。
上述各个作用于不同环节的干预试验特点总结见表1。
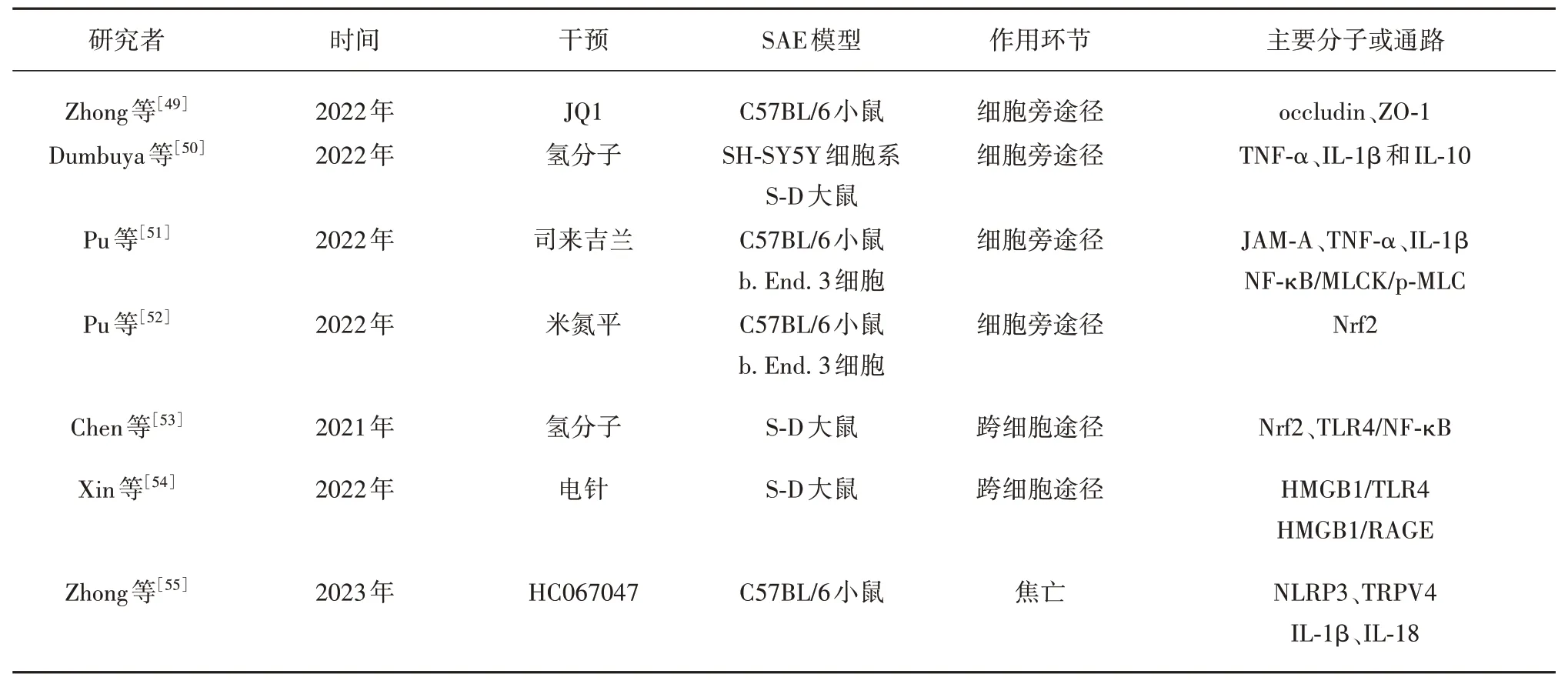
表1 LPS诱导BBB损伤的干预实验总结
4 总结与展望
BBB 作为CNS 内血管系统的复杂多细胞结构,将CNS 与系统循环分离并且调节物质的流入和流出,以维持CNS的稳态[56]。然而,作为一个具有物质交换功能的屏障结构,BBB 经常在各种致病因素的作用下受损,导致屏障功能的破坏和渗透性的增加,这可以表现为细胞旁途径和跨细胞途径的通透性增加,而直接的后果是血液中的细胞因子、病原体以及免疫细胞通过BBB 到达CNS,而这是SAE 产生的重要机制[6]。由TJs 所维持的细胞旁途径以及P-gp 与穿胞作用所构成的跨细胞途径不仅会受到LPS 的直接破坏而影响通透性,在很多情况下还会参与到LPS破坏BBB的其他过程中,因此我们认为这2个方面是LPS破坏BBB 屏障功能的基本形式。在未来的研究中可以把细胞旁和跨细胞途径作为中心环节来对如何保护BBB 的结构及功能进行研究。此外,作为NVU 的组成部分与BBB 通透性调控之间的作用日趋复杂和多样化,进而动态调节BBB的屏障功能。因此通过研究如何增加药物向脑部的渗透性来作用于上述成分,从而保护LPS 作用下的BBB 是一个需要更多研究的领域。由于LPS 可通过多种机制破坏BBB,但目前有关于通过上述机制保护BBB 屏障功能的研究较少。因此,我们认为研究人员在之后的研究中应该尝试着阻断LPS对BBB 的破坏作用来预防及治疗SAE,为控制脓毒症的严重并发症提供新策略。还需要进一步研究不同通路的交互作用,以更好地理解它们在SAE治疗中的相互关系。制定综合治疗策略,针对多个通路联合干预,以提高治疗效果。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:刘平川负责文献收集、撰写论文;梅岚幸子、彭逍遥负责拟定写作思路;杨粤凝负责绘制图表;罗钰鼎负责文稿审校修改;王建负责论文设计并定稿。

