微生物阿魏酸酯酶及其在食品中的应用研究进展
陈舒薇,王丹芸,娄婷婷,吴子健,张宏宇*,王素英,李炳娟,张得光,杨金山
(1.天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津 300134;2.天津科技大学生物工程学院,天津 300457;3.天津海关动植物与食品检测中心,天津 300461)
阿魏酸(ferulic acid,FA)又称4-羟基-3-甲氧基肉桂酸,具有较好的抗氧化性,能够清除自由基[1]。在乳制品中,FA 可与酪蛋白交联提高牛奶的稳定性。FA也可与细胞壁多糖交联提高生物利用率调节免疫反应。FA 常以单体或二聚体形式存在于共生科单子叶科(如小麦、水稻、大麦、燕麦、玉米、高粱和甘蔗)的植物细胞壁多糖网络和甜菜粕、谷壳、米糠等食品加工材料中,可以使植物细胞壁多糖彼此交联并与木质素交联,从而限制多糖水解酶对这些底物的水解[2]。
阿魏酸酯酶(feruloyl esterases,FAEs)是羧酸酯酶的一个亚类,可通过水解羟基肉桂酸和阿拉伯木聚糖之间的酯键,释放游离的羟基肉桂酸如FA,同时可充当辅助酶,协助其他酶在生物质转化中进入其作用位点。FAEs 大多来源于真菌[3-5]、细菌[6-7]以及放线菌[8]等微生物,少数来源于植物。FAEs 的水解或酯交换产物具有降血脂、抗血栓、抗菌消炎、疏散血小板、清除自由基、提高免疫力、预防阿尔兹海默症等功效[9],可作为添加剂和抗氧化剂等用于酒类、面包、茶叶的生产[1]。
自1987年被发现以来[10],关于FAEs 的新酶挖掘、性质鉴定、构效关系解析以及分子改造等方面的研究不断被报道。基于此,本文总结近年来FAEs 的来源、结构、分类、催化机理和分子改造等方面的研究进展,并重点讨论FAEs 在食品领域的应用现状及前景,以期为FAEs 的进一步挖掘和应用提供参考。
1 阿魏酸酯酶概述
1.1 阿魏酸酯酶的来源
1987年,Mackenzie 等[10]首次在橄榄色链霉菌(Streptomycesolitrochromogenes)中发现了FAEs,1991年Faulds 等[11]将其分离纯化。研究发现,原核生物(细菌)和真核生物(真菌和植物)中均含有FAEs,其中真菌来源的FAEs 占据主要地位,植物FAEs 的相关报道较少,仅有的研究报道均以来源于大麦芽的FAEs 为研究对象。目前已得到功能验证及表征的FAEs 见表1。
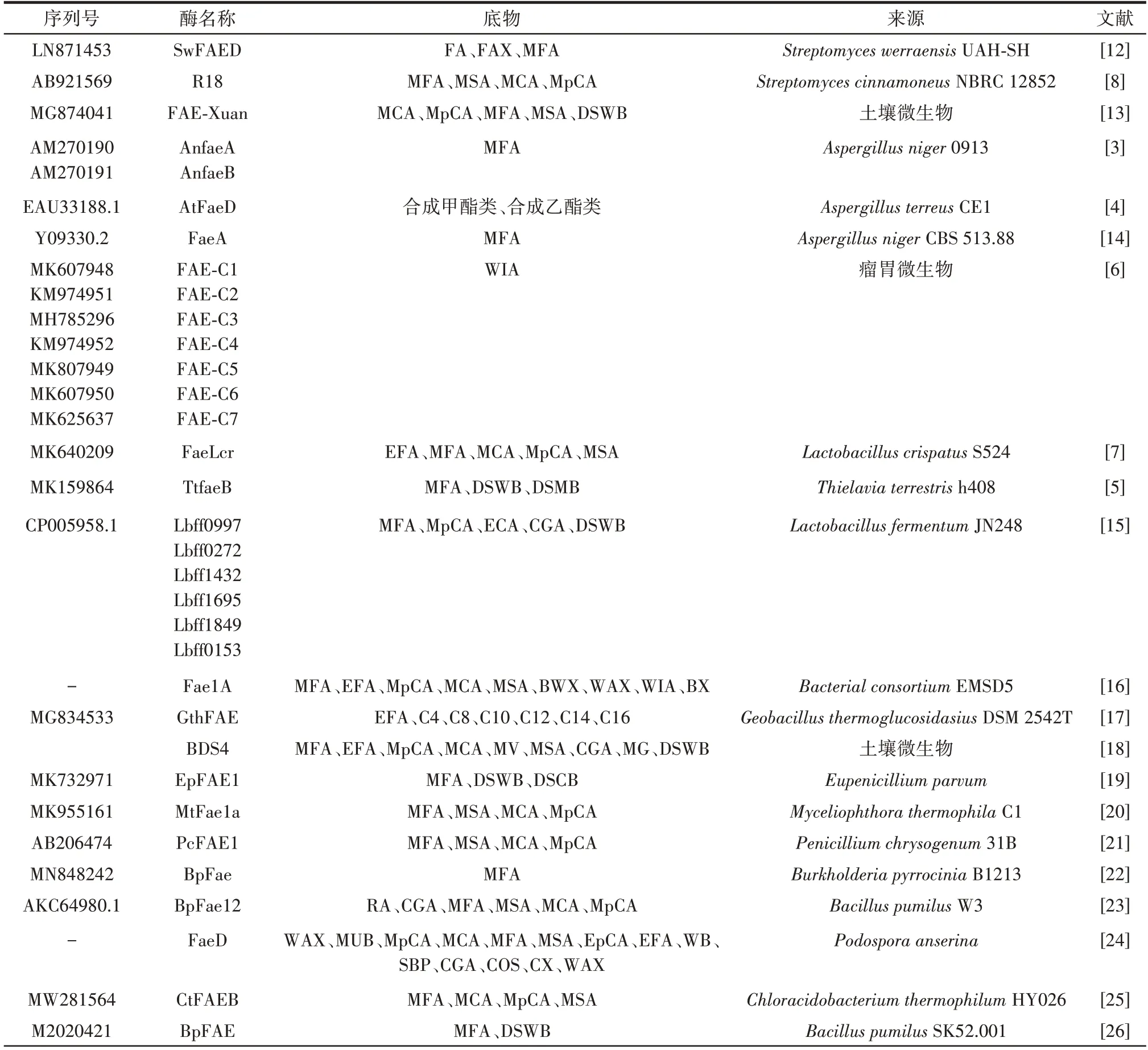
表1 近5年不同来源的FAEs 及其底物谱Table 1 Feruloyl esterases from different sources and their substrate spectra identified in recent five years
目前已发现的FAEs 来源真菌主要包括黑曲霉(Aspergillusniger)[3]、黄曲霉(Aspergillusflavus)、土曲霉(Aspergillusterreus)[4]、裂褶菌(Schizophyllumcommune)、紫孢侧耳菌(Pleurotussapidus)、太瑞斯梭孢壳霉(Thielaviaterrestris)[5]、米麴菌(Aspergillusoryzae)、嗜热毛壳菌(Chaetomiumthermophilum)[25]、纤维素分解菌(Talaromycescellulolyticus)[4]、尖刀镰孢菌(Fusarium oxysporum)、嗜热镰孢菌(Scytalidiumthermophilum)[27]、宇佐美曲霉(Aspergillususamii)[29]、立枯丝核菌(Rhizoctoniasolani)、丝状真菌柄孢霉(Podosporaanserina)[24]、微细正青霉(Eupenicilliumparvum)[19]、嗜热毁丝霉(Myceliophthorathermophila)[20]、产紫青霉(Penicilliumpurpurogenum)[3]、韦腊链霉菌(Streptomyceswerraensis)以及产黄青霉(Penicilliumchrysogenum)[21]等。FAEs 的来源细菌主要包括普雷沃氏菌(Prevotellasp.)[6]、大肠杆菌(Escherichiacoli)、嗜热纤维梭菌(Clostridiumthermocellum)、梭状芽孢杆菌(Clostridiumsp.)、卷曲乳杆菌(Lactobacilluscrispatus)[7]、吡咯伯克霍尔德氏菌(Burkholderiapyrrocinia)[22]、植物乳杆菌(Lactobacillus plantarum)、发酵乳杆菌(Lactobacillusfermentum)[15]、淀粉乳杆菌(Lactobacillusamylovorus)[26]、嗜酸乳杆菌(Lactobacillusacidophilus)[30]、约氏乳杆菌(Lactobacillus johnsonii)[6]、法氏乳杆菌(Lactobacillusfarciminis)、短小芽孢杆菌(Bacilluspumilus)[23]、热葡萄糖苷地芽孢杆菌(Geobacillusthermoglucosidasius)[17]、纤维堆囊菌(Sorangiumcellulosum)和肠拟杆菌(Bacteroidesintestinalis)等。FAEs 的来源放线菌主要包括橄榄色链霉菌(Streptomycesolivaceus)和肉桂链霉菌(Streptomycescinnamoneus)[8]等。基于宏基因组分析的FAEs 的来源微生物包括瘤胃微生物[6]、白蚁肠道微生物、堆肥微生物、土壤微生物[28]和马粪便微生物。
1.2 阿魏酸酯酶的分类
FAEs 可水解多种底物,如MFA、MCA、ChA/CGA、RA等,FAEs 环内氨基酸残基、催化位点附近的结构以及底物结合位点的差异使FAEs 具有不同的底物谱。最早的FAEs 分为A 型和B 型,该方法主要依据FAEs 酯化释放阿魏酸二聚体进行分类。后来,FAEs 被分为A、B、C、D 4 类,该分类方法依据FAEs 对4 种模式底物的水解特性及释放二阿魏酸的能力(见表2 和图1)。但该分类方法不包括部分细菌来源的FAEs,这部分FAEs 被归类为E 类。
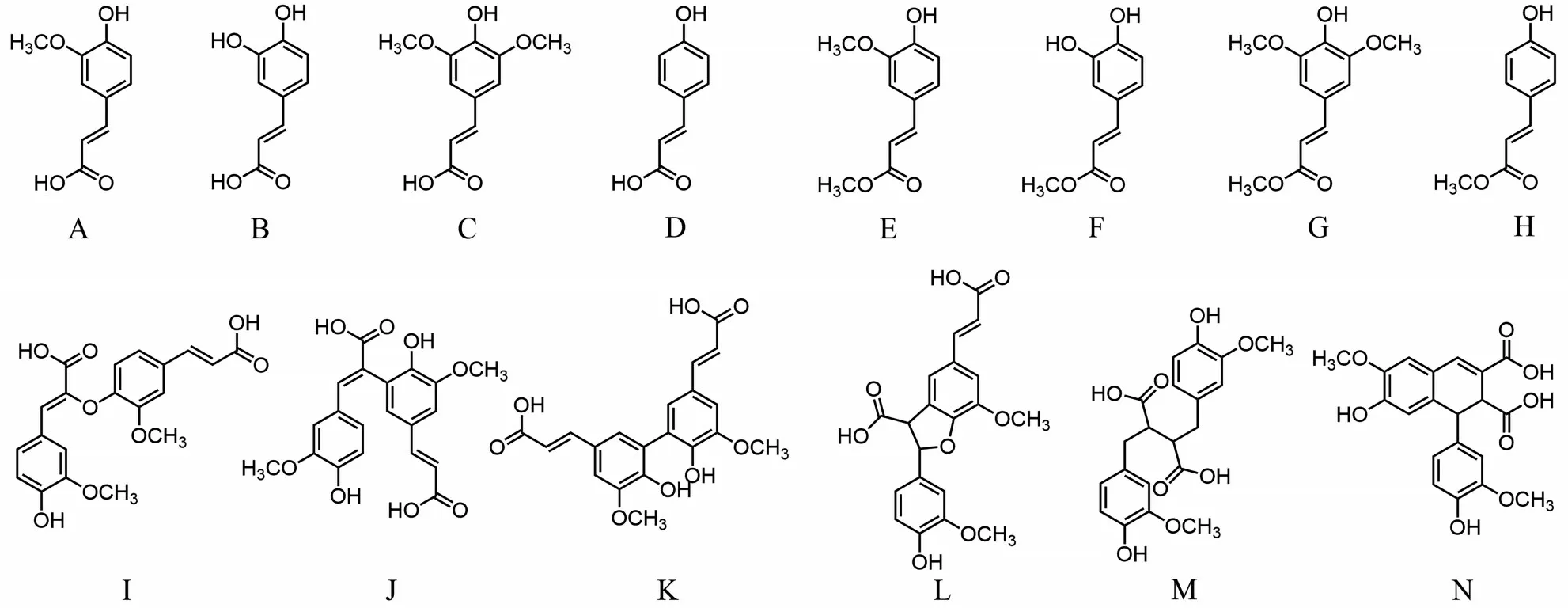
图1 羟基肉桂酸、羟基肉桂酸酯及阿魏酸二聚体结构Fig.1 Structures of hydroxycinnamic acid,hydroxycinnamic acid ester,and ferulic acid dimer
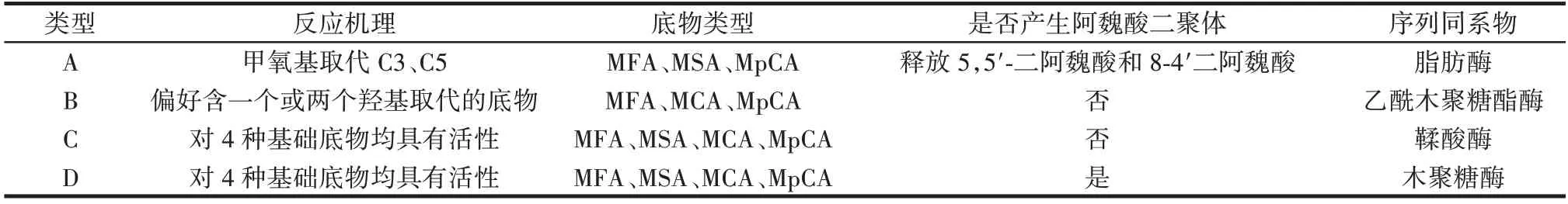
表2 FAEs 的分类Table 2 Classification of feruloyl esterases
2 阿魏酸酯酶的结构及其催化机制
2.1 阿魏酸酯酶的三维结构
FAEs 为高度分化的酯酶,在结构上有明显差异。目前,包括来源于嗜热纤维梭菌[31]、黑曲霉[32]、米麴菌、肉桂链霉菌、植物乳杆菌、尖刀镰孢菌[33]、热葡萄糖苷地芽孢杆菌[34]以及肠拟杆菌[35]等的FAEs 已经获得晶体结构。不同来源的FAEs 属于不同家族,但大多遵循Ser-His-Asp 三联体的催化机制并以丝氨酸(Ser)为亲核中心。图2 列举了3 种不同来源的FAEs 晶体结构。
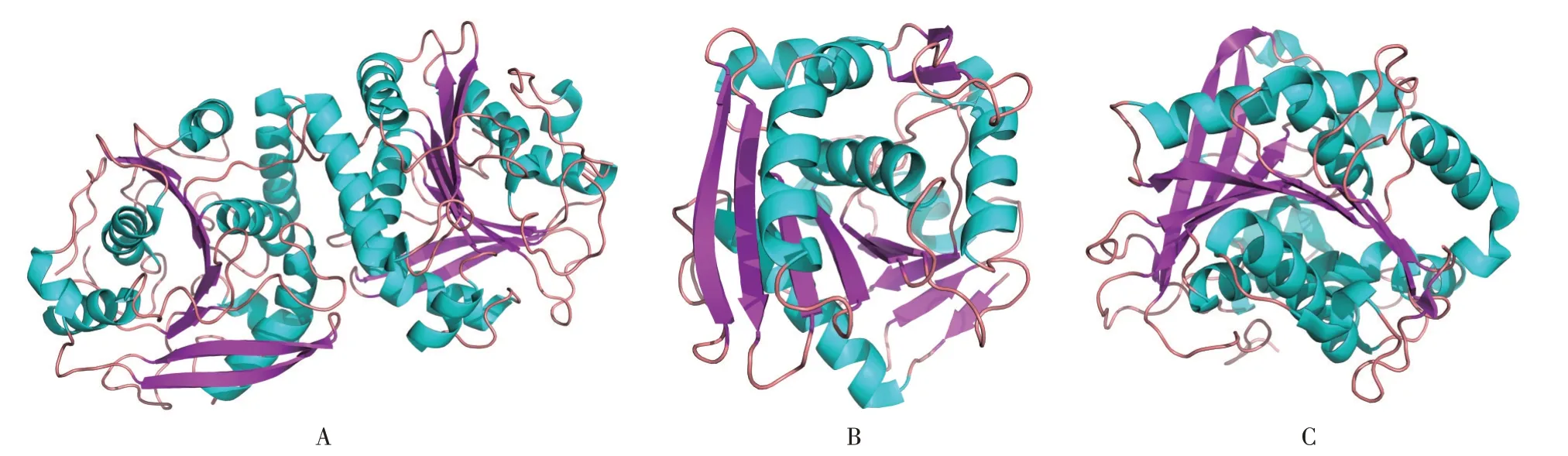
图2 不同来源的FAEs 晶体结构Fig.2 Crystal structures of different feruloyl esterases
2001年,来源于嗜热纤维梭菌的FAEs 晶体结构首次被解析,其催化三联体为Ser954-Asp1018-His1058,属于α/β 水解酶[36]。2004年Hermoso 等[37]解析了AnFaeA 的晶体结构,其来源于黑曲霉,催化三联体为Ser133-Asp194-His247,活性位点由盖子结构(残基68-80)和环(残基226-244)组成。2018年Misugi等[8]解析了肉桂链霉菌来源的FAEs 结构,其三联体为Ser191-Asp214-His268,loop 环(Lys142-Asp152)组成疏水口袋。2011年,Udatha 等[38]报道了324 个FAEs 序列的Ser-Asp-His 催化三联体。有报道显示,在紫孢侧耳菌中发现了罕见的Ser-His-Glu 催化三联体水解机制,该三联体由亲核丝氨酸、绝对保守的组氨酸和酸性残基(天冬氨酸或谷氨酸)组成,天冬氨酸和谷氨酸都可以作为水解催化三联体中的质子受体,这种机制在FAEs 中很罕见,多见于α/β 水解酶超家族。
目前,较多关于黑曲霉来源的FAEs 文献被报道。Hermoso 等[37]已解析来源于黑曲霉的AnFaeA(PDB:1USW)。来源于黑曲霉的FAEs 催化位点构象见图3。
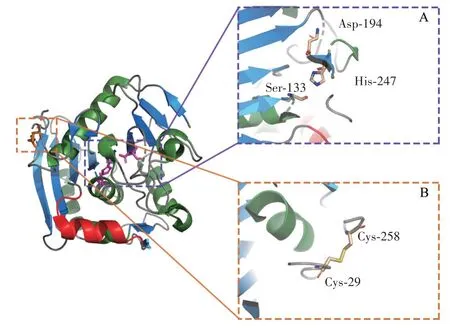
图3 来源于黑曲霉的FAEs 催化位点构象Fig.3 Conformation of catalytic site of feruloyl esterases from Aspergillus niger
AnFaeA 的构象采用α/β 水解酶折叠构象,由一组主要的9 链混合β 折叠、两组次要的2 链β 折叠和7 个α 螺旋组成。AnFaeA 存在3 个二硫键,其中Cys29-Cys258 形成了一个包埋Trp 残基的疏水口袋。AnFaeA 的催化三联体为Ser133-Asp194-His247,Ser残基具有构成亲核的共有序列GXSXG。AnFaeA 有类似于脂肪酶盖子结构(Lid)的α-螺旋结构(68~80 位残基),但相较脂肪酶盖子结构,AnFaeA 具有更高比例的极性氨基酸残基和α-螺旋结构糖基化修饰(N79 YTL)。这使AnFaeA 不具有脂肪酶相应结构的“开-关”活性中心的功能,也不具备“界面激活”的催化特性。
2.2 阿魏酸酯酶的催化机理
FAEs 常使用阿魏酰寡糖(如阿魏酸-Ara-Xyl1-3、阿魏酸-Ara 1-3、对香豆酰Ara-Xyl1-3)、羟基肉桂酸模型底物(甲基、乙基、对硝基苯基、α-萘基阿魏酸)、短链脂肪酸模型底物(如α-乙酸萘酯、乙酸伞形花酯和丁酸伞形花酯)作为活性测定底物。但该模型只显示该酶是否具有活性,而不显示它们是否对FA 或羟基肉桂酸具有特异性。自然界中FAEs 可以以麦麸、玉米秸秆等植物生物质为底物,水解羟基肉桂酸和木聚糖相连的酯键释放羟基肉桂酸,也可以水解生成酚类化合物。在麦麸、玉米秸秆等农业生产废弃物中,酯键将羟基肉桂酸和阿魏酸二聚体与木聚糖相连,具体见图4。
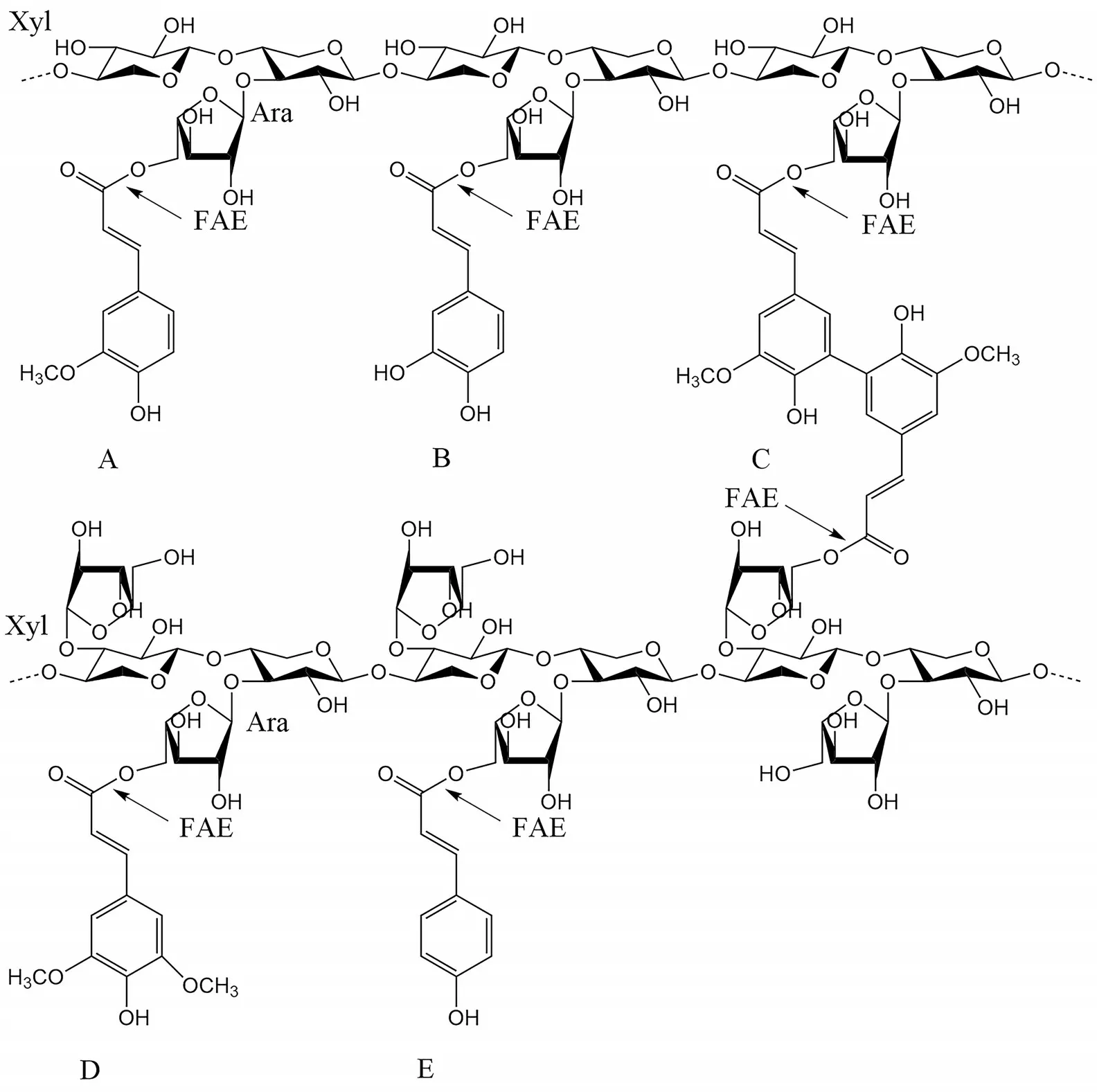
图4 羟基肉桂酸和阿魏酸二聚体连接阿拉伯木聚糖酯Fig.4 Linkage of hydroxycinnamic acid and diferulic acid with arabinoxylan ester
FAEs 催化机制与丝氨酸蛋白酶家族一致,常使用丝氨酸亲核攻击反应。催化过程分为酰化和脱酰两个步骤,脱酰步骤决定了催化效率。FAEs 的催化机理见图5。
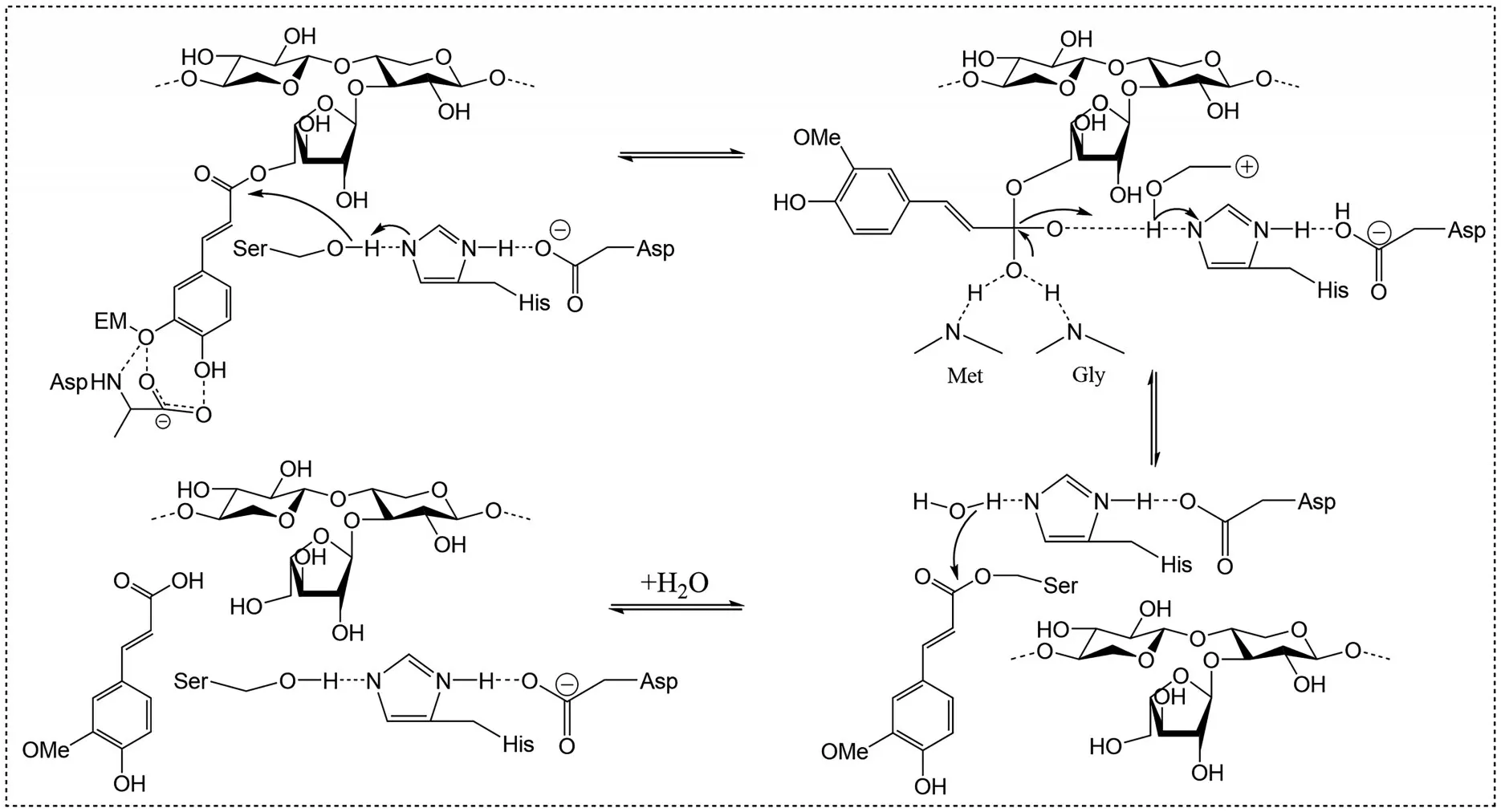
图5 FAEs 的催化机理Fig.5 Catalytic mechanism of feruloyl esterases
酰化过程起始于丝氨酸中的羟基氧亲核攻击底物酯键中的羰基碳,随后丝氨酸的质子转移到组氨酸咪唑基团。羰基氧(氧阴离子)与两个NH 基团(氧阴离子洞)通过静电作用维持稳态;质子化的组氨酸与天冬氨酸形成氢键。此时底物酯与三元催化体构成过渡态四面体。随后,质子化的组氨酸将质子传递给底物酯中的氧,此时四面体稳态破坏,形成酰基-酶中间体,进入脱酰过程。脱酰过程:形成中间体后弱亲核试剂(水、低聚寡糖、醇类物质)攻击酰基-酶中间体中的羰基碳,随后组氨酸夺取弱亲核试剂中的质子,形成新的过渡态四面体。之后质子被质子化的组氨酸转移到丝氨酸的羟基氧中,新的四面体解体释放底物。
3 阿魏酸酯酶的工程化改造及高通量筛选
天然来源的FAEs 热稳定性差、催化活力弱,因此FAEs 的分子改造获得了广泛的研究。目前,FAEs 的改造策略主要包括定向进化、半理性设计以及理性设计。部分FAEs 分子改造的代表性成果见表3。
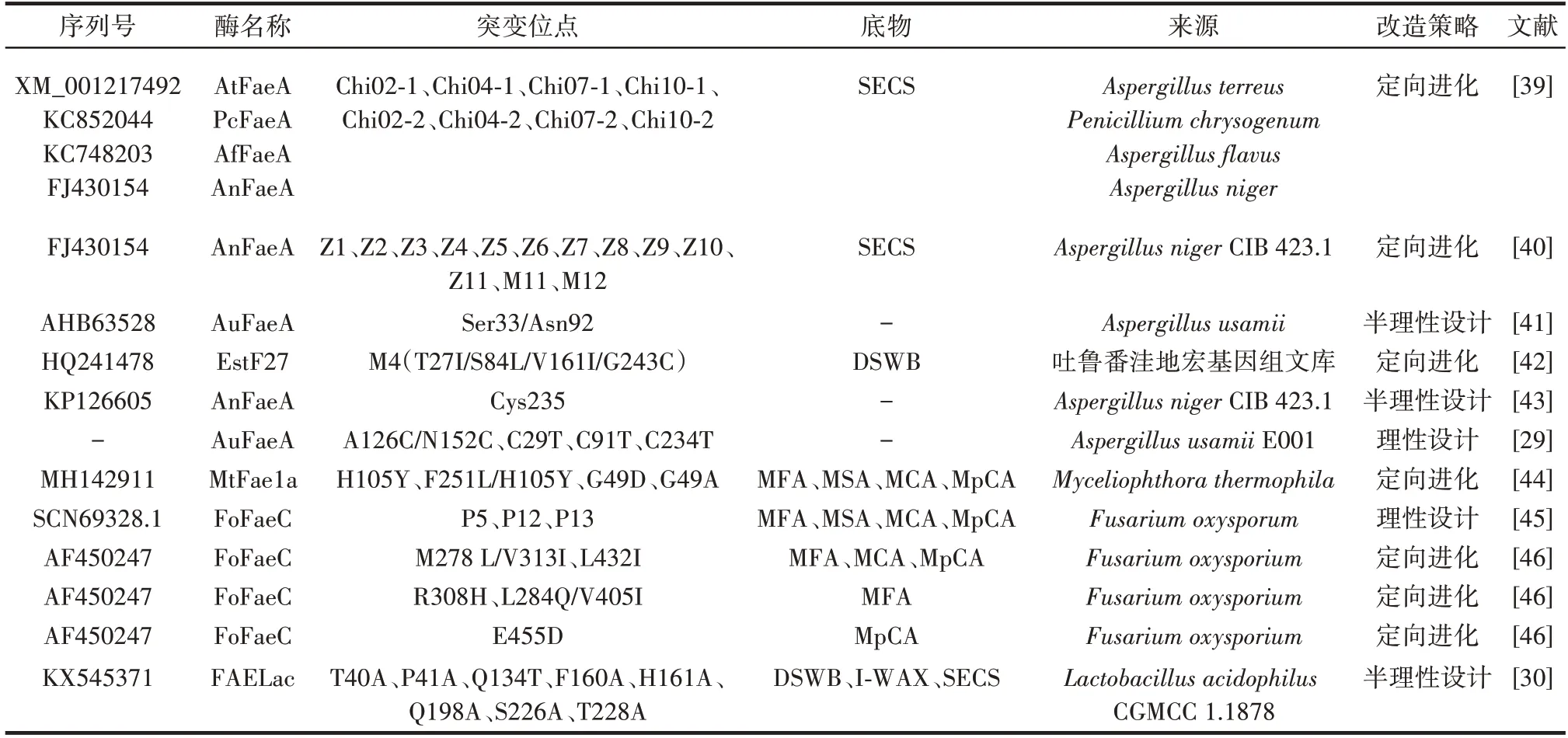
表3 部分FAEs 分子改造的代表性成果Table 3 Representative results of molecular modification of feruloyl esterases
3.1 阿魏酸酯酶的定向进化
定向进化方法主要分为基于非重组的体外随机进化、基于重组的体外随机进化和基于重组的体内随机进化。基于非重组的体外随机进化如易错PCR(errorprone PCR,epPCR)、基于重组的体外随机进化如DNA改组(DNA shuffling)[47]、基于重组的体内随机进化如多元基因组工程(multiplex automated genome engineering,MAGE)、多元质粒工程(multiplex iterative plasmid engineering,MIPE)等,以上策略均已广泛应用。ep-PCR 也称随机突变,指在扩增目的基因的同时引入碱基错配,控制DNA 突变频率是关键。epPCR 理想碱基置换率依赖于随机突变的DNA 片段长度,DNA 突变频率一般为每1 000 个碱基0.25~20 个置换。Varriale等[44]通过epPCR 技术进行定向进化试验以获得比野生酶活性更高的变体。最佳变体L432I 粗上清液可水解除MSA 外的所有受试底物,其对MpCA、MFA 和MCA 的水解活性高于野生型FoFaeC。
DNA 改组技术又称有性PCR,通过组合亲本基因群中的突变以获取最佳突变组合的酶。DNA 改组不仅可加速积累有益突变,而且可使酶的两个或更多的已优化性质合为一体。Li 等[41]采用DNA 改组技术,从由4 种同源亲本FAEs 构建的DNA 改组文库中筛选出热稳定性增强的嵌合体FAEs,加入2~4 个有益突变后,与亲本酶相比嵌合体65 ℃下的半衰期增加了22 倍,FA 的释放量增加了12.8 倍。
3.2 阿魏酸酯酶的半理性设计
半理性设计采用非随机方式更有针对性地改造蛋白质、提高筛选效率,包括蛋白质序列比对、晶体结构分析等。半理性设计的关键是通过计算机模拟获得潜在的有益突变位点,再利用适当的饱和突变技术构建突变文库。饱和突变技术包括基因位点饱和诱变技术(gene site saturation mutagenesis,GSSM)、组合活性中心饱和突变技术(combinatorial active site saturation test,CAST)、迭代饱和突变技术(iterative saturation mutagenesis,ISM)等。Yin 等[48]通过ISM 技术,根据BFITTER 软件分析的B 因子值和PoPMuSiC 算法预测的ΔG 值,对Ser33 和Asn92 两种氨基酸进行饱和突变。通过序列筛选法初步筛选出15 个变异株,最佳变异株S33E/N92R 在50 ℃下的半衰期为野生型FAEs的3.6 倍。可见ISM 技术显著提升了FAEs 的热稳定性,有望在工业应用中促进植物生物质材料在高温下的酶降解。
3.3 阿魏酸酯酶的理性设计
理性设计是指通过计算机建模预测蛋白质活性位点以及突变对目标蛋白稳定性、折叠以及与底物结合的影响。理性设计通过蛋白质设计指导和模拟筛选试验,提高试验的成功率,方法主要有同源比对、蛋白质表面电荷优化、设计二硫键等。Yin 等[29]使用MODIP和DbD 计算工具,预测二硫键,同时使用MD 模拟设计额外的二硫键,探究二硫键对来源于宇佐美曲霉的FAEs 热稳定性的影响。研究表明,引入二硫键后变异体在55 ℃下的半衰期为188 min,与野生型相比提高了12.5 倍。消除天然二硫键后蛋白的热稳定性至少降低10 ℃。结果证实,二硫键对FAEs 的热稳定性有显著贡献。Antonopoulou 等[45]采用小分子对接模拟技术对来源于尖刀镰孢菌的FAEs 进行理性设计。结果表明,突变体对于4 种模型底物的亲和力提高,但对含有羟基取代底物的催化效率和转化率降低。
生物合成技术如定向进化、半理性设计、理性设计等可增加FAEs 的多样性,但如何从大量的突变体中筛选有益突变仍是亟需解决的问题。其筛选方法主要分为功能筛选和序列筛选。功能筛选包括表型检测法、异源互补法、诱导基因表达法,根据宿主菌外在表征(水解圈、抑菌圈、颜色反应)筛选阳性克隆子。该方法要求目的蛋白和底物的反应易于鉴定,编码基因在外源宿主细胞中充分表达。其中表型检测法是使用最多的方法,可通过设计显色底物、荧光探针[49]高通量筛选FAEs。目前,有研究用单体羟基肉桂酸酯模型底物检测发色团(如对硝基苯基、α-萘基阿魏酸酯)的释放或底物(如甲基、阿魏酸乙酯)的还原,也有研究以荧光物质为底物(如CNPF[41]、4NTC-Fe[44])使用显色法进行筛选,此类方法可能会造成底物和产物之间的光谱重叠,但快速且易于执行。反相高效液相色谱法是检测FA 和羟基肉桂酸从阿魏酰化多糖和寡糖中释放的最常用技术。但它非常耗时,并且通常需要在分析之前先进行分离或提取步骤,因此也有研究使用高效薄层色谱法和电化学传感器法进行酶促筛选。序列筛选包括PCR 法、生物信息学法,可依据序列的相似性,以相关功能基因的保守序列为基础设计PCR 引物,然后通过PCR 扩增筛选期望的目标克隆。该方法不依赖外源基因在宿主细胞中的表达,但较难发现新型基因。
4 阿魏酸酯酶在食品领域中的应用
4.1 阿魏酸酯酶在面团发酵中的应用
小麦粉是许多烘焙产品的主要成分,阿拉伯木聚糖是面团改良的主要目标,由水溶性阿拉伯木聚糖(water-extractable arabinoxylan,WEAX)和不溶性阿拉伯木聚糖(water-unextractable arabinoxylan,WUAX)组成。FAEs 可作为辅助酶与木聚糖酶、纤维素酶协同作用增加阿拉伯木聚糖含量和面团体积[50]。Schulz等[12]将FAEs 与具有木聚糖酶活性的α-淀粉酶和半纤维素酶联合使用进行烘焙,结果表明在面团制备过程中添加低活性FAEs 后,面包体积增加,reSwFAED 和多糖降解酶处理后面包体积增加的原因可能是WUAX 转化为WEAX。与WEAX 相比,WUAX 对烘焙产品有负面影响,因为它们吸附水分并阻碍面筋网络的形成。
4.2 阿魏酸酯酶在酒类酿造中的应用
衡量啤酒质量的标准有香气、麦汁过滤速度、风味稳定性等。FAEs 可与木聚糖酶协同应用,以促进大米和其他谷物释放FA 等香气成分,在发酵和老化过程中转化为芳香族衍生物。Uno 等[51]对发酵清酒中FAEs 活性进行测定,发现FA 的浓度在接种后9~12 d达到最高。造成麦汁过滤速度较慢的原因主要是麦芽中的阿拉伯木聚糖发生氧化交联反应,在大麦麦芽糖化阶段添加FAEs 可提高麦芽的过滤性能。通过清除过氧自由基或提高酚酸含量可以增强啤酒风味稳定性,也可通过添加FA 清除啤酒中的羰自由基和过氧自由基,抑制羰基化合物形成,提高啤酒抗氧化力。Szwagjier[52]在麦芽糖化过程中添加FAEs,使麦汁中游离酚酸和FA 含量升高,大大提高了麦汁的抗氧化能力。
4.3 阿魏酸酯酶在膳食纤维补充剂中的应用
FAEs 或产FAEs 的乳酸菌可制作成酶制剂直接服用,提高人体对膳食的生物利用度。细菌细胞在消化道内易被降解,因此可用微胶囊包封技术保持FAEs活性。Tomaro-Duchesneau 等[53]和Bhathena 等[54]的研究均利用海藻酸盐-聚赖氨酸-海藻酸盐微胶囊包封FAEs 生产菌,结果证实,游离发酵乳杆菌和微胶囊化发酵乳杆菌活力差异显著,证明了FAEs 在膳食纤维补充剂方面的工业潜力。
4.4 阿魏酸酯酶在茶叶中的应用
冠突散囊菌是黑毛茶、茯苓茶、黑茶等茶叶发酵过程中的优势菌种,有降脂、抗腹泻、降胆固醇、抑菌等保健功能。刘闫等[55]对冠突散囊菌的功效成分进行研究,认为FAEs 可破坏茶叶细胞壁的细胞骨架结构,产生游离FA。冠突散囊菌发酵黑毛茶后FA 产量与当归、佛手散中FA 含量接近,证实了黑毛茶中冠突散囊菌在产FAEs 方面的潜力。陈锦[56]从茯苓茶中筛选出产FAEs 最优冠突散囊菌,对茯苓茶中冠突散囊菌产FA 含量及其抗氧化作用进行研究。冠突散囊菌产FA可达44.87 μg/g,其FA 含量与抗氧化能力呈正相关,能用于制备抗氧化性高的新型茶叶。雷林超[57]通过FAEs 与木聚糖酶的协同作用,促进黑茶中木质纤维的降解,以制备富含FA 的新型黑茶茶叶。发酵后FA 可达28.77 μg/g。
4.5 阿魏酸酯酶在低聚木糖制备中的应用
低聚木糖(xylooligosaccharides,XOS)具有降血脂、降血压、抗血栓、抗癌等功效,也能改善肠道菌群、预防腹泻,常作为甜味剂、稳定剂、乳化剂和益生元,广泛应用在食品中,FAEs 可作为辅助酶高效生产XOS。Ávila 等[58]将FAEs 与木聚糖内切酶和α-L-阿拉伯呋喃糖苷酶共同降解甘蔗秸秆和咖啡壳生产XOS,产量分别为10.23 g/L 和8.45 g/L。此外,木聚糖酶/FAEs 双功能酶[59]也被发现,Wang 等[16]将来自细菌EMSD5 的木聚糖酶/FAEs 双功能酶在大肠杆菌中异源表达,以小麦阿拉伯木聚糖、脱浆麦麸、超细磨玉米秸秆和蒸汽爆破玉米为底物,探究FA 和XOS 在不同底物中的释放量,发现在蒸汽爆破玉米芯中FA 释放量最高。
5 总结
FAEs 可水解羟基肉桂酸和阿拉伯木聚糖之间的酯键释放羟基肉桂酸,也可作为辅助酶,高效生产XOS,有潜力成为植物生物质综合利用的重要工具,有较高的商业应用前景。本综述主要总结了FAEs 的来源、结构、分类、催化机理、分子改造及其食品应用方面的研究进展。在过去几年中,FAEs 的工业应用范围不断扩大,其应用主要趋向于将农业工业废料转化为有价值的产品,以及合成新型酯连接的羟基肉桂酸产品如保健品等。但多数天然来源FAEs 热稳定性和催化活性较差,较难应用于工业化生产。在未来研究中,基于以下3 个方面开展进一步的研究:1)通过理性设计、半理性设计以及定向进化等策略对FAEs 进行分子改造是提高其热稳定性和催化活性的有效途径;2)FAEs相关酶的晶体结构数据需要进一步丰富,从而增强氨基酸残基突变位点的选择基础,这也是未来研究中亟待解决的重点问题;3)由于FAEs 的底物具有多样性,如何从大量的突变体中高通量筛选有益突变仍是亟需解决的问题。

