分离自Mahewu中乳酸菌的体外益生潜力评估
Meluleki Hungwe,闫梦娜,许婷婷,李妍,王鑫弛,王艳萍,耿伟涛
(天津科技大学食品科学与工程学院,天津市食品质量与健康重点实验室,天津 300457)
乳酸菌(lactic acid bacteria,LAB)是一类代谢碳水化合物产生乳酸的细菌,它们通常被用作益生菌培养物或发酵食品的发酵剂[1]。竞争力强、性能高的乳酸菌菌株可以通过益生菌潜力测试来筛选,选中的可用作益生菌[2]。益生菌是一种活的生物体,如果足量食用,可以对宿主人体产生一定的健康益处。益生菌的分离和应用所考虑的主要特征是它们在人类食用后被公认为安全(generally recognized as safe,GRAS),并且在食用后能够在体内保证足够数量[3]。目前已有大量关于在动物中使用乳酸菌来调节免疫系统和黏附上皮细胞的研究,证明了发酵过程中用作发酵剂培养物的乳酸菌可以作为益生菌的重要来源[4]。因此,近年来,人们对从不同来源的发酵食品和产品中分离和表征具有益生功能的乳酸菌产生了极大的研究兴趣[5]。
Mahewu 是一种在南部非洲广泛食用的由乳酸菌和酵母菌发酵玉米糊制得的天然发酵饮料[6-7]。这种发酵饮料不仅可以供成年人和幼儿饮用,在贫困地区甚至被用作婴儿的断奶食品[8]。Mahewu 的主要原料为玉米面和水,经煮沸灭菌并放置至冷却后,加入高粱麦芽作为发酵剂[9]。高粱麦芽是制作Mahewu 的关键因素,其可提供发酵过程所需的乳酸菌、酵母菌和β-淀粉酶。已经有研究表明,乳酸菌的发酵作用是赋予Mahewu 众多营养和健康功能的主要原因之一[10]。因此,Mahewu 中分离获得的乳酸菌有潜力作为功能性发酵谷物中的发酵菌种或者作为重要的益生菌进行深入的开发。
乳酸菌作为一种益生菌,需要能够承受胃液的酸性条件,并具有抵抗胆盐的能力,可存活并定殖于或作用于肠道[11-12]。因此,具有益生功能的细菌被用作益生菌之前,必须通过体外评估进行益生特性、安全性的测试[13]。本研究对来自津巴布韦的发酵剂制备的Mahewu 中8 株潜在益生菌进行分离、分子生物学鉴定和益生特性评估,以期为非洲传统发酵食品中益生菌资源开发和功能评价提供一定的研究基础。
1 材料与方法
1.1 材料与试剂
高粱麦芽:津巴布韦Meso 企业(私人)有限公司;硫酸亚铁(FeSO4,分析纯):天津市化学试剂一厂;人工胃液(无菌,pH1.5):福州飞净生物科技有限公司;猪胆汁盐:上海生威科技有限公司;MRS 琼脂、MRS 液体培养基:北京奥博兴生物科技有限公司;过氧化氢(H2O2,分析纯):上海源叶生物科技有限公司;二甲苯、水杨酸、无水甲醇(均为分析纯):上海阿拉丁生化科技有限公司;高糖DMEM 培养基[含10% 胎牛血清(fetal bovine serum,FBS)]:武汉普诺赛生命科技有限公司;胰蛋白酶(250 U/mg)、青霉素、链霉素、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、聚乙二醇辛基苯基醚(均为分析纯):北京索莱宝科技有限公司;DNA 提取试剂盒、Taq PCR Mix 预混液(2×,含蓝染料):生工生物工程(上海)股份有限公司。
1.2 仪器与设备
Eclipse E200 显微镜:日本尼康公司;Multiskan GO全波长读数仪/超微量分光光度计、150i 型CO2细胞培养箱:赛默飞世尔科技公司;Sigma 3-18K 离心机:北京博华仪器有限公司;Delta 320 pH 计:梅特勒托利多科技(中国)有限公司;Gel Doc XR+全自动凝胶成像仪:美国BIO-RAD 公司;DYY-Ⅲ-6B 型稳压稳流电泳仪:北京六一仪器厂;YP-N 普通药物天平:上海精科天平厂;SQL810C/1010C 高压灭菌器:日本YAMATO 公司;DY-2 型厌氧培养箱:浙江冷冻机总厂;UV-9600 型紫外可见分光光度计:北京瑞利分析仪器公司;Mastercycler®X50-PCR 热循环仪:艾本德(中国)有限公司。
1.3 方法
1.3.1 Mahewu 的制备
将蒸馏水与玉米粉按100∶5(mL/g)混合,煮沸15 min,冷却至40 ℃,加发酵剂高粱麦芽,充分搅拌,室温发酵48 h,监测发酵物的pH 值和可滴定酸度(titratable acidity,TTA),参照Onyango 等[14]的方法进行。可滴定酸度(T,%)计算公式如下。
式中:A为滴定所需的NaOH 体积,mL;V为测试的样品的体积,mL;0.009 为乳酸换算系数。
1.3.2 乳酸菌的分离与筛选鉴定
取Mahewu 样品,用MRS 液体培养基梯度稀释,将各梯度的稀释液涂布于MRS 琼脂固体培养基上,37 ℃厌氧培养24 h。挑取平板上符合乳酸菌特征的白色圆形菌落,纯化传代培养3 代后保存于4 ℃。基于表型和生化特征对挑取的菌落进行初步的筛选和鉴定。
使用细菌DNA 提取试剂盒提取乳酸菌菌株的全基因组DNA。使用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)扩增16S rRNA 基因。对聚合酶链式反应(polymerase chain reaction,PCR)产物进行测序,依据16S rRNA 基因测序结果,利用MEGA 11 软件构建系统发育树。
1.3.3 菌株耐酸和耐胆盐能力的测定
参考Li 等[15]测定菌株对模拟胃液和胆盐的耐受性。各个菌株接种到MRS 液体培养基中过夜培养,将离心(4 ℃,8 000 r/min,10 min)获得的菌体沉淀经磷酸盐缓冲溶液(phosphate belanced solution,PBS)洗涤两次后用pH1.5 的模拟胃液(simulated gastric juice,SGJ)悬浮。37 ℃孵育3 h,收集0 h 和3 h 的样品各100 μL,接种至5 mL MRS 液体培养基中,培养8 h 后测量OD600,分别记为A1、A2。菌株在模拟胃液下的存活率(W,%)使用以下公式进行计算。
配制含有猪胆汁盐浓度分别为0%、0.1%、0.3%和0.5% 的MRS 液体培养基后,以1% 接种量接种各乳酸菌,培养4 h 后,测量培养物的OD600,试验组记为A1,对照组记为A0。不同浓度胆盐条件下的存活率(D,%)使用以下公式进行计算。
1.3.4 细胞表面疏水性和自聚集能力测定
将待测菌株的培养物经4 ℃、8 000 r/min 离心10 min,收集菌体细胞,参照Rokana 等[16]的方法进行细胞表面疏水性的测定,参照Zommiti 等[17]的方法进行自聚集能力测定。
将菌体细胞在PBS 中洗涤两次后重悬于PBS 中,测量600 nm 处吸光度(A0)。将1 mL 二甲苯与3 mL细胞悬液混合后,37 ℃孵育1h 确保有机相和水相分离。随后,取1 mL 水相在600 nm 处测量吸光度(A1)。细胞疏水性(X,%)利用以下公式计算。
将收集的各个菌株的菌体细胞在PBS 中洗涤两次后,重悬在PBS 中至OD 值在0.3 左右,并置于厌氧培养箱中37 ℃孵育。于2、6、12、24 h 后,测定上层悬浮液在600 nm 处吸光度。自聚集能力(Z,%)利用以下公式计算。
式中:A1为2、6、12、24 h 后的吸光度;A0为0 h 时的初始吸光度。
1.3.5 DPPH 自由基清除活性测定
各个菌株对DPPH 自由基的清除活性参照Halliwell 等[18]的方法进行。将1 mL 过夜培养的离心(4 ℃、6 000 r/min、20 min)获取的菌液上清液分别与1 mL DPPH 溶液(0.2 mmol/L,无水乙醇溶解)或1 mL 无水乙醇混合,静置30 min 后,6 000 r/min 离心20 min 取上清,于517 nm 处测量吸光度,记录为As或Ab。同样,1 mL 发酵液上清与1 mL DPPH 溶液混合后,经反应后于517 nm 处测量吸光度作为空白对照(Ac),DPPH 自由基清除活性(P,%)计算公式如下。
1.3.6 羟基自由基清除活性测定
羟基自由基清除活性的测定参照Halliwell 等[18]的方法,并略作修改。在试管中依次加入1 mL FeSO4溶液(5 mmol/L)、1 mL 水杨酸-乙醇溶液(5 mmol/L)以及1 mL H2O2(3 mmol/L),混合均匀后,加入各菌株发酵液上清1 mL,加入去离子水定容到10 mL。混匀后37 ℃水浴30 min,6 000 r/min 离心20 min 后所得的上清液于510 nm 处测吸光度。同上述处理相同,空白培养基代替发酵液上清进行吸光度的测量,羟基自由基清除活性(Q,%)计算公式如下。
式中:Ac为空白培养基参与反应后在510 nm 处的吸光度;As为各发酵液上清参与反应后在510 nm 处的吸光度。
1.3.7 Caco-2 细胞黏附能力测试
按照占萌等[19]的方法,Caco-2 细胞在含10% FBS和双抗(100 U/mL 青霉素和100 μg/mL 链霉素)的DMEM 培养基,于37 ℃、5%CO2的CO2细胞培养箱中培养,每2 d 换液1 次,待细胞贴壁生长为单层细胞后,加入0.5 mL 0.25% 的胰酶消化后进行传代。经计数后,以每孔1 mL(1×106个/mL Caco-2 细胞)接种于12 孔板中,于37 ℃、5%CO2的CO2细胞培养箱中再次培养至单层贴壁,无菌PBS 洗涤细胞3 次后用于黏附试验。
待测菌株接种于MRS 液体培养基,培养24 h 后,8 000 r/min 离心5 min 收集菌体,PBS 洗涤3 次后,利用PBS 进行重悬,制备浓度约为108CFU/mL 的菌体悬液。
取1 mL 制备好的乳酸菌菌体悬液,分别加入单层Caco-2 细胞的12 孔板中,37 ℃、5%CO2条件下共孵育3 h。随后,弃去孔中的菌悬液,并利用无菌PBS 清洗3 次除去未黏附的乳酸菌细胞。利用1 mL 的1% 聚乙二醇辛基苯基醚(Triton X-100)裂解细胞20 min,稀释涂布MRS 平板,对黏附在Caco-2 细胞上的乳酸菌进行计数,记为x,接种的细胞数记为y。乳酸菌菌株对Caco-2 细胞的黏附能力通过黏附率进行表征,黏附率(N,%)计算公式如下。
1.4 数据处理
数据分析使用SPSS 26.0 软件,所有试验均进行3 次,结果以平均值±标准差表示。在p<0.05 的水平上有显著性差异。
2 结果与分析
2.1 Mahewu 的pH 值和可滴定酸度
Mahewu 利用高粱麦芽中的乳酸菌和酵母菌对煮沸的玉米糊进行发酵制备。其中,酸度是Mahewu 发酵过程中的重要指标。Mahewu 的pH 值和可滴定酸度的变化如图1所示。
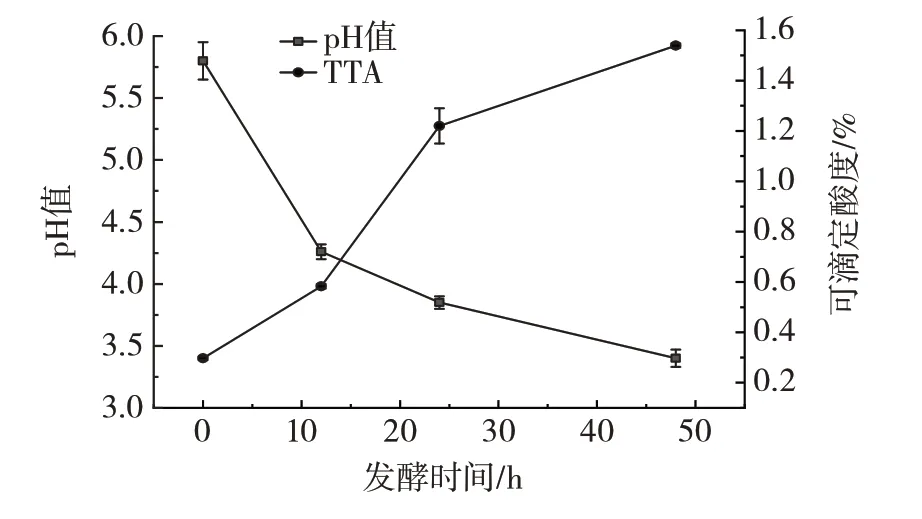
图1 Mahewu 发酵过程中的pH 值和可滴定酸度变化Fig.1 pH and titratable acidity during Mahewu fermentation
由图1 可知,在发酵开始10 h 内pH 值迅速下降,48 h 后pH 值降至3.33。同时,初始为0.29% 的可滴定酸度在20 h 内迅速上升,在发酵结束时增加到1.53%。pH 值和可滴定酸度的变化符合Mahewu 生产过程中的发酵特征[20]。
2.2 Mahewu中乳酸菌的分离和鉴定
将发酵48 h 的Mahewu 经MRS 液体培养基梯度稀释,于MRS 琼脂上培养48 h 后,获得大量乳酸菌菌落。随后,通过形态观察过氧化氢酶试验和革兰氏染色,选取了8 株(菌株编号分别为H-1、H-3、H-4、H-7、H-9、H-11、H-14 和H-17)显示具有典型乳酸菌特征的菌株进行后续研究。其中,H-1、H-3、H-7、H-14 和H-17 为杆菌,而H-4 和H-9 为球菌。
对分离获得的菌株进行基于16S rRNA 的菌种鉴定。克隆并测序获得相应菌株的16S rRNA 序列后,BLAST 进行序列比对初步获得相关菌株的种属信息。选取若干参考菌株的16S rDNA 序列进行系统发育树的绘制,结果如图2所示。
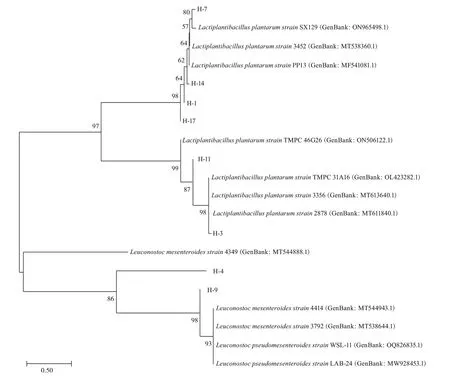
图2 分离菌株与参考菌株共同绘制的系统发育树Fig.2 Phylogenetic tree of isolated strains and reference strains
由图2 可知,菌株H-1、H-3、H-7、H-11、H-14 和H-17 与植物乳植杆菌(Lactiplantibacillusplantarum)最为相似,而菌株H-4 和H-9 与肠膜状明串珠菌(Leuconostocmesenteroides)或假肠膜状明串珠菌(Leuconostoc pseudomesenteroides)最为相似。上述类群均已被列入欧洲食品安全局资格认定名单的推荐生物制剂列表以及国际乳品联合会公报的“在发酵食品中证明安全的微生物品种目录”[21]。
2.3 对模拟胃液和胆盐的耐受性
对严苛的胃肠道环境的耐受性是乳酸菌发挥益生菌功能的基础[22],因此本研究对Mahewu 中分离的乳酸菌进行了模拟胃液和胆盐的耐受性研究。模拟胃液主要由稀酸、胃蛋白酶等组成,经无菌处理,其组分和pH 值与胃液一致。各个菌株对模拟胃液的耐受性如图3所示。
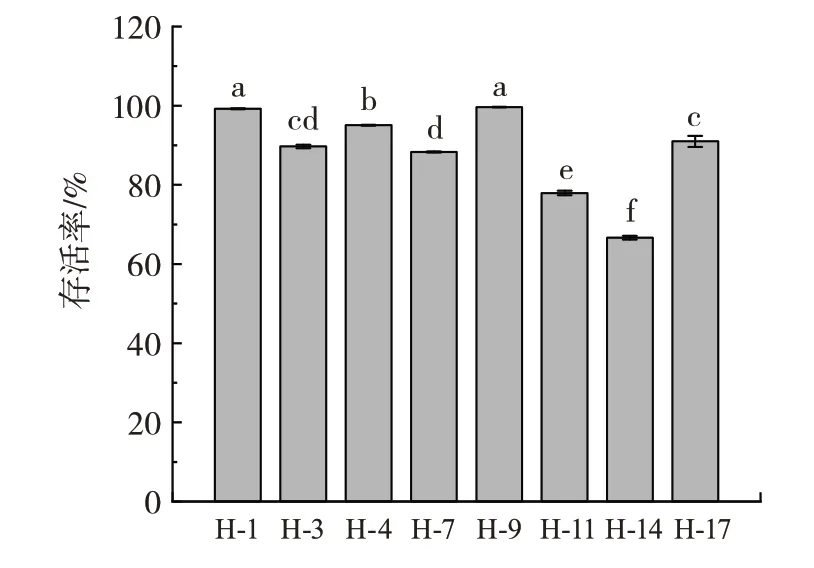
图3 乳酸菌菌株对模拟胃液的耐受性Fig.3 Tolerance of lactic acid bacteria to simulated gastric juice
由图3 可知,所有分离的菌株的存活率均在60%以上。菌株H-9 具有最高的存活率(99.62%),菌株H-1 和H-4 的存活率略低于菌株H-9,分别为99.30%和95.15%。菌株H-14 对模拟胃液的耐受性最低,存活率仅为66.30%。
菌株对不同浓度的胆盐的耐受性如图4所示。
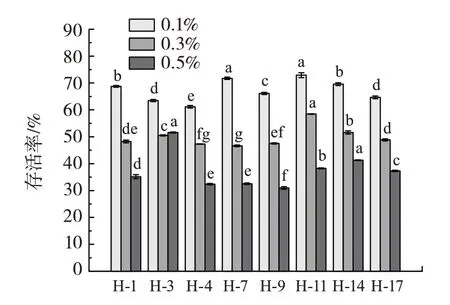
图4 乳酸菌菌株对不同浓度胆盐的耐受性Fig.4 Tolerance of lactic acid bacteria to different concentrations of bile salts
由图4 可知,所有菌株对0.1% 胆盐具有耐受性,存活率超过60%,菌株H-7 和H-11 的存活率甚至超过了70%;当胆盐浓度为0.3%时,所有菌株存活率均超过45%,H-11 的存活率最高。胆盐浓度为0.5%时,所有菌株的生长均受到很强的抑制,其中菌株H-3 对胆盐的耐受性最高,达到了51.4%。
2.4 分离菌株的细胞表面疏水性和自聚集能力
细菌的疏水性和自聚集能力是一种细胞表面特性,有助于实现乳酸菌菌株在消化道自身的保护和对肠道的黏附。自聚集的体外测试有助于评估益生菌在胃肠道黏附和定殖的潜在能力[23]。分离菌株的细胞表面疏水性如图5所示。
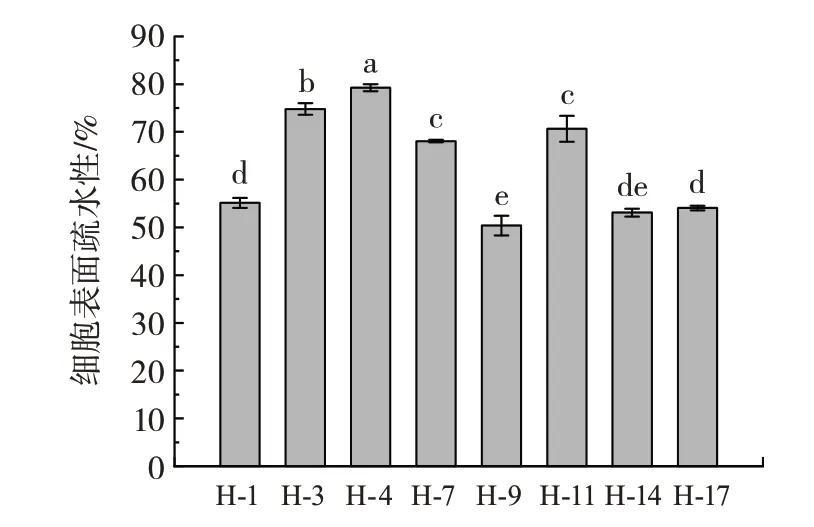
图5 菌株的细胞表面疏水性Fig.5 Cell surface hydrophobicity of the bacteria
由图5 可知,疏水性最高的菌株为H-4,达到了79.00%;除此以外,菌株H-3、H-7 和H-11 也具有较高的疏水性(74.80%、68.06% 和70.65%)。疏水性最低的为菌株H-9,其疏水性仅为49.35%。
图6 为各乳酸菌菌株的自聚集能力。
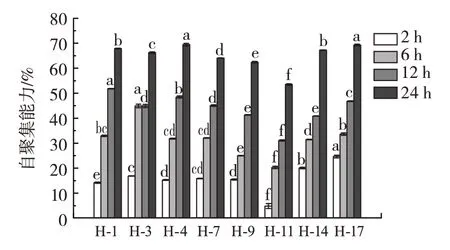
图6 菌株的自聚集能力Fig.6 Auto aggregation of the bacteria
由图6 可知,各个菌株随着时间的延长自聚集的现象逐渐加强。其中,菌株H-1、H-4 和H-17 在各个时间段均表现出较强的自聚集能力,并且菌株H-4 和H-17 在24 h 表现出较强的自聚集能力,分别为68.89%和68.81%。
2.5 对Caco-2 细胞的黏附能力
进一步利用人结肠癌细胞系Caco-2 细胞株测试本研究所分离的乳酸菌对肠道上皮细胞的黏附能力。Caco-2 细胞是一种体外培养的肠上皮细胞,可以经体外培养表现出成熟的肠上皮细胞的特性,并作为细胞模型来进行益生菌在肠道表皮黏附的模拟试验[24]。经过3 h 的共孵育使得各个菌株菌体细胞充分与Caco-2细胞黏附,对黏附有乳酸菌的Caco-2 细胞进行裂解处理,并对黏附的乳酸菌进行活菌计数,结果见图7。
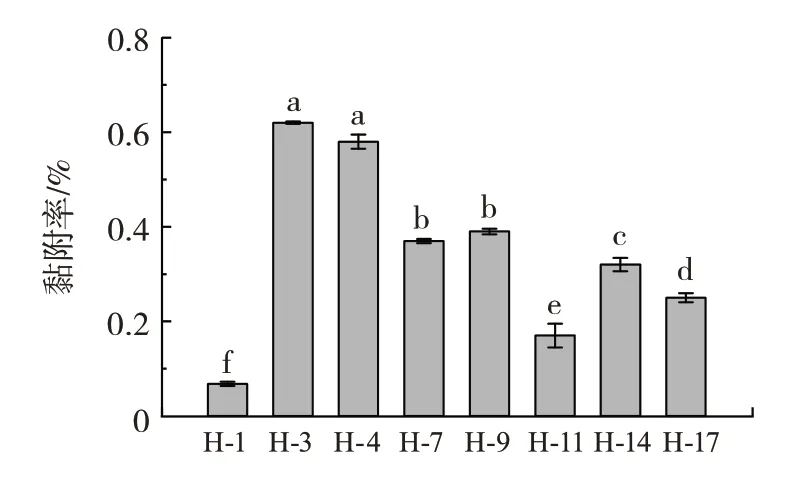
图7 各菌株对Caco-2 细胞的黏附性Fig.7 The adhesion ability of the bacteria
由图7 可知,各组的乳酸菌数目均为106CFU/孔左右,计算黏附效率得到全部菌株的黏附效率在0.068%~0.620% 之间。其中,菌株H-3 的黏附率最高(0.620%),而表面疏水性和自聚集能力均为最强的菌株H-4 具有0.58% 的黏附率。菌株H-1 的黏附率最低,仅为0.068%。
2.6 分离菌株的抗氧化能力
抗氧化能力指的是对于氧自由基和其他形成自由基的物质的消除或减少作用。菌株的抗氧化能力是评价益生菌品质时需要考虑的关键特征之一。DPPH 自由基清除活性的测定是一种常用的筛选与测定样品抗氧化性能的有效和直接的方法[18]。DPPH 自由基清除活性与羟基自由基清除活性见图8 和图9。
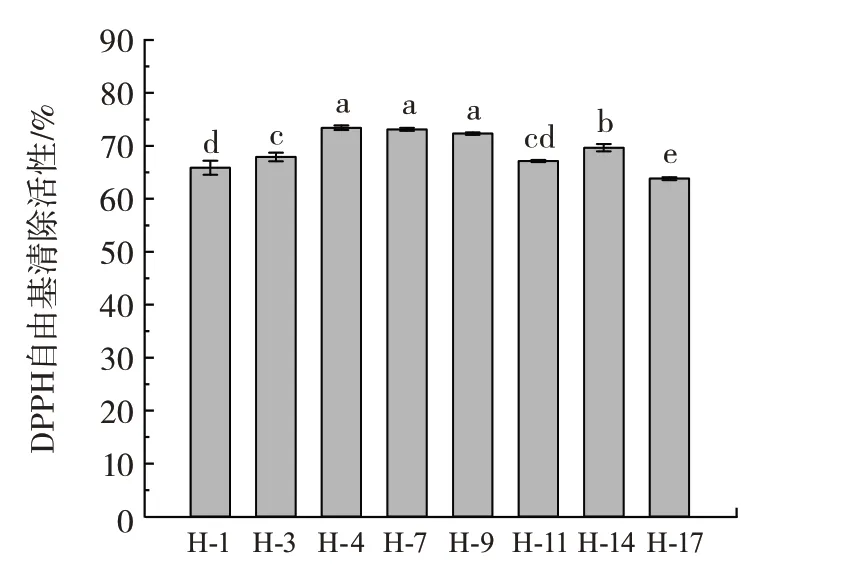
图8 不同菌株对DPPH 自由基清除活性Fig.8 DPPH radical scavenging activity of different strains of bacteria
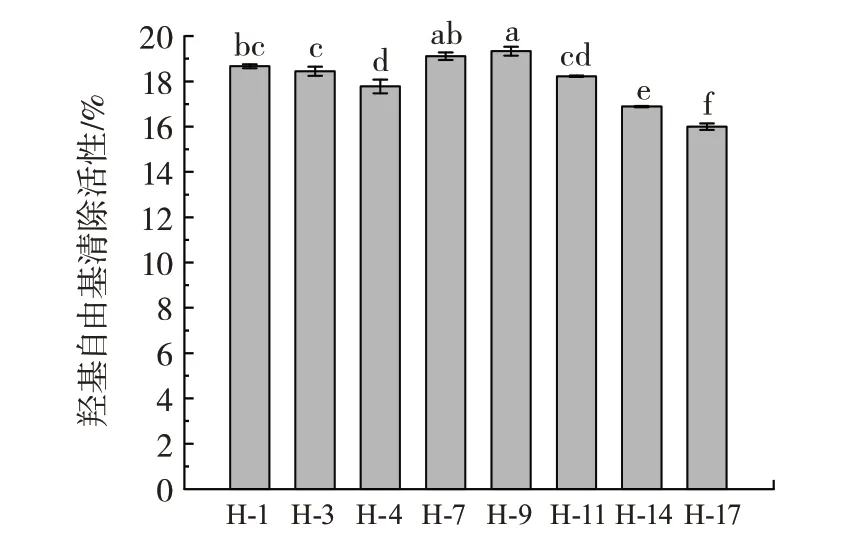
图9 不同菌株对羟基自由基清除活性Fig.9 Hydroxyl radical scavenging activity of different strains of bacteria
图8 显示,所有菌株的DPPH 自由基清除活性均在63% 以上,其中,菌株H-4 的DPPH 自由基清除活性最高,为73.43%;其次是菌株H-7,为73.12%。羟基自由基是体内芬顿反应的主要产物之一,是一种生物体内重要的活性自由基[25]。在图9 中,本试验测定的8 株菌株的发酵液上清对羟基自由基的清除活性在16.00%~19.33% 之间,均表现出一定的羟基自由基清除活性。其中,菌株H-9 的清除活性最强,为19.33%,其次是菌株H-7,具有19.11%的羟基清除活性。
3 结论
在本研究中,对来自津巴布韦的发酵剂制备的Mahewu 中筛选得到的8 株乳酸菌进行分子生物学鉴定、发酵性能测定和潜在的益生功能分析。生理生化试验和16S rRNA 测序的结果表明,8 株乳酸菌菌株中的H-1、H-3、H-7、H-11、H-14 和H-17 属于植物乳植杆菌(Lactiplantibacillusplantarum),菌株H-4 和H-9 属于肠膜状明串珠菌或假肠膜状明串珠菌。这8 株菌株都具有一定的模拟胃液和胆盐耐受性、较高的细胞表面疏水性和自聚集能力、一定的Caco-2 细胞的吸附能力、DPPH 自由基和羟基自由基清除活性,表现出较好的益生菌特征。本研究证明,从Mahewu 分离的乳酸菌具有良好的益生菌潜能,它们有可能适合用作功能性发酵食品的发酵剂、辅助发酵剂或额外添加菌株。本研究为深入开发非洲传统发酵食品中的益生菌资源提供研究基础。

