双孢蘑菇中一种4R型MYB转录因子的基因克隆和生物信息学分析
刘翔,赵紫璇,赵月盈,赵诗睿,贾子怡,姜含越,袁帅,孟德梅
(天津科技大学食品科学与工程学院,天津 300457)
转录因子(transcription factors,TF)是一类DNA 结合蛋白,可以特异性地与基因启动子中DNA 特定序列发生相互作用,对其进行转录表达的调控[1]。V-myb 禽成髓细胞病病毒癌基因同源物(V-myb avian myeloblastosis viral oncogene homolog,MYB)是重要的转录因子家族之一,通常包含4 个结构功能域[2-3],其中,靠近氨基N 端的一段高度保守的氨基酸序列称为DNA 结合域,该区域一般由1~4 个不完全重复的R 序列串联组成[4-5]。根据R 结构特征可将MYB 转录因子分为1RMYB、R2R3-MYB、3R-MYB 和4R-MYB 4 个亚家族[6-7],它们广泛存在于植物、动物以及真菌中。R2R3-MYB型转录因子是植物MYB 转录因子家族中最大的成员[8-9],在调控植物生长发育、参与调节生物或非生物胁迫的过程中具有重要作用[10]。例如,Sun 等[11]研究发现R2R3-MYB 转录因子CaMYB108 沉默会负向调控雄蕊的发育;R2R3-MYB 转录因子OsMYB30 可转录上调OsPAL6和OsPAL8基因的表达,诱导水稻对褐飞虱的抗性增强[12];Fang 等[13]发现杨树中存在PtrMYB94基因,该基因参与杨树中脱落酸依赖的正向干旱胁迫调控。目前,虽然R2R3-MYB 转录因子的功能研究较多,但是有关4R-MYB 转录因子的研究甚少且作用尚不清晰。MYB 转录因子的分类及功能[14-15]如表1所示。

表1 MYB 转录因子的分类及功能Table 1 Classification and functions of MYB transcription factors
此外,与植物相比,食用菌中转录因子的研究十分有限,对MYB 转录因子家族的研究更是少之又少。目前,已有研究从基因组水平对香菇(Lentinula edodes)[16]、金针菇(Flammulinavelutipes)[17]、灵芝(Ganodermalucidum)[18]和平菇(Pleurotusostreatus)[19]中的MYB 类转录因子进行了生物信息学分析和鉴定,但关于双孢蘑菇中MYB 转录因子的研究鲜见。前期研究通过转录组学从双孢蘑菇子实体中发现了一个MYB 编码基因(gene3947),为了更好地了解和分析其特性以及探寻可能的生物学功能,本研究对该基因进行了克隆,对其理化性质、信号肽、保守结构域以及二、三级结构进行预测,将其保守结构域与其他物种中4R型MYB 的氨基酸保守结构域序列进行了比对和亲缘关系分析,之后对其亚细胞定位与启动子序列进行了分析,为后续深入研究提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
双孢蘑菇子实体:江苏裕灌现代农业科技有限公司;pGEX-6P-1 载体:天津科技大学食品营养与安全重点实验室保存;T4 DNA 连接酶:Thermo Fisher Scientific;EcoR I 限制性内切酶和Escherichiacoli(E.coli)DH5α:北京全式金生物技术股份有限公司;XhoI 限制性内切酶:美国NEB 公司;胶回收试剂盒:生工生物工程(上海)股份有限公司;质粒小提试剂盒:天根生化科技(北京)有限公司。
含有卡那霉素的(luria-bertani,LBK)固体培养基的配制:分别称取5.0 g 酵母提取物,10.0 g 胰蛋白胨,10.0 g 的NaCl,15.0 g 琼脂粉,用蒸馏水充分溶解,调pH 值至7.0 后,定容至1.0 L,在121 ℃的条件下高压蒸汽灭菌20 min,待培养基冷却至60 ℃,向培养基中加入1 mL(100 mg/mL)的卡那霉素,摇匀后分装至无菌培养皿中,凝固后于4 ℃保存备用。
1.2 仪器与设备
Veriti9902 PCR 仪:美国应用生物系统有限公司;Champ Gel 5000 凝胶成像仪:赛智科技有限公司;ZXDPB2120 电热恒温箱:上海智诚分析仪器制造公司。
1.3 RNA 提取、反转录及引物设计
参考Wang 等[20]的方法提取双孢蘑菇总RNA,消化RNA 中残留的基因组,检测消化后RNA 的纯度和质量,最终反转录得到互补DNA(complementary DNA,cDNA)样品。根据前期转录组学测序中MYB 编码基因(gene3947)的序列,设计Ab4RMYB扩增所需特异性引物(F:5′CGCAAAGAACGGAAGGTGAT 3′和R:5′GCCAGAAGCAACAATAGTCGC 3′)。
1.3.1 基因的克隆及测序
以反转录后的cDNA 为模板,利用设计的特异性引物,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,PCR 扩增的反应条件为95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min 30 s,以此条件扩增35 个循环;72 ℃终延伸15 min。反应结束后,用1%的琼脂糖凝胶电泳对PCR 扩增产物进行检测,并用胶回收试剂盒将条带大小正确的PCR 产物进行回收。
将pGEX-6P-1 空载质粒和经PCR 回收的目的片段分别用限制性酶EcoR I 和XhoI 在37 ℃恒温条件下双酶切3 h,利用T4 DNA 连接酶于4 ℃反应8~12 h,将酶切后的PCR 片段连接至pGEX-6P-1 载体,构建pGEX-Ab4RMYB重组质粒。利用化学转化法将重组质粒化转入E.coliDH5α 感受态细胞,并涂布于LBK 固体培养基中,于37 ℃恒温培养8~12 h。使用质粒小提试剂盒提取质粒,用限制性酶EcoR I 和XhoI 做双酶切验证,酶切正确的质粒进一步送检进行测序验证。
1.3.2 生物信息学分析软件
通过在线工具对Ab4RMYB 转录因子的理化性质、蛋白信号肽、核定位信号、蛋白结构等进行分析,所用工具如表2所示。

表2 生物信息学分析工具Table 2 Tools used in bioinformatics analysis
1.3.3 多序列比对和系统进化树构建
将Ab4RMYB 的保守结构域序列与高等植物、低等植物和真菌中已知的4R 型MYB 转录因子的保守结构域序列通过DNAMAN6.0 进行多序列比对;不同物种的MYB 蛋白保守结构域序列通过Clustal W 进行多序列比对后导入MEGA11.0 以邻位相近法(neighbor joining,NJ)构建系统进化树。上述氨基酸序列信息均来自于NCBI 数据库(https://www.ncbi.nlm.nih.gov/),保守结构域序列均通过表2 中SMART 在线工具寻找。
1.3.4 基因启动子序列分析
从NCBI 数据库中下载Ab4RMYB基因的启动子序列(起始密码子上游2 000 bp),将基因的启动子序列提交到PlantCARE 工具中(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),同时使用TBtools 软件对顺式元件进行可视分析。
1.4 数据处理
数据由GSDS、SignalP-4.1、UCLA-DOE LAB—SAVES v6.0、DNAMAN6.0 分析得出,并采用Origin 2018 制图,由MEGA11.0 以NJ 法构建系统进化树,由iTOL 进行美化处理。
2 结果与分析
2.1 基因的克隆及序列分析
Ab4RMYB基因编码区的扩增结果见图1。

图1 基因的扩增结果Fig.1 PCR amplification product
由图1 可知,得到了片段大小1 200 bp 左右的PCR 产物,与预期基本一致。
重组载体的双酶切验证见图2。
根据图2 琼脂糖凝胶检测结果表明,得到了大小分别为1 200 bp 和6 600 bp 左右的基因片段。质粒测序结果表明,成功克隆出大小为1 209 bp 的基因片段。用DNAMAN6.0 对测序结果和转录组测序基因编码区进行序列比对,结果表明序列相似性为100%。
将测序后的序列提交至NCBI 数据库,查询到该基因位于基因组的1601735-1603347 区域,mRNA 全长为1 613 bp。通过GSDS 基因结构显示器将目的基因当中的外显子和内含子相对位置进行可视化,基因的外显子和内含子分析如图3所示。
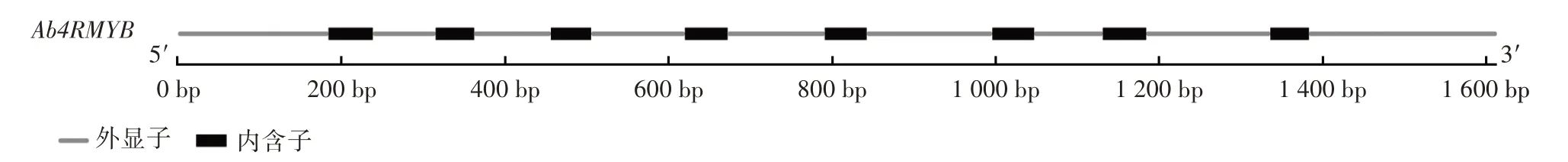
图3 Ab4RMYB 基因的外显子和内含子分析Fig.3 Exons and introns of Ab4RMYB
由图3 可知,其序列包含9 个外显子(1~184 bp、239~315 bp、363~456 bp、506~620 bp、673~791 bp、843~996 bp、1 048~1 131 bp、1 185~1 336 bp、1 384~1 613 bp)和8 个内含子(185~238 bp、316~362 bp、457~505 bp、621~672 bp、792~842 bp、997~1 047 bp、1 132~1 184 bp、1 337~1 383 bp)。
2.2 Ab4RMYB 转录因子基本性质分析
该基因翻译的氨基酸为402 个,将氨基酸序列进行一级结构分析,结果如表3所示。
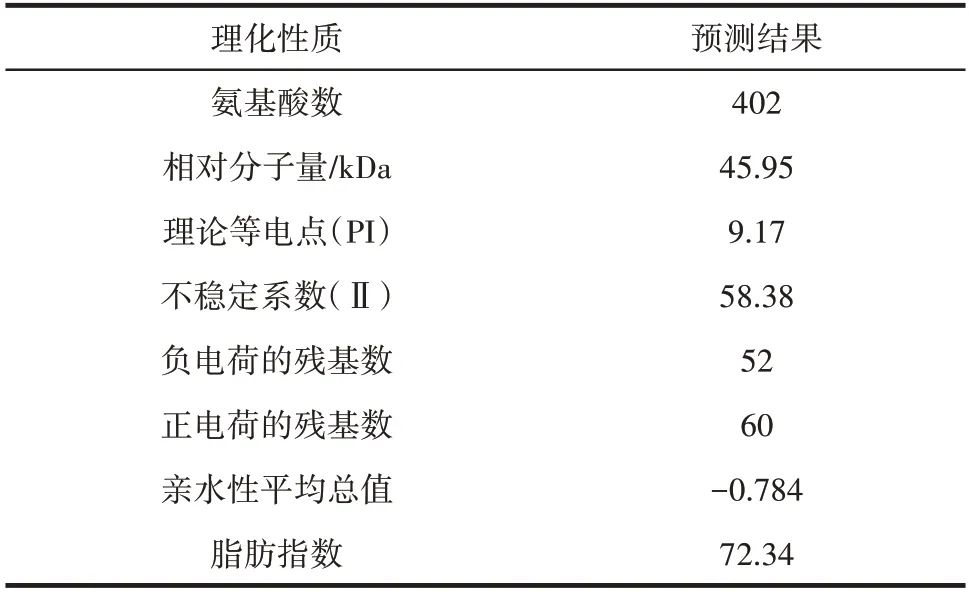
表3 Ab4RMYB 转录因子的基本性质Table 3 Basic properties of Ab4RMYB
由表3 可知,其蛋白分子大小为45.95 kDa,理论等电点为9.17,不稳定系数58.38,脂肪指数为72.34,亲水性平均值为-0.784,属于亲水性蛋白。
2.3 Ab4RMYB 转录因子信号肽预测
部分分泌蛋白依靠N 端存在的一小段有特定结构的氨基酸残基序列穿过细胞质膜,这段特殊序列称为信号肽或分泌信号序列[21]。Ab4RMYB 转录因子的信号肽预测结果如图4所示。
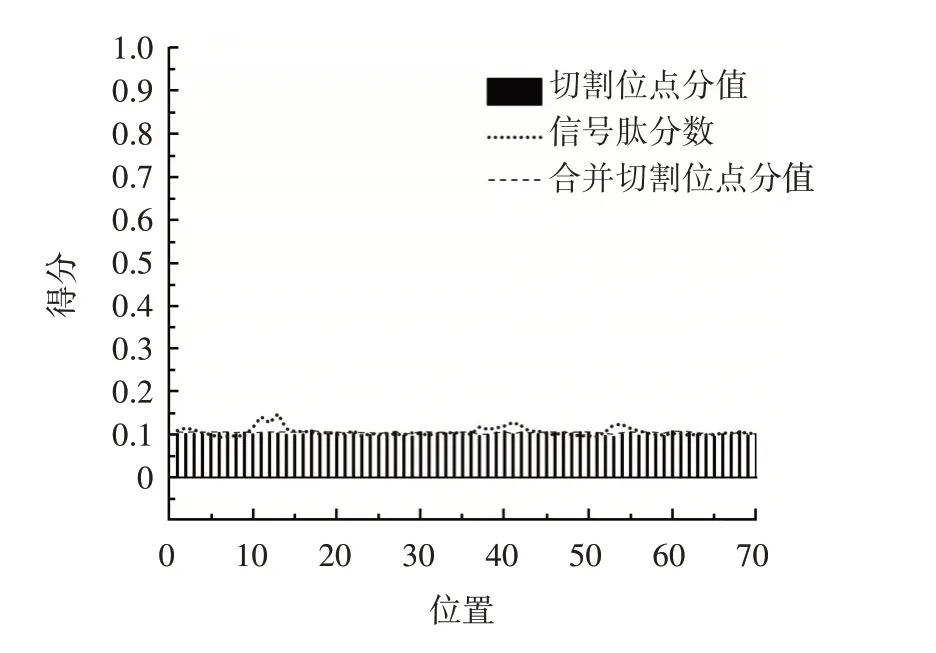
图4 Ab4RMYB 转录因子的信号肽预测Fig.4 Prediction of signal peptides of 4RAbMYB
由图4 预测的结果中可见,切割位点的最大值为0.110,位于17 位氨基酸;合并切割位点最大值为0.110,位于17 位氨基酸;信号肽分数的最大值为0.148,位于13 位氨基酸。信号肽分数平均值0.111,其预测的剪切点在1~16 位氨基酸。信号肽分数平均值远远小于0.5,说明Ab4RMYB 转录因子不含信号肽结构,不是分泌蛋白。
2.4 二级结构和保守结构域分析
用Prabi SOPMA 预测二级结构,结果如图5所示。

图5 Ab4RMYB 的二级结构及保守结构域预测Fig.5 Secondary structure and predicted conserved domains of Ab4RMYB
由图5A 可知,Ab4RMYB 转录因子二级结构中含有大量的α-螺旋和无规则卷曲,少量的β-转角和延伸链结构,从数量上看,主要以无规则卷曲(47.26%)和α-螺旋(45.52%)结构为主。
使用SMART 数据库预测Ab4RMYB 蛋白含有的保守结构域,由图5B 可知,Ab4RMYB 蛋白分布着4 个SANT 重复保守序列,分别处于第66~140 位、143~190 位、195~254 和261~316 位的氨基酸之间,从结构上预测Ab4RMYB 属于4R 类型MYB 转录因子。
2.5 三级结构预测及模型质量评估
将Ab4RMYB 转录因子保守结构域(66~316aa)序列提交到I-TASSER 服务中通过从头建模法获取蛋白质的三级结构模型如图6所示。
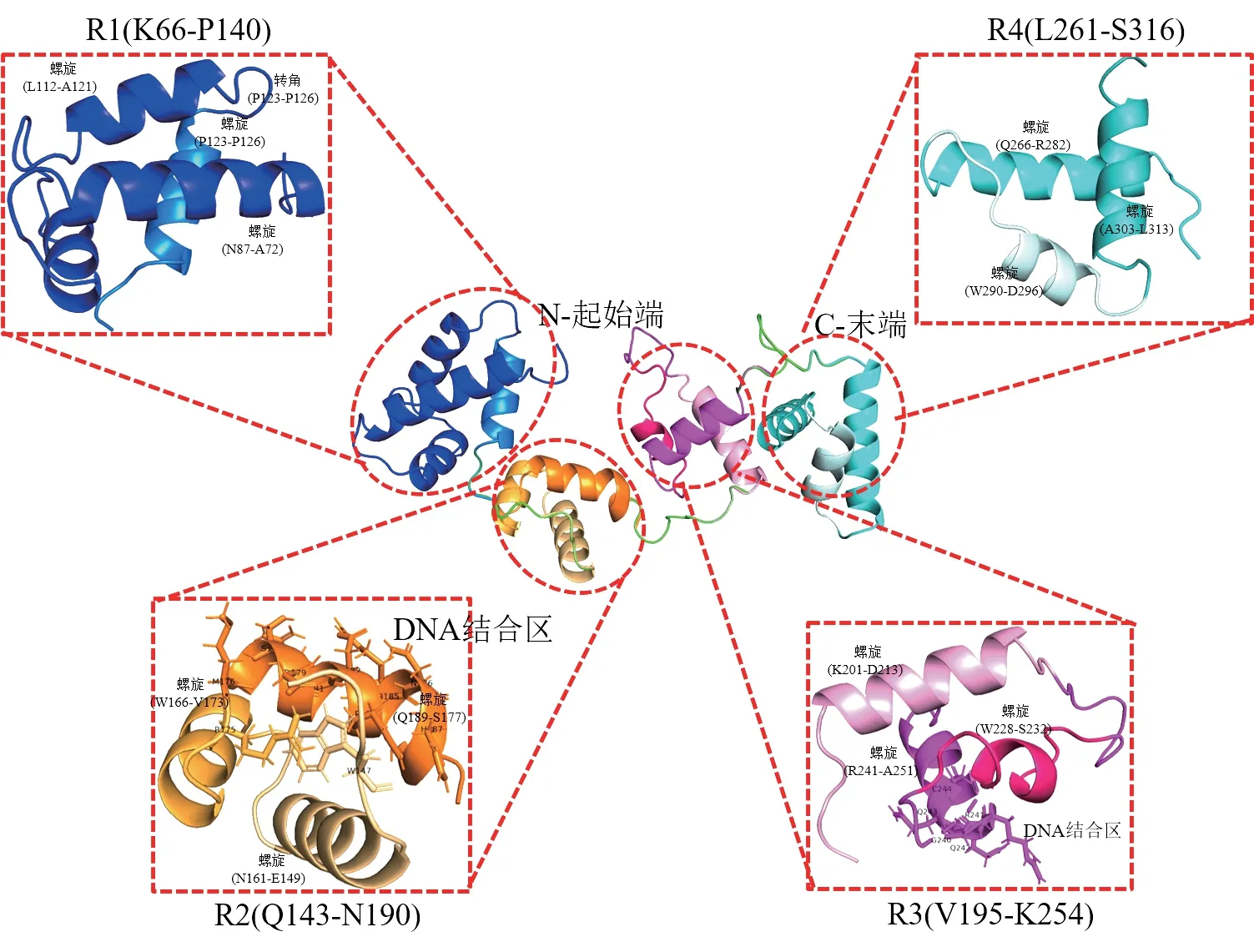
图6 Ab4RMYB 转录因子三级结构预测Fig.6 Predicted tertiary structure of Ab4RMYB
由图6 可知,Ab4RMYB 转录因子蛋白在N、C 两端存在两条向外延伸的无规则卷曲长链,其内部存在4 个主要的不完全重复螺旋结构(R),结构中存在较多的α-螺旋和无规则卷曲,这与二级结构预测结果相符。InterPro 工具预测Ab4RMYB 转录因子存在2 个MYB DNA-binding domain,分别定位于R2(W147-G197)和R3(P198-W248)序列。
通过UCLA-DOE LAB—SAVES v6.0 中提供的ERRAT、WHATCHECK、PROCHECK 工具分别对三级结构模型的不同原子间的非键相互作用、立体化学参数和立体化学质量进行分析,结果图7所示。
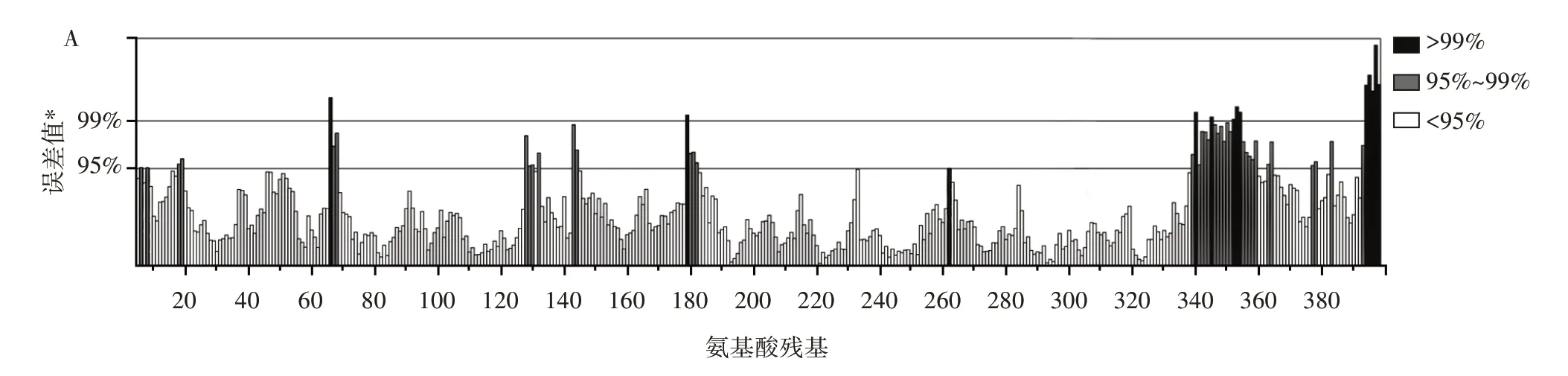
图7 三级结构的质量评估Fig.7 Quality assessments of the predicted tertiary structure
原子间的非键相互作用力结果显示,Ab4RMYB转录因子结构域的Overall Quality Factor 为87.310,大于85;立体化学参数结果显示,Ab4RMYB 转录因子结构域模型评估的48 个指标中21 个指标通过,17 个指标警告,10 个指标错误(图7B);立体化学质量结果显示,94.1%氨基酸残基落在最佳区和允许区,说明该模型的构象符合立体化学的规则(图7C)。3 个工具获取的评估结果均显示预测模型质量较好。
2.6 保守区域的多序列比对和关键氨基酸分析
将双孢蘑菇中Ab4RMYB 的保守结构域(66~316aa)与高等植物、低等植物以及真菌中的MYB 转录因子的SANT 保守结构域进行序列比对。我们选取了高等植物中的MYBs 包括:苹果(Malusdomestica,XP_008393534.1)、杜梨(Pyrusbetulifolia,APY20264.1)、桃(Prunuspersica,XP_007210492.1)、可可树(Theobromacacao,XP_007036689.1)、芸薹(Brassicarapa,XP_009145933.1);低等植物中MYBs 包括:莱茵衣藻(Chlamydomonasreinhardtii,XP_042914591.1)、团藻(Volvoxcarteri,XP_002952676.1)、衣藻(Chlamydomonasschloesseri,KAG2450615.1);真菌中MYBs 包括:白环蘑(Leucoagaricus,KXN89584.1)、纹缘盔孢伞(Galerinamarginata,KDR83959.1)、隆纹黑蛋巢菌(Cyathus striatus,KAF9006580.1)。Ab4RMYB 转录因子的多序列比对和保守氨基酸分析结果如图8所示,其中B 图为Ab4RMYB 转录因子氨基酸同源性百分比,序列的高度表示序列在该位置上的保守性。
从图8 可看出,11 个来自不同物种的4R-MYB 转录因子的保守域都是由4 个不完全重复序列(R)即R1、R2、R3、R4 组成,通过氨基酸序列比对可以发现共有20 个100%保守的氨基酸残基(如图8A 黑色标注),其中9 个位于螺旋区域(α),11 个位于非螺旋区域中。20 个保守的氨基酸残基中包含6 个100%保守的色氨酸,分布于4 个R 区中,并且R2 和R3 区域中规律存在着2 个100% 保守的色氨酸残基,更为重要的是它们间隔20~30 个氨基酸,分别位于相邻的两个螺旋之间,共同形成一个疏水核心,对维持空间结构具有重要的意义[22]。不仅如此,每个保守的色氨酸前后都存在75%保守性的其他氨基酸残基(如图8A 深灰色标注),共同形成保守域。这些保守的氨基酸残基对于螺旋-转角-螺旋(helix-turn-helix,HTH)结构的维持也具有至关重要的作用。
在75%保守性的氨基酸残基(图8A 深灰色标注)中,相比于低等植物,双孢蘑菇与其他真菌和高等植物的相似度更高,比如真菌和高等植物α4 中的丙氨酸(A),α5 中的第一个谷氨酸(E),α7 前端的精氨酸(R)以及内部的半胱氨酸(C)、酪氨酸(Y)在低等植物中分别被甘氨酸(G),天冬氨酸(D),苯丙氨酸(F),缬氨酸(V)和色氨酸(W)所替代。此外Ab4RMYB 保守结构域中147W、175R、176M、178S、179D、181R、182D、183R、185R、186N、187H、240G、241R、242Q、243Q、244C 共16 位氨基酸被预测为DNA 结合位点。研究表明[23-24],AACNG 是植物中R2R3-MYB 结合的重要顺式作用元件,其中拟南芥R2R3-MYB 中的K-55、N-106、K-109、N-110 被报道是识别与结合AACNG 基序至关重要的氨基酸[25]。但是,我们通过氨基酸序列分析并未在Ab4RMYB 序列中发现上述能够识别和结合该顺式作用元件的4 个氨基酸,说明4R 型MYB 转录因子可能与R2R3 型MYB 转录因子识别和结合的顺式作用元件不同。
2.7 亲缘关系分析
为更好地了解双孢蘑菇中Ab4RMYB 转录因子的系统发育关系,将双孢蘑菇中Ab4RMYB 与植物、动物和真菌中MYB 蛋白的保守域进行系统发育树分析,生物NCBI 号均来自NCBI 数据库。用MEGA11.0 以NJ 法构建系统进化树,设置bootstrap 值为1 000。不同物种中MYB 蛋白的系统发育树分析结果如图9所示。
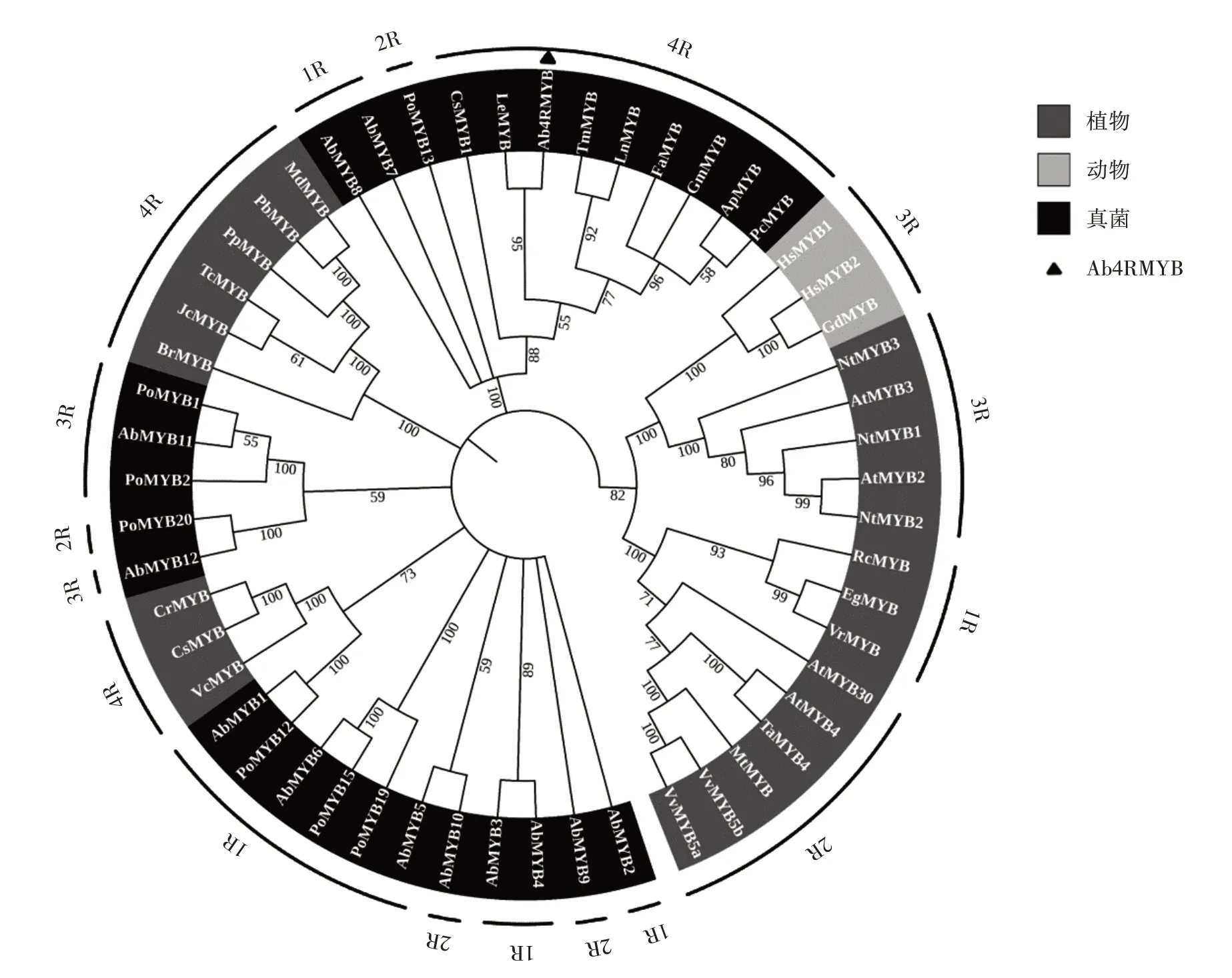
图9 不同物种中MYB 蛋白的系统发育树分析Fig.9 Phylogenetic tree of MYB proteins in different species
由图9 可知,进化树结果表明,同一类别的MYB转录因子亲缘关系更近,本文研究的双孢蘑菇中的Ab4RMYB 转录因子与白环蘑中的LeMYB 转录因子相似度最高,亲缘关系最近。
2.8 Ab4RMYB 转录因子核定位信号和亚细胞定位分析
通过多种在线软件预测Ab4RMYB 的核定位信息,结果如表4所示。
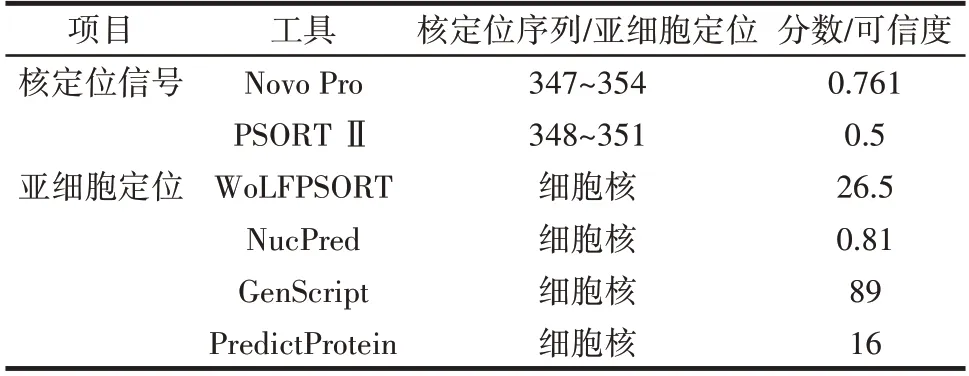
表4 Ab4RMYB 转录因子亚细胞定位分析Table 4 Subcellular localization of Ab4RMYB
由表4 可知,Novo Pro 预测核定位信号位于347~354 位氨基酸,PSORT Ⅱ预测核定位信号位于348~351 位氨基酸,两种在线预测软件均显示其具有核定位序列(Nuclear localization sequence,NLS),可以进入细胞核。随后,我们利用多种在线工具对Ab4RMYB亚细胞定位进行预测,结果均显示其定位于细胞核。
2.9 Ab4RMYB 基因启动子序列分析
真核生物基因的启动子由核心启动子和上游启动子两部分组成,是一类重要的DNA 序列。其作为基因表达的关键调控元件,具有控制基因转录和调节基因表达水平的功能[26]。为了探究Ab4RMYB 转录因子在双孢蘑菇中可能参与或调控的生物过程,进一步通过PlantCARE 启动子序列分析工具对Ab4RMYB基因的启动子序列进行分析,结果如表5所示。
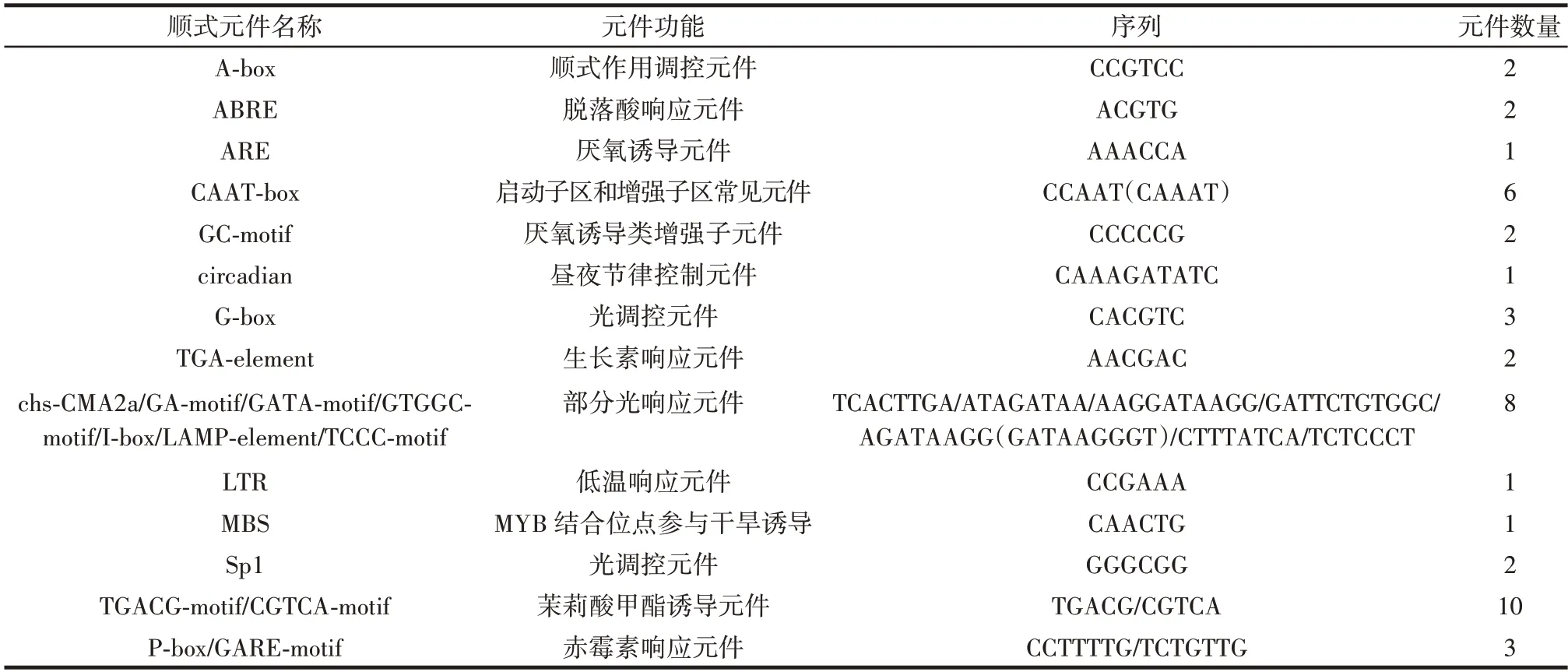
表5 Ab4RMYB 基因启动子顺式元件预测表Table 5 The cis-acting elements in Ab4RMYB promoter
Ab4RMYB基因启动子序列中除含有2 个A-box,6 个CAAT-box 基本元件外,还含有13 个光反应元件(1 个GTGGC-motif、1 个GATA-motif、1 个GA-motif、1 个chs-CMA2a、2 个I-box、1 个LAMP-element、1 个TCCC-motif、2 个Sp1 和3 个G-box)和1 个昼夜节律控制元件(circadian),此类元件的存在说明Ab4RMYB基因有可能在双孢蘑菇的生长发育环节发挥着重要的作用[27]。与此同时,还含有1 个参与低温响应元件(LTR)、1 个参与干旱应答的元件(MBS),3 个厌氧诱导所必需元件(1 个ARE 和2 个GC-motif)。这些说明Ab4RMYB基因在响应生物抗逆应答方面可能具有一定的调控机制。除此之外,发现其中还包含多种激素响应的顺式作用元件,如10 个茉莉酸甲酯诱导元件(5 个CGTCA-motif 和5 个TGACG-motif),2 个生长素响应元件(TGA-element)、2 个脱落酸响应元件(ABRE)、3 个赤霉素响应元件(1 个P-box 和2 个GARE-motif),这些元件的存在说明Ab4RMYB基因可能在特定的信号通路中发挥作用。通过以上分析表明,Ab4RMYB基因可能在双孢蘑菇生长发育环节、抗非生物胁迫以及病原防御中具有重要的调控功能。
3 讨论与结论
本研究首次从双孢蘑菇中克隆到了一种4R型MYB转录因子编码基因(Ab4RMYB),该基因编码区长1 209 bp,编码402 个氨基酸;其蛋白序列含有4 个保守的SANT-MYB 结构域和规律性分布的色氨基酸残基,属于MYB 转录因子家族中的4R-MYB 型,与白环蘑中的4R-MYB 转录因子亲缘关系最近。结合信号肽分析和亚细胞定位预测分析,显示其可在细胞核中发挥转录因子的功能。氨基酸序列分析显示,该基因编码蛋白序列中不含有植物R2R3-MYB 识别和结合AACNG 顺式作用元件所需的氨基酸残基[28-30],说明Ab4RMYB 转录因子可识别和结合的顺式作用元件可能与植物中R2R3-MYBs 转录因子不同。因此,后续研究中可通过酵母单杂、凝胶阻滞迁移、双荧光素酶等实验对其可结合的顺式作用元件及可转录调控的基因进行进一步研究。此外,启动子序列分析结果表明,该基因启动子区域具有多个响应生物抗逆应答和响应激素调控的元件,说明Ab4RMYB 可能与植物中R2R3-MYBs 转录因子有类似功能[31-32],能够参与调控双孢蘑菇的逆境胁迫反应及茉莉酸等激素信号的调控过程。但是,Ab4RMYB 能够通过转录调控哪些基因或代谢过程进而参与调控这些生物过程,以及其转录调控的具体分子机制还需后续的详细研究。
综上所述,本研究对双孢蘑菇中Ab4RMYB 转录因子进行基因克隆及生物信息学分析鉴定,为今后进一步深入解析该转录因子的结构特征和相关功能,及后续双孢蘑菇中的生物学功能的验证奠定了基础。

