巨大芽孢杆菌对江蓠植株琼脂直接脱硫工艺的建立及优化
宋阳,刘振,毛相朝
(中国海洋大学食品科学与工程学院,山东青岛 266403)
琼脂是红藻细胞壁内基质的主要成分[1],因其凝胶特性被广泛应用于食品、化工和医疗等行业[2-5]。在全球范围内,琼脂年产量超过14 500 t,2015年产值达到约2.46 亿美元[6]。琼脂主要来源于石花菜属(Gelidium)、江蓠属(Gracilaria)的植株,只有少量来自其它物种[7-8]。石花菜琼脂具有较好的品质,是生产高品质琼脂的首选原料,但石花菜属的产量较低,不能满足生产需要[9]。江蓠琼脂因硫含量高导致其凝胶强度较低,但江蓠属的物种则具有藻体大、产量高等优势。目前,80%的琼脂是以江蓠为原料进行提取和加工的[10-11]。
琼脂中存在的硫酸基团是导致其凝胶性能下降的主要因素,因此需要对琼脂进行脱硫处理[12-13]。目前工业中最常用的琼脂脱硫方法是化学法[14],但其碱处理过程中存在反应条件剧烈、环境污染严重等问题[15-16]。另一方面,以芳基硫酸酯酶进行琼胶脱硫具有环境友好、反应条件温和、得率高等优点[17-18],但该方法存在酶活较低、在催化过程中酶逐渐失活且酶制剂制备工艺流程复杂繁琐的问题,因此成本高,仅停留在实验室阶段,未实现工业化应用。微生物琼脂脱硫法是利用微生物自身生长的硫需求来进行琼脂脱硫的方法。在缺乏其它硫源的情况下,微生物要获得供应自身生长的硫元素,就必须连续不断地进行琼脂脱硫,所以随着微生物的生长,用于脱硫的微生物数量不断增加,形成脱硫的正循环。微生物法可以有效解决酶法脱硫中需要较高加酶量的问题,将酶法琼脂脱硫中酶的异源表达、纯化制备、酶催化琼脂脱硫几个步骤简化为一个步骤,工艺流程简单,节约成本。
巨大芽孢杆菌能以琼脂为唯一硫源且不以琼脂为碳源,已被证实能够用于琼脂脱硫[19]。基于此,已建立了两种微生物琼脂脱硫方法,包括琼脂液体脱硫法和琼脂平板脱硫法[19]。但以上两种方法仍不成熟。其中,琼脂液体脱硫法存在微生物细胞和高黏度的液态琼脂难以分离的问题,琼脂平板脱硫法微生物细胞与琼脂接触面积小、脱硫率较低,导致该方法难以工业化生产应用。同时在上述两种方法中所使用的脱硫底物是琼脂粉,而目前工业中的生产原料则是以江蓠为主的红藻。
本研究利用巨大芽孢杆菌建立以江蓠为原材料的琼脂脱硫技术。由于江蓠植株是含有琼脂且在自然环境下稳定存在的,因此探究巨大芽孢杆菌直接对江蓠进行脱硫的效果。植株直接脱硫法操作简单、微生物与琼脂接触面积大,在生产应用方面具有相对较高的可行性。本研究探究紫外、乙醇、臭氧和NaClO 等灭菌方法,并对培养基中的江蓠添加量、培养基碳源、氮源和缓冲盐的浓度等进行优化,以期通过优化该工艺提高微生物法琼脂脱硫的效率,实现琼脂脱硫工艺的革新和琼脂产品的提质升级。
1 材料与方法
1.1 试剂与材料
菌株为巨大芽孢杆菌,由中国海洋大学食品科学与工程学院海洋食品生物技术与工程实验室筛选获得,已保藏至中国典型培养物保藏中心,储存编号为CCTCC M 20221885,菌株名称为OUC-Gel(QD)-w#DS#1-WMX,简称WMX。江蓠:绿新(福建)食品有限公司。产地为印度尼西亚,置于干燥通风处储藏。
蛋白胨、酵母粉:英国OXOID 公司;次氯酸钠溶液、75%乙醇:上海麦克林生化科技股份有限公司;琼脂粉:上海索莱宝生物科技有限公司;5×M9 基础盐、M9 微量元素:艾礼生物科技(上海)有限公司;D-葡萄糖、磷酸氢二钠、磷酸二氢钾、氯化钠、氯化钡、氯化铵、明胶、硫酸钾、碘酸钠、盐酸:国药集团化学试剂有限公司;余氯:美国哈希公司。所用试剂均为分析纯。
1.2 仪器与设备
TMS-TOUCH 型质构仪:美国FTC 公司;Multiskan FC 酶标仪:美国赛默飞世尔科技公司;V-5600(PC)紫外分光光度计:上海元析仪器有限公司;PHS-25 酸度计:上海雷磁仪器有限公司;ZSZY-88CH 振荡培养箱:知楚仪器有限公司;HFsafe-1200LC(A2)型超净台:力新仪器(上海)有限公司;PEM 电解式臭氧水机:武汉威蒙环保科技有限公司;SCIENTZ-10ND 冷冻干燥机:宁波新芝生物有限公司。
1.3 试验方法
1.3.1 巨大芽孢杆菌发酵脱硫方法
自保藏的甘油管中取0.5 mL 巨大芽孢杆菌菌液接入5 mL LB 培养基(将1.0 g NaCl、0.5 g 酵母粉、1.0 g蛋白胨加入至100 mL 纯水中,混匀后分装5 mL 至试管中,密封后在115 ℃灭菌30 min)中,在37 ℃、200 r/min培养12 h 后,吸取1 mL 的上述菌液至100 mL 的琼脂片M9 培养基(在100 mL 的纯水中加入1.5 g 的琼脂粉振荡混匀后,115 ℃灭菌30 min,随后趁热在超净台中倒入培养皿中,待冷却凝固后切成约1.0 cm×1.0 cm×0.3 cm 的薄片。在经115 ℃、30 min 灭菌处理的锥形瓶中加入20 mL 的琼脂片、20 mL 配好的5×M9 基础盐溶液、10 mL 200 g/L 葡萄糖溶液和100 μL 微量元素溶液,并用无菌水补足至100 mL)中,并在37 ℃、200 r/min的振荡培养箱中培养24 h,获得种子液。
将洗净的江蓠置于超净台中暴露于紫外条件下进行30 min 的灭菌,随后称取15 g 湿重的江蓠植株转移至无硫M9 培养基(20 mL 5×M9 基础盐溶液、10 mL 200 g/L 葡萄糖溶液和100 μL 的微量元素溶液,加入灭过菌的锥形瓶中并用无菌水补足至100 mL)中,并加入5 mL 的种子液,在37 ℃、200 r/min 振荡培养箱培养12 h,每12 h 测1 次OD600nm,待菌体生长至平稳期后,分别收集培养基和江蓠植株,将江蓠植株在灭菌锅中加热提胶,趁热用200 目滤布过滤,冷却凝固后,转移至-20 ℃冰箱8 h,使凝胶所含的水分结成冰。次日于室内向阳处解冻脱水。待不再有水泌出后,将泌出的水分倒掉。用保鲜膜包裹泌水后的琼脂并扎若干小孔后,转移至-80 ℃冰箱2~3 h 后放入冷冻干燥机进行干燥。以上为接菌且有葡萄糖组。接菌且无葡萄糖组是指无硫M9 培养基中不加入10 mL 200 g/L 葡萄糖溶液,其它操作均与接菌且有葡萄糖组一致。未接菌且有葡萄糖组则是在培养过程中不加入种子液,其它操作均与接菌且有葡萄糖组一致。水组是指培养过程中不加入培养基而用纯水代替,其它操作均与接菌且有葡萄糖组一致。
1.3.2 江蓠灭菌方法的优化试验
1.3.2.1 75%乙醇灭菌试验
江蓠浸泡在75%乙醇45 min 后,转移至洁净的烧杯中,在超净台中紫外线照射30 min 后,称量湿重为15 g 的江蓠至锥形瓶,后加入至无硫M9 培养基,并接入种子液后,放入37 ℃、200 r/min 振荡培养箱,24 h 后测定OD600nm。
1.3.2.2 臭氧水灭菌试验
将江蓠置于2 mg/L 的臭氧水中45 min,其余步骤与1.3.2.1 中一致。其中2 mg/L 的臭氧水由臭氧水机制得,并采用中性碘化钾法测定臭氧水浓度[20-21]。
1.3.2.3 次氯酸钠灭菌试验
将洗净的江蓠置于0.025%、0.050%、0.100%、0.200% 和0.400% 有效氯的NaClO 中约25 min,后用纯水冲洗3 遍,在超净台中紫外线照射30 min 后,再用纯水冲洗3 遍,其余步骤与1.3.2.1 中一致。
除氯步骤为将上述第二次用无菌水冲洗后的样品于220 r/min、37 ℃振荡48 h,后再接入巨大芽孢杆菌种子液和原无硫M9 培养基中10 mL 200 g/L 葡萄糖溶液。
有效氯的测定使用碘量法,取5 mL 不同浓度梯度的碘酸钾溶液并用余氯试剂振荡混匀后,记录在564 nm处的吸光度并制成标准曲线。将待测液经过上述操作后的吸光度代入标准曲线计算即得出有效氯浓度。
1.3.3 江蓠添加量的优化试验
将江蓠植株清洗后常温晾干,获得干江蓠。分别将0.50、0.75、1.00、1.25 g 干江蓠和100 mL 含有0.100% 有效氯的次氯酸钠溶液加入锥形瓶中,在37 ℃条件下220 r/min 振荡45 min。随后,在超净台中将锥形瓶中的液体倒出,保留江蓠,并用纯水多次冲洗江蓠至pH 中性。将清洗后的江蓠,加入至无糖无硫M9 培养基(20 mL 5×M9 基础盐溶液和100 μL 微量元素溶液,加入经115 ℃、30 min 灭菌处理的锥形瓶中并用无菌水补足至100 mL),37 ℃、220 r/min 振荡除氯48 h 后,在超净台中紫外线照射30 min,加入10 mL 的20%葡萄糖溶液和5 mL 种子液,放入37 ℃、200 r/min振荡培养箱培养,培养4 d,每天测定OD600nm。
1.3.4 培养基的优化试验
1.3.4.1 添加微量元素浓度的试验
将1 g 干江蓠和100 mL 含有0.1%有效氯的次氯酸钠溶液加入锥形瓶中,封口后置于37 ℃、220 r/min摇床,充分浸泡45 min。随后,在超净台中将锥形瓶中的液体倒出,并用纯水多次冲洗江蓠至pH 为中性。将清洗后的江蓠,加入至无糖无硫M9 培养基,37 ℃、220 r/min 振荡培养箱除氯48 h 后,在超净台中紫外线照射灭菌30 min,加入10 mL 的20% 葡萄糖溶液和5 mL 种子液,放入37 ℃、200 r/min 振荡培养箱培养,每天测定1 次OD600nm,共培养2 d,上述发酵为添加微量元素组。同时设置一个不添加微量元素的无糖无硫M9 培养基对照组,其它步骤与添加微量元素组一致,为不添加微量元素组。
1.3.4.2 添加缓冲盐浓度的试验
方法与碳氮源组一致,5×M9 基础盐中的Na2HPO4和KH2PO4分别设置成原浓度的0、0.10、0.25、0.50、1.00、1.50 倍,每天测定一次OD600nm,培养2 d。
1.3.4.3 添加葡萄糖浓度的试验
方法与碳氮源组一致,且葡萄糖浓度设置成0%、0.5%、1.0%、1.5%、2.0%和3.0%,培养2 d。
1.3.4.4 添加NH4Cl 浓度的试验
方法与碳氮源组一致,且5×M9 基础盐中NH4Cl浓度设置成0%、0.10%、0.25%、0.50%、0.75%、1.00%、1.50%,培养2 d。
1.3.5 多次转接的方法
在上述经过优化的条件发酵后,隔24 h 吸取200 μL 测OD600nm。OD600nm不再升高时,将江蓠植株转接至新的无硫M9 培养基进行再次发酵。重复3 次后,将菌液和江蓠用滤布分离,多次冲洗后在锥形瓶中加入100 mL 纯水,在100 ℃下进行提胶2 h。随后趁热用200 目的纱布过滤,获得琼脂胶液,在室温下冷却后,在-20 ℃冷冻约8 h,次日在室温下解冻后,用保鲜膜封存,在-80 ℃预冻3 h 后冻干。
1.3.6 碱法脱硫的方法
将100 g 干江蓠加入1 500 mL 6% 的NaOH 溶液中,并在87 ℃水浴加热3 h,再经过4 次水洗后转移至含有0.65 mL 浓硫酸、0.96 g 草酸的1 500 mL 溶液中酸化0.5 h、水洗后再用0.04% 的NaClO 漂白0.5 h[22]。煮胶、脱水和干燥等过程与1.3.5 中一致。
1.3.7 琼脂性能测定
1.3.7.1 琼脂硫酸基含量的测定
将0.1~0.3 g 琼脂样品加入50 mL 1 mol/L HCl 后在115 ℃酸解240 min,用0.45 μm 的滤膜过滤后,取5 mL上述酸解液送至青岛菲优特检测有限公司检测,使用HJ84—016《水质无机阴离子(F-、Cl-、NO2-、Br-、NO3-、PO43-、SO32-、SO42-)的测定离子色谱法》进行检测。
脱硫率(Y,%)的计算公式如下。
式中:C1为脱硫前的硫酸基含量,%;C2为脱硫后的硫酸基含量,%。
1.3.7.2 凝胶强度的测定
将琼脂样品研磨成粉后,称取1.5%的琼脂并加入纯水中,把上述样品放入微波炉中加热并振荡至完全溶解,趁热倒入直径2 cm、高1.5 cm 的圆柱形容器中,冷却后转移至4 ℃冰箱静置约8 h。次日使用质构仪测得琼脂挤压至破裂的最大力。质构仪的参数为检测速度60 mm/min、穿刺深度5 mm。使用直径6 mm 的圆柱形探针测量样品。凝胶强度的计算公式如下。
式中:G为凝胶强度,g/cm2;F为琼脂挤压至破裂的最大力,N;g 为重力加速度,9.8 N/kg;S为截面积,cm2。
1.3.7.3 琼脂得率的测定
将处理前江蓠样品烘干至恒重,称量干重,记质量为G1(g)。称量上述样品处理后获得的琼脂,记质量为G2(g)。得率(D,%)计算公式如下。
1.3.7.4 分子量的测定
琼脂样品加热溶解后使用高效液相色谱法进行多糖分子量的测定。使用TSK-Gel GMPWxL(7.5 mm×300 mm)色谱柱;流动相为0.1 mol/L 硫酸钠,柱温为35 ℃;流速为0.5 mL/min;检测器为示差检测器。根据已知分子量的葡聚糖绘制标准曲线,标准曲线方程为y=-0.453 0x+12.971 1,R2=0.998 0。多糖样品的分子量由保留时间代入标准曲线方程计算得出。
1.3.7.5 透明度的测定
将1.5%的琼脂溶液加热至完全溶化,趁热倒入比色皿中,测定液体波长在750 nm 处的透光率即为透明度。
1.3.7.6 溶解温度、熔化温度、凝固温度的测定
1)溶解温度:将1.5%的琼脂置于60 ℃水浴锅中,并缓慢升温,当摇晃后无固体颗粒且溶液均一透明后,记该温度为溶解温度。
2)熔化温度:将1.5%的琼脂加热至完全溶解后插入温度计,待其冷却形成凝胶后,在胶体表面放置1 颗玻璃珠,并缓慢升温,当玻璃珠下落至底面,记该温度为熔化温度。
3)凝固温度:将1.5%的琼脂加热至完全溶解后插入温度计,并缓慢降温。当试管倾斜90°琼脂不发生流动,且温度计拔出时液面没有明显变化时的温度,记该温度为凝固温度。
1.4 数据处理
采用Excel 软件进行数据整理,采用Origin 软件进行图表制作。
2 结果与讨论
2.1 基于紫外灭菌的江蓠植株直接脱硫方法
本试验所采用的江蓠植株在吸水膨胀后其直径在3~7 mm,使得其单位琼脂的比表面积相对琼脂平板涂布法大幅提高。该方法的脱硫示意图及脱硫效果见图1。
菌体浓度越高,其生长所需要的硫越多,该菌的脱硫效率越强。由图1B 可知,对江蓠植株进行发酵培养,接菌且有葡萄糖组在24 h 时OD600nm达到3.7,较原平板法发酵微生物生长趋势明显提升。该培养条件下菌体生长状态较好,因此推测江蓠植株直接脱硫法有相对较高的脱硫率。同时水处理的对照组OD600nm未有明显提升,说明江蓠中所含有的杂质对OD600nm影响较小。
由图1C 可知,植株直接发酵培养的OD600nm随着发酵次数的增加而降低,表明培养基中硫酸基含量限制了巨大芽孢杆菌的后续生长,间接说明脱硫有效果。图1D 显示,未接菌的组别硫酸基含量为2.75%,接菌1 次、2 次、3 次硫酸基含量分别为1.26%、0.97%、0.59%,随着转接次数的增加,凝胶的硫酸基含量下降,其在第3 次接菌后脱硫率达到78.54%,较平板脱硫法的脱硫率21% 提高了两倍以上。说明该方法的确有良好的脱硫效果。
然而经过处理的琼脂凝胶强度低于检测限,无法测出,即琼脂中硫酸根的降低并未使得凝胶强度升高,说明有其它原因影响了凝胶强度。由图1B 可知,未接菌且有葡萄糖组的OD600nm变化趋势与接菌且有葡萄糖组的OD600nm变化趋势一致,说明即便不接巨大芽孢杆菌,也有微生物能明显生长,推测未接菌且有葡萄糖组中生长的微生物是因附着于江蓠植株表面而引入发酵体系的。另一方面,接菌且无葡萄糖组的OD600nm在48 h 后明显上升,说明有微生物生长,而巨大芽孢杆菌是无法利用琼脂为唯一碳源生长的细胞[19],因此推测附着于江蓠植株而引入的杂菌中有能以琼脂为碳源生长的微生物,即该微生物可以将琼脂多糖链降解,降低其分子量,从而影响凝胶强度。综上推测紫外线灭菌无法将江蓠植株表面的微生物全部杀灭,有必要对江蓠植株直接脱硫方法进行灭菌方法的优化。
2.2 灭菌方法的确定
2.2.1 乙醇或臭氧水灭菌的试验
75% 乙醇和臭氧水常用于微生物灭菌,且易挥发容易去除[20-23]。乙醇、臭氧水对江蓠植株的灭菌效果见图2。
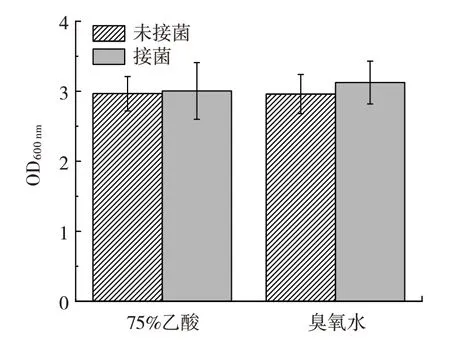
图2 75%乙醇或臭氧水处理后接巨大芽孢杆菌及未接菌发酵液的OD600 nmFig.2 OD600 nm of fermentation liquid with/without inoculation of Priestia megaterium after the treatment with 75%ethanol or O3 water
如果75%乙醇或臭氧水处理有良好的灭菌效果,则24 h 的未接菌组OD600nm应接近于0。然而,由图2可知,未接菌组24 h 的OD600nm与接菌组没有明显差异。说明在未接巨大芽孢杆菌种子液时,即使经过75%乙醇或臭氧水处理,该体系仍然有其他微生物生长,因此上述两种除杂菌方法与原来的紫外线灭菌法效果接近,不能有效地杀灭江蓠植株上附着的微生物,故不采用75%乙醇或臭氧水灭菌方法。
2.2.2 次氯酸钠灭菌的试验
NaClO 是日常生活中常见的消毒剂,在琼脂的传统碱法提取工艺中被用于琼脂漂白,一定范围内NaClO浓度越高脱色效果越显著[24-25]。不同有效氯浓度的次氯酸钠溶液对江蓠植株的漂白及灭菌效果见图3。
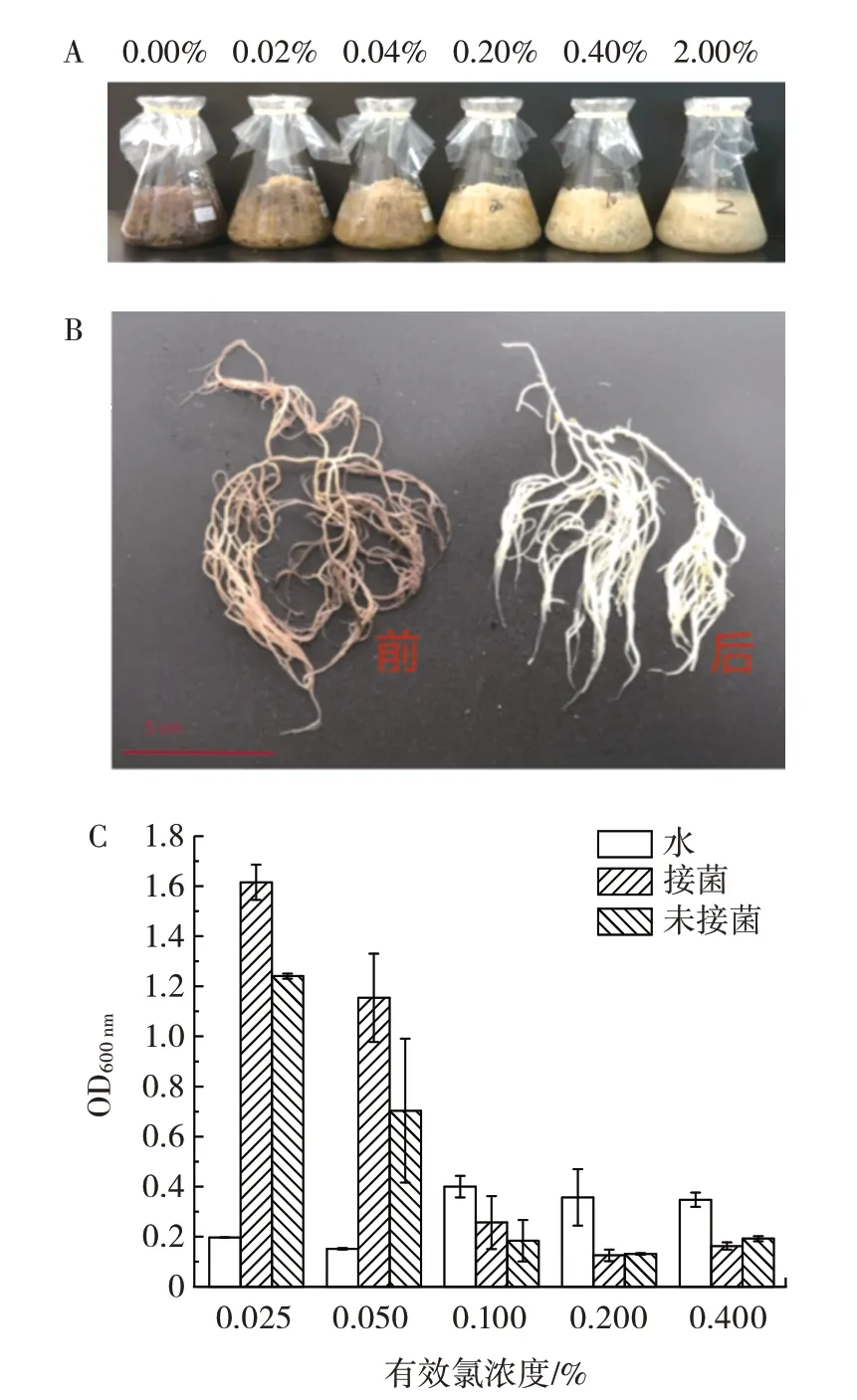
图3 NaClO 对江蓠植株的漂白及灭菌效果Fig.3 Bleaching and sterilization effects of NaClO on the Gracilaria plant
由图3A 与图3B 可知,次氯酸钠对江蓠植株有明显的漂白作用。同时由图3C 可知,在0.100%有效氯及以上浓度可观察到其OD600nm最高值明显低于0.050% 有效氯及以下的浓度,说明在0.100% 以上有效氯的浓度会有效杀灭江蓠植株上所附着的微生物。但与此同时随着次氯酸钠浓度的增高,其pH 值会变高,江蓠植株长时间在碱性过高的环境,会导致胶体自溶,使得琼脂最终的得率下降。因此在保证灭菌效果的前提下,应当尽可能选取低浓度的NaClO。基于此,灭菌剂次氯酸钠的浓度确定为0.100%的有效氯。
由图3C 可知,随着次氯酸钠的加入,巨大芽孢杆菌的细胞生长也由此受到抑制,因此需要对灭菌后的江蓠进行余氯去除处理后再进行接菌。对次氯酸钠灭菌方法增加除氯步骤,结果见图4。
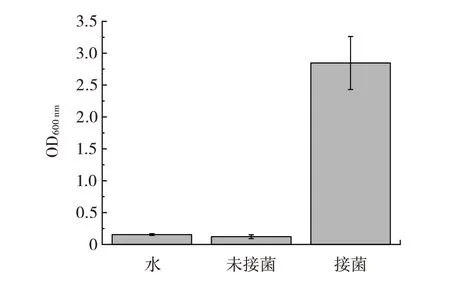
图4 NaClO 溶液处理并除氯后接菌及不接菌江蓠植株发酵3 d 后的OD600 nmFig.4 OD600 nm of fermentation liquid for 3 days with/without inoculation of Priestia megaterium after NaClO treatment and dechlorination
由图4 可知,接菌组的OD600nm明显高于未接菌组的OD600nm与水组的OD600nm,由此说明空转除氯步骤的增加,使得脱硫微生物生长良好,该方法可以有效避免除氯过程中杂菌污染。综上可知,在经过0.100%次氯酸钠处理后,再进行48 h 的除氯,最后接入巨大芽孢杆菌种子液的条件下,巨大芽孢杆菌细胞能够在该条件下进行增殖从而脱硫。
2.3 培养基江蓠添加量优化
巨大芽孢杆菌分别在添加不同质量江蓠的100 mL 培养基中的生长情况见图5。
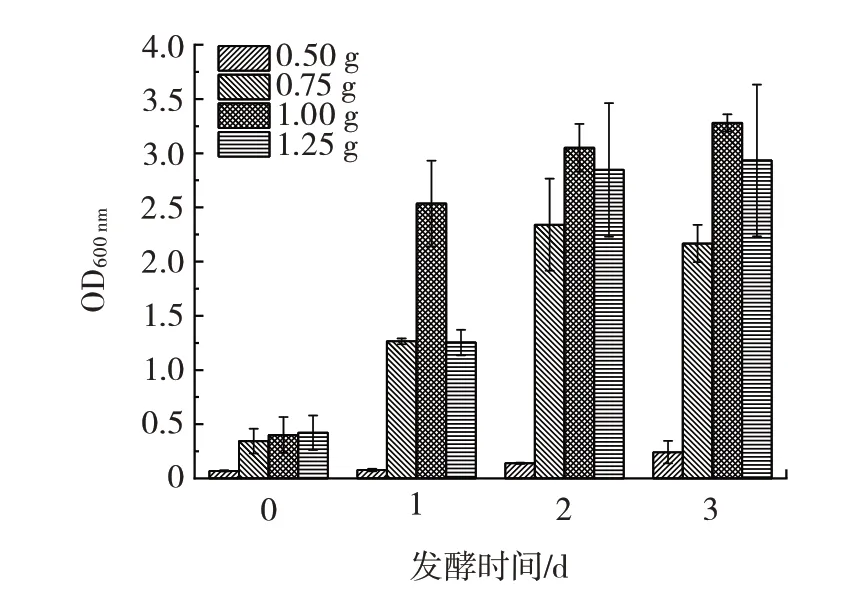
图5 巨大芽孢杆菌分别在添加不同质量江蓠的100 mL 培养基中的生长情况Fig.5 Growth of Priestia megaterium in 100 mL of culture media with different weights of Gracilaria plant
由图5 可知,巨大芽孢杆菌以1.25 g 和1.00 g 江蓠为唯一硫源时OD600nm的变化情况相似,表明其菌体密度也相似,而添加1.25 g 琼脂时,单位琼脂所能够接触的微生物更少,因此1.00 g 的琼脂添加量比1.25 g更合适。同时0.50 g 的OD600nm在3 d 达到最大值,最高OD600nm约为1.00 g 时的1/2,单位琼脂的微生物浓度是相同的,而在处理时1.00 g 能在单位培养基中处理更多琼脂,1.00 g 培养基利用率更高。综上选择1.00 g 为最适的江蓠添加量。
2.4 培养基成分浓度优化
培养基成分对巨大芽孢杆菌生长的影响见图6。
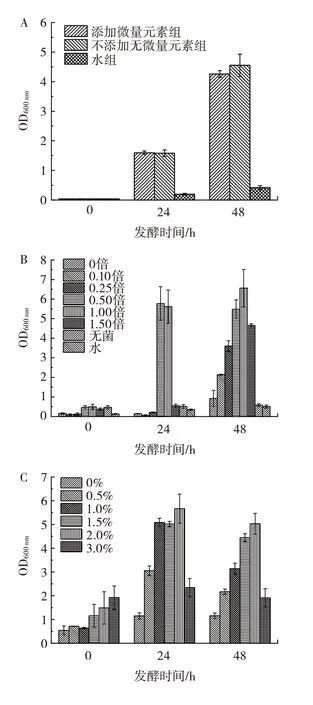
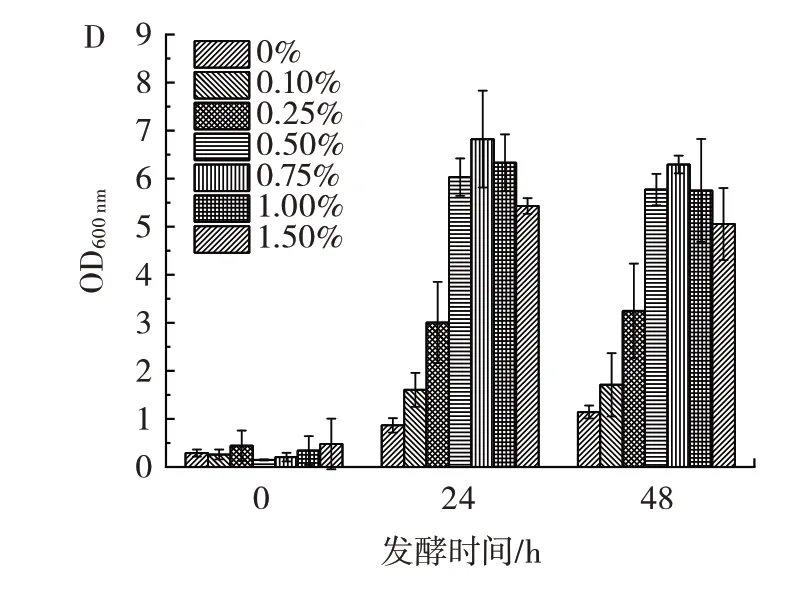
图6 培养基成分浓度对巨大芽孢杆菌在江蓠培养基中生长情况的影响Fig.6 Effect of component concentration on the growth of Priestia megaterium in culture medium with Gracilaria plant
由图6A 可知,加微量元素或不加微量元素对于巨大芽孢杆菌在江蓠植株直接脱硫体系中生长情况影响不大。推测是由于江蓠植株中本身就富含多种矿物质,为微生物提供了大量生长所需的微量元素。因此对于后续发酵培养中均不再额外加入微量元素。在图6B 中可以观察到缓冲盐浓度在其原浓度的0.50 倍和1.00 倍条件下,巨大芽孢杆菌长势均明显比其它浓度更好,其中1.00 倍的OD600nm在48 h 时较0.50 倍更高,故选1.00 倍缓冲液浓度。由图6C 和图6D 可知,葡萄糖浓度和NH4Cl 浓度分别在2.00%和0.75%时OD600nm最高,因此选取以上浓度为培养基最适宜的发酵浓度。
综上,经过对培养基的成分进行类型的筛选和浓度的优化,得出在植株直接脱硫体系中原浓度的缓冲液、2.0% 葡萄糖和0.75% 的NH4Cl,且不额外加微量元素是最适宜的培养基条件。
2.5 江蓠植株直接脱硫的效果
在最适条件下发酵前后琼脂的得率、凝胶强度和硫酸基含量如表1所示,琼脂的分子量、凝固温度、溶解温度、熔化温度、透明度变化如图7所示。
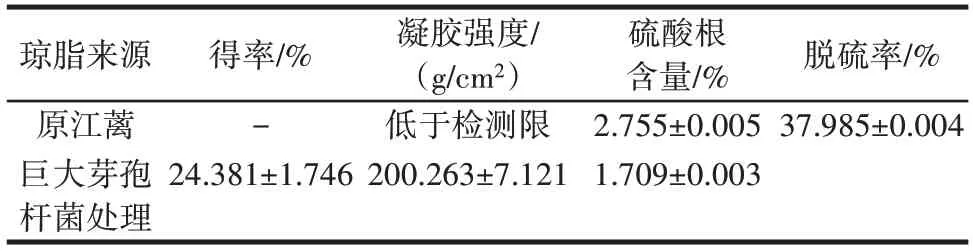
表1 江蓠植株直接脱硫后提取琼脂的得率和性能结果Table 1 Yield and performance of agar extracted from Gracilaria plant after direct desulfation
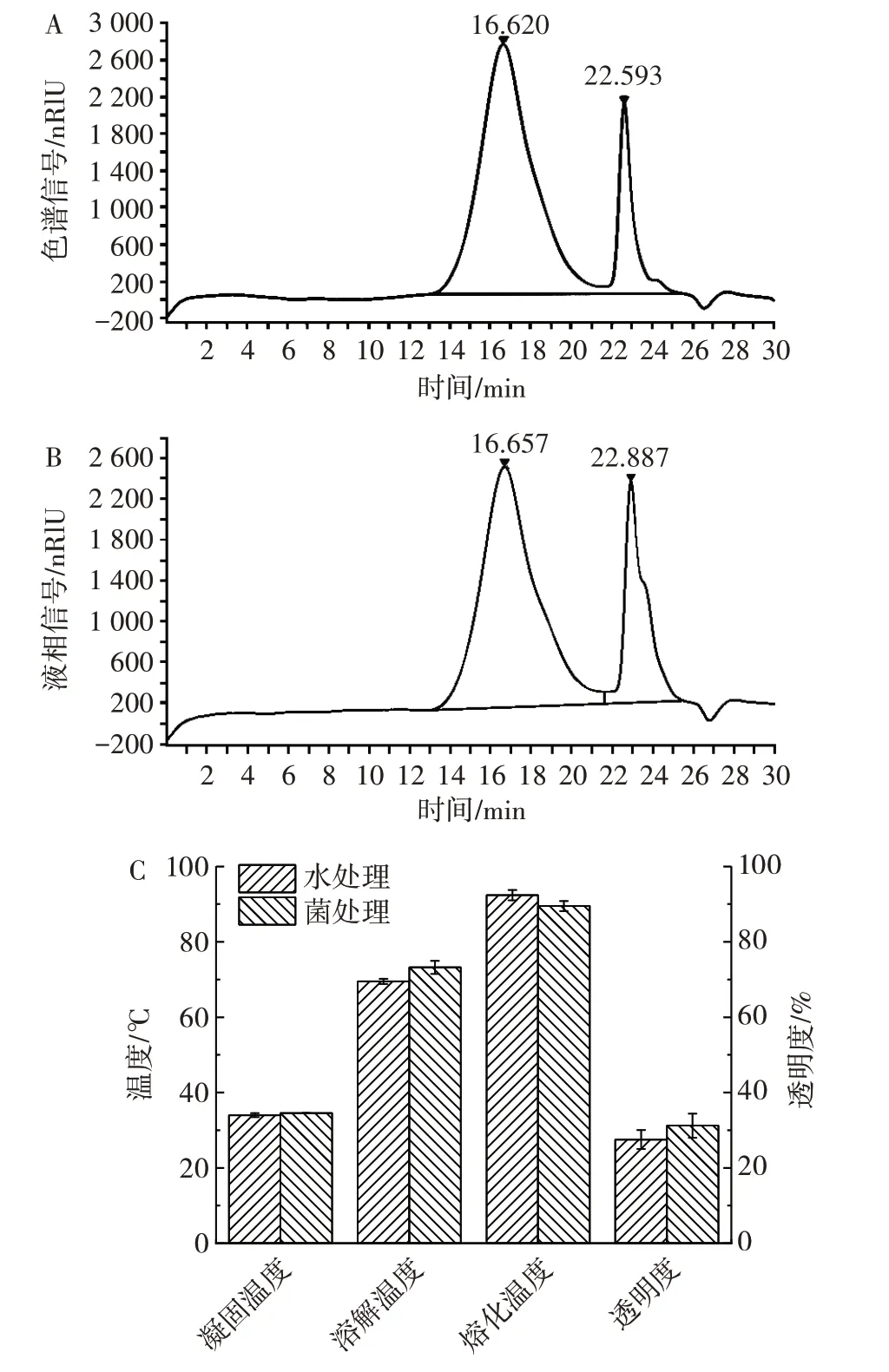
图7 江蓠植株微生物法琼脂脱硫的效果Fig.7 Effect of agar desulfation of Gracilaria plant by microbial method
由表1 可知,江蓠植株直接脱硫工艺的得率为(24.381±1.746)%,工业常用的碱法提胶的得率在20%~30%,因此,该得率处于当前工业琼脂提取的中间水平。微生物处理后植株直接脱硫法的脱硫率达到37.985%,凝胶强度从低于检测限(≤100 g/cm2)提升至(200.263±7.121)g/cm2,而碱法脱硫所得到的样品凝胶强度为(749.602±16.113)g/cm2,微生物法脱硫后,获得琼脂的凝胶强度与现行产业化、成熟的工艺仍然存在一定差距,所获得的产品品质仍然有待进一步提升。从表1 中37.985%的脱硫率看出江蓠植株琼脂的硫酸基含量有效降低,同时凝胶强度有质的提升;充分说明了该方法对江蓠植株的琼脂进行微生物脱硫有成效且有助于琼脂凝胶强度的提升。
由图7A 和图7B 可知,经脱硫后,琼脂分子量由469 758 Da 变化至442 399 Da,有所下降但幅度并不大。同时脱硫前后的熔化、溶解、凝固温度和透明度与水处理对照无明显差别(图7C),说明本文中建立的脱硫工艺在降低硫含量、提高凝胶强度的同时,对琼脂各方面其它性质并无不利影响。综上所述,微生物法江蓠植株直接脱硫在提升琼脂凝胶强度的同时,并不会对琼脂熔化、溶解、凝固温度和透明度等其它重要指标有明显影响。
3 结论
本研究建立了以巨大芽孢杆菌为脱硫主体的微生物江蓠植株直接脱硫工艺。紫外灭菌微生物江蓠植株直接脱硫法脱硫率能达到78.54%;但存在染菌、凝胶强度差的弊端。基于此本研究优化了灭菌方法,最终建立了有效氯浓度为0.100% 的次氯酸钠灭菌工艺;同时优化了微生物江蓠植株直接脱硫法最佳发酵条件,确定了在每100 mL 的微生物江蓠植株直接脱硫发酵体系中加入1.00 g 干重的江蓠植株,并确定在培养基中添加2.0%葡萄糖、6.72 g/L Na2HPO4、3.00 g/L KH2PO4、0.75%NH4Cl 且不需要额外加微量元素。江蓠植株通过优化的直接脱硫处理后,样品的脱硫率达到37.985%,凝胶强度从低于检测限提升至(200.263±7.121)g/cm2,即通过微生物法脱硫提高了琼脂的凝胶强度,且得率与碱处理得率相近,熔化温度、溶解温度、凝固温度、透明度未因微生物法处理而发生显著改变。

