双酶协同增加青稞慢消化淀粉含量的工艺优化
李岩,孙康娜,宋晓凡,陈富章,金苏宇,韩丽娟,叶英,院珍珍,2*
(1.青海大学农牧学院,青海西宁 810016;2.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016)
青稞(highland barley)又被称为裸大麦、米大麦或淮麦,在我国西藏、青海、云南及四川的甘孜州等高海拔地区大面积种植[1],具有高蛋白、高纤维、高维生素、低脂肪、低糖的“三高两低”成分结构特性[2]。研究表明,与其他谷物相比,青稞的血糖生成指数较低[3],其所具有降血糖的功效可能是通过诱导氨基酸、生物胺以及有机酸的分布改变,从而改善胰岛素敏感性[4-5],临床研究也验证了这一发现,毕铭鑫等[6]开展的为期3个月的临床研究也认为青稞麦片有显著改善空腹血糖受损患者的糖脂代谢的效果。
淀粉是人们膳食中所需能量的最多来源,对于维持人体的正常生理和活动具有重要的作用[7]。Englyst等[8]将淀粉按照其在人体中的消化状态分类,将淀粉划分为快消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)。研究表明,SDS 可以持续提供能量,并有助于控制血糖和胰岛素水平,不会使血糖短时间出现大幅度起伏,因此,增加慢消化淀粉的含量,有助于心血管疾病、糖尿病及肥胖病人病情的调控[9-10]。
β-淀粉酶又称为麦芽糖苷酶,是一种能够破坏淀粉末端的α-1,4 糖苷键的外切酶,淀粉经β-淀粉酶处理后,α-1,6 糖苷键的数量相对增加,短链淀粉增多,同时提高了分支密度,使得淀粉中SDS 含量升高,从而起到延缓葡萄糖释放速率的作用[11]。α-葡萄糖苷酶,又被称作α-D-葡萄糖苷水解酶,它可以从低聚糖类底物的非还原末端切开α-1,4 糖苷键,或者将葡萄糖残基(游离出)转移到另一糖类底物形成α-1,6 糖苷键,生成低聚异麦芽糖等[12]。高群玉等[13]通过试验发现处理普通玉米淀粉采用β-淀粉酶协同葡萄糖苷转移酶,使慢消化淀粉的含量可以得到有效提高,淀粉的消化性能也得到了一定的改善。肖瑀等[14]通过β-淀粉酶和α-葡萄糖苷酶协同处理普通红薯淀粉,结果表明,复合酶处理后红薯淀粉短链的比例有很明显的增多,平均链长也变得很低,分支密度有了明显增加。Shi 等[15]β-淀粉酶和α-葡萄糖苷酶协同处理豌豆淀粉,结果显示慢消化淀粉提高了10%左右,处理后的淀粉表现出较小数量的长支链,较大数量的短支链和更高的分支分数,分支率大约提高了10%。本试验主要采用酶法,通过β-淀粉酶协同α-葡萄糖苷酶来研究青稞快消化淀粉,以期为后续应用开发低糖青稞食品奠定基础。
1 材料与方法
1.1 材料与试剂
α-葡萄糖苷酶(700 000 U/mL):上海吉至生化科技有限公司;β-淀粉酶(700 000 U/mL):沧州夏盛酶生物技术有限公司;糖化酶(100 000 U/mL):江苏锐阳生物科技有限公司;猪胰α-淀粉酶(455 000 U/g):合肥博美生物科技有限责任公司;对硝基苯-α-D-葡萄糖苷(4-nitrophenyl β-D-glucopyranoside,PNPG):上海麦克林生化科技有限公司;萌芽黑青稞粉:青海汉和生物科技有限公司;淀粉试剂盒(50T/48S)、磷酸缓冲盐溶液(phosphate buffered saline,PBS):Solarbio 生物科技有限公司;氢氧化钠、酒石酸钾钠(分析纯):天津市河东区红岩试剂厂。
1.2 仪器与设备
恒温振荡水浴锅(HH-6):常州国华电器有限公司;紫外可见分光光度计(UV-1780):日本岛津公司;大容量冷冻离心机(LR-10M):湖南赫希仪器装备有限公司。
1.3 方法
1.3.1 酶改性青稞粉的制备
用蒸馏水将一定量的青稞粉溶解搅拌,之后加入5 mL 的乙酸钠缓冲溶液(1 mol/L,pH5.0)搅拌均匀,加入α-葡萄糖苷酶及β-淀粉酶溶液各857 μL[16-18],盖上塞子并立即放入50 ℃的恒温振荡水浴锅(150 r/min)中反应4 h。反应结束后将盛有样品的锥形瓶放入90 ℃的恒温水浴锅中灭酶10 min,每隔2 min 摇1 次,防止灭酶不均匀。将锥形瓶放入冷水中冷却至常温,将锥形瓶中样品装入离心管中,设置离心机转速为5 000 r/min 离心10 min 后弃上清液留沉淀,用蒸馏水洗涤后再次离心,将沉淀物放在平皿里,于60 ℃烘箱烘干。烘干后样品在粉碎机中粉碎,得到酶改性青稞粉,密封保存。
1.3.2 总淀粉含量的测定
采用淀粉含量检测试剂盒法测定酶改性青稞粉总淀粉含量。通过试验得到标准曲线方程为Y=12.192x+0.002,R2=0.999 2。总淀粉含量(T,mg/g)计算公式如下。
式中:x为标准曲线的浓度,mg/mL;n为所需的稀释倍数,1 000;V为试验提取的总体积,1.7 mL;W为样品的质量,0.1 g。
1.3.3 体外模拟消化法测定青稞粉中慢消化淀粉含量参照缪铭等[19]的方法,并作修改。利用体外模拟消化法测定消化性能:准确称量0.2 g 淀粉的样品于测试管中,加入3 个洁净玻璃珠,15 mL 醋酸钠缓冲液(0.2 mol/L,pH5.2),加入现配的混合酶(猪胰α-淀粉酶和糖化酶)溶液10 mL,摇匀后立即置于37 ℃恒温振荡器水浴振荡,于20、120 min 分别取2 mL 水解液,沸水浴灭酶,在4 500 r/min 的条件下离心15 min,吸取上清液100 μL 加入900 μL 水和提前配制好的2 mL二硝基水杨酸显色剂,沸水浴5 min 进行显色后,进行冷却,冷却后加入12 mL 去离子水后用紫外分光光度计于540 nm 处测定其葡萄糖含量。此步骤设置空白对照组。按下面公式计算慢消化淀粉含量(S,%)。
式中:T为总淀粉含量,mg/g;G20为酶解反应20 min 后的葡萄糖含量,mg/g;G120为酶解反应120 min后葡萄糖的含量,mg/g;G为葡萄糖当量,mg/g;At为吸光值;D为稀释倍数,1 500;Wt为青稞粉质量,g。
1.3.4 单因素试验
分别改变青稞粉浓度(6%、8%、10%、12%、14%)、α-葡萄糖苷酶添加量(140、145、150、155、160 U/g 青稞粉)、β-淀粉酶添加量(140、145、150、155、160 U/g青稞粉)、酶解时间(6、7、8、9、10 h)和酶解温度(48、49、50、51、52 ℃),考察各因素对青稞粉酶改性效果的影响。
1.3.5 响应面试验
以单因素试验结果为基础,以酶解青稞粉浓度、酶解温度和α-葡萄糖苷酶添加量为考察因素,以酶解后的慢消化淀粉含量为响应值,采用Design-Expert 8.0.6进行响应面设计。因素水平见表1。
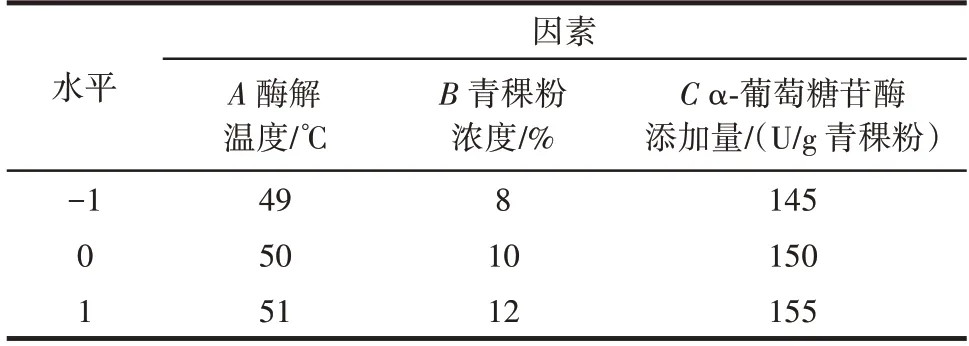
表1 响应面分析因素和水平Table 1 Factors and levels of response surface methodology
1.3.6 酶解青稞粉体外降血糖活性测定
1.3.6.1 α-淀粉酶抑制率测定
α-淀粉酶抑制率测定参照梁宗瑶等[20]的方法并稍做修改。将样品液稀释至0.312 5 mg/mL 并吸取150 μL 于试管中,再向试管中加入0.5 U/mL 的α-淀粉酶液150 μL,将放有样品的试管置于37 ℃恒温箱中反应10 min,结束后在试管中加入1% 的可溶性淀粉250 μL,再将试管放入37 ℃恒温箱反应10 min 后加入显色剂DNS 500 μL,置于沸水浴反应5 min,流水冷却后在540 nm 处测吸光值。反应体系中采用0.05 mol/L PBS(pH6.8)作为溶液及待测样品的空白对照,按下面公式计算α-淀粉酶抑制率(m,%)。
式中:a为待测样品组的测定吸光值;b为空白组的测定吸光值;c 为对照组的测定吸光值。
1.3.6.2 α-葡萄糖苷酶抑制率测定
α-葡萄糖苷酶抑制率测定参照赖晓桦等[21]的方法并稍做修改。在试管中加入一定量的酶改性青稞粉,分别加入一定量的PBS(pH6.8,0.05 mol/L)和PNPG(20 mol/L)溶液,将其混匀后置于37 ℃恒温箱中反应10 min 后加入0.2 U/mL 的α-葡萄糖苷酶溶液,继续在恒温箱中反应20 min 后加入反应终止液0.1 mol/L Na2CO3。反应终止后于405 nm 处测吸光值。反应体系中采用0.05 mol/L 磷酸盐缓冲液(pH6.8)作为溶液及待测样品的空白对照。α-葡萄糖苷酶抑制率(p,%)按下式计算。
式中:a为待测样品组的测定吸光值;b为空白组的测定吸光值;c为对照组的测定吸光值;d为PBS 的测定吸光值。
1.4 数据处理
试验重复3 次,采用Excel 软件和Design-Expert 8.0.6 对试验数据进行分析处理及绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 青稞粉浓度对慢消化淀粉含量的影响
青稞粉浓度对慢消化淀粉含量的影响如图1所示。
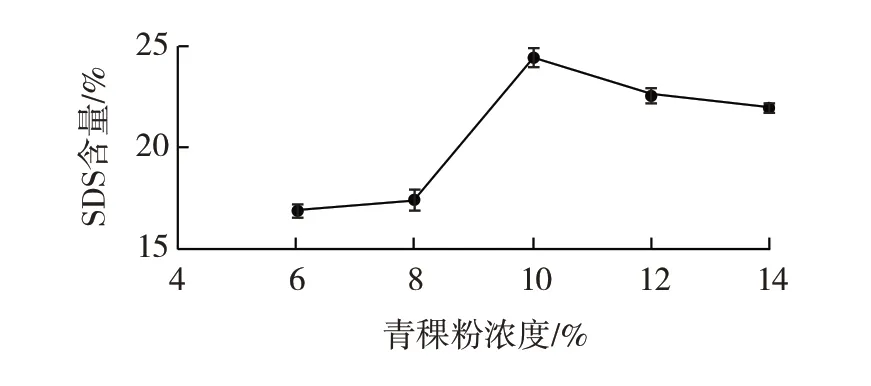
图1 青稞粉浓度对慢消化淀粉含量的影响Fig.1 Effect of concentration of highland barley powder on slowly-digestible starch
由图1 可知,SDS 含量随着青稞粉浓度的增加而增加,当青稞粉浓度为10% 时,慢消化淀粉含量达到最大值24.43%,在青稞粉浓度大于10%后,可能是因为溶液过于黏稠使酶和底物接触不方便,导致慢消化淀粉含量减小。
2.1.2 α-葡萄糖苷酶添加量对慢消化淀粉含量的影响
α-葡萄糖苷酶添加量对慢消化淀粉含量的影响如图2所示。
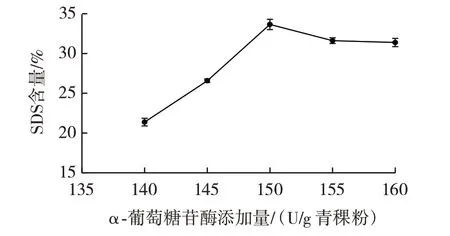
图2 α-葡萄糖苷酶添加量对慢消化淀粉含量的影响Fig.2 Effect of α-glucosidase addition on slowly-digestible starch
由图2 可知,SDS 含量随α-葡萄糖苷酶添加量的增加,先增大后减小,当α-葡萄糖苷酶添加量为150 U/g 青稞粉时,慢消化淀粉含量达到最高值33.65%,当α-葡萄糖苷酶添加量大于150 U/g 青稞粉时,可能是因为青稞粉酶解所需要的酶已经饱和,底物中没有过多的非还原性末端被切开,从而使得葡萄糖含量减少,形成的非发酵性糖变少,所以慢消化淀粉含量下降。
2.1.3 β-淀粉酶添加量对慢消化淀粉含量的影响
β-淀粉酶添加量对慢消化淀粉含量的影响如图3所示。
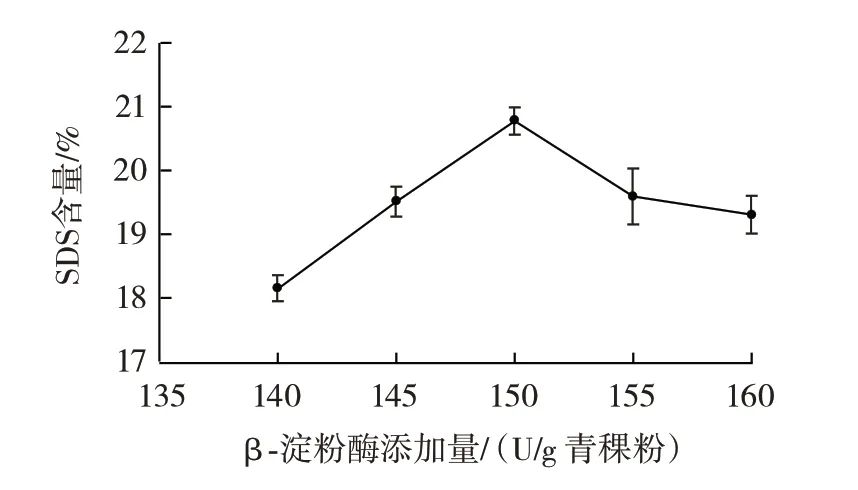
图3 β-淀粉酶添加量对慢消化淀粉含量的影响Fig.3 Effect of β-amylase addition on slowly-digestible starch
从图3 可知,β-淀粉酶添加量为150 U/g 青稞粉时,慢消化淀粉含量达到最大值20.78%,当β-淀粉酶添加量小于150 U/g 青稞粉时,可能是因为β-淀粉酶增加,底物青稞粉断开α-1,4 糖苷键得到的麦芽糖增加,从而进行转化得到慢消化淀粉,所以慢消化淀粉含量呈上升趋势,而当β-淀粉酶添加量大于150 U/g 青稞粉时,青稞粉酶解所需要的β-淀粉酶已经饱和,慢消化淀粉含量下降。
2.1.4 酶解时间对慢消化淀粉含量的影响
酶解时间对慢消化淀粉含量的影响如图4所示。
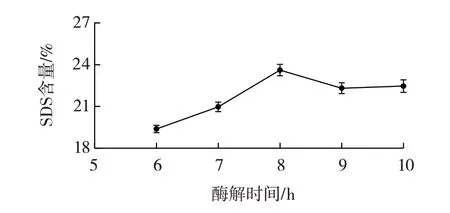
图4 酶解时间对慢消化淀粉含量的影响Fig.4 Effect of enzymatic hydrolysis time on slowly-digestible starch
由图4 可知,在其他酶改性条件一定的情况下,当酶解时间为8 h 时,慢消化淀粉含量达到最大值为22.84%,当酶解时间小于8 h,慢消化淀粉含量会随着酶解时间的延长而变大,大于8 h 后由于酶解过程逐渐结束,慢消化淀粉含量趋于平稳。
2.1.5 酶解温度对慢消化淀粉含量的影响
酶解温度对慢消化淀粉含量的影响如图5所示。

图5 酶解温度对慢消化淀粉含量的影响Fig.5 Effect of enzymatic hydrolysis temperature on slowlydigestible starch
由图5 可知,随着酶解温度的上升,随慢消化淀粉含量逐渐增加,当酶解温度达到50 ℃时,慢消化淀粉含量达到最高值28.34%,随后可能是因为酶解温度过高影响酶的活性,所以慢消化淀粉含量下降。
2.2 响应面优化及分析
2.2.1 模型的建立与显著性检验
基于单因素试验进行响应面优化分析,以酶解温度(A)、青稞粉浓度(B)和α-葡萄糖苷酶添加量(C)为响应面的影响因素,以慢消化淀粉含量为响应值,试验结果见表2。未将β-淀粉酶浓度作为考察因素,是因为其与α-葡萄糖苷酶具有相同的酶活力并且在单因素试验中表明,当酶添加量均为150 U/g 青稞粉时,慢消化淀粉含量最高,因此为了节约成本及时间,选择了其中一种酶作为考察因素。
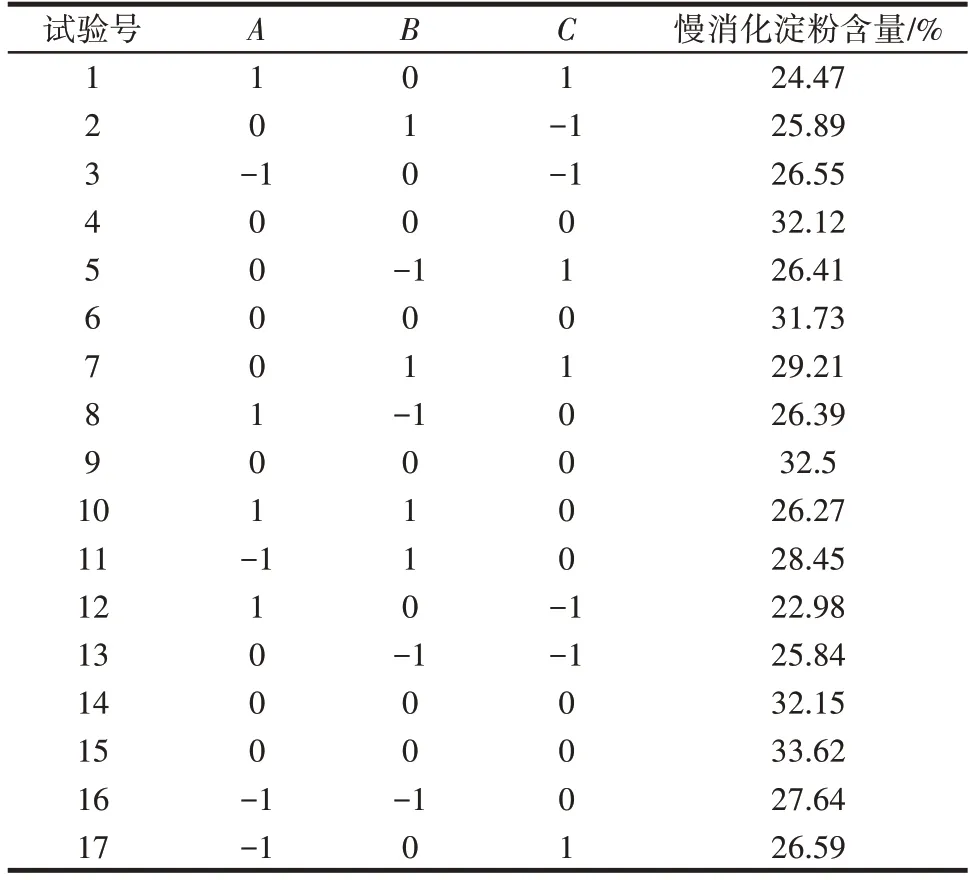
表2 响应面分析方案及试验结果Table 2 Design and results of response surface methodology
对表2 试验数据利用Design-Expert 软件进行多元回归拟合。总结出慢消化淀粉含量与酶解温度(A)、青稞粉浓度(B)和α-葡萄糖苷酶添加量(C)的二次多项回归模型为Y=32.42-1.13A+0.44B+0.68C-0.23AB+0.36AC+0.68BC-3.47A2-1.77B2-3.81C2。
对上述的回归模型进行方差分析,结果如表3所示。
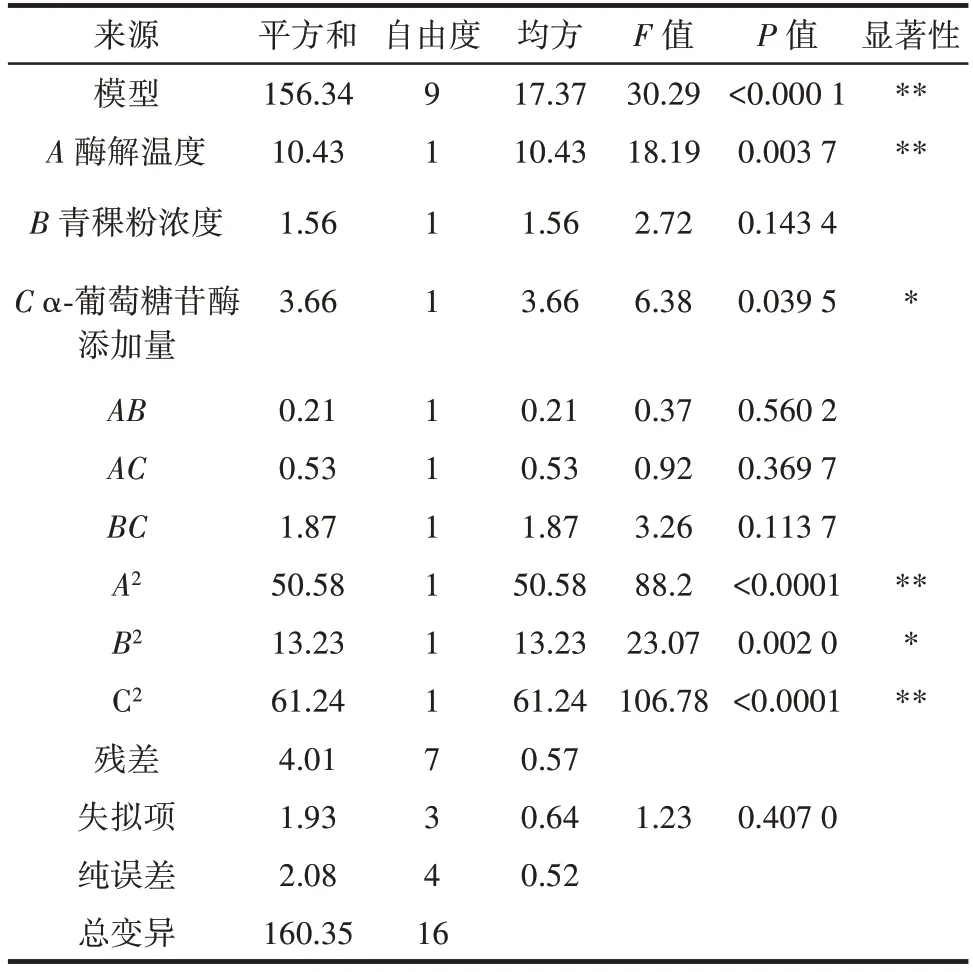
表3 慢消化淀粉含量方差分析Table 3 Variance analysis of slowly-digestible starch
从表3 可知,该模型P<0.000 1,且F值为30.29,结果表明拟合模型具有高度的显著性。失拟项体现出了模型中的数据变异,失拟项的F值为1.23,P值为0.407 0,说明失拟项不显著,无失拟因素在该回归方程中存在,回归模型与实测值能得到很好的拟合。从结果可以得到3 个因素对慢消化淀粉含量的影响因素大小为酶解温度>α-葡萄糖苷酶添加量>青稞粉浓度。A、A2、C2对青稞慢消化淀粉含量的影响极显著,C、B2对青稞慢消化淀粉含量的影响显著,AB、AC、BC对慢消化淀粉含量的影响不显著,因此试验因素对响应值Y的影响不是简单的线形关系,二次项对响应值也有很大影响。以上均说明该模型可用于增加青稞慢消化淀粉含量的工艺优化。
2.2.2 响应面优化
等高线越圆表示两因素交互作用越不显著,反之两因素交互作用越显著;响应面图中,曲线越弯曲,坡度越大,则表明因素对结果影响较大。各要素之间的交互作用的响应面和等高线图如图6所示。
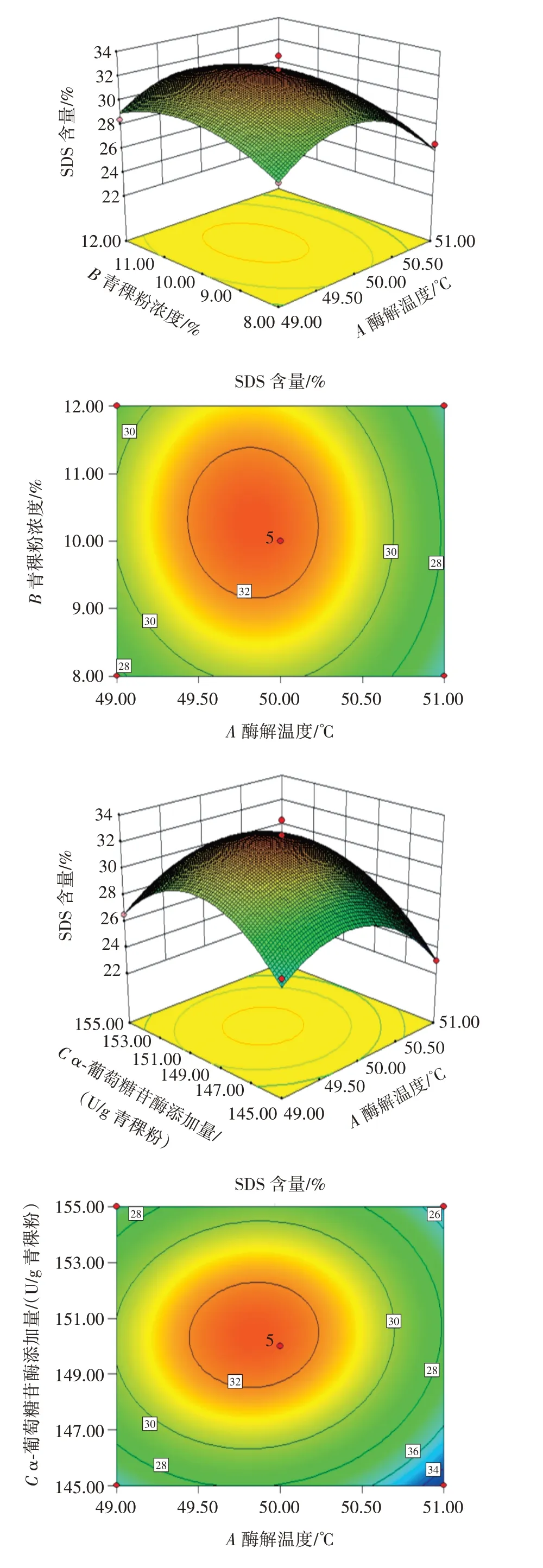
由图6 可知,青稞粉浓度和α-葡萄糖苷酶添加量的等高线呈椭圆,响应面曲面坡度最大,说明青稞粉浓度和α-葡萄糖苷酶添加量的交互作用最显著,与方差分析结果一致。
2.2.3 最佳提取工艺条件的验证
响应面试验结果得出双酶酶解增加慢消化淀粉的理论条件为青稞粉浓度9.8%、α-葡萄糖苷酶添加量为150.5 U/g 青稞粉、酶解温度49.6 ℃,预测在该条件下青稞慢消化淀粉含量为32.58%。考虑到实际操作的局限性,将试验条件调整为青稞粉浓度为10%,α-葡萄糖苷酶添加量150 U/g 青稞粉,酶解温度为50 ℃,重复3 次试验进行验证试验,所得平均SDS 含量为33.62%,该结果与理论值接近,表明最优工艺参数准确可靠,该模型可以较好地预测青稞慢消化淀粉含量。
2.3 降糖活性分析
在人体内,淀粉等碳水化合物先被α-淀粉酶水解为双糖,再被α-葡萄糖苷酶水解成单糖,之后才会被小肠吸收,因此α-淀粉酶和α-葡萄糖苷酶的活性如果得到了抑制,就可以达到餐后血糖降低的目的。青稞原粉及酶改性青稞粉的降糖活性如表4所示。

表4 降糖活性分析Table 4 Analysis of hypoglycemic activity
由表4 可知,与原粉相比酶改性青稞粉的α-淀粉酶和α-葡萄糖苷酶的抑制率分别增加了62.97% 和52.46%,可能是因为在酶解过程中破坏了青稞粉的结构,使其与消化酶的接触减少,而且在试验过程中进行了水洗离心弃上清液这一步骤,使部分水溶性的麦芽糖、葡萄糖等随上清液被移除,因此α-淀粉酶和α-葡萄糖苷酶的抑制率增加。
3 结论
基于双酶协同技术增加青稞慢消化淀粉含量,在单因素试验结果的基础上采用响应面优化设计,结果表明最佳酶解方案为青稞粉浓度10%、酶解温度50 ℃、α-葡萄糖苷酶添加量150 U/g 青稞粉。经验证后酶改性青稞粉中SDS 含量为33.62%,分析得到理论预测值为32.58%,相对误差为1.04%,与验证试验结果相符。在体外降糖活性方面,α-淀粉酶和α-葡萄糖苷酶的抑制率与原粉相比分别增加了62.97% 和52.46%。本试验研究结果可为青稞的深度开发利用及青稞低血糖生成指数食品的研发提供参考。

