荠菜粗多糖提取优化及其理化功能与抗氧化性
张欣,刘盈,刘会平,马笑笑,李灿,张慧慧,王兵
(天津科技大学食品科学与工程学院,天津 300457)
荠菜[Capsellabursa-pastoris(L.)Medik]是一年或两年生草本植物,在植物分类学上种属十字花科荠属,又名护生草、鸡心菜、地米菜等[1]。荠菜的发源地在中国,因其耐寒抗旱、易种植等优点,很快成为遍布全世界温带地区的草本作物[2],受到越来越多研究者的青睐,樊慧娟等[3]从荠菜中分离出9 种类黄酮并评估其保肝活性;廖雨冰等[4]基于网络药理学分析了荠菜中的活性成分,研究荠菜治疗高血压的作用机制;刘思妤等[5]通过构建2 型糖尿病(type 2 diabetes mellitus,T2DM)小鼠及高糖诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤模型,观察荠菜提取物对T2DM 血管损伤的作用;曹小燕等[6]采用超声辅助提取荠菜多酚,对多酚的提取工艺进行了优化并分析其抗氧化性。
如今,广泛分布在动物、植物和微生物中,具有多种生理活性的天然多糖引起了人们的关注[7]。天然多糖作为一种高分子量的水溶性活性物质,结构复杂多样,其分子量、单糖组分等都决定了它们的功能性质,如抗氧化性、乳化性、抗菌、保湿等[8]。这些特性可以在食品加工中改善食品黏度和乳液稳定性,增强食品口感和质地。
荠菜具有较高的食用价值,但在实际应用中多以鲜食为主,加工水平较低,产品附加值利用率不高,荠菜相关产业的开发仍有极大的空间。荠菜中不仅含有大量的黄酮类、有机酸、氨基酸、无机物等营养物质,还含有丰富的糖类。然而,关于荠菜多糖的结构特性、构效关系的报道很少,限制了其在食品工业中的大规模应用。荆云等[9]采用超微粉碎联合超声辅助法提取荠菜多糖;张华等[10]研究了荠菜多糖的提取工艺及清除自由基作用;王华等[11]对荠菜多糖进行分离纯化并分析其单糖组成。本研究采用单因素试验和响应面试验优化料液比、提取时间、提取温度3 个因素对荠菜粗多糖提取率的影响,得到最优荠菜粗多糖提取条件,鉴定分析荠菜多糖[Capsellabursa-pastoris(L.)polysaccharides,CBP]的总糖含量、蛋白质含量、糖醛酸含量、分子量、单糖组成、功能特性和抗氧化性,提高荠菜多糖在食品领域的潜在应用价值,以期为荠菜多糖的进一步应用和功能性食品开发提供参考。
1 材料与方法
1.1 材料与试剂
荠菜:市售;无水乙醇、正丁醇、溴化钾:天津市江天化工技术股份有限公司;浓硫酸:北京化工厂;三氯甲烷:天津市化学试剂厂;T 系列葡聚糖标准品、单糖标准品、植物总酚(total phenolics,TP)含量检测试剂盒、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH);2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[(2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]:北京索莱宝科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
WN-500 台式小型粉碎机:广州旭朗机械设备有限公司;R-300 旋转蒸发仪:上海亚荣生化仪器厂;ST-16R 高速冷冻离心机:湘潭湘仪仪器有限公司;FD-1A-50 真空冷冻干燥机:上海比朗仪器制造有限公司;HH-6恒温水浴锅:上海博迅实业有限公司;Model680 酶标仪:美国Bio-Rad 公司;RP-10 活化柱:天津博纳艾杰尔科技有限公司;Nicolet iS50 红外光谱仪(Fourier transform infrared spectroscopy,FT-IR):美国Thermo Scientific 公司;1260 型高效液相色谱(high performance liquid chromatography,HPLC)仪:安捷伦科技有限公司;UV-1800 紫外光谱仪:日本岛津公司;TGA-Q500 型热重分析仪:美国TA Instruments Waters LLC 公司;ICS-5000 型离子色谱仪:戴安(DIONEX)公司。
1.3 方法
1.3.1 荠菜粗多糖的提取
使用粉碎机将干燥的荠菜粉碎成粉末,过80 目筛密封储存备用。称取适当的荠菜粉末,采用水提醇沉法提取多糖,90 ℃热水浸提3 h,然后4 000 r/min 离心20 min,过滤得到上清液,将上清液用旋转蒸发仪减压浓缩至原体积的1/3,缓慢加入乙醇至溶液的乙醇终浓度为80%,4 ℃保持过夜后4 000 r/min 离心20 min,弃去上清液收集沉淀,将残留乙醇完全挥发后加入少量蒸馏水复溶,冷冻干燥得到荠菜粗多糖。荠菜粗多糖提取率(J,%)计算公式如下。
式中:W1为荠菜粗多糖的质量,g;W0为荠菜粉末的质量,g。
1.3.2 单因素试验
按照1.3.1 提取工艺考察料液比[1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)]、提取时间(1、2、3、4、5 h)、提取温度(60、70、80、90、100 ℃)和提取次数(1、2、3、4、5)对荠菜粗多糖提取率的影响。
1.3.3 响应面优化
在1.3.2 的基础上,选择响应面法进行优化,进一步对料液比(A)、提取时间(B)、提取温度(C)进行三因素三水平试验,确定荠菜粗多糖的最优提取条件,因素水平编码如表1所示。

表1 响应面因素水平编码Table 1 Level coding of factors in the response surface design
1.3.4 多糖的纯化
将适量的荠菜粗多糖用蒸馏水溶解,加入3 倍体积的Sevag 试剂(氯仿∶正丁醇=4∶1,体积比),充分振荡20 min 后4 000 r/min 离心15 min 分层,保留多糖溶液、舍弃中间蛋白层、回收利用下层有机相并重复操作直至中间蛋白层除尽为止,收集多糖溶液并旋出残留有机相,采用3.0×105Da 透析袋除去其它小分子杂质获得纯化的荠菜多糖[Capsellabursa-pastoris(L.)polysaccharides,CBP]。
1.3.5 基本成分测定
采用苯酚-硫酸法测定总糖含量[12],绘制葡萄糖标准曲线得到回归方程:Y=6.432 9x+0.079 2,R2=0.997 6,计算CBP 的总糖含量;采用考马斯亮蓝法测定蛋白质含量[13],绘制牛血清蛋白标准曲线得到回归方程:Y=0.066 6x+0.559 0,R2=0.992 0,计算CBP 的蛋白质含量;采用间羟基联苯法测定糖醛酸含量[14],绘制半乳糖醛酸标准曲线得到回归方程:Y=5.36x+0.088 4,R2=0.995 0,计算CBP 的糖醛酸含量;总酚含量按照植物总酚(TP)含量检测试剂盒测得。
1.3.6 分子量测定
采用超纯水将T 系列葡聚糖标准品配制成1 mg/mL溶液,过0.22 μm 滤膜备用,使用高效液相色谱仪检测分析,以保留时间为横坐标,相对分子质量的对数值为纵坐标绘制标准曲线。
同时配制1 mg/mL 的CBP 溶液,按照上述方法进行检测,计算CBP 的平均分子量。
1.3.7 单糖组成测定
将单糖标准品混匀制得对照品混合液(50 mg/L),过0.22 μm 滤膜后备用。
向试管中加入5 mg CBP、1 mL 三氟乙酸(2 mol/L),振荡溶解后于110 ℃条件下密封反应2 h,N2吹干;再加入1 mL 甲醇溶液充分溶解,N2吹干,重复3 次得到CBP 的降解产物。将降解产物稀释至100 mg/L,依次过0.22 μm 滤膜及RP-10 活化柱,使用离子色谱仪进行检测。通过与单糖标准品的保留时间进行比较,分析CBP 的单糖组成,根据峰面积计算CBP 单糖摩尔比例。
1.3.8 红外光谱测定
称取1.00 mg 完全干燥的多糖样品,置于洁净的石英研钵中,并与溴化钾充分混合(质量比1∶120),研磨均匀,压片机制片,使用红外光谱扫描仪分析,扫描范围4 000~400 cm-1。
1.3.9 理化功能
1.3.9.1 热重分析
称取样品5.0 mg 于铝制样品坩锅内,将样品盘放置于热重分析仪中,设置温度30~600 ℃、加热速率为25 ℃/min 进行测定。
1.3.9.2 持水性和持油性测定
参照Ben Romdhane 等[15]的方法并稍作修改,称取0.3 g CBP 置于离心管中,分别加入适量水或大豆油,混合均匀后密封静置1 h,4 000 r/min 离心20 min,除去上清液,计算持水性(S,g/g)和持油性(Y,g/g),计算公式如下。
式中:W0为样品质量,g;W1为样品和离心管的质量,g;W2为持水样品和离心管的质量,g;W3为持油样品和离心管的质量,g。
1.3.9.3 起泡性及泡沫稳定性测定
参照Ktari 等[16]的方法并稍作修改,将不同浓度的CBP 溶液(5、10、20、40、60 mg/mL)以10 000 r/min 均质3 min,计算起泡性(Q,%),在30 min 后计算泡沫稳定性(P,%),计算公式如下。
式中:V0为初始体积,mL;V1为均质后总体积,mL;V2为静置30 min 后的总体积,mL。
1.3.9.4 乳化性及乳化稳定性测定
参照Wang 等[17]的方法并稍作修改,将不同浓度的CBP 溶液(5、10、20、40、60 mg/mL)与等体积大豆油混匀,以10 000 r/min 均质3 min,1 000 r/min 离心10 min,计算乳化性(R,%),将乳液在80 ℃下加热30 min,冷却至室温后1 000 r/min 离心10 min,计算乳化稳定性(W,%),计算公式如下。
式中:V0为初始体积,mL;V1为均质后总体积,mL;V2为加热30 min 后总体积,mL。
1.3.10 抗氧化性测定
1.3.10.1 DPPH·清除率测定
参照Liu 等[18]的方法并稍作修改,将2 mL 不同浓度的CBP 溶液(0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/mL)、2 mL 0.1 mmol/L 的DPPH 溶液混匀,黑暗下反应0.5 h,517 nm 测定吸光度。DPPH·清除率(RDPPH,%)的计算公式如下。
式中:A1为多糖或阳性对照组(VC)的吸光度;A2为蒸馏水代替DPPH 的吸光度;A0为蒸馏水代替多糖或VC的吸光度。
1.3.10.2 ABTS+·清除率测定
参照张凤培等[19]的方法并稍作修改,将2 mL 不同浓度的CBP 溶液(0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/mL)、2 mL 0.1 mmol/L 的ABTS 溶液混匀,黑暗下反应0.5 h,734 nm 测定吸光度。ABTS+·清除率(RABTS,%)的计算公式如下。
式中:A1为多糖或阳性对照组(VC)的吸光度;A2为蒸馏水代替ABTS 的吸光度;A0为蒸馏水代替多糖或VC的吸光度。
1.3.10.3 ·OH 清除率测定
参照Hou 等[20]的方法并稍作修改,将2 mL 不同浓度的CBP 溶液(0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/mL)、2 mL 6 mmol/L 的FeSO4溶液、2 mL 6 mmol/L 的水杨酸·无水乙醇溶液、2 mL 6 mmol/L 的H2O2溶液依次混匀,37 ℃避光0.5 h,510 nm 测定吸光度。·OH 清除率(ROH,%)的计算公式如下。
式中:A1为多糖组或阳性对照组(VC)的吸光度;A2为蒸馏水代替H2O2的吸光度;A0为蒸馏水代替多糖或VC的吸光度。
1.3.10.4 总还原力的测定
参照秦子芳等[21]的方法并稍作修改,将1 mL 不同浓度的CBP 溶液(0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/mL)、2.5 mL 0.2 mol/L pH6.6 磷酸缓冲液、2.5 mL 1%铁氰化钾依次混匀,50 ℃反应20 min。随后加入2.5 mL 10%三氯乙酸终止反应,离心(3 000 r/min,10 min)取上清液2.5 mL,加入2.5 mL 蒸馏水、0.5 mL 0.1% FeCl3混匀后静置10 min,在510 nm 处测定吸光度。总还原力(△A)的计算公式如下。
△A=A1-A2
式中:A1为多糖组或阳性对照组(VC)的吸光度;A2为蒸馏水代替多糖或VC的吸光度。
1.4 数据处理
试验数据均采用SPSS 20.0 处理,统计结果采用平均值±标准差表示。P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对荠菜粗多糖提取率的影响
料液比对荠菜粗多糖提取率的影响见图1。
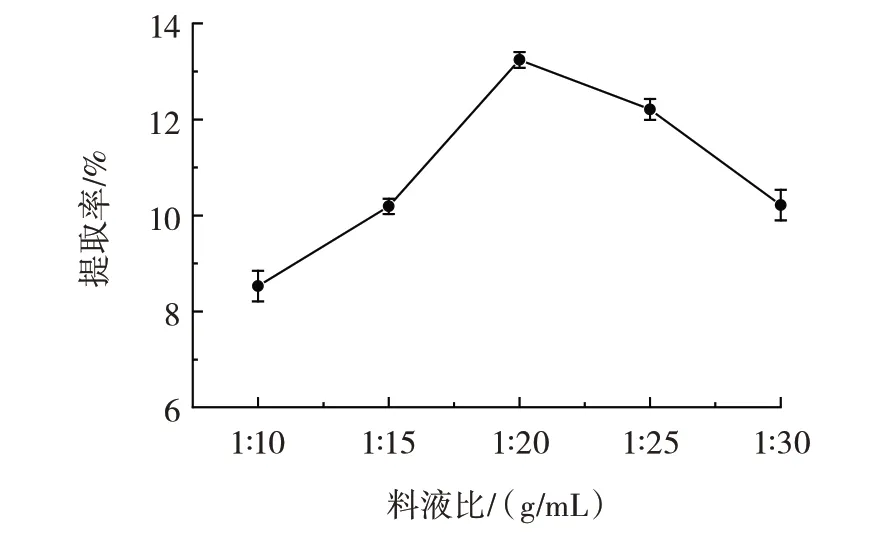
图1 不同料液比对提取率的影响Fig.1 Effects of different solid-to-liquid ratios on the extraction rate
由图1 可知,料液比在1∶10~1∶20(g/mL),荠菜粗多糖能够充分浸提到溶液中,粗多糖的提取率呈快速增长的趋势,在1∶20(g/mL)时达到峰值,为(13.24±0.16)%;继续增加溶剂体积,溶液中分子之间的相互约束作用降低,从而导致粗多糖提取率逐渐下降[22],因此选择1∶15、1∶20、1∶25(g/mL)进行响应面优化试验。
2.1.2 提取时间对荠菜粗多糖提取率的影响
提取时间对荠菜粗多糖提取率的影响见图2。
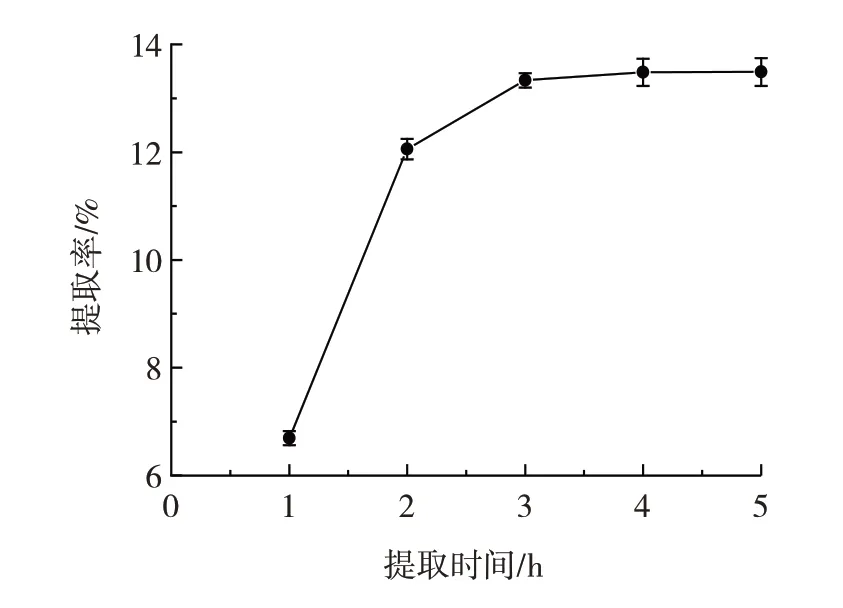
图2 不同提取时间对提取率的影响Fig.2 Effects of different extraction time on the extraction rate
由图2 可知,粗多糖随着提取时间的延长而充分溶出,荠菜粗多糖提取率逐渐升高,当提取时间到达3 h时,提取率为(13.33±0.13)%,继续延长提取时间,提取率趋于稳定,后续提取率仅轻微升高,表明粗多糖大部分已被析出,达到饱和,提取率不再随着提取时间的延长而增加,因此选择2、3、4 h 进行响应面优化试验。
2.1.3 提取温度对荠菜粗多糖提取率的影响
提取温度对粗多糖提取率的影响见图3。
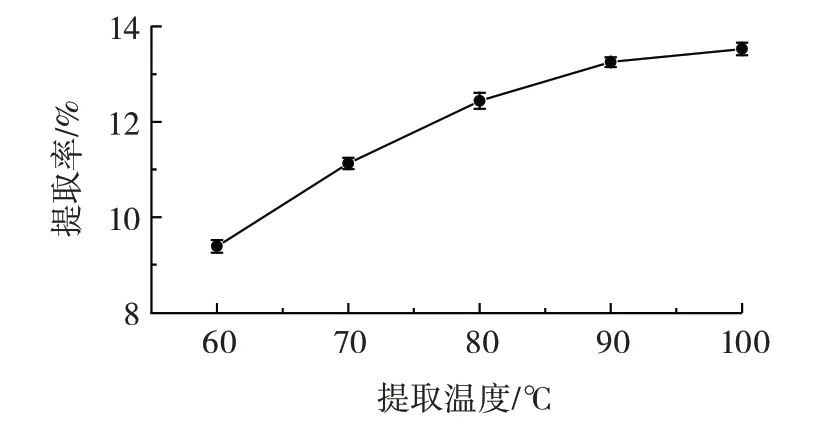
图3 不同提取温度对提取率的影响Fig.3 Effects of different extraction temperatures on the extraction rate
由图3 可知,随着提取温度的升高,水溶性多糖能够从荠菜组织中更快、更容易地渗出[23]。当提取温度达到90 ℃时,提取率为(13.25±0.10)%,随后提取率从快速增加转变成缓慢增加。因此选择80、90、100 ℃进行响应面优化试验。
2.1.4 提取次数对荠菜粗多糖提取率的影响
提取次数对荠菜粗多糖提取率的影响见图4。
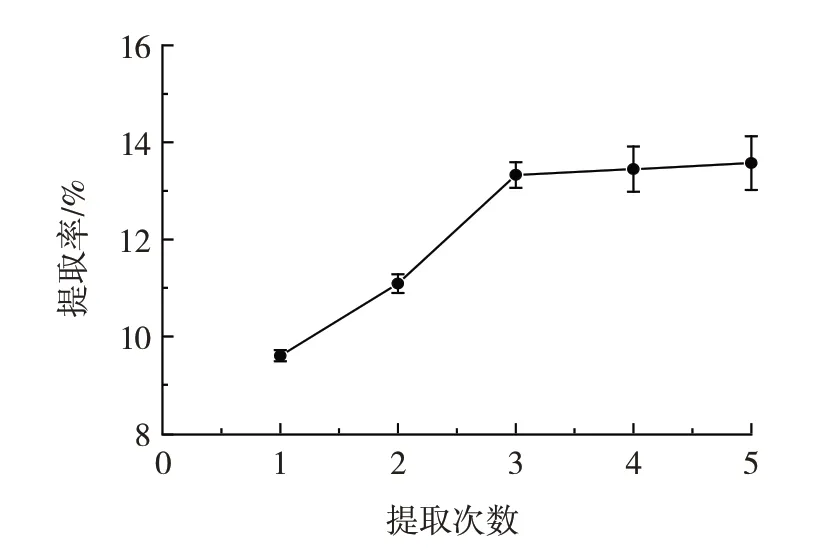
图4 不同提取次数对提取率的影响Fig.4 Effects of different extraction times on the extraction rate
由图4 可知,提取次数从1 次增加到3 次时,荠菜粗多糖提取率迅速升高为(13.33±0.27)%;随着提取次数的继续增加,提取率增长缓慢。提取次数的增加会导致资源的浪费,因此确定3 次为最佳提取次数。
2.2 响应面试验结果
响应面试验设计方案及结果见表2。
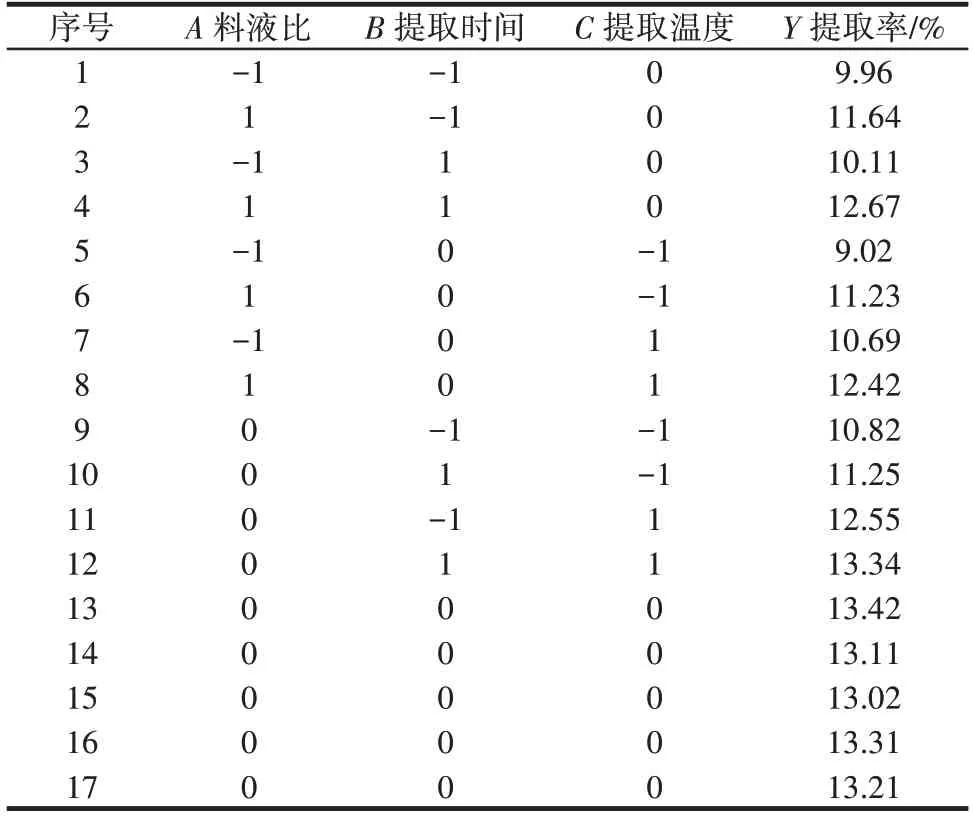
表2 响应面试验设计与结果Table 2 Design and results of response surface experiments
将表2 的试验数据进行响应面分析,得到回归方程:Y=13.21+1.02A+0.30B+0.84C+0.22AB-0.12AC+0.09BC-1.63A2-0.48B2-0.74C2。为分析模型是否有效,进行方差分析,结果见表3。
由表3 可知,失拟项P=0.306 2>0.05,影响不显著,表示模型没有异常项,说明此响应面优化试验模型可以用于荠菜粗多糖提取条件优化的预测,根据F值可知各因素对荠菜粗多糖提取率的影响顺序为料液比>提取温度>提取时间。最优提取条件为料液比1∶21.82(g/mL)、提取时间3.03 h、提取温度92.93 ℃,预测荠菜粗多糖提取率为13.55%。
为了实际操作过程中更加准确和方便,修改条件并进行验证试验:选择料液比1∶20(g/mL)、提取时间3 h、提取温度90 ℃,荠菜粗多糖实际提取率为(13.35±0.09)%,与预测值较吻合,说明该模型预测荠菜粗多糖的提取率可以应用到实际工作中。
2.3 基本成分分析和分子量测定结果
CBP 基本成分分析高效液相色谱图和基本成分如表4 和图5所示。
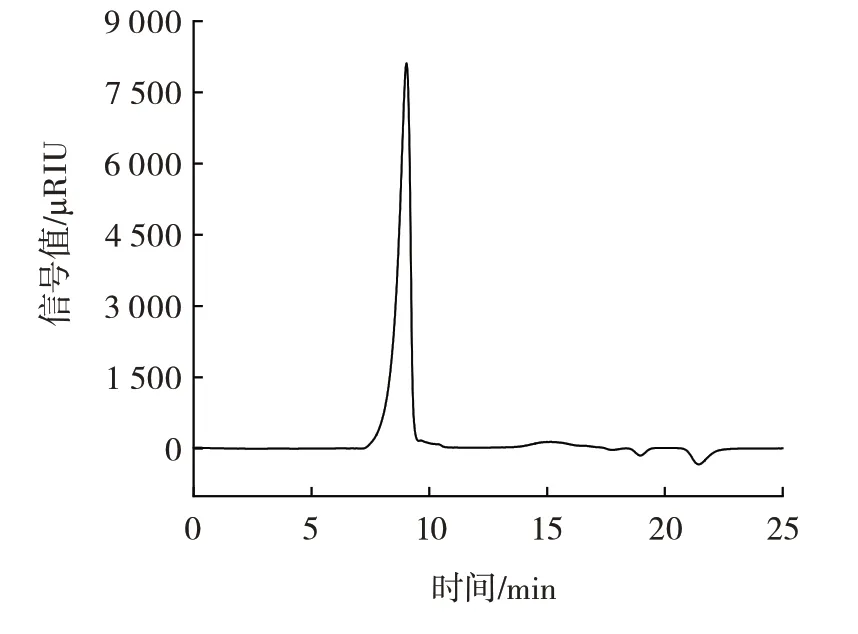
图5 CBP 的高效液相色谱图Fig.5 HPLC chromatogram of polysaccharide from CBP

表4 基本成分分析Table 4 Content of basic nutrients
由表4 可知,CBP 的总糖含量为(83.24±0.01)%,蛋白质含量为(1.75±0.19)%,糖醛酸含量为(18.38±0.93)%,表明CBP 是一种纯度较高的水溶性酸性多糖。
由图5 可知,CBP 在9.032 min 处出现单一对称峰,表明CBP 的分子量分布较为均一。根据葡聚糖标准品得出标准曲线为Y=-0.349 9X+9.341,R2=0.993 9,代入方程计算得出CBP 的分子量为1.63×106Da。分子量的大小决定了多糖的性质,高分子量是植物多糖的特征之一。
2.4 单糖组成分析结果
CBP 的单糖组成如图6所示。
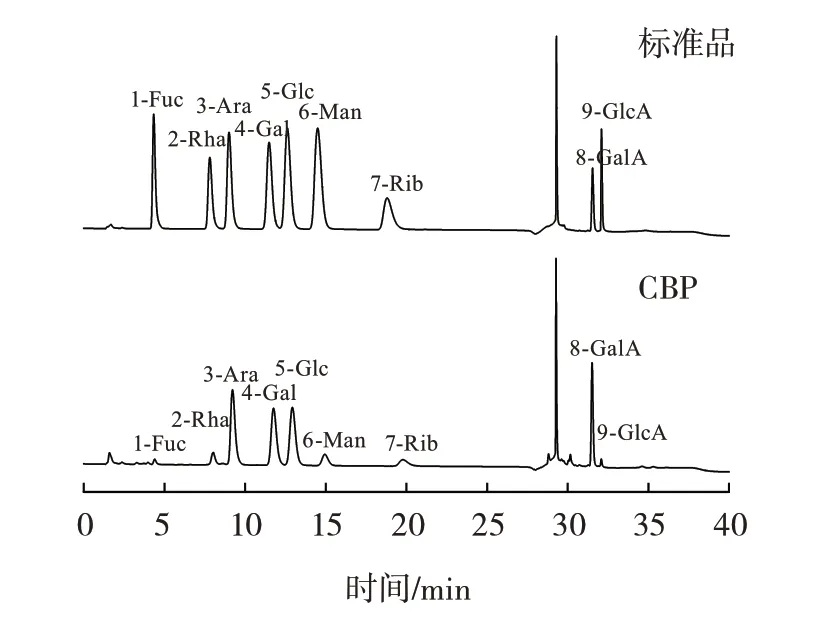
图6 离子色谱图Fig.6 Ion chromatography
由图6 可知,CBP 的单糖组成为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、核糖、半乳糖醛酸和葡萄糖醛酸,摩尔比为2.85∶8.12∶70.00∶53.32∶58.10∶11.78∶8.93∶30.27∶1.00,CBP 主要由阿拉伯糖、半乳糖、葡萄糖和半乳糖醛酸组成。天然多糖的复杂结构与单糖组成密切相关,不同多糖的单糖组成大相径庭,同种原料所提取的多糖往往也会因原料产地、处理方式等原因造成单糖组成的差异。王华等[11]提取的荠菜多糖,其单糖组成为D-木糖、L-鼠李糖、D-甘露醇和D-葡萄糖,摩尔比为1.0∶1.8∶270.8∶1.0,造成这两种荠菜多糖单糖组成差异的原因可能是提取方法不同。
2.5 红外光谱分析结果
CBP 的红外光谱如图7所示。
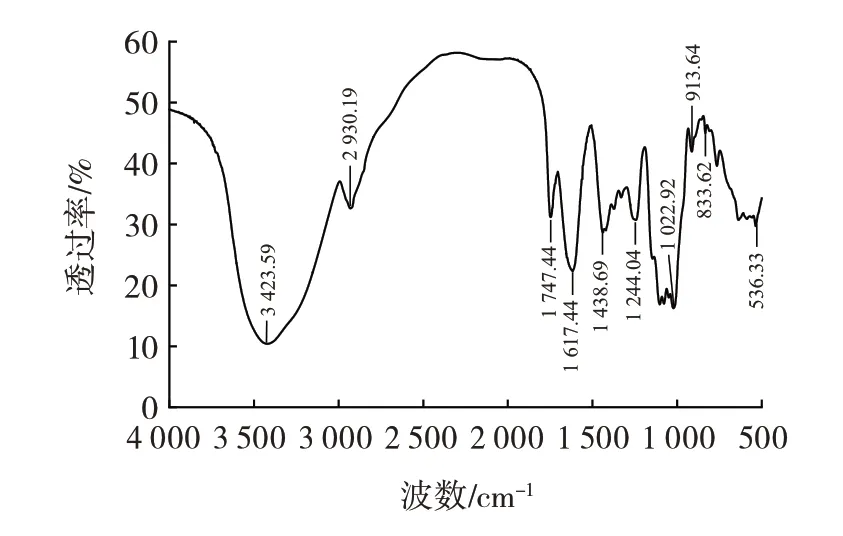
图7 CBP 的红外光谱Fig.7 FT-IR spectrum of CBP
2.6 理化功能测定结果
2.6.1 热重分析结果
CBP 的热重曲线图如图8所示。
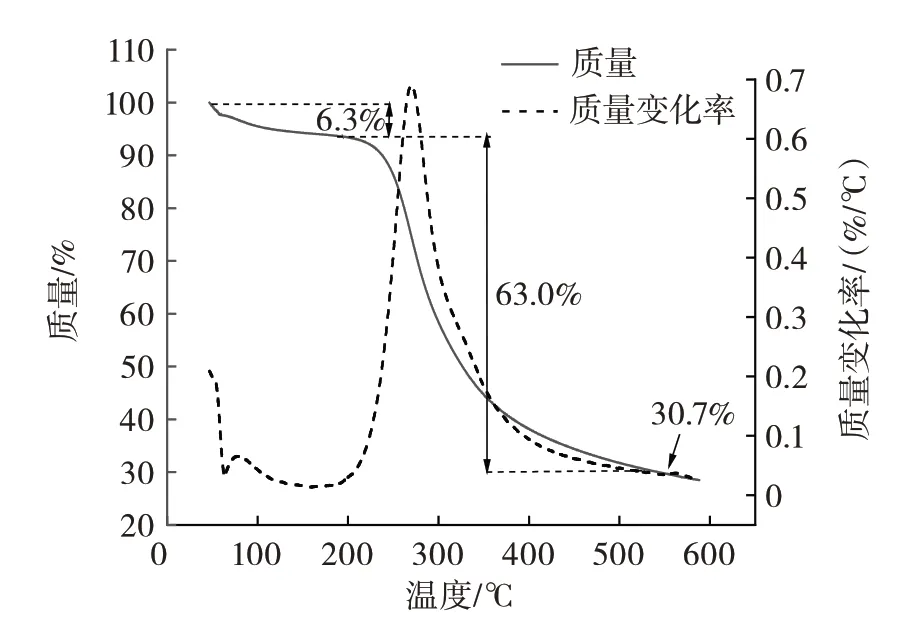
图8 CBP 热重曲线图Fig.8 Thermogravimetric curve of CBP
由图8 可知,CBP 随温度的升高质量变化分为3 个阶段,在200 ℃以下,多糖开始缓慢失重,失重6.3%,此阶段为多糖暴露在空气中吸收水分或者提取过程中残存的有机试剂的挥发;在200~400 ℃,多糖快速分解,失重明显,此阶段多糖质量损失63.0%,原因可能是温度过高导致多糖结构被破坏而发生分解反应;在400~600 ℃,为缓慢碳化阶段,多糖在此阶段内分解为灰分和无机成分剩余质量为30.7%。热重分析结果表明,CBP 在200 ℃以下具有良好的热稳定性。
2.6.2 功能特性结果
持水性可以评估产品的稳定性、质地和感官,持油性反映了产品的吸油能力[24],CBP 功能特性的测定结果如图9所示。
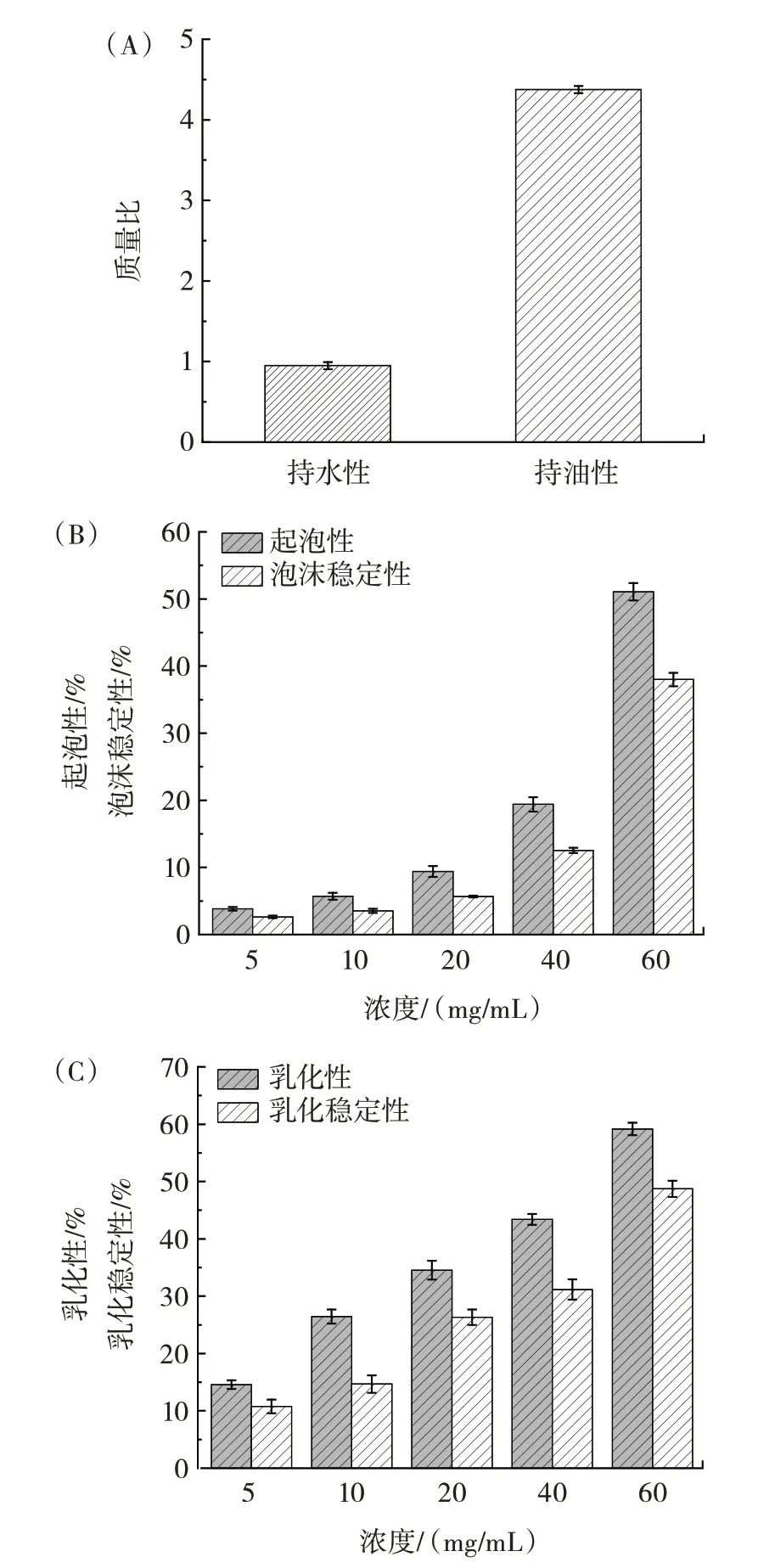
图9 CBP 的功能特性Fig.9 Functional characteristics of CBP
由图9(A)可知,CBP 的持水性和持油性为(0.95±0.04)、(4.37±0.05)g/g。与其他多糖相比,持水性略有不足,Ben Jeddou 等[25]提取的马铃薯皮多糖持水性和持油性为(4.097±0.537)、(4.398±0.040)g/g,Hadidi 等[26]提取的菠萝芯多糖持水性和持油性为3.11、4.25 g/g。CBP 具有相似的持油性,可以作为风味保持剂来增加食品的口感。
由图9(B)可知,溶液在5~20 mg/mL 时能形成轻微的泡沫,由于浓度较低的原因,这些泡沫很不稳定,30 min 后基本消散;在60 mg/mL 时起泡性及泡沫稳定性能够分别达到(51.07±1.28)%、(38.00±1.00)%,表明CBP 的起泡性及泡沫稳定性均以剂量依赖性方式增加,且与浓度有很大的关系。
由图9(C)可知,随着多糖浓度从5 mg/mL 增加到60 mg/mL,乳化性及乳化稳定性逐渐增加,最终达到(59.17±1.10)%、(48.72±1.41)%,表明浓度的增加提高了乳液的乳化性和乳化稳定性。除了浓度外,高分子量也是决定乳化性和乳化稳定性的重要因素之一,Bai等[27]在研究甘薯茎叶多糖时发现,高分子量所对应的乳化性和乳化稳定性更强。
2.7 抗氧化性测定结果
CBP 的抗氧化测定结果如图10所示。
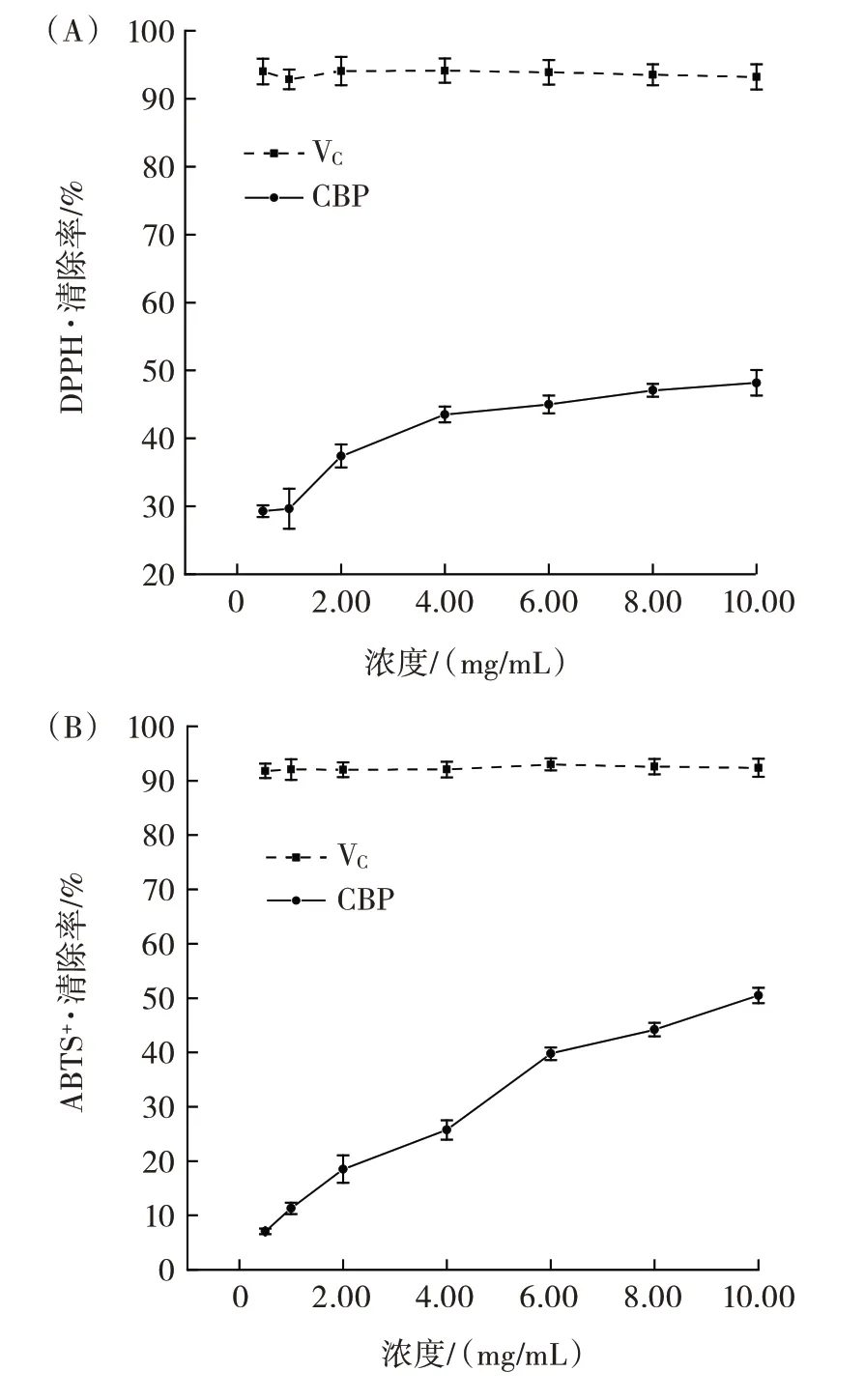
图10 自由基清除率Fig.10 Antioxidant capacity of CBP
由图10(A)可知,随着CBP 浓度的增加,对DPPH·的清除能力逐渐增强,当CBP 浓度为10.00 mg/mL 时,DPPH·清除率为(48.16±1.87)%。研究表明,多糖的DPPH·清除能力与位于支链的阿拉伯糖和半乳糖含量有关。Lo 等[28]在研究单糖组成及侧链构象与多糖的清除能力之间的关系时证实,由侧链的1,6-糖苷键连接的半乳糖和由侧链的1,4-糖苷键连接的阿拉伯糖的含量与DPPH·的清除率呈正相关,CBP 虽然含有较多的阿拉伯糖和半乳糖,但CBP 对DPPH·的清除作用相对较弱,推测CBP 的阿拉伯糖和半乳糖可能属于主链位置,相关结构还需进一步论证。
由图10(B)可知,CBP 对ABTS+·的清除率随浓度的升高而增加,当CBP 浓度为10.00 mg/mL 时,ABTS+·的清除率为(50.49±1.43)%,经计算可知,CBP对于ABTS+·清除率的IC50值为9.16 mg/mL,这可能与CBP 分子量较大有关,Wang 等[29]通过分析降解多糖的抗氧化性研究发现,低分子量的多糖清除ABTS+·的效果更好。
由图10(C)可知,当CBP 浓度为10.00 mg/mL 时,·OH 清除率为(70.75±1.81)%,IC50值为5.08 mg/mL,表明CBP 对·OH 的清除能力较强,这可能与CBP 中的糖醛酸含量较高有关,Zheng 等[30]采用不同提取方法制备多糖,结果表明含有更多糖醛酸的酸性多糖抗氧化活性更高。
由图10(D)可知,在0.50~10.00 mg/mL 浓度范围内,CBP 总还原力与吸光度呈量效关系[31],随着浓度的增加,总还原力继续增加但不明显,当CBP 浓度为10.00 mg/mL 时,总还原力为0.54±0.01。VC浓度在0.50~1.00 mg/mL 范围内还原力随着浓度的增加还原力迅速上升,当浓度大于1.00 mg/mL 后趋于平缓,总还原力最高为1.94±0.06。
多糖的抗氧化能力不仅仅只受个别因素影响,而是多种因素相互作用的结果,因此需要进一步的研究来探究它们之间的相关性。
3 结论
基于单因素试验和响应面试验得到荠菜粗多糖的最优提取条件为料液比1∶20(g/mL)、提取时间3 h、提取温度90 ℃,实际提取率为(13.35±0.09)%。总糖含量为(83.24±0.01)%,糖醛酸含量为(18.38±0.93)%,CBP 是一种含有α-糖苷键和β-糖苷键的酸性多糖,且含有糖醛酸和硫酸基;热重分析结果表明,CBP 在200 ℃以下具有良好的热稳定性;离子分析结果表明CBP 主要由阿拉伯糖、半乳糖、葡萄糖和半乳糖醛酸组成,摩尔比为70.00∶53.32∶58.10∶30.27。此外,CBP 的持水性一般,具有一定的持油能力,低浓度CBP 的起泡性及泡沫稳定性较差,随着浓度的增加起泡性及泡沫稳定性也随之增加;高浓度CBP 具有良好的乳化性及乳化稳定性,使其有可能用于风味保持剂来增加食品的口感。CBP 清除自由基能力大小依次为·OH>ABTS+·>DPPH·。CBP 具有良好的清除·OH 能力,并在一定程度上表现出量效关系,但清除DPPH·的能力较弱。

