吊干杏杏仁蛋白功能特性和结构特性
李舒婷,齐薇燕,白鹏丽,闫兴,周志强,陆健康*,艾明艳
(1.塔里木大学食品科学与工程学院,新疆阿拉尔 843300;2.南疆特色农产品深加工兵团重点实验室,新疆阿拉尔 843300;3.塔里木大学分析测试中心,新疆阿拉尔 843300;4.武汉市农业科学院,湖北武汉 430207)
吊干杏又称树上干杏,属蔷薇科(Rosaceae)李亚科(Prunoideae)杏属(Prunus)植物,因其熟后不落,在树上风干而得名。吊干杏杏肉甘甜细腻,富含抗氧化物;杏仁风味独特,富含蛋白质、糖、维生素等营养物质[1],具有较高的经济价值。含有人体必需的8 种氨基酸,其配比接近1973年修正联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)/世界卫生组织(World Health Organization,WHO)标准必需氨基酸模式,此外,甜杏仁中富含的微量元素硒高达27.6 μg/100 g[2],对防癌抗癌有良好的医疗辅助作用,是优良的药食兼用植物蛋白源。
当前,国内外对杏的研究多集中于杏仁的药用价值、精深加工以及产品的开发等,如杏仁蛋白的有效血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽的鉴定[3]、杏仁蛋白功能和结构特性与pH 值关系[4]、杏仁豆腐的研发[5]以及生物活性等。目前,植物组分蛋白方面的研究较为广泛,例如,韩海涛等[6]发现核桃清蛋白对DPPH 自由基清除能力最高,清除率可达97.15%,且具有较高的体外消化率;封小龙[7]研究花生球蛋白的制备工艺及谷氨酰胺转氨酶(glutamine transaminase,TG)改性对花生球蛋白结构特性的影响。李述刚[8]对SC-1 扁桃仁2S-清蛋白的纯化、氨基酸组成和结构特性进行了分析。然而,目前关于吊干杏杏仁分离蛋白及组分蛋白的营养价值、功能和结构特性的研究较少,极大制约了吊干杏杏仁蛋白产品的开发及生产加工过程中品质的有效控制。为满足食品工业中特定的应用条件,对吊干杏杏仁组分蛋白的研究十分必要。
本研究以新疆阿克苏地区吊干杏为原料,采用Osborne 分级分离法和传统碱溶酸沉法分别提取清蛋白、球蛋白和分离蛋白,研究这3 种蛋白的氨基酸组成以及功能和结构特性,揭示3 种蛋白的异同点,以期为提高吊干杏杏仁的综合利用和组分蛋白的精深加工提供参考。
1 材料与方法
1.1 材料与试剂
吊干杏:采自新疆阿克苏地区,取杏仁,去皮后于0~4 ℃下贮藏备用。石油醚、氯化钠、氢氧化钠、氯化钾:天津市致远化学试剂有限公司;硼酸:天津市盛奥化学试剂有限公司;甲基红、甘氨酸:上海山浦化工有限公司;碳酸钠、甲基橙、溴甲酚绿、溴酚蓝:天津市光复精细化工研究所;磷酸氢二钠:洛阳市化学试剂厂;磷酸二氢钠:天津市风船化学试剂科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfonate,SDS):天津博迪化工股份有限公司。所用试剂均为分析纯。
1.2 仪器与设备
冷冻干燥机(FD-1D-80):北京博医康实验仪器有限公司;酸度计(pHS-3C 型):上海仪电科学仪器股份有限公司;电子天平(JA5003)、紫外可见分光光度计(752):上海箐海仪器有限公司;半自动凯氏定氮仪(K1301):北京同德创业科技有限公司;超声波清洗机(SB-3200DTDN):宁波新芝生物科技股份有限公司;数显恒温水浴锅(HHS-S4):上海博迅实业有限公司医疗设备厂;高速冷冻离心机(GL-22LM):湖南星科科学仪器有限公司;高速台式离心机(E20K):长沙鑫奥仪器仪表有限公司;傅里叶变换红外光谱仪(Frontier):美国PE 公司;L-8900 全自动氨基酸分析仪:日本日立公司。
1.3 试验方法
1.3.1 样品处理
1.3.1.1 脱脂粉的制备
采用李述刚[8]的方法,并稍作改动。吊干杏核去壳,浸泡20 min 手工去内皮,冷冻干燥后,选取颗粒饱满、色泽均匀的吊干杏杏仁在粉碎机中粉碎5 s,重复3 次。将粉碎后的杏仁粉过18 目筛,以石油醚为有机溶剂,采用索氏提取法脱脂24 h,通风干燥后,再次粉碎过60 目筛,继续脱脂12 h,在通风处放置约24 h,待石油醚完全挥发后,过60 目筛得吊干杏杏仁脱脂粉,放置4 ℃冰箱中保存备用。
1.3.1.2 分离蛋白和组分蛋白的制备
1)组分蛋白的制备
清蛋白和球蛋白的制备[9]:准确称取吊干杏杏仁脱脂粉45 g,以料液比1∶10(g/mL)溶于蒸馏水,用2 mol/L NaOH 溶液调pH 值至7.0,在室温下磁力搅拌1 h,在4 ℃、8 000 r/min 条件下离心10 min 取上清液,抽滤后,透析72 h;除去上清液后在所得沉淀中加入2% NaCl 溶液,在室温条件下磁力搅拌1 h,相同条件下离心后,取上清液抽滤后,进行透析72 h。透析结束后将样品冷冻干燥分别得到清蛋白和球蛋白。
2)分离蛋白的制备
分离蛋白的制备[7]:称取脱脂粉45 g,以料液比1∶10(g/mL)溶于蒸馏水中,用2 mol/L NaOH 溶液调pH值至9.0,室温下磁力搅拌1 h,在4 ℃、6 000 r/min 离心15 min 后取上清液,复提3 次后合并上清液,用2 mol/L HCl 溶液调节pH 值至4.5。静置后取底层浑浊蛋白,在4 ℃、6 000 r/min 条件下离心15 min,取出蛋白沉淀,使其分散于少量蒸馏水中,用2 mol/L NaOH 溶液调pH 值至7.0,真空冷冻干燥后得到分离蛋白,置于-20 ℃条件下保存备用。
1.3.2 蛋白含量的测定
参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》,用凯氏定氮法测定蛋白质含量,蛋白质换算系数F 为5.18。
1.3.3 蛋白功能特性的研究
1.3.3.1 溶解性的测定
参照Horax 等[10]的方法并适当修改。称取0.5 g杏仁分离蛋白,用1 mol/L NaOH 溶液和1 mol/L HCl溶液将磷酸盐缓冲液(0.01 mol/L)的pH 值调为7,溶解杏仁分离蛋白,在25 ℃磁力搅拌40 min 后,在4 ℃条件下3 000 r/min 离心20 min,过滤并稀释上清液,用考马斯亮蓝法测定蛋白质含量,根据下列公式计算蛋白的溶解性。
式中:X为溶解性,%;C1为上清液中总蛋白含量,mg/mL;C2为样品中总蛋白含量,mg/mL。
1.3.3.2 持油性的测定
参考彭倩[11]的方法并适当修改。称取0.2 g 样品,放入干燥的10 mL 离心管中,加入5 mL 食用油,充分振荡混匀后,置于40 ℃水浴中保温30 min,在4 500 r/min条件下离心20 min。去除离心管中未吸附的大豆油,称重。按照如下公式计算持油性。
式中:X为持油性,g/g;m1为空离心管质量,g;m2为离心管、样品及吸附油的总质量,g;m0为蛋白样品的质量,g。
1.3.3.3 不同pH 值下起泡性及泡沫稳定性的测定
参考Thaiphanit 等[12]的方法测定。将蛋白样品充分分散于磷酸盐缓冲液(pH 值为3、5、7、9,0.01 mol/L)中,在25 ℃搅拌40 min 后,在4 ℃、6 000 r/min 条件下离心15 min,取上清液,用磷酸盐缓冲液稀释,用考马斯亮蓝法测定蛋白质浓度,用磷酸盐缓冲液稀释,使得上清液中蛋白质浓度达到1 mg/mL。取1 mg/mL 蛋白溶液10 mL 置于50 mL 塑料量筒中,以17 600 r/min 均质2 min,将均质后的泡沫面高度记为V0,静置60 min后再次记录泡沫面高度,记为V60,依次类推静置到90 min。起泡性公式如下。
式中:Y为起泡性,%;V0为均质后的泡沫体积,mL;V60为静置60 min 后泡沫体积,mL。泡沫稳定性公式如下。
式中:P为泡沫稳定性,%;V0为均质后的泡沫体积,mL;V60为静置60 min 后泡沫体积,mL。
1.3.4 蛋白结构特性的研究
1.3.4.1 氨基酸组成分析
氨基酸含量测定参照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》,利用全自动氨基酸分析仪对吊干杏杏仁中3 种蛋白进行测定。
1.3.4.2 表面疏水性的测定
参考代晓凝等[13]的方法并稍作修改。充分分散蛋白样品于磷酸盐缓冲液(pH7.0,0.01 mol/L)中,在25 ℃磁力搅拌40 min 后,4 ℃条件下6 000 r/min 离心15 min,取上清液,用磷酸盐缓冲液稀释后,用考马斯亮蓝法测定蛋白质浓度,用磷酸盐缓冲液稀释上清液,使得蛋白质浓度达到5 mg/mL。取5 mg/mL 蛋白待测液1 mL 和1 mg/mL 溴酚蓝200 μL 加入5 mL 离心管中,室温下涡旋振荡30 s,混合均匀,以无蛋白样品的磷酸盐缓冲溶液(pH7.0,0.01 mol/L)为空白对照。在4 ℃、6 000 r/min 条件下,离心15 min,取上清溶液稀释10 倍,于595 nm 波长下测得吸光度。按如下公式计算表面疏水性。
式中:Y为表面疏水性;A0为空白对照的吸光度;A1为样品上清溶液稀释10 倍后的吸光度。
1.3.4.3 巯基和二硫键含量的测定
参照齐宝坤等[14]的方法测定蛋白巯基含量,并作适当修改。
游离巯基的测定:将蛋白粉末溶于磷酸盐缓冲液(pH7.0,0.01 mol/L)中,使蛋白溶液浓度为5 mg/mL。取2 mL 蛋白溶液,加入5 mL Tris-甘氨酸缓冲溶液(0.086 mol/L Tris,0.09 mol/L 甘氨酸,4 mmol/L 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),混匀后调pH8.0)中,再加入0.1 mL 浓度为4 mg/mL 5,5-二硫代双(2-硝基苯甲酸)[5,5′-dithio bis-(2-nitrobenzoic acid),DTNB]的Ellman 试剂。在涡旋振荡混匀后,于25 ℃条件下水浴20 min,用分光光度计测定412 nm 波长下的吸光度,以不加Ellman 试剂的溶液作为对照,每个样品做3 组平行取均值。
总巯基的测定:将上述游离巯基的测定中加入5 mL Tris-甘氨酸缓冲溶液换为5 mL Tris-甘氨酸-8 mol/L 尿素-0.5%SDS 缓冲液,其他步骤如上文所述。巯基含量和二硫键含量计算公式如下。
式中:X为巯基含量,μmol/g;Y为二硫键含量,μmol/g;P为总巯基含量,μmol/g;Q为游离巯基含量,μmol/g;A412为加Ellman 试剂时样品的吸光度与不加Ellman 试剂时样品的吸光度的差值;D为样品稀释系数;73.53=106/(1.36×104),其中1.36×104为Ellman 试剂的摩尔消光系数,L/(mol·cm);C为蛋白样品溶液的浓度,mg/mL。
1.3.4.4 傅里叶变换红外吸收光谱测定
参考Yan 等[15]的方法并作适当调整。取干燥的蛋白样品和溴化钾,按1∶100 质量比混合,研磨均匀并压片,以纯溴化钾为空白对照,使用红外光谱仪进行扫描。扫描范围为4 000~400 cm-1,以4 cm-1的分辨率共扫描32 次。通过红外光谱仪扫描可得到红外光谱图谱,蛋白的二级结构主要是对蛋白质特征吸收峰波数为1 700~1 600 cm-1的红外光谱谱图进行基线校正、去卷积、二阶求导及曲线拟合处理,根据蛋白中各二级结构的波段位置和对应特征吸收峰的面积大小,可以反映蛋白质分子中各二级结构含量的变化规律。
1.3.4.5 聚丙烯酰胺凝胶电泳测定
参照Fang 等[16]的方法测定凝胶电泳,并作适当调整。利用SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)测定分离蛋白、清蛋白和球蛋白的分子量分布。使用质量分数为13% 分离胶和5.0% 浓缩胶,将蛋白样品溶于磷酸盐缓冲液(pH7.0、0.01 mol/L)中,并使其浓度达到0.5 mg/mL,每种蛋白溶液与加样缓冲液涡旋混匀后在100 ℃加热5 min,待温度降为室温后,在还原状态下测定,加样量为20 μL,电泳缓冲液为Tris-甘氨酸(0.125 mol/L Tris,1.25 mol/L 甘氨酸,0.5%SDS),于25 mA 下恒流进行,将凝胶电泳仪的电压设定为40 V,待样品进入分离胶后调高电压至85 V,3 h 左右电泳结束。用0.25% 考马斯亮蓝(R-250)染色6 h 后,用脱色剂反复脱色至条带清晰,然后用凝胶成像系统进行分析处理。
1.4 数据统计
每组试验均进行3 次后取平均值,数据经Excel处理,采用Origin 9.0、PeakFitv 4.12 软件作图,采用统计软件SPSS Statistics 26 进行显著性检验(P<0.05)。
2 结果与分析
2.1 分离蛋白和组分蛋白的分析
吊干杏杏仁分离蛋白及2 种组分蛋白含量如图1所示。
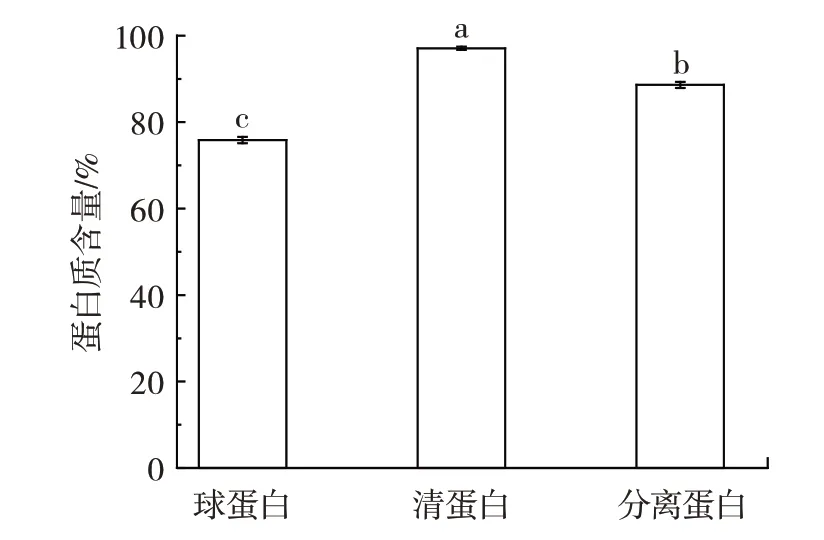
图1 3 种提取蛋白的含量Fig.1 Contents of three extracted proteins
杏仁脱皮粉碎后,以石油醚为有机溶剂脱脂,用索氏提取法得到杏仁脱脂粉,通过Osborne 分级分离法和碱溶酸沉法分别提取得到清蛋白、球蛋白和分离蛋白。由图1 可知,清蛋白、球蛋白和分离蛋白含量依次为97.08%、75.84% 和88.61%。清蛋白较其他2 种样品的粗蛋白质含量差异显著(P<0.05)。
2.2 蛋白功能特性的分析
2.2.1 溶解性分析
吊干杏杏仁分离蛋白及2 种组分蛋白溶解性见图2。
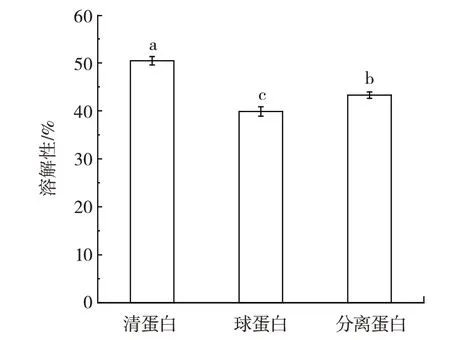
图2 吊干杏杏仁中3 种蛋白溶解性Fig.2 Solubility of three proteins in almond kernel of hanging dried apricot
蛋白质的溶解性是指蛋白质表面极性基团与水分子相互作用后,蛋白质在水中分散的程度[17]。良好的溶解性通常具有良好的蛋白质加工特性,而在食品加工中不溶性蛋白的应用价值有限,溶解性是其他功能性质的基础前提[18]。由图2 可知,在pH 值为7 的条件下,3 种蛋白的溶解性大小依次为清蛋白(50%)>分离蛋白(43%)>球蛋白(39%)。清蛋白溶解性显著高于其他两种蛋白(P<0.05)。3 种蛋白的溶解性结果与彭倩[11]分级提取的澳洲坚果蛋白研究结果一致。表面疏水性被认为是影响溶解度和许多功能性质的重要因素[19],表面疏水性越大,溶解度越小,说明球蛋白表面含有的疏水性残基较多,会与水分子产生斥力,导致蛋白质聚集和沉淀[20],从而降低蛋白质的溶解度。因此,吊干杏杏仁清蛋白在食品辅料的应用潜力更大,可作为一种新型食品添加剂应用于食品加工领域中。
2.2.2 持油性分析
持油性是指蛋白质与油相互作用时吸附油脂的能力。蛋白质结构中的非极性侧链可以与油脂结合,保留油脂在食品中的风味,此外,持油性可改善食品的适口性,并延长食品的保质期[21]。优良的持油性是减少油脂损失,稳定食品的关键,多用于肉制品、烘焙食品、奶制品的生产。吊干杏杏仁分离蛋白及2 种组分蛋白持油性测定结果如图3所示。
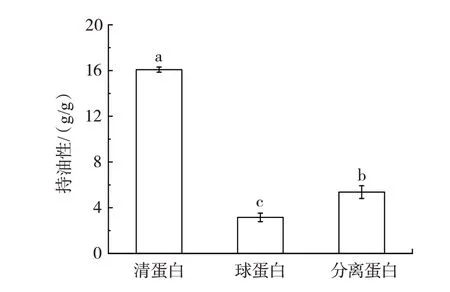
图3 吊干杏杏仁中3 种蛋白持油性Fig.3 Oil holding capacity of three proteins in almond kernel of hanging dried apricot
由图3 可知,3 种蛋白的持油性大小依次为清蛋白(16.06 g/g)>分离蛋白(5.37 g/g)>球蛋白(3.15 g/g)。3 种蛋白持油性之间具有显著性差异(P<0.05)。其中,清蛋白的持油性显著高于其他两种蛋白,此结论与彭倩[11]的研究结果一致。清蛋白的持油性和溶解性优良,属于两亲性蛋白;分离蛋白与葵花籽蛋白(4.12 g/g)[22]的持油性大小接近,球蛋白与豇豆蛋白(3.56 g/g)[23]的持油性大小相近。吊干杏杏仁中清蛋白的持油性较好,能够应用于高油脂食品的生产加工中,如饼干、素肉、糖果等,对产品的研发具有一定的研究价值。
2.2.3 不同pH 值下起泡及起泡稳定性分析
起泡性是指蛋白质经过外界作用力高速搅打,使蛋白质分子部分展开,吸附至水-空气界面,形成一层薄而坚韧的膜,从而形成泡沫;通过观察,若泡沫体积发生变化,说明泡沫稳定性发生变化[24]。蛋白质的起泡性与泡沫稳定性与pH 值变化的结果,如图4所示。
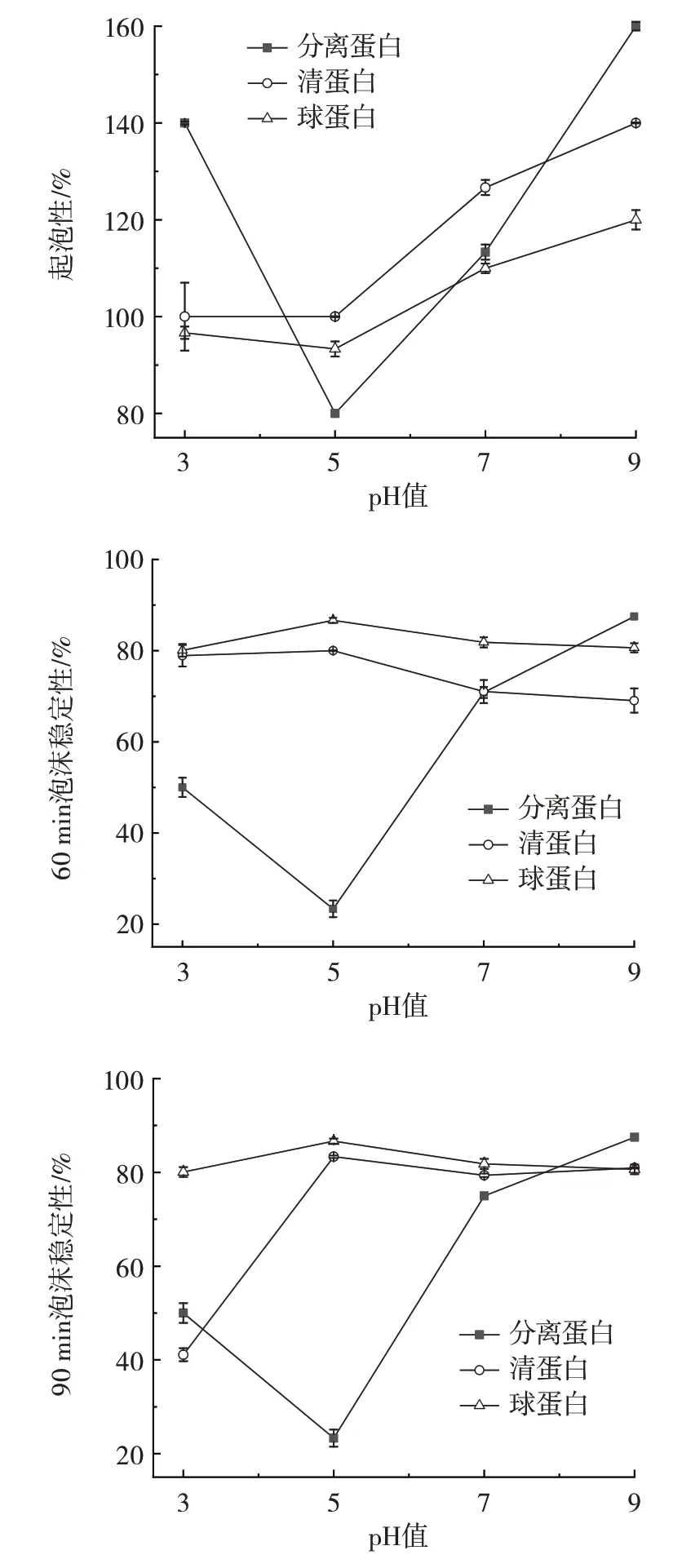
图4 吊干杏杏仁中3 种蛋白起泡性及泡沫稳定性Fig.4 Foaming properties and foam stability of three proteins in almond kernel of hanging dried apricot
由图4 可知,3 种蛋白在pH3~9 时,起泡性为80%~160%;起泡性随着pH 值的增加均呈现先下降后上升的趋势。3 种蛋白均在pH5 左右起泡能力最差,之后随着pH 值增大,起泡能力明显提高,在pH 值为9 时起泡性达到最大,其中分离蛋白的起泡性最好。分析原因可能是pH 值在5 附近时溶解度较低,只有少量的可溶性蛋白吸附至气-液界面,导致起泡量少。而偏离pH5 时,酸/碱性增加,蛋白的溶解性增大,甚至带来更多的静电荷,增加静电斥力,降低蛋白的疏水相互作用,利于可溶性蛋白快速吸附至气-液界面,发挥出更加优良的界面性质[25],利于蛋白质起泡能力的增强。在pH 值为7 时,3 种蛋白的起泡性大小依次为清蛋白>分离蛋白>球蛋白,与图2 溶解性结论一致,表明清蛋白可更好地与水产生相互作用,促进蛋白质分子展开,增强包裹空气的能力,从而促进泡沫的形成。
清蛋白和球蛋白的泡沫稳定性变化趋势相似,均在pH5 附近泡沫稳定性最好,并随着pH 值的增加蛋白质的稳定性呈不同程度下降,与起泡能力刚好呈现相反的变化趋势。这是由于pH5 附近蛋白质的泡沫量少,未溶解的蛋白质粒子增强了泡沫表面的黏度[26],从而提高了泡沫稳定性。此外,在90 min 后,球蛋白的泡沫稳定性高于清蛋白,说明球蛋白随着静置时间延长,泡沫体积下降更缓慢,蛋白质分子之间的表面活性更强。分离蛋白泡沫稳定性与清蛋白、球蛋白相反,均随pH 值的增大出现先减小后增大趋势,与李超[17]的花椒籽仁分离蛋白结果一致。
2.3 蛋白结构特性的分析
2.3.1 氨基酸组成
分析蛋白质中氨基酸的组成能有效评估蛋白的营养价值,吊干杏杏仁3 种蛋白的氨基酸组成结果如表1所示。
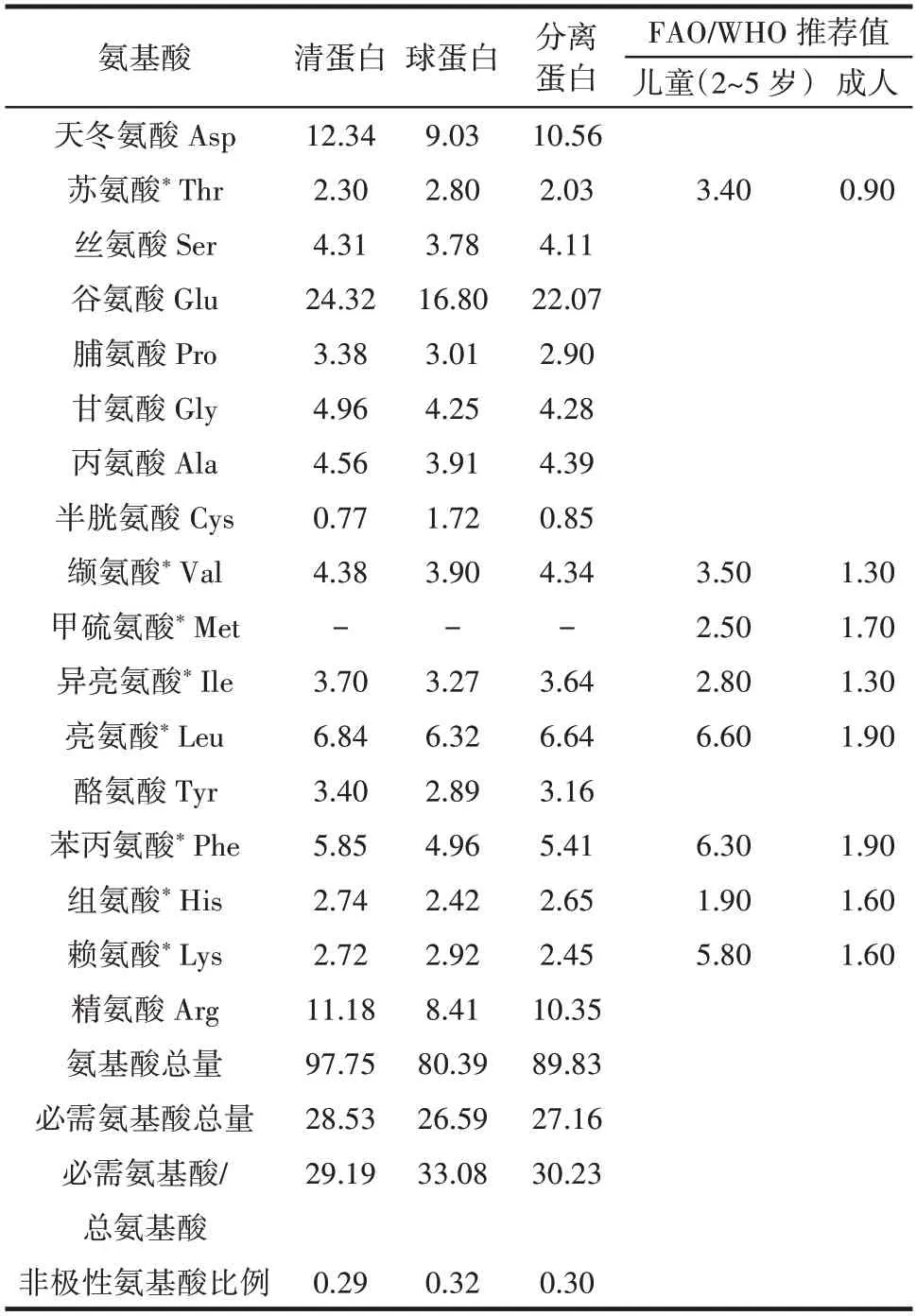
表1 吊干杏杏仁蛋白的氨基酸组成Table 1 Amino acid composition in almond kernel of hanging dried apricot%
蛋白质是人体必需的营养物质之一,能维持机体的健康和生理功能。外源性食物摄入后,会被水解,将蛋白质转化成氨基酸并被人体识别,合成人体所需的蛋白质。由表1 可知,3 种蛋白质富含16 种氨基酸,组成比较全面,都含有人体8 种必需氨基酸中的7 种(甲硫氨酸未检测出),各含量之间具有明显差异。3 种蛋白质的氨基酸总量大小依次为清蛋白(97.75 g/100 g)>分离蛋白(89.83 g/100 g)>球蛋白(80.39 g/100 g)。球蛋白的必需氨基酸含量/氨基酸总量的比例最高,达33.08%,其次为分离蛋白30.24%,与大豆蛋白(34.00%)[23]接近,表明吊干杏杏仁蛋白可作为一种优良的氨基酸膳食资源,具有一定的研究价值。
由表1 还可以看出,吊干杏杏仁的3 种蛋白富含多种必需氨基酸,从氨基酸的评价角度分析,吊干杏杏仁的3 种蛋白第一限制性氨基酸为甲硫氨酸,其余氨基酸均满足FAO/WHO 的成人摄取量标准。3 种蛋白均只有甲硫氨酸不能满足摄入量标准,与扁桃仁[8]、坚果蛋白[11]、豆类蛋白[23]等必需氨基酸研究结果一致。与FAO/WHO 的儿童(2~5 岁)摄取量标准相比,3 种蛋白的缬氨酸、异亮氨酸、组氨酸含量均高于摄入标准,此外,清蛋白和分离蛋白的亮氨酸含量也高于FAO/WHO 的儿童(2~5 岁)摄入标准,均可作为营养补充剂应用于婴幼儿食品中。综上所述,吊干杏杏仁清蛋白、球蛋白和分离蛋白的必需氨基酸含量丰富,氨基酸组成接近FAO/WHO 推荐的氨基酸模式。
吊干杏杏仁的3 种蛋白中,谷氨酸含量最高,其次为天冬氨酸和精氨酸,这与张清安等[2]和Lin 等[27]研究的结果一致。由于天冬氨酸、谷氨酸和精氨酸都是极性氨基酸,因此导致3 种蛋白的非极性氨基酸含量较低。清蛋白中非极性氨基酸比例最低,仅为0.29。
2.3.2 表面疏水性分析
吊干杏杏仁3 种蛋白的表面疏水性结果如图5所示。
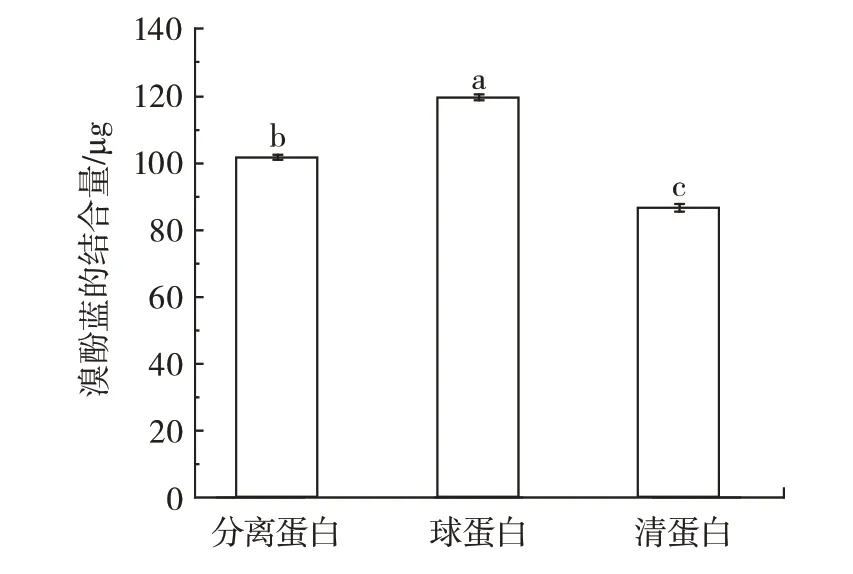
图5 吊干杏杏仁中3 种蛋白表面疏水性Fig.5 Surface hydrophobicity of three proteins in almond kernel of hanging dried apricot
表面疏水性反映疏水簇暴露在蛋白质分子表面上的程度,是与其界面活性有关的性质,样品蛋白的疏水性可用溴酚蓝与蛋白质分子中的疏水性残基相结合来测定。从图5 可以看出,吊干杏杏仁中3 种蛋白的表面疏水性从大到小依次为球蛋白(119.33 μg)>分离蛋白(101.54 μg)>清蛋白(86.54 μg)。球蛋白较清蛋白和分离蛋白差异显著(P<0.05)。蛋白质的表面疏水性与非极性氨基酸含量有关[28],由表1 可知,球蛋白中非极性氨基酸比例最高(0.32),因此表现出最高的表面疏水性。此外,根据许晶等[29]研究表明,蛋白分子内部的疏水性残基越多,溶解性越差,说明表面疏水性是决定蛋白溶解性的重要因素,这也从一定程度上证明了清蛋白的溶解性大于球蛋白的溶解性。
此外,蛋白质的表面疏水性与游离巯基含量相关,当游离巯基含量较高时,蛋白分子的折叠程度较高,更多的疏水性残基被暴露出来,蛋白质结构中亲水和疏水氨基酸残基之间的平衡是影响蛋白质溶解度的一个重要因素,这又与蛋白质的起泡性有关。与齐宝坤等[14]研究结果一致。
2.3.3 巯基和二硫键含量分析
巯基和二硫键含量分析结果如图6所示。
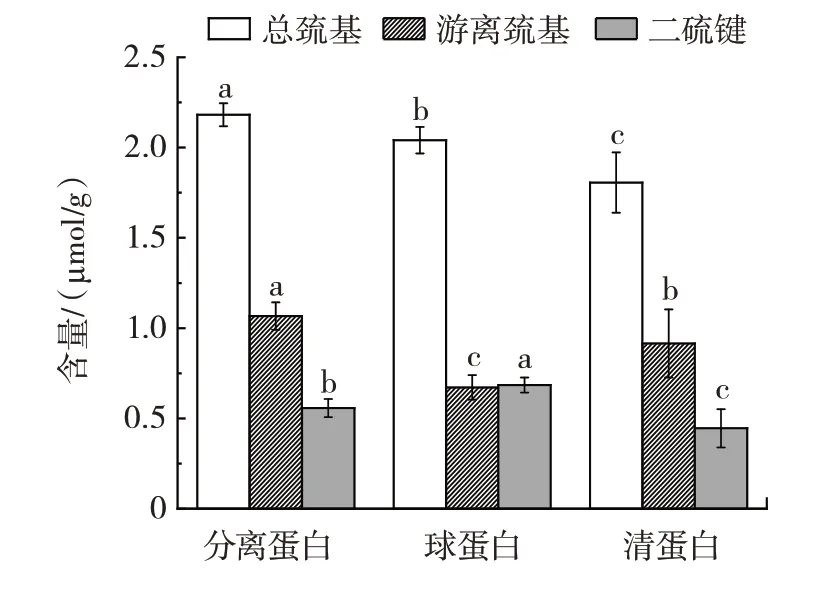
图6 吊干杏杏仁中3 种蛋白巯基和二硫键含量Fig.6 Sulfhydryl groups and disulfide bonds of three proteins in almond kernel of hanging dried apricot
巯基和二硫键是维系蛋白质分子结构的化学键,对肽链的空间结构起稳定作用[14]。由图6 可知,吊干杏杏仁中分离蛋白、球蛋白和清蛋白的游离巯基含量依次为(1.07±0.07)、(0.67±0.06)、(0.92±0.18)μmol/g;二硫键含量依次为(0.56±0.05)、(0.69±0.04)μmol/g 和(0.45±0.10)μmol/g。3 种蛋白之间各含量均差异性显著(P<0.05)。蛋白质三级结构的折叠程度可由游离巯基/总巯基的含量反映,蛋白分子含量越高,其内部结构暴露出的疏水性基团越多[30],所以疏水力维持蛋白质的三级结构[31]。由图6 可知,清蛋白的游离巯基/总巯基值最大,分离蛋白次之,球蛋白最小,表明清蛋白暴露的疏水性基团最多,疏水性最强,也验证了清蛋白拥有较好的溶解性。当蛋白质变性后,二硫键易发生氧化还原反应生成游离巯基,蛋白结构变疏松,即二硫键越多,蛋白结构越紧密。因此,可推测出蛋白质结构紧密程度为球蛋白>分离蛋白>清蛋白。
2.3.4 傅里叶变换红外吸收光谱分析
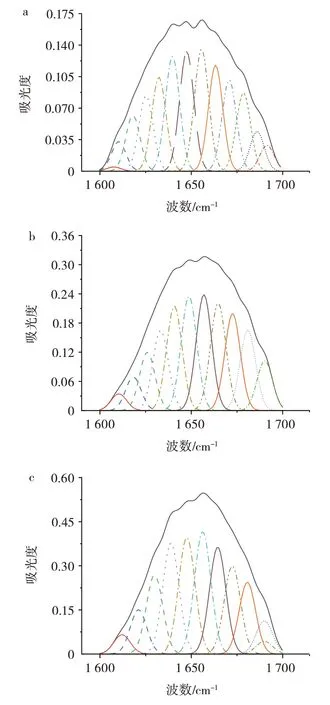
图7 吊干杏杏仁中3 种蛋白酰胺I 带高斯拟合红外图谱Fig.7 Gauss fitting of three protein amide I bands in almond kernel of hanging dried apricot
根据PeakFit v 4.12 软件导出的积分面积分布表,对分离蛋白、清蛋白和球蛋白的二级结构中各含量进行峰谱归属判定,结果如图8所示。
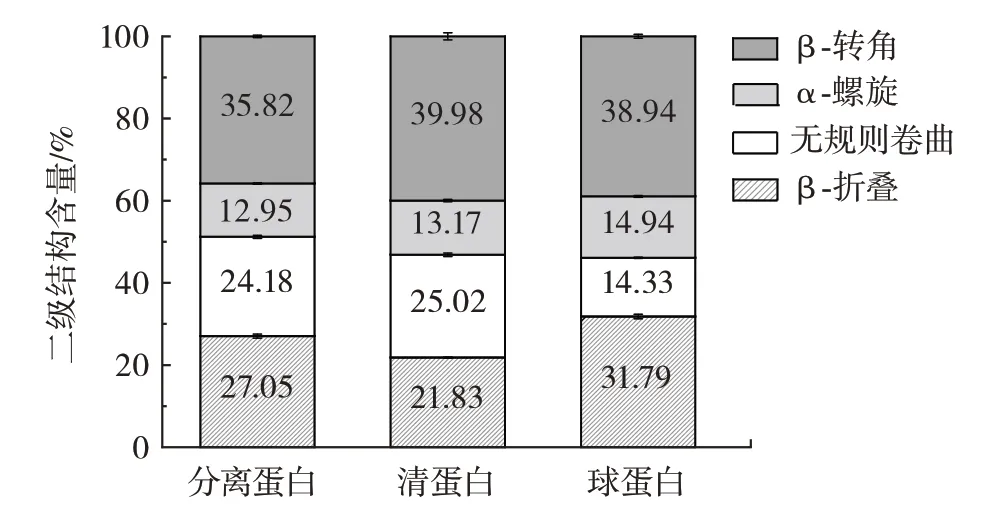
图8 吊干杏杏仁中3 种蛋白二级结构含量Fig.8 Secondary structure of three proteins in almond kernel of hanging dried apricot
由图8 可知,3 种蛋白质均含4 种结构:β-转角、α-螺旋、无规则卷曲和β-折叠。其中,β 折叠和β 转角所占比例最大,是主要的二级结构。球蛋白的β-折叠含量高于其他两种蛋白,清蛋白的β 转角含量较其他两种蛋白高。黎卫[33]研究结果表明,在蛋白质二级结构中,β-折叠和α-螺旋是有序的蛋白结构,其稳定性较好,无规则卷曲和β-转角是无序结构,其稳定性较差。对比3 种蛋白的无序结构发现,清蛋白明显比分离蛋白、球蛋白的无序结构含量高,说明清蛋白较其他两种蛋白更易受温度影响而导致蛋白质结构改变。
此外,疏水性与蛋白质的二级结构相关。当无规则卷曲含量较高时,分子相对伸展,暴露出更多的疏水性残基,导致疏水性较高,因此表面疏水性与无规则卷曲含量存在线性正相关[34],这可能是清蛋白疏水性较高的原因。
2.3.5 SDS-PAGE 分析
吊干杏杏仁中3 种蛋白的SDS-PAGE 电泳图谱如图9所示。
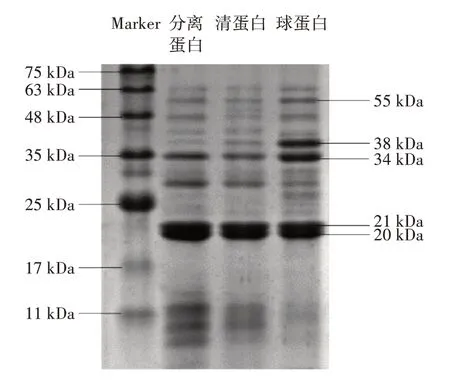
图9 吊干杏杏仁中3 种蛋白SDS-PAGE 分析图谱Fig.9 SDS-PAGE of three proteins in almond kernel of hanging dried apricot
聚丙烯酰胺凝胶电泳是将蛋白质按不同的亚基分子量,进行梯度分离,因此蛋白质的分子量分布范围可对照Marker 来表征[35]。由图9 可知,3 种蛋白的亚基分布范围均较广,分子量范围约为11~63 kDa,其中分离蛋白的条带主要集中在11、20、21、30、35 kDa,清蛋白的条带集中在20、21、30、35 kDa,球蛋白主要集中在20、21、34、38 kDa。3 种蛋白在20、21 kDa 这两个条带的灰度值较高,说明在此范围内蛋白的分子量含量丰富。在11 kDa 亚基低分子量条带处,分离蛋白和清蛋白的区域染色较深,球蛋白几乎没有,这应该是球蛋白较其他两种蛋白溶解性具有差异的主要原因。
3 结论
吊干杏杏仁分离蛋白及组分蛋白的营养价值、功能和结构特性之间有明显差异。采用Osborne 分级分离法和碱溶酸沉法提取得到的吊干杏杏仁清蛋白、球蛋白和分离蛋白的含量依次为97.08%、75.84% 和88.61%。清蛋白的持油性最高(16.06 g/g),与目前研究较多的其他植物蛋白的持油性相当,有向应用于食品工业发展的潜力。在pH 值为7 的条件下,3 种蛋白的溶解性大小依次为清蛋白>分离蛋白>球蛋白,与疏水性呈现负相关。在pH3~9 时,吊干杏杏仁蛋白起泡能力为80%~160%,pH 值在5 附近时,3 种蛋白质均表现出最低的起泡性;球蛋白、清蛋白的泡沫稳定性与起泡性趋势相反。3 种蛋白的亚基分子主要集中在11~38 kDa,分离蛋白和球蛋白主要由中、小分子量亚基构成,其中球蛋白在大于41 kDa 也有少量分布,说明球蛋白二硫键含量较多,分子结构较紧密;清蛋白、球蛋白和分离蛋白的疏水性大小依次为:球蛋白(119.33 μg)>分离蛋白(101.54 μg)>清蛋白(86.54 μg);二级结构均以β 折叠和β 转角为主。
综上所述,吊干杏杏仁分离蛋白和2 种组分蛋白均存在一些优良性质,如清蛋白持油性高,在pH3~9时蛋白质总体起泡性高,可以作为一种天然的食品发泡剂。但其本身也存在着大多数植物蛋白都不可避免的缺点,蛋白质溶解性不高,对此可采用合适的改性方法对吊干杏杏仁蛋白进行改性,以克服其本身溶解性较低的缺点,获得更优秀的功能特性,为吊干杏杏仁蛋白的开发与利用提供理论依据。

