金属肽酶含血小板反应蛋白1作为妊娠剧吐诊断标志物的可行性研究
王海燕,蒙 秋,张 静,黄守国
(海口市人民医院妇产科,海南 海口 570208)
妊娠剧吐(hyperemesis gravidarum,HG)是指妊娠早孕反应严重,频繁恶心呕吐不能进食,以致发生体液失衡甚至终止妊娠、威胁孕妇生命[1]。HG会对孕妇的情绪、认知、行为造成不同程度的危害[2]。HG可导致孕妇无法进行日常工作,导致焦虑和抑郁,迫使一些患者终止妊娠,可增加围产期妊娠期贫血、妊娠期高血压、小于胎龄儿和低出生体质量儿等不良结局的发生率[3]。有研究表明,人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)的异构体、受体及细胞外环境中分泌的其他分子会相互作用,这可能是导致呕吐症状的原因,但尚未有明确的结果[4]。现如今,有研究明确表明HCG与HG无关,HG与生长分化因子(growth and differentiation factor 15,GDF15)相关[5]。GDF15由滋养细胞表达,在HG患者和呕吐较严重或时间较长患者的血清中显著上调[6]。滋养细胞转化形成中间滋养细胞,由中间滋养细胞启动胎儿-母体面部的细胞外和血管内侵袭,并将GDF15分泌到母体血液中,细胞外基质(extracellular matrix,ECM)的蛋白被水解破坏,基质金属蛋白酶(matrix metalloproteinases,MMPs)开始在胎盘形成过程中发挥作用[7]。然而金属肽酶含血小板反应蛋白家族是调节MMPs的蛋白酶之一,金属肽酶含血小板反应蛋白1(a disintegrin and metalloproteinase with thrombospondin motifs-1,ADAMTS-1)就是ADAMTS家族的第一个成员,它通过与血管内皮生长因子结合调节血管生成,调节滋养细胞侵袭的深度在妊娠形成和健康妊娠的延续中发挥作用[8]。有研究发现ADAMTS-1对早期妊娠结局的预测具有重要作用,通过受试者工作特征曲线(receiver operating characteristic curve,ROC)得到的临界值对临床早期预测不良妊娠结局具有重要意义[9]。目前关于ADAMTS-1的研究主要以动物为研究对象,针对人群的研究相对较少[10]。本研究旨在探索患者外周ADAMTS-1表达水平作为HG诊断标志物的可行性。
1 资料与方法
1.1 一般资料
本研究纳入海口市人民医院2019年1月至2022年1月收治的100名孕妇作为研究对象,其中49名确诊为妊娠剧吐的患者作为实验组,另51名健康孕妇为对照组。纳入标准:①参照妊娠剧吐诊断标准[11],诊断为HG;②患者及家属知情同意,并签署知情同意书。排除标准:①糖尿病、肥胖症、消化性溃疡或胃炎、肝脏或胆囊疾病(胆管炎或胆结石)、甲状腺功能障碍、尿路感染、乳糜泻、心血管或肾脏疾病史;②有流产风险的患者;③多胎妊娠或通过辅助生殖技术获得的妊娠;④妊娠滋养细胞疾病和自身免疫性疾病。本研究经我院伦理委员会审批通过。
1.2 血清ADAMTS-1表达水平的测量
隔夜禁食8~12小时后的清晨,采集参与者肘前静脉血样,以4000rpm转速离心10分钟。为测量血清ADAMTS-1蛋白酶,诊断HG后采集患者的血液样本,将其储存在-80℃直至检测。将冷冻的血清样品解冻至室温并且不稀释,添加到先前用ADAMTS-1单克隆抗体包被的孔中,添加生物素标记的抗ADAMTS-1抗体和链霉亲和素-HRP,之后形成免疫复合物。恒温孵育后,通过洗涤去除未结合的酶,然后加入色原溶液A和B。终止溶液用于终止反应,形成的黄色光密度用酶标仪在450nm处测量。ADAMTS-1血清表达水平利用标准曲线计算获得。
1.3 统计分析

2 结果
2.1 两组孕妇的一般资料和临床特征比较
两组之间的一般资料和临床特征无明显统计学差异(P>0.05),如表1所示。

表1 两组间一般资料和临床特征的比较
2.2 两组孕妇的生化指标比较
实验组的尿酮、血糖、谷丙转氨酶、中性粒细胞计数、血小板比积、血小板平均体积、降钙素原、血小板分布宽度和ADAMTS-1高于对照组且具有显著统计学意义(P<0.05),如表2所示。
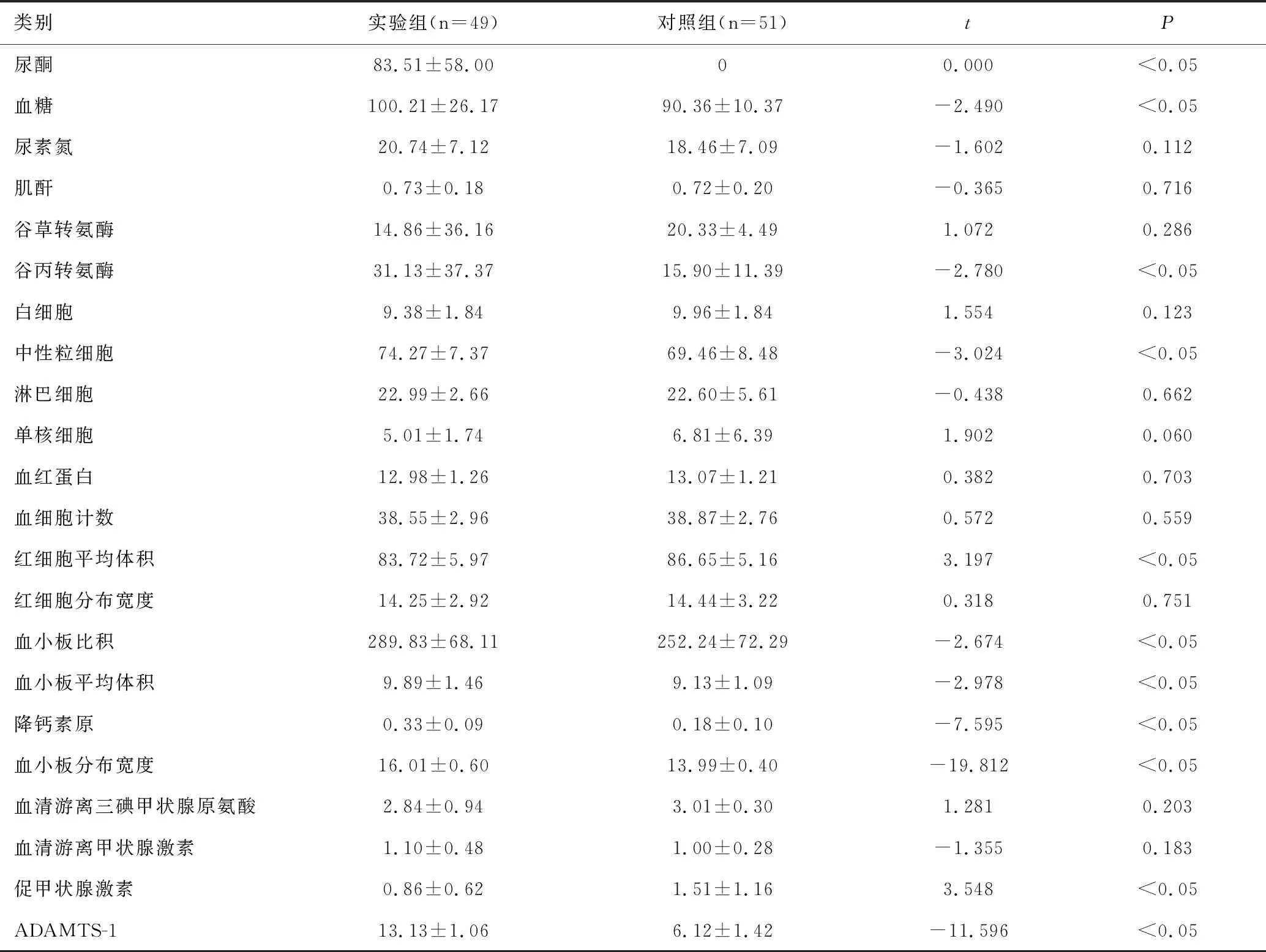
表2 两组孕妇的生化指标比较
2.3 关于ADAMTS-1表达水平的相关性分析
ADAMTS-1与尿酮、谷丙转氨酶、中性粒细胞计数、血小板平均体积、降钙素原、血小板分布宽度显著正相关(P<0.05),与红细胞平均体积和促甲状腺激素显著负相关(P<0.05),如表3所示。

表3 ADAMTS-1表达水平的相关性分析Table 3 Correlation analysis of ADAMTS-1 expression levels
2.4 ROC分析
使用患者外周ADAMTS-1表达水平诊断HG的ROC曲线下面积(area under the curve,AUC)为0.94(95%CI:0.88~1.00)。用于诊断HG的患者外周ADAMTS-1临界值为9.48ng/mL,灵敏度为85.71%,特异性为98.04%,如图1所示。

图1 ADAMTS-1诊断HG的ROC曲线
3 讨论
3.1 ADAMTS-1作为HG诊断标志物的潜力
妊娠剧吐(HG)是发生在妊娠期的严重恶心和呕吐症状,通常在孕期前三个月出现。这种症状可能导致脱水、体重减少、电解质失衡和营养不良等并发症。ADAMTS-1是一种多功能金属酶,它参与了许多生物学过程,包括组织重建、细胞凋亡、细胞增殖、炎症反应等。虽然已有研究表明ADAMTS-1与不良妊娠结局有关,但鲜有研究证明ADAMTS-1与HG之间的关系。因此本研究分析了ADAMTS-1作为HG诊断标志物的可行性。
3.2 ADAMTS-1与HG患者的相关性
本研究显示,实验组HG患者相比于对照组的健康孕妇,其血清ADAMTS-1明显升高。该结果与许相洋[9]等人的研究共同表明ADAMTS-1的表达可作为临床诊断的重要依据。某项研究中,HG患者发生小胎龄的发生率增加[12],子痫前期患者血液中的ADAMTS-1表达水平较低,而胎盘组织中的ADAMTS-1表达水平则高于对照组。ADAMTS-1 能够参与调节ECM蛋白[13]。ADAMTS-1在HG患者体内表达水平升高,可能是由于ADAMTS-1作为血管内皮生长因子(vascular endothelial growth factor,VEGF)拮抗剂发挥作用。HG患者ADAMTS-1表达水平较高,胎盘分泌的ADAMTS-1可能作为补偿机制,调节恶心呕吐中心的血管通透性。由于胎盘及神经组织中的VEGF受体类型不同,ADAMTS-1可能对大脑中的VEGF受体无效,GDF15及其他生长因子、细胞因子可能会降低ADAMTS-1的活性[14]。
目前有研究阐明GDF15高表达与HG密切相关。妊娠期GDF15主要由胎盘细胞产生,并在血液中循环[15]。有研究者发现GDF15基因编码TGF-β超家族成员,并在胎盘的滋养层细胞中高水平表达,该蛋白在妊娠前两个月含量很高,其作用是促进胎盘发育,抑制细胞因子,以防产生炎症,继而抑制妊娠的继续[16]。 GDF15能通过调节中枢神经系统神经递质,作用于特定的下丘脑受体,通过下游神经肽(如瘦素、血清素、饥饿素等)促进饱腹感[17]。因此患者过度分泌GDF15,会导致HG患者的慢性恶心和呕吐。多项研究表明GDF-15可能与ADAMTS家族有着密切的联系,例如GDF15通过调控组织抑制因子(tissue inhibitor of metalloproteinases,TIMPs)表达来调节MMPs的活性。未经处理的GDF15分泌前体分子会结合ECM的成分,从而创造出潜在的基质GDF15存储[18],而ADAMTS家族是ECM的重要组成部分。因此推测HG患者集体中GDF15通过调控TIMPs的表达,进而影响到ADAMTS-1的表达。本研究提出了ADAMTS-1可作为HG患者的诊断标志物,但后续需进一步收集GDF15和ADAMTS-1的表达水平来进一步验证本次研究的推测。
3.3 小结
本研究ADAMTS-1表达水平与尿酮显著正相关。酮体是脂肪酸经肝脏分解的代谢产物,通常在体内水平较低,当葡萄糖不足或葡萄糖利用发生障碍时,机体会产生酮体为外周组织提供能量[19]。长期恶心和呕吐的HG患者可出现饥饿性酮症,这可能损害母体和胎儿的神经元系统[20]。ADAMTS-1作为VEGF拮抗剂,具有保护血脑屏障免受酮体负面影响的功能。某研究中显示尿酮症与ADAMTS-1表达水平之间呈正相关[21]。研究者认为HG中的尿酮与妊娠期间炎症反应相关,并非HG[22]。本研究发现相比于对照组健康孕妇,实验组的炎症标志物如血小板分布宽度、降钙素原和血小板平均体积更高。
本研究显示HG患者血清ADAMTS-1显著升高,ADAMTS-1表达水平与尿酮呈正相关。提示ADAMTS-1可能作为诊断HG的有效标志物。了解ADAMTS-1的生物学功能及其在妊娠剧吐中发挥的作用,有助于我们了解该疾病发病机制,为治疗方法提供新思路。

