化学学科核心素养在高中化学教学中的具体体现
——以原电池的电极判断及电极反应式书写的再认识及应用为例
郑志明,范艳玲,刘龙海
(云南省下关第一中学,云南 大理 671000)
电化学是新课程标准中“化学反应与能量”部分的知识,是化学学科“宏观辨识与微观探析,变化观念与平衡思想,证据推理与模型认知,实验探究与创新意识,科学精神与社会责任[1]”五大核心素养的具体体现之一。近年来高考题目中对电化学的考察频率非常之高,试题题目常考常新,通常以新型电源为知识背景,这类题目高起点,低落点,往往是围绕电化学基本原理命题,其中电极判断以及电极反应式的书写及正误判断几乎是必考内容。本文将围绕五大化学核心素养和大家一起探讨电化学中原电池的电极判断及电极反应式的书写等相关知识。
1 变化观念与平衡思想的载体——原电池电极的判断
传统教学中,教师通常没有从根本上解释何为正、负极,而是直接将结论或现象抛给学生,从而使学生容易出现一听就懂,一做就错的问题,核心素养中的“变化观念与平衡思想”所指向的是物质转化层面的相关内容,含物理变化、化学变化以及化学变化过程中的平衡问题、变化的规律和变化的守恒、能量等问题,属于物质的动态层面[2]。原电池的电极判断过程中涉及到在电势差的作用下电子的定向移动从而产生电能以及电极上所发生的氧化、还原反应等内容正是“变化观念与平衡思想”的具体体现方式。
1.1 电极的得名
电极的概念是M.法拉第进行系统电解实验后在1834年提出的,原意只指构成电池的插在电液中的金属棒,在现代电化学中电极其实是原电池的基本组成部分[2]。利用自发氧化还原反应产生电流的装置叫原电池,一个原电池必须由两个基本部分组成:两个电极和电解质溶液,给出电子发生氧化反应的电极,如丹尼尔电池(图1所示)中的Zn极,由于其电势较低,被称为负极(negative electrode);而接受电子发生还原反应的一极,如Cu极,由于其电势较高,而称作正极(positive electrode)[3]。
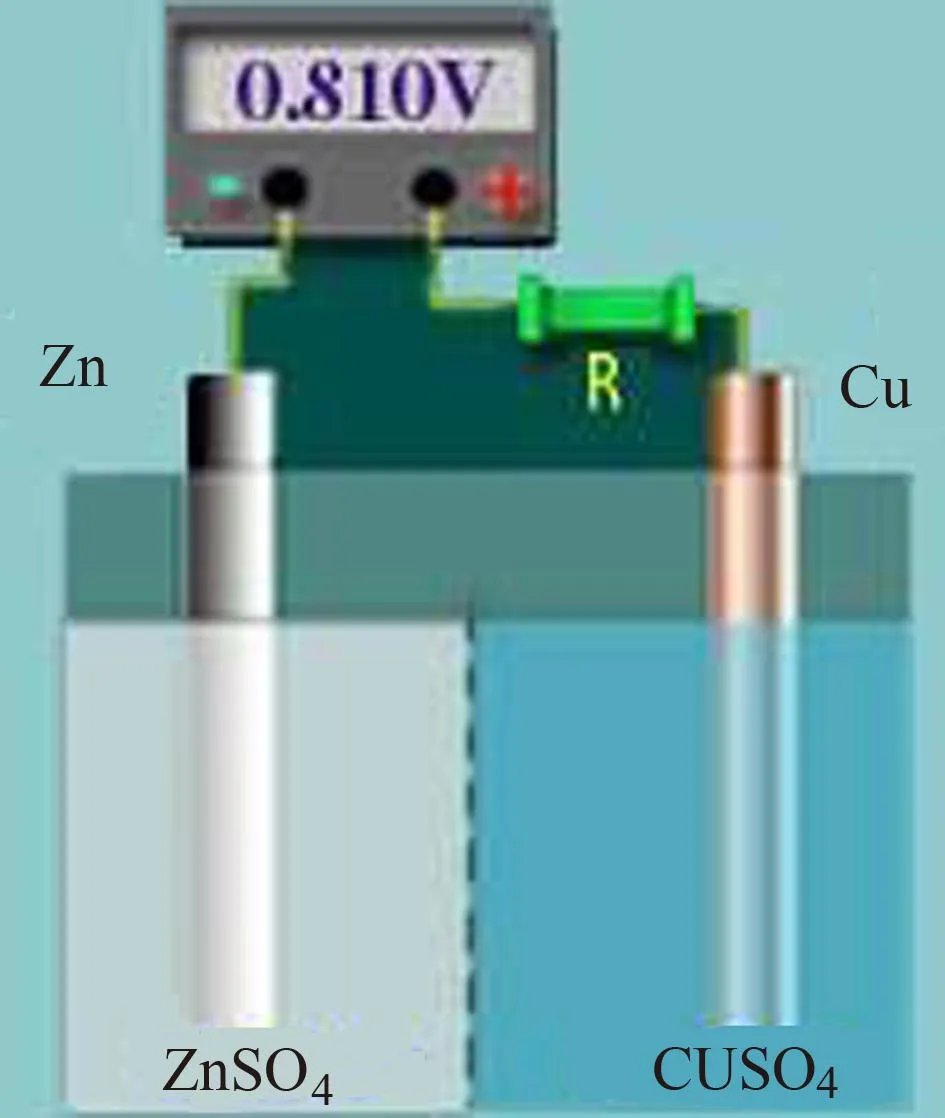
图1 丹尼尔电池
1.2 电极的判断
从上述分析可知,判断电极的实质是电势的相对高低,电势较高的为正极,电势较低的为负极,从物理学我们还知道,在外电路中电子将自发的从电势较低的一极向电势较高的一极移动,电流的流向与电子的流向相反,即:电流将从正极流向负极,如果用化学语言描述即:失去电子的一极是负极,得到电子的一极是正极。可以推导原电池的工作原理见图2。
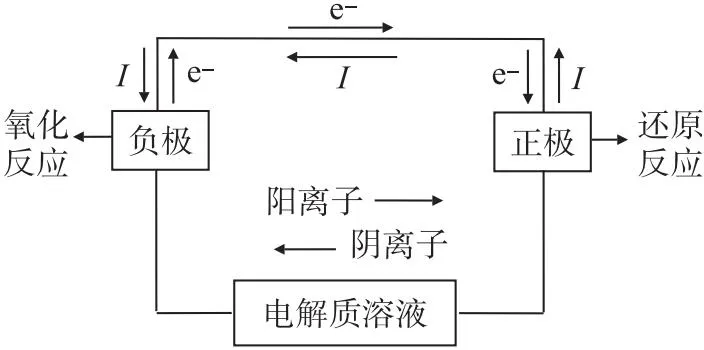
图2 原电池的工作原理
为方便掌握,将电极的一些常见判断依据以表格的形式总结,详见表1。
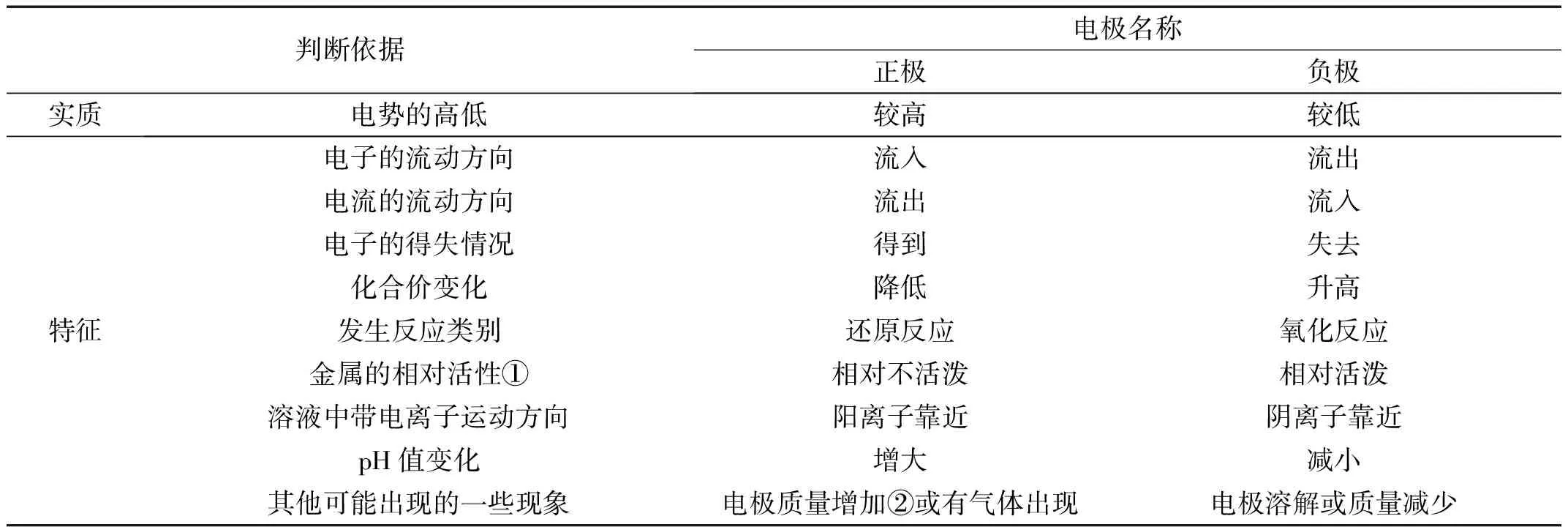
表1 常见的电极判断依据
2 宏观辨识与微观探析的介质——电极反应式的书写
化学方程式是描述化学反应的语言,是连接宏观物质和微观粒子的纽带,原电池反应的实质是氧化还原反应,与普通的氧化还原反应不同的是,原电池中的氧化反应和还原反应通常分别在两极发生,因此对于初学者而言电极反应式的书写,尤其是燃料电池中电极反应式的书写显得比较困难。笔者将电极反应式的书写方法总结为顺口溜如下:
负极氧化正还原,外界环境要体现。三个守恒记心间,正负之和总不变。即:负极发生氧化反应,正极发生还原反应,这是电极反应式书写的核心依据;外界环境是指电解质溶液的酸碱性、使用何种离子交换膜、熔融金属氧化物或碳酸盐等条件;三个守恒包括电荷守恒、质量守恒、电子守恒;正、负两极的电极反应式之和应与总反应相同。
例1:CH3OH和O2在KOH溶液中组成燃料电池,请写出该电池的电极反应式及总方程式。
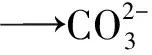
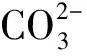
第三步:依据电荷守恒原理配平以上电极反应式,缺少的物质可从介质中寻找。负极左边有 6 mol 正电荷,右边有 2 mol 负电荷,因为该电池为碱性电池,所以应该在左边添加 8 mol OH-,正极左边有 4 mol 负电荷,右边应有 4 mol OH-。
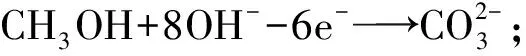
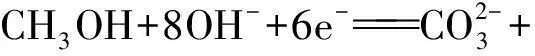
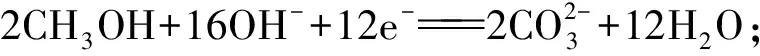
电极反应的实质是微观粒子在负极发生氧化反应、正极发生还原反应的过程,电极反应式架起了微观粒子与宏观物质联系的桥梁,将无法用肉眼观察的化学反应变得更加直观,让生涩而枯燥的化学知识变得有血有肉。
3 实验探究与创新意识的体现——高考实战演练
高考试题是检验学科核心素养是否达成的重要依据,电化学部分是近年高考的必考内容之一,该部分内容通常以新型电池和燃料电池为载体,围绕原电池的工作原理尤其是电极判断及电极反应式的书写等知识进行命题,题目源于教材中的传统电池模型,落脚点却通常高于教材知识,而这正是学科核心素养中实验探究与创新意识的具体体现。
例2:(2023·广东卷,6)负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图3。下列说法正确的是

图3 电池的工作原理
A.Ag作原电池正极
B.电子由Ag经活性炭流向Pt

D.每消耗标准状况下 11.2 L 的O2,最多去除 1 mol Cl-

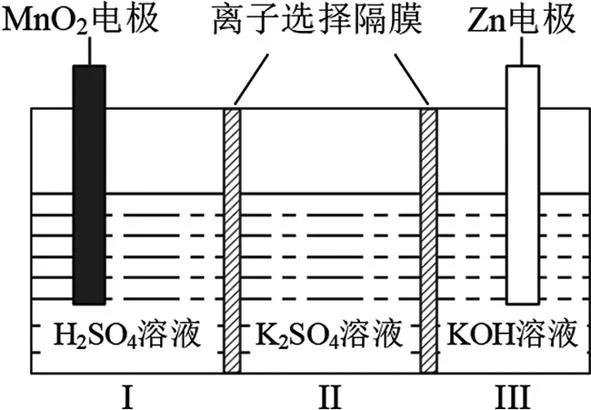
图4 水性电解液
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
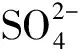

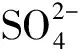
判断电极的物理依据是电势的相对高低,由于电势差的存在,电子从负极流向正极,即:负极失电子、正极得电子,进而可以推知一系列的化学现象、实验特征;电极反应的实质是氧化还原反应。
4 结语
电极判断及电极反应式书写的学习过程促进了宏观辨识与微观探析,变化观念与平衡思想,实验探究与创新意识的化学学科核心素养的养成,化学学科核心素养的培养应贯穿于高中化学教学的始终。

