一种有机凝胶因子对二氧化碳可视化传感的综合实验设计*
于子茜,张 欣,孙贺略,冯 祺,刘 博
(河北师范大学 化学与材料科学学院,河北省有机功能分子重点实验室,河北 石家庄 050024)
环境恶化是21世纪威胁人类生存和发展的重大问题之一,而气候变暖位居全球十大环境问题之首,给人类的生存环境带来重大的危害,如海平面上升、气候反常、海洋风暴增多等。最近几十年来,全球变暖的罪魁祸首极有可能是人类生活、生产排放的大量温室气体,而导致全球变暖的温室气体,主要是二氧化碳[1-3]。因此,对二氧化碳的监测与排放控制具有全球性环境战略意义。另外,出于对人们呼吸安全的考虑,在相对封闭的空间,如矿井、船舱、潜水器以及隧道等,对CO2的监测也是十分重要的。目前,检测二氧化碳的方法有:红外光谱法、pH值法、气相色谱法等[4-6]。但是,由于这些方法普遍具有价格昂贵、需要依靠大型仪器和操作复杂等缺点,很难实现对二氧化碳的实时监测[7]。因此,如何开发出简单、快速、实时以及在线的监测方法,近年来成为了该领域的研究热点。
有机小分子凝胶因子(low moLecular-mass organic gelators,LMOGs)是一类用很少量就可以在大量有机溶剂中自发地聚集、组装成有序结构,进而使整个体系凝胶化的低分子量有机化合物[8]。由于凝胶会对外界微小的物理、化学刺激产生响应,并且引起凝胶聚集态与溶液分散态之间的可逆转变,因此可用于开发可视化传感智能型凝胶材料。另外,将光学分析法与智能凝胶体系结合,可以对被分析物提供定量和可视化的双渠道,甚至三渠道分析手段。但是,到目前为止,有关这类传感体系在二氧化碳检测方面的研究报道并不多见。针对这一研究现状,我们以萘酰亚胺为荧光团母体,合成了一种在3位上修饰了一个萘环的新型凝胶因子。研究表明,此凝胶因子可以在二甲基亚砜(DMSO)中形成稳定的凝胶,并且以一种阴离子诱导策略为基础,通过溶液和凝胶态之间的相互转化,对CO2提供了一种可视化的传感模式,而且通过荧光光谱变化,实现了CO2的定量分析。
本实验是通过我们最近取得的科研成果转化而来。一方面,该综合实验涉及有机合成化学、超分子化学、仪器分析化学、计算机软件技术等多个学科领域,不仅可以使本科生体会到多学科交叉的魅力,还可以培养学生多种实验技能的综合运用能力和独立科研能力;另一方面,生态环境的保护也是建立人类命运共同体的重要组成部分,生态环境资源的使用和维护关乎到全球民众的福祉。因此,在实验教学过程中,培养学生的生态环境保护意识和责任感也是非常重要的。
1 实验部分
1.1 实验原理
1.1.1 目标化合物的合成路线
本实验以3-硝基-1,8-萘二甲酸酐为起始原料,首先与正丁胺发生缩合反应,生成N-丁基-3-硝基-1,8-萘酰亚胺(2);然后中间体2经过硝基还原反应,生成N-丁基-3-氨基-1,8-萘酰亚胺(3);最后中间体3再与2-萘甲酰氯发生胺基上的羰基化反应,生成目标化合物NAP-BUT。如图1所示。
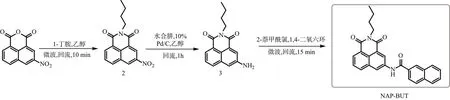
图1 凝胶因子NAP-BUT的合成路线图
1.1.2 二氧化碳的传感机制
本实验采取的是一种由氟离子诱导的二氧化碳传感策略,如图2所示。首先,NAP-BUT分子以氢键作用自组装形成凝胶,体系在光激发下具有较强的荧光;然后,在阴离子作用,通过去质子作用分解氢键,从而形成分散的溶液体系。此时,由于触发了萘酰亚胺荧光母体的分子内电荷转移(ICT)效应,体系的颜色会发生相应的变化,同时体系荧光也会发生淬灭。当向体系通入二氧化碳时,由于水分的存在,使得二氧化碳与水分子作用形成碳酸,进而电离出的氢离子补偿给失去质子的凝胶因子,使得凝胶因子的分子结构得以恢复,并重新通过氢键作用自组装形成凝胶,体系再次发出荧光,并且在此过程中二氧化碳以碳酸氢根离子的形式稳定存在于凝胶体系中。由于ICT效应的存在,通过电荷转移过程,分子内部形成了一个带正电荷和负电荷的极性结构,这种极性结构导致了不同的发射颜色,这些变化过程还伴随紫外吸收和荧光的变化。

图2 凝胶在氟离子诱导下对二氧化碳的传感机理示意图

图3 NAP-BUT(3.5%)在DMSO(1 mL)中形成的凝胶对不同量的氟离子响应图(左图)和NAP-BUT(6.0×10-4 mol/L)的DMSO溶液对氟离子响应的紫外吸收光谱变化图(右图)
1.2 主要原料和试剂
3-硝基-1,8-萘二甲酸酐(北京伊诺凯科技有限公司,99.0%),正丁胺(天津市大茂化学试剂厂,99.5%),2-萘甲酰氯(阿法埃莎化学有限公司,98.0%),四丁基氟化铵(阿拉丁试剂上海有限公司,98.0%),二氧化碳(石家庄市桥西西三教制氧站,99.99%)。
1.3 仪器
旋转蒸发器(RE-52A,上海亚荣生化仪器厂),微波反应器(WBFY-205,巩义市予华仪器有限责任公司),荧光分光光度计(F-4500,日立(中国)有限公司)。
1.4 合成、表征及测试方法
1.4.1 中间体2的制备
准确称取 0.24 g(1 mmoL)3-硝基-1,8-萘二甲酸酐于 100 mL 单颈圆底烧瓶中,加入 30 mL 无水乙醇溶解,磁力搅拌下逐滴加入含 0.08 g(1.1 mmoL)正丁胺的 1 mL 乙醇溶液,滴加完毕后,将混合物放入微波反应器中,设定功率 800 W,回流反应 10 min。反应结束后,反应物自然冷却至室温,有大量淡黄色絮状沉淀生成。抽滤,烘干滤饼,得 179 mg 淡黄色固体2,产率为60%。
1.4.2 中间体3的制备
准确称取 0.15 g(0.5 mmoL)中间体2于 50 mL 双颈圆底烧瓶中,加入 10 mL 无水乙醇,搅拌下将其溶解。然后加入 0.1 mL(1.7 mmoL)水合肼,将反应物温度升至 78 ℃ 时,向烧瓶中分批次加入 13 mg 的10%Pd/C。在氮气保护下,将混合物加热回流 1 h。在滤纸上铺一层硅藻土,然后对反应混合物进行抽滤分离Pd/C,将滤液旋干后,放于真空干燥箱中烘干,得 90 mg 黄色固体3,产率为65%。
1.4.3 NAP-BUT的制备
准确称取 0.09 g(0.3 mmoL)中间体3并置于 25 mL 单颈圆底烧瓶中,加入 6 mL 1,4-二氧六环将其溶解,冰浴下向其滴加溶有 0.08 g(0.4 mmoL)2-萘甲酰氯的1,4-二氧六环溶液(2 mL),滴加完成后室温下反应 30 min,然后将混合物放入微波反应器中,设定功率 800 W,回流反应 15 min。反应完成后,将溶剂旋干,以二氯甲烷为洗脱剂(DCM)利用柱色谱法对产物进行提纯,待洗脱剂旋干后将产物放入真空干燥箱中烘干,得 105 mg 淡黄色固体NAP-BUT,产率为75%。
1.4.4 化合物的表征
1)固体化合物的熔点测定
中间体和目标化合物均为固体,因此首先对它们进行熔点测定。采用显微熔点法(X-5显微熔点仪,巩义予华),对每个样品进行3次测试取平均值。
2)核磁共振光谱测定
取 6 mg 左右的样品溶解于 0.5 mL 氘代氯仿或氘代DMSO中,导入石英核磁管中,在一台Bruker Avance AVIII-500Q (500 MHz)核磁共振仪上进行测试。
3)质谱和元素分析
将微量样品溶解于乙腈或甲醇中,在一台连有AB SCIEX 3200Q TRAP LC/MS/MS系统的Agilent 1260 INFINITY 高效液相色谱仪上进行质谱测定。化合物的元素分析是在一台Elemerlar Vario EL III元素分析仪上进行测定,测试前需要将样品充分干燥。
1.4.5 凝胶的制备及性质测定
1)加热-冷却法制备凝胶
将适量的凝胶因子(质量分数5%)与 1 mL 溶剂混合于带盖的玻璃小瓶中,封好后进行加热直到凝胶因子全部溶解得到澄清溶液,然后静置冷却至室温。将小瓶倒置,如果所得凝胶状物体附于瓶底且无明显溶剂留下,即可判定形成了凝胶。
2)最小凝胶化质量分数的测定
在含有较高质量分数凝胶因子的凝胶中,逐渐加入同样的溶剂进行稀释,每稀释一次,凝胶化体系都要经过加热-冷却的过程。判断每一次稀释体系是否形成凝胶,直到不再形成凝胶为止。记录最后一次形成凝胶时凝胶因子的质量分数,即形成凝胶的最小质量分数(MGC),单位为%。
3)相转变温度的测定
将一个 100 mg 的小钢球置于凝胶顶部,于恒温加热油浴中,慢慢升温,加热速度控制在 1 ℃/min 左右。当加热到凝胶无法支撑小钢球的质量而使其掉到瓶底时,记录此时的温度,即为此凝胶转变为溶液的最低温度(Tg)。
1.4.6 荧光光谱测定
在本实验中,将待测溶液装入一个光路为 1 cm 的石英比色皿中,采用一台Hitachi F-4500荧光分光光度仪对待测样品进行荧光光谱测定。
1.4.7 二氧化碳测试样品的准备
本实验对二氧化碳的检测有两种形式:一种是二氧化碳气流的检测;另一种是检测空气中的二氧化碳。在第一种情况中,测试前需要将一个V10FD-XS型流量控制器的一端与一个带有压力表的高压CO2(99.99%)气体钢瓶连接,另一端用胶皮管与一根长针头相连。测试时直接将长针头插入测试溶液样底部进行鼓泡,控制器的可控气体流速范围为0至 10 mL/min。在第二种情况中,直接将含有氟离子的溶液样品静置于空气中 3 h 待测。
2 结果与讨论
2.1 中间体和凝胶因子的合成
目标化合物的合成涉及三步反应:第一步,中间体的合成。 使用的是1,8-萘二甲酸酐衍生物和脂肪胺之间的缩合反应,采用了微波对反应进行加热,结果只需要 10 min 就可以完成反应。 第二步,中间体的合成。 涉及萘环3位上的硝基还原成氨基的反应,反应完成后将反应混合物直接进行过滤,将滤液的溶剂旋干后就可以得到纯度较高的产物,无需进一步提纯就可以直接进行下一步反应。最后,以2-萘甲酰氯作为酰基化试剂,无需加入缚酸剂,直接与中间体3在1,4-二氧六环中发生氨基的酰基化反应得到目标化合物NAP-BUT。
2.2 DMSO凝胶的制备及氟离子响应的条件优化
经过测试发现,化合物NAP-BUT可以在二甲基亚砜(DMSO)中形成稳定的凝胶,其最小凝胶化质量分数(MCG)和凝胶-溶液相转变温度(Tg)分别为2.7%和 40 ℃。因此用于测试样品中的凝胶因子质量分数等于或高于MGC,本实验以含有3.5%凝胶因子的DMSO凝胶为例进行测试,每一个凝胶或溶液样品的溶剂用量均为 1 mL。
二氧化碳测试前,测定对凝胶转变所用氟离子的量。 测定过程中的氟离子是以四丁基氟化铵的形式加到凝胶表面。 当氟离子溶液滴加到凝胶表面时,淡黄色凝胶逐渐融化为红色的溶液,颜色的变化是由ICT效应引起的,这一点可根据NAP-BUT在氟离子作用下的紫外吸收光谱的变化进行解释 (如图3)。 当氟离子的用量达到凝胶因子质量分数的5倍时,凝胶可完全转变为溶液,并且凝胶完全转变为溶液只需要 10 min(如图4)。

图4 NAP-BUT(3.5%)在DMSO(1 mL)中形成的凝胶在5倍氟离子存在下随时间变化示意图
2.3 二氧化碳的可视化传感
2.3.1 对二氧化碳气流的测试
首先,在含有凝胶因子和氟离子的DMSO溶液中,通入CO2气流,观察实验现象并进行荧光测试,结果如图5所示。随着CO2的通入,红色透明溶液逐渐变浑浊,当CO2的通入量达到 5 mL 时,红色溶液转变成淡黄色凝胶,同时荧光恢复。另外,将所得凝胶加热到大于Tg温度的同时通入氮气(N2),体系又可以恢复到了原来的红色溶液状态,这说明溶液到凝胶的转化过程是可逆的。荧光滴定测试表明,随着CO2的通入,468 nm 处的发射峰逐渐增强,且 468 nm 处的相对荧光强度与CO2的通入量之间呈线性关系,所拟合的公式为I/I0=117V(CO2)-43(R=0.9899)。拟合结果如图5插图所示。
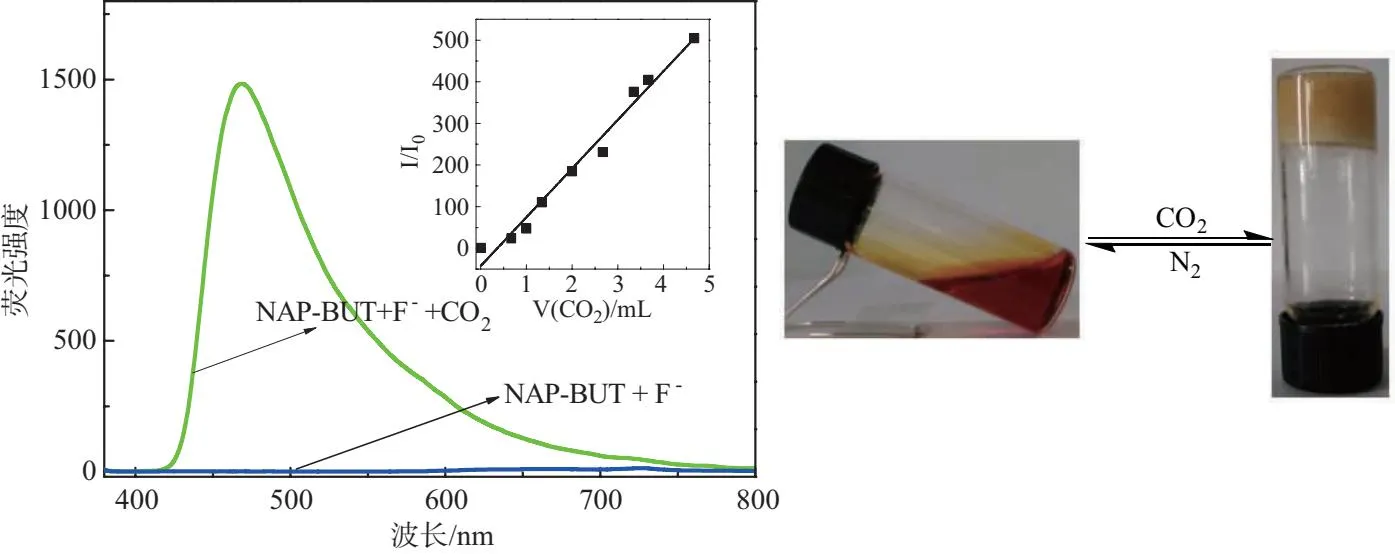
左图:凝胶因子3.5%,氟离子用量为凝胶因子的5倍,激发波长为 360 nm,发射波长为 468 nm,插图为相对荧光强度变化值与CO2体积的线性关系拟合图;右图为溶液-凝胶可逆转化示意图
2.3.2 对当地空气中二氧化碳的测试
由于空气中含有0.03%(体积分数)的CO2,可以采用相同的测试手段研究以上溶液传感体系在空气中对CO2的响应情况,如图6所示。将测试溶液置于当地空气中 3 h 后,溶液可完全转变成凝胶。在测试体系相态转变的过程中,其颜色也由红色转变为黄色,并且荧光也有所恢复。这些测试结果说明,该传感体系可以颜色变化、溶液至凝胶转变,以及荧光变化方式对空气中的CO2进行可视化定性传感和光谱定量分析。
3 教学实施和课时安排
本实验教学是通过科研成果转化而来的一项综合实验,目标教学对象是大三本科生,旨在锻炼学生动手操作能力、独立思考能力、交流合作能力等。教学实施主要分为四部分:课前准备、制备合成(9学时)、表征(6学时)、性质测试(9学时)。
1)课前准备阶段。教师在“学习通”平台发布本实验有关参考文献等学习资料,使学生复习荧光分析法,了解CO2的应用和危害,能针对实验研究背景预习实验内容,了解实验目的,讨论并初步进行设计实验方案,对实验现象进行预判。
2)制备合成阶段。学生在教师指导下合成中间体2和3及凝胶因子NAP-BUT。遇到特殊现象要引导学生分析并解决,训练学生的有机合成及分离提纯基本技能,采取师生互动式教学,实验过程当中教师要时刻注意安全问题,把握实验进度,保证实验的顺利实施。
3)表征阶段。教师演练操作,学生分组合作,教师指导下对所合成的化合物进行表征如质谱、核磁共振及元素分析等,锻炼学生操作大型仪器,分析谱图。
4)性质测试阶段,分组式教学,制备凝胶并对凝胶进行性质测试,教师指导下利用相关软件对所得测试数据进行处理,并分析测试结果。最后,小组交流实验过程分析现象,撰写实验报告,将课堂知识与实际生活联系起来,理论联系实际,扩大应用范围。
4 结语
本文合成了一种结构中含有酰胺键和萘环的萘酰亚胺类凝胶因子,并将其在DMSO中所形成的凝胶开发成一种CO2传感材料。研究表明,被开发的凝胶材料可以在氟离子作用下转变为溶液,所得溶液无论对CO2气流还是空气中的CO2都具有可视性的传感功能,即CO2的存在可以使溶液转变为凝胶,并且此相转变过程伴随颜色和荧光的变化。本实验无需价格昂贵的大型仪器,直接用肉眼就可以观察到CO2的传感过程,具有很强的趣味性,可以激发学生对实验的学习兴趣,并且在实验过程中还可以通过思政教育培养学生的环境保护意识,因此比较适合作为大学本科生的专业综合实验进行广泛推广。

