知母皂苷AⅢ对肝癌细胞Akirin2基因表达及细胞增殖的抑制作用*
孙 琦 王洪博 高 玮 孙 豪
1.石家庄市人民医院药学部 (河北 石家庄, 050000) 2.河北省胸科医院 3.河北省中医院药学部 4.石家庄市裕华区疾病预防控制中心
肝细胞癌起病隐匿,因此很多患者丧失了外科手术的治疗机会,而目前并没有疗效显著的化疗药物和有效的治疗方式,因此探索肝癌治疗的新途径和明确其发病机制对肝癌治疗和预防及减少患者死亡率具有重大意义[1]。中药知母的主要成分是知母皂苷。近年来研究发现知母皂苷AⅢ(TA-Ⅲ)具有抗肿瘤作用,包括肺癌、神经母细胞瘤、白血病、黑色素瘤等多种肿瘤[2,3]。可见,TA-Ⅲ的抗肿瘤作用具有多样性和安全性。但关于知母皂苷对肝癌的相关作用鲜有报道,TA-Ⅲ是否对肝癌细胞有抗肿瘤效果及其分子生物学机制尚不清楚。Akirin2基因是近年来发现的基因家族,又被称作FBI1,与14-3-3β蛋白相互作用,Akirin2基因在各种癌细胞系中过表达,包括胶质母细胞瘤细胞和嗜铬细胞瘤细胞等[4],研究指出Akirin2基因可通过激活IL-6/STAT3/VEGFA信号通路促进胆管癌中的血管生成[5],但Akirin2是否在肝癌中表达还尚不清楚。既往研究指出知母菝葜皂苷元可促进肝癌细胞的凋亡[6]。但目前关于TA-Ⅲ与肝癌间的作用机制尚不明确。因此,我们探究TA-Ⅲ是否可以影响Akirin2表达,为肝癌的临床治疗和机制研究提供参考。
1 资料与方法
1.1 研究对象 选取在2015年1月至2017年1月于我院103例接受根治性手术的原发性肝细胞癌患者作为研究对象。纳入标准:①符合原发性肝癌诊疗指南(2022版)中肝细胞癌诊断标准[1];②术前患者未接受放化疗及免疫治疗;③患者均知情同意。术中取癌组织和距离癌灶大于5 cm的癌旁组织。本研究已通过伦理批准,电话随访每3个月1次,随访结果进行生存率分析,总生存期=接受手术至死亡日期(或最后一次随访时)。
1.2 试剂和仪器 TA-Ⅲ(纯度>98%)购自中国药品生物制品检定所,上海碧云天生物科技有限公司购买RIPA缓冲液,培养基和FBS(胎牛血清)购买于美国Gibco公司,HepG2、SMMC-7721、BEL-7402 和L02细胞购买于上海中国科学院细胞库,MTT和BCA试剂盒分别购自美国Sigma和Thermo公司,德国Eppendorf公司购买离心机和PCR仪,流式细胞仪购买于美国Beckman公司,美国invitrogen公司购买TRIzol试剂盒和转染试剂盒Lip 2000。
1.3 细胞培养和转染 按常规操作进行。
1.4 细胞处理和分组 实验将TA-Ⅲ分为 0、5、10、20和40 mol/L 5组分别对HepG2细胞进行48 h处理。另外根据Akirin2转染方式不同分为Akirin2过表达组(Akirin2 mimics转染至HepG2细胞)和Akirin2 inhibitor组(Akirin2 inhibitor转染至HepG2细胞)、TA-Ⅲ+Akirin2过表达组、紫杉醇组(80 μg/ml处理HepG2细胞)。
1.5 RT-qPCR检测mRNA的表达 基因检测,通过转录和反转录组织和细胞中提取的总RNA,GAPDH为内参,相对表达量=2-ΔΔCt,引物列表见表1。

表1 本实验引物
1.6 免疫组织化学染色及MTT法检测细胞增殖 按常规操作进行。
1.7 平板克隆形成实验检测肝癌细胞克隆形成 制备单细胞悬液,进行平板克隆形成实验,根据MTT法实验结果根据浓度不同将TA-Ⅲ 随机分为10、20、40 mol/L处理,对照组给予等量PBS处理,将处理过的细胞以每孔1 000个的浓度接种在六孔板中,培养2~3周后,肉眼可见克隆时,培养结束,用吉姆萨液染色固定好的细胞30 min,显微镜下观察克隆情况。
1.8 流式细胞术检测细胞凋亡及Western blot检测蛋白表达按常规操作进行。
1.9 MTT、Western blot和流式检测Akirin2转染和TA-Ⅲ对过表达Akirin2的HepG2细胞的增殖、克隆、凋亡的影响 RT-qPCR检测转染效率,使用转染成功后的HepG2细胞进行MTT、平板克隆、WB和流式检测Akirin2过表达组、Akirin2 inhibitor组以及TA-Ⅲ+Akirin2过表达组对细胞的增殖、克隆和凋亡的影响。
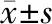
2 结果
2.1 肝癌组织中Akirin2表达水平 见图1、2。
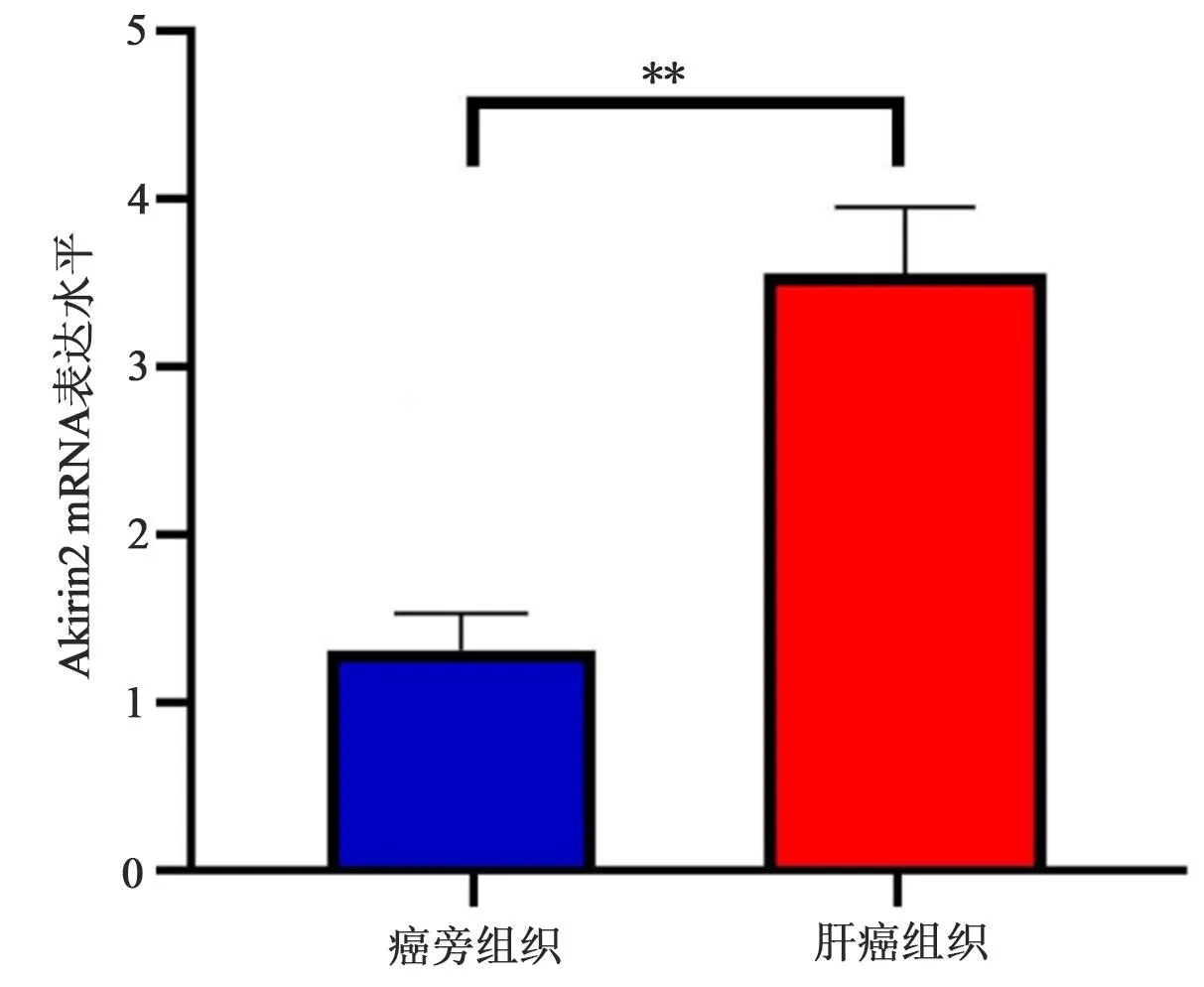
图1 Akirin2 mRNA在肝癌和癌旁组织的表达

图2 Akirin2在肝癌组织和癌旁组织蛋白相对表达(1、3、5、7、9、11、13为肝癌组织;2、4、6、8、10、12、14为癌旁组织)
2.2 Akirin2蛋白在肝癌组织中表达与患者总体生存率的关系 在免疫组化检测中,Akirin2在肝癌组织中显著高表达(P<0.05,图3)。我们将95例随访后的患者根据Akirin2染色评分分为高和低表达2组。结果显示,Akirin2高表达患者生存时间要低于低表达患者(P<0.05,图4)。
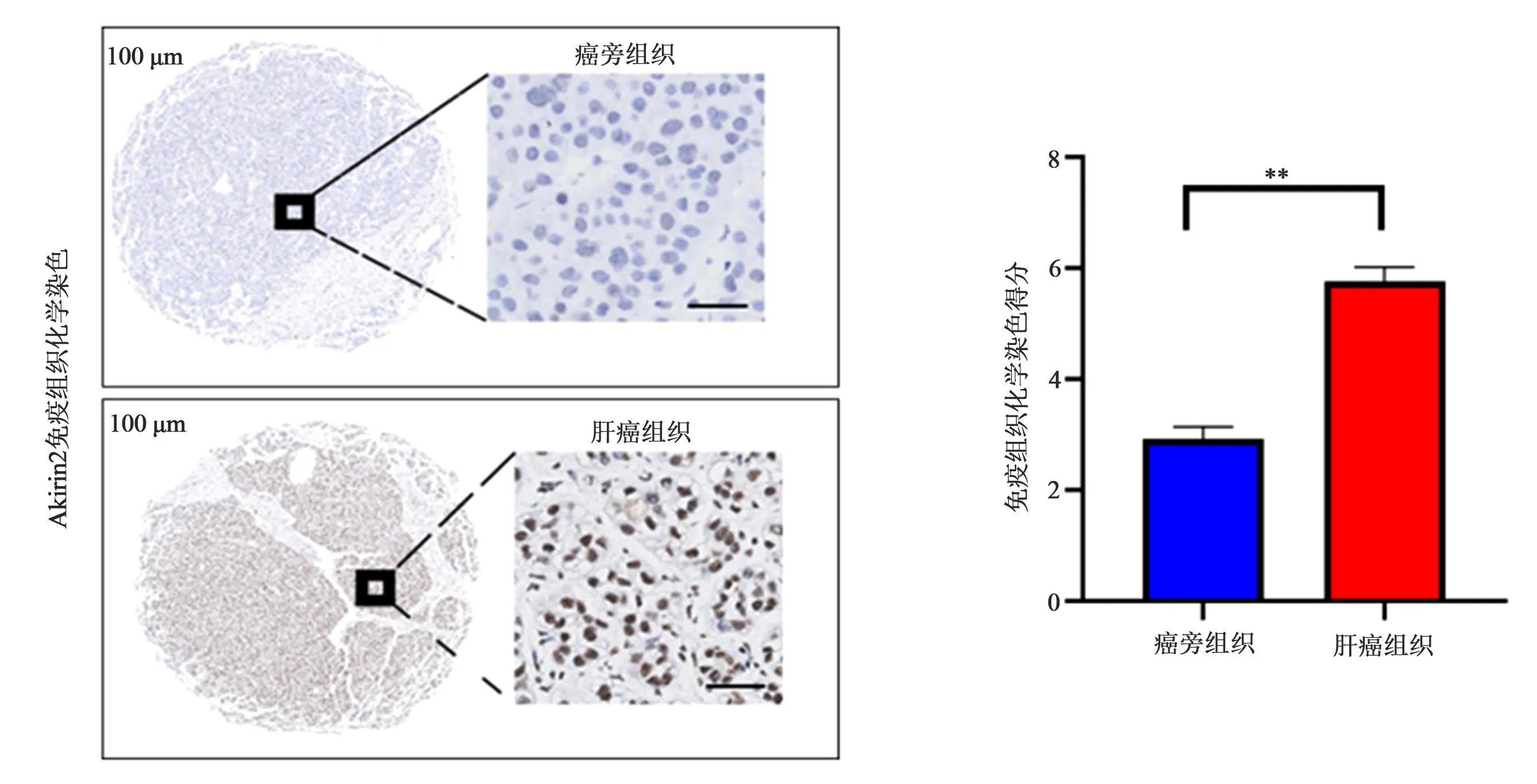
图3 免疫组化检测Akirin2在患者肝癌和癌旁组织中的表达(HE,400×)

图4 Akirin2不同表达方式与患者生存率的相关性
2.3 Akirin2在不同肝癌细胞中的表达 为明确Akirin2蛋白在不同肝癌细胞中的表达,我们通过RT-qPCR和Western blot分别检测正常肝细胞L02细胞、3种肝癌细胞(SMMC-7721、BEL-7402、HepG2)中的mRNA和蛋白表达。结果显示,3种癌细胞中的Akirin2 mRNA和蛋白表达均显著高于正常肝细胞。
3种肝癌细胞比较,HepG2细胞Akirin2 mRNA和蛋白表达更显著(图5,P<0.05),因此我们选择HepG2细胞进行后续实验。
图5 各组细胞中Akirin2的表达(**P<0.05)
2.4 Akirin2对肝癌细胞增殖的影响 转染后的HepG2细胞的Akirin2 mRNA表达见表2。MTT法和平板克隆形成实验结果显示,Akirin2 inhibitor组会导致细胞生长和克隆能力显著降低,相反,Akirin2在HepG2细胞中的过表达则显著增加增殖和集落形成能力(P<0.05,图6)。

图6 MTT法(A)和平板克隆实验(B)检测细胞活力(**P<0.05)

表2 转染后的HepG2细胞的Akirin2 mRNA表达
2.5 Akirin2对肝HepG2细胞凋亡的影响 Akirin2过表达可显著降低凋亡,而Akirin2 inhibitor则可显著促进细胞凋亡(图7)。Western blot检测Akirin2对cleaved-caspase3、caspase-PARP蛋白表达,结果显示,Akirin2抑制后cleaved-caspase3、caspase-PARP蛋白升高;Akirin2过表达后cleaved-caspase3、caspase-PARP蛋白降低(图8)。

图7 流式细胞检测细胞凋亡
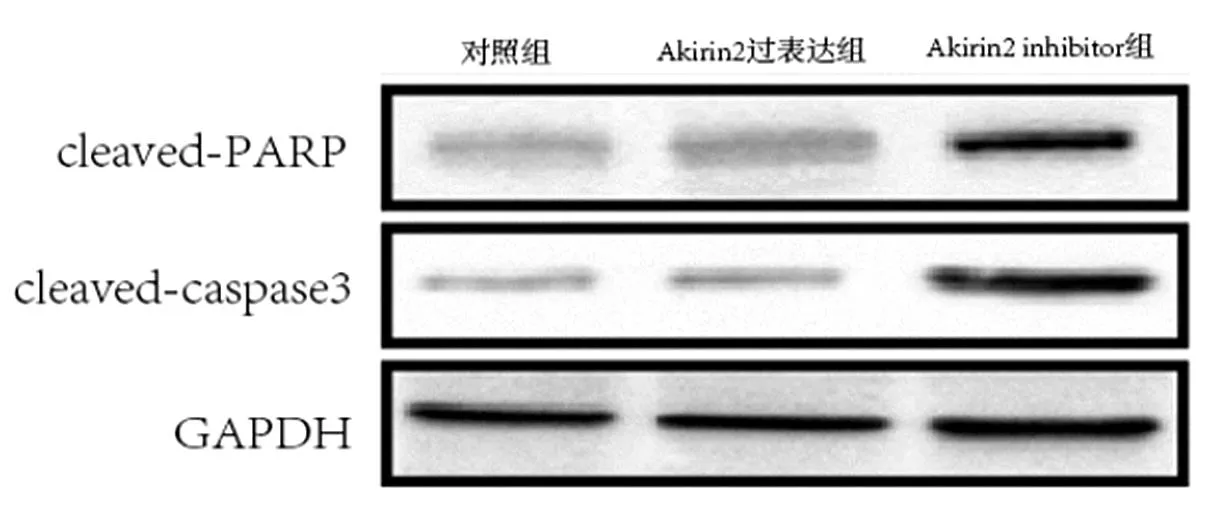
图8 Western blot检测Akirin2抑制和过表达对细胞凋亡相关蛋白的影响
2.6 TA-Ⅲ抑制HepG2细胞增殖 分别用0、5、10、20、40 mol/L浓度的TA-Ⅲ和80 μg/mL的紫杉醇干预HepG2细胞增殖情况,干预时间分别为24 h和48 h。结果显示与空白对照组比较,TA-Ⅲ处理组的HepG2细胞增殖活力显著被抑制,细胞增殖活性抑制与干预浓度、时间成正比(图9,P<0.05),且40 mol/L浓度的TA-Ⅲ和80 μg/ml的紫杉醇干预结果差异无统计学意义(P>0.05)。
2.7 TA-Ⅲ诱导HepG2细胞凋亡 分别用0、5、10、20、40 μmol/L浓度的TA-Ⅲ和80 μg/ml的紫杉醇干预HepG2细胞增殖情况。结果显示,TA-Ⅲ细胞凋亡与干预浓度、时间成正比,HepG2细胞凋亡显著增多趋势,TA-Ⅲ 40 mol/L时效果最佳(P<0.05,图10)。且TA-Ⅲ各组的HepG2细胞凋亡率和凋亡蛋白表达随浓度升高而增加(图11)。

图10 流式细胞术检测TA-Ⅲ影响肝癌细胞的凋亡情况
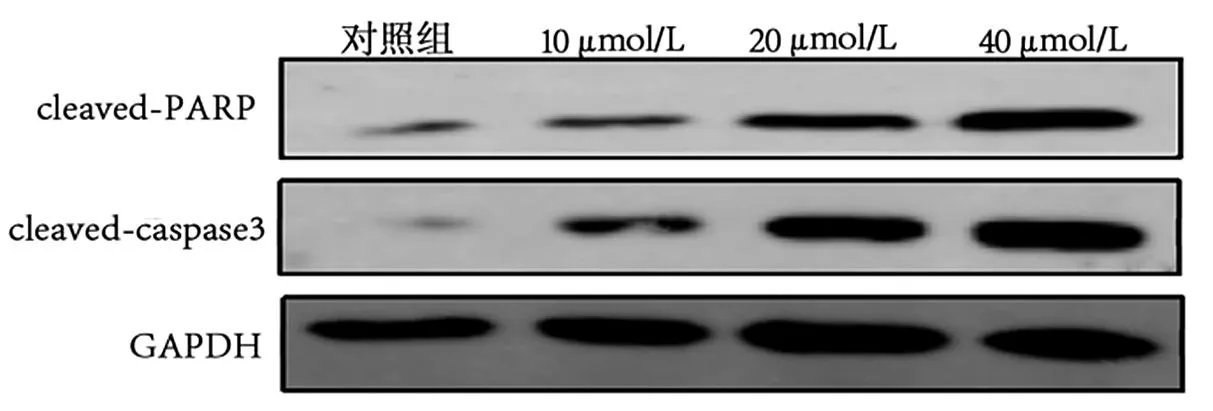
图11 Western blot检测TA-Ⅲ对凋亡蛋白影响
2.8 TA-Ⅲ下调HepG2细胞Akirin2的表达 Western blot的结果显示,与空白对照组比较,TA-Ⅲ(10、20、40 mol/L)组的HepG2细胞中的Akirin2蛋白表达水平显著降低(P<0.05,图12)。

图12 Western blot检测不同浓度TA-Ⅲ对肝癌细胞中Akirin2表达影响
2.9 Akirin2影响TA-Ⅲ对肝癌细胞的抑制作用 为了进一步检测TA-Ⅲ对HepG2及Akirin2蛋白的影响,将HepG2细胞随机分为NC组、Akirin2过表达组、TA-Ⅲ(40 μmol/L)组、TA-Ⅲ+Akirin2过表达组。结果显示,与TA-Ⅲ组比较,TA-Ⅲ+Akirin2过表达组HepG2细胞活力升高(P<0.05,图13A),细胞凋亡率(P<0.05,图13B)、cleaved-caspase3蛋白、caspase-PARP表达量降低(图13C)。

图13 A:MTT法检测细胞活力(**P<0.05);B:Western blot检测HepG2细胞凋亡相关蛋白的表达;C: 流式细胞术检测HepG2细胞凋亡
3 讨论
肝癌的发病机制涉及到多种致癌因素,包括激活原癌基因、信号通路的改变及多种因子的诱导和改变等[7,8],但目前仍处于探索阶段。Akirins已被确定为一组高度进化保守的核因子。至少有两个Akirin家族成员,名为Akirin1和Akirin2,而Akirin2是14-3-3β的功能伴侣,在多种癌细胞系过表达[9,10],有研究显示在大鼠乳腺癌、肺癌及胶质瘤细胞中Akirin2基因具有致癌功能[11-13]。Akirin2敲减基因细胞在小鼠模型中表现出肿瘤生长缓慢和较少的肿瘤转移[14],这些结果均表明,Akirin2基因可能是多种癌症的癌基因。因此有必要探究其与肝癌是否存在联系。我们在临床肝癌患者癌组织中发现,Akirin2呈现高表达,且Akirin2高表达患者生存率和生存时间都较低表达患者低,这提示Akirin2可能与肝癌存在密切联系。因此我们将进一步研究二者的关系。
我们通过体外实验研究发现,Akirin2转染显著改变了HepG2肝癌细胞增殖和凋亡情况。而癌症在很大程度上被视为一系列无限制增殖的疾病,在各种类型的侵袭性肿瘤中,高增殖指数通常伴随着高凋亡指数[15]。细胞凋亡可激活caspases信号通路。而cleaved-caspase、cleaved-PARP是测量肿瘤细胞凋亡的重要标记物。长期以来,避免细胞凋亡的能力一直被认为是恶性和恶性前期细胞的重要后天特征。因此,抗凋亡途径已被确定为恶性疾病的重要途径[16]。我们继续研究发现Akirin2过表达显著增加了HepG2肝癌细胞增殖、抑制了细胞凋亡,Akirin2过表达显著降低了cleaved-caspase、cleaved-PARP蛋白的表达,Akirin2抑制显著增高了cleaved-caspase、cleaved-PARP蛋白的表达,这些结果表明Akirin2可能参与了caspase激活途径的肝癌细胞凋亡,进而影响了肝癌的发生和发展。
知母作为祖国医学传统中药,具有滋阴降火、润燥滑肠的作用,常用于阴虚内热证,具有抗炎和解热的作用[17,18]。TA-Ⅲ是知母的重要有效成分,可抑制肿瘤细胞增殖,被认为可诱导自噬和随后的线粒体依赖性凋亡细胞死亡,其病理机制是引起活性氧(ROS)的产生增加和相关的线粒体功能障碍[19,20],其介导的细胞死亡可能涉及mTOR通路的破坏。而调节细胞增殖和凋亡已成为抗癌研究的重要药物靶点。本研究发现TA-Ⅲ抑制HepG2肝癌细胞增殖,诱导其凋亡,并呈现浓度、时间依赖性。这表明TA-Ⅲ具有良好的抗肿瘤作用,同时我们还发现肝癌细胞给予TA-Ⅲ后,Akirin2蛋白表达显著下降,而我们之前的结果已经证明Akirin2蛋白高表达会增加细胞增殖、减少其凋亡。这提示Akirin2蛋白有可能是TA-Ⅲ诱导HepG2肝癌细胞凋亡的潜在靶点。因此我们再继续研究证明这一结论发现,当Akirin2过表达后,TA-Ⅲ对HepG2肝癌细胞的增殖情况、细胞凋亡率、cleaved-caspase、cleaved-PARP蛋白的表达部分被逆转,这些结果进一步表明,Akirin2可能参与TA-Ⅲ抑制肿瘤细胞增殖和诱导凋亡的作用的过程,并提示下调Akirin2可能是治疗肝癌的可行性策略。
综上所述,在肝癌中Akirin2呈现高表达水平,TA-Ⅲ可抑制肝癌细胞增殖并促进凋亡,这可能是TA-Ⅲ通过抑制Akirin2表达进而诱导细胞凋亡,希望这一发现能为肝细胞癌的治疗和机制研究提供线索。

