微RNA-30d-5p通过调控ABCB5对胰腺癌进程的影响
郑坚江,阿木提江·马合木提,郭磊,刘跃全,张涛
作者单位:新疆维吾尔自治区人民医院胰腺外科,新疆维吾尔自治区 乌鲁木齐 830001
胰腺癌(pancreatic adenocarcinoma, PAAD)是消化系统的高度恶性肿瘤。其中位生存期为3~6个月,5 年生存率低于5%。尽管手术切除和辅助用药的治疗效果已经取得了进展,但胰腺癌的生存率在过去几十年中并没有明显提高[1]。最新流行病学调查报告称,胰腺癌是全球第12位最常见的肿瘤和第4 位肿瘤杀手。在中国,胰腺癌的发病率逐年增加。胰腺癌早期的非典型症状和缺乏敏感的肿瘤生物标志物导致失去最佳手术机会。寻找高度特异性和有效的胰腺癌生物标志物以提高手术切除率是当务之急[2-3]。除了临床和病理预测因素外,胰腺癌的分子亚型也越来越受到重视。分子谱分析技术揭示了癌基因和抑癌基因对癌症发展、转移模式、治疗反应和预后的影响。
微RNA(miRNA)是小的非编码RNA分子(包含约22个核苷酸),在 RNA 沉默和基因表达的转录后调控中发挥作用。它通过与靶基因结合的方式以调节基因表达,在癌细胞的增殖、凋亡和转移中起关键作用[4-5]。最近,发现许多miRNA在人类恶性肿瘤中失调,包括肺癌、乳腺癌、结肠癌和胰腺癌等[6-8]。最近研究发现miR-30d-5p 在不同的病理条件下异常表达,例如癌症和炎症[9-10]。先前的研究已经证实miR-30d-5p 在多种癌症中表达下调[11-12]。然而,miR-30d-5p 在胰腺癌中的潜在机制尚未得到充分证实。
生物信息学分析表明miR-30d-5p 和ABCB5 之间存在相互作用。ABCB5 作为ATP 结合盒(ABC)转运蛋白的主要成员,可以维持干细胞的休眠状态,降低细胞对外界物理和化学刺激的敏感性。它已被确定为恶性黑色素瘤衍生细胞的分子标志物[13]。ABCB5 的敲低显著抑制了荷瘤小鼠的肿瘤体积[14-15]。但miR-30d-5p 和ABCB5 之间的相互关系在胰腺癌中尚未报道。本研究收集了胰腺癌样本,以揭示miR-30d-5p 在影响其临床特征中的作用。本研究试图探讨ABCB5 在胰腺癌发展中的作用及其与miR-30d-5p 的关系,为胰腺癌的生物标志物筛选及靶向治疗的开发提供依据。
1 资料与方法
1.1 一般资料选取2016 年12 月至2019 年1 月来新疆维吾尔自治区人民医院接受手术治疗的胰腺癌病人35例,术后即刻获得胰腺肿瘤组织和癌旁非肿瘤组织(距离癌组织>3 cm)。其中男性21 例,女性14 例;年龄(58.6±13.7)岁(范围为22~71 岁)。组织学分级包括低分化13 例、中分化14 例、高分化9例。根据国际抗癌协会(union for international cancer control,UICC)进行分期:Ⅰ~Ⅱ期17 例,Ⅲ期18例。无淋巴结转移24 例,有淋巴结转移11 例。病人术前未接受任何化疗、放疗或免疫治疗,所有病理学诊断均由2 名以上的病理科医生(主治医师以上)进行确认。手术切除后,将组织冷冻在液氮中直至使用。病人或其近亲属对研究方案签署知情同意书。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 细胞培养人胰腺癌细胞系(CFPAC-1,SW1990,Capan-1 和PANC-1)和正常胰管上皮细胞系(HPDE)购自于北京北纳生物有限公司。所有细胞均放置在含有5% 二氧化碳的标准加湿培养箱中在37 ℃环境下在含有10%胎牛血清(Gibco,美国,10099-141)的RPMI-1640培养基中培养。
1.3 细胞转染使用Lipofectamine®3000 试剂(Thermo Fisher Scientific,美国,L3000-015)在说明下进行转染。miR-30d-5p mimic 和NC 购自GenePharma(中国上海)。为了确认转染效率miR-30d-5p,细胞分为三组:对照组,未转染的细胞;NC 组,细胞转染NC;miR-30d-5p mimic 组,细胞转染miR-30d-5p mimic。NC 序列:5'-GUGUAACACGUCUAUACGCCCA-3' 和 miR-30d-5p 模拟序列:5'-CAUAAAGUAGAAAGCACUACU-3'。ABCB5 过表达载体 pcDNA3.1-ABCB5 和pcDNA3.1 空白载体由吉凯基因(中国上海)生产。为了确认ABCB5 的转染效率,将细胞分为三组:对照组,未转染的细胞;pcDNA3.1 组,用pcDNA3.1 转染细胞;pcDNA3.1-ABCB5,用pcDNA3.1-ABCB5转染细胞。
1.4 实时荧光定量PCR(qRT-PCR)根据试剂盒的方案,本研究使用TRIzol®RNA 分离试剂(Invitrogen,美国,R0016)从肿瘤组织和细胞中提取总RNA。然后,mRNA 使用High Capacity cDNA Reverse Transcription 转录为cDNA。根据制造商的方案,使用SYBR Green PCR Master Mix(Takara,日本,QPK-201)进行qRT-PCR 分析。对于miRNA 检测,U6 作为检测的内参基因。为了检测mRNA,使用GAPDH 作为内参基因用于检测。下面列出了引物序 列 :miR-30d-5p 正 向 引 物 :5'-CAUAAAGUAGAAAGCACUACU-3' 和反向引物:5'-UAGUGCUUUCUACUUUAUGUU-3';U6 正向引物:5'-CCTGGCACCCAGCACAAT-3' 和反向引物:5'-TGCCGTAGGTGTCCCTTTG-3';ABCB5 的正向引物:5'-TCAGAGAAATGGAACTGCAGAAGA-3' 和反向引物: 5'-AAGGAAGGCAGGCTCCATTG-3'; GAPDH 正向引物:5'-AACAGCAACTCCCACTCTTC-3'和反向引物:5'-CCTGTTGCTGTAGCCGTATT-3'。循环条件如下:95 ℃初始变性10 min,随后95 ℃ 10s、55 ℃ 10 s和72 ℃ 30 s 40个热循环。最后在72 ℃延伸10 min。采用2-ΔΔCt法对基因表达进行相对定量。
1.5 蛋白质印迹法使用蛋白提取试剂(50 mmol/L Tris HCl,pH 7.4; 120 mmol/L 氯化钠; 1%Nonidet P-40; 0.25%脱氧胆酸盐; 0.1%十二烷基硫酸钠)提取蛋白质。然后使用BCA 蛋白测定试剂盒对样品蛋白质浓度进行标准化。将蛋白质提取物均等地加到10%SDS聚丙烯酰胺凝胶上,进行电泳,然后转移到硝基纤维素膜上。用5%脱脂牛奶的PBS 封闭后,用相关一抗ABCB5(1∶1 000)孵育过夜,然后是辣根过氧化物酶结合的二抗(Santa Cruz Company)。通过化学发光底物试剂盒(Millipore Company,美国)检测条带吸光度。
1.6 双萤光素酶报告基因检测通过RT-PCR扩增了人ABCB5 基因的3'非翻译区。 突变体的构建也是通过用定制的合成3'-UTR DNA 替换3'-UTR而产生的。通过双萤光素酶报告系统(Promega,美国)测量海肾和萤火虫萤光素酶的活性。根据制造商的说明,所有的瞬时转染均使用Lipofectamine 3000(Invitrogen,美国,L3000-015)进行。
1.7 细胞活力和增殖分析通过CCK-8 试剂盒来确定细胞活力。按照制造商的操作说明,各处理组在转染处理后检测相关细胞增殖情况。
1.8 细胞凋亡检测各组在培养48 h后采集细胞,并在避光条件下使用100 μL 的细胞培养基中加入5 μL Annexin V FITC 和5 μL 碘化丙啶进行染色。经过20 min 的孵育后,利用流式细胞仪(FACScan,美国)测定细胞凋亡率。
1.9 MiRNA 靶基因位点预测TargetScan(http://www.targetscan.org)数据库用于预测miR-30d-5p 和ABCB5的靶向位点和结合序列。
1.10 裸鼠成瘤实验5周龄的雄性BALB/c 裸鼠购自上海实验动物公司(上海SLAC 公司,GX1347)。将稳定表达miR-30d-5p 模拟物及ABCB5 过表达的5.0×106PC 细胞皮下注射到裸鼠前腿下方的皮肤上。在16 d 内观察小鼠的肿瘤形成。 然后处死小鼠,并确定每个肿瘤的体积及质量。
1.11 统计学方法数据分析采用SPSS 22.0 软件进行分析,定量数据采用±s表示。两组间比较采用配对t检验。三组及三组以上的数据采用单因素方差分析(one-way ANOVA),事后采用Tukey 法进行两两比较,检验水准为0.05。
2 结果
2.1 MiR-30d-5p 在胰腺癌组织中低表达微阵列分析显示 miR-30d-5p 是胰腺癌组织中下调幅度最大的 miRNA,此外我们通过TCGA 数据库验证了miR-30d-5p 在肿瘤组织中显著下降(图1)。我们对miR-30d-5p 的预后验证了低表达与不良预后显著相关。QRT-PCR 检测发现,与正常组织(1.03±0.17)相比,其在肿瘤组织中的表达(0.35±0.08)显著下降(t=66.79,P=0.003)。进一步与HPDE(0.98±0.18)相比,CFPAC-1,SW1990,Capan-1 和PANC-1 细胞系中miR-30d-5p 的表达(0.63±0.08、0.23±0.07、0.48±0.07、0.31±0.05)也显著降低(F=15.78,P=0.005)。

图1 微RNA-30d-5p在胰腺癌组织前10个差异表达微RNA热图
2.2 MiR-30d-5p 对胰腺癌细胞增殖能力的影响首先,与NC(1.12±0.07)相比,qRT-PCR 的结果证实转染后Capan-1(2.48±0.32)和PANC-1(2.84±0.29)细胞中 miR-30d-5p 的表达更高(t=7.83,P=0.004 和t=10.28,P=0.006)。同时,CCK-8检测显示细胞生长被miR-30d-5p 显著抑制(P<0.05)。同样,与NC(1.00±0.02)相比,miR-30d-5p 可减少Capan-1(0.36±0.17)和PANC-1(0.43±0.12)细胞集落数(t=36.30,P<0.001和t=35.61,P<0.001),见图2。
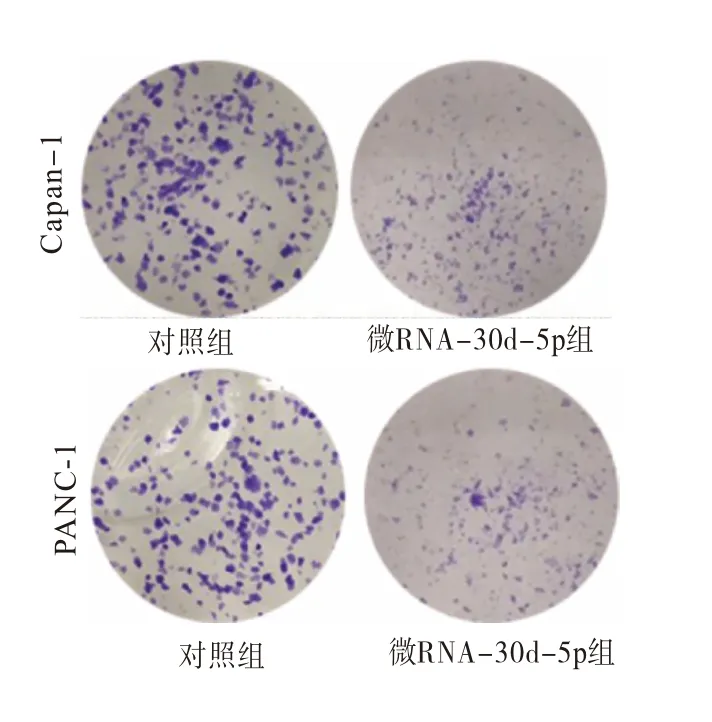
图2 集落形成检测转染微RNA-30d-5p后两种细胞的集落数情况(HE染色×200)
2.3 MiR-30d-5p 能够靶向ABCB5 发挥作用热图显示胰腺癌组织中mRNA 的差异表达,见图3。PC 组中ABCB5 的表达(2.73±0.28)明显高于正常组织(1.12±0.07)(t=41.25,P=0.003)。进一步检测胰腺癌细胞株中ABCB5 mRNA 和蛋白水平,与HPDE(1.328±0.162)相比,Capan-1(3.755±0.40)和PANC-1(3.545±0.24)细胞中ABCB5 mRNA 和蛋白水平均上调(F=233.20,P=0.003 和F=186.23,P=0.002),见图4。利用Targetscan 数据库预测(图5),本研究确定了ABCB5和miR-30d-5p之间的潜在相互作用位点。此外,萤光素酶报告实验表明,与阴性对照组相比,共转染ABCB5野生型和miR-30d-5p模拟物时,相对萤光素酶活性显著降低。

图3 ABCB5在PC中高表达并被微RNA-30d-5p靶向调控:A为TCGA mRNA分析的火山图;B为TCGAmRNA分析的热图
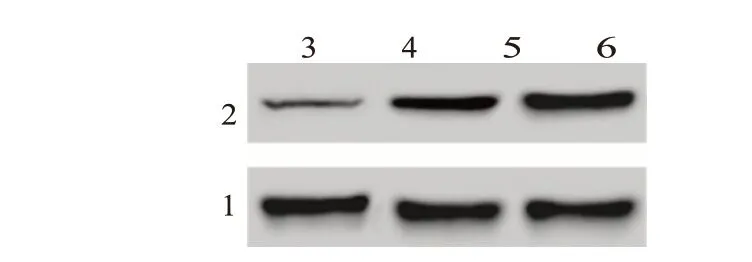
图4 蛋白质印迹法检测ABCB5的蛋白水平

图5 预测的miR-30d-5p和ABCB5之间的结合位点
2.4 MiR-30d-5p 通过靶向ABCB5 影响胰腺癌细胞的增殖、凋亡、迁移和侵袭与NC(1.14±0.08)比较,QRT-PCR 结果显示ABCB5 mRNA 表达水平在si-ABCB5 组(0.37±0.06)中的表达显著降低,而ABCB5 组(3.08±0.26)则促进了它的表达(F=559.90,P=0.003),见表1,图6。
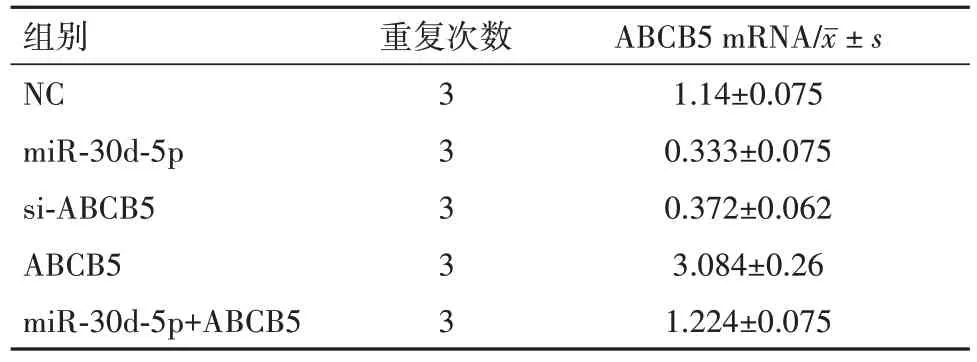
表1 ABCB5 mRNA在Capan-1细胞系不同处理组中的表达
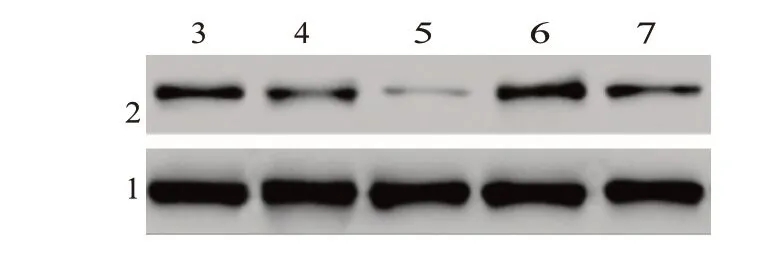
图6 蛋白质印迹法检测各处理组ABCB5蛋白的表达
细胞活力结果表明,转染si-ABCB5 或miR-30d-5p mimics 的肿瘤细胞增殖被显著抑制,而ABCB5组的细胞增殖能力显著增强;而当miR-30d-5p mimics 的共同转染则逆转了ABCB5 对细胞增殖的促进作用(F=473.60,P=0.004)。细胞凋亡试验显示,miR-30d-5p mimic组和si-ABCB5组的细胞凋亡率显著高于NC 组,而ABCB5组的凋亡率显著降低;而当miR-30d-5p mimics 的共同转染则逆转了凋亡趋势(F=90.43,P=0.005)。
划痕和Transwell 实验表明,ABCB5 组促进了Capan-1 细胞的迁移和侵袭,而 miR-30d-5p 转染能够逆转ABCB5 对迁移及侵袭的影响(F=155.50,P=0.005),见图7。最后在PANC-1 细胞中我们进行了同样的重复验证,结果趋势与Capan-1 细胞中出现的趋势是相同的(图8;表2,3)。
表2 ABCB5 mRNA 在PANC-1细胞系不同处理组中的表达及蛋白水平比较/± s
表2 ABCB5 mRNA 在PANC-1细胞系不同处理组中的表达及蛋白水平比较/± s
组别NC miR-30d-5p si-ABCB5 ABCB5 miR-30d-5p+ABCB5重复次数3 3 3 3 3 ABCB5 mRNA 0.793±0.079 0.238±0.008 0.262±0.004 2.162±0.101 0.865±0.016 ABCB5 mRNA蛋白表达1.110±0.053 0.440±0.040 0.400±0.044 2.767±0.119 1.263±0.108
表3 PANC-1细胞系不同处理组闭合创面的细胞迁移情况及侵袭细胞数量比较/± s
表3 PANC-1细胞系不同处理组闭合创面的细胞迁移情况及侵袭细胞数量比较/± s
处理组NC miR-30d-5p si-ABCB5 ABCB5 miR-30d-5p+ABCB5重复次数3 3 3 3 3闭合创面/%43.153±5.967 27.720±4.035 29.820±5.087 79.123±5.614 47.363±2.456侵袭细胞数量2.490±1.050 2.230±1.000 2.440±1.110 2.390±1.053 0.138±0.055
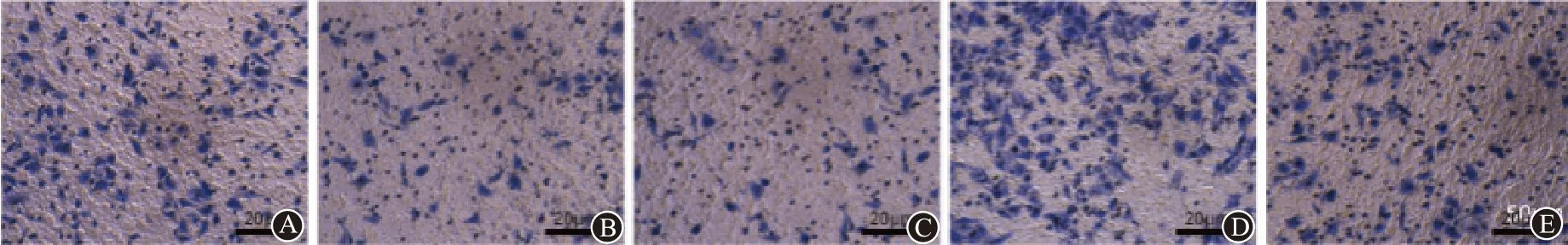
图7 Transwell侵袭试验各处理组细胞侵袭情况(MicroStackerTM法 ×200):A为NC;B为微RNA-30d-5p;C为si-ABCB5;D为ABCB5;E为微RNA-30d-5p+ABCB5
2.5 MiR-30d-5p 通过靶向 ABCB5 影响体内肿瘤生长本研究使用小鼠肿瘤模型验证了miR-30d-5p/ABCB5对胰腺导管腺癌的影响。结果显示,miR-30d-5p 组小鼠的肿瘤生长受到明显抑制,而ABCB5组则加速了肿瘤生长;然而,在同时转染miR-30d-5p和ABCB5的小鼠中,肿瘤生长情况与对照组相似(F=237.40,P<0.01),见图9A。同样地,在刺激后的30 d内,与相关对照组相比,miR-30d-5p组的肿瘤质量显著减少,而ABCB5 组则增加;然而,在NC 组和miR-30d-5p+ABCB5 组差异无统计学意义(F=458.0,P=0.663)。通过HE 和KI67 染色观察发现,转染ABCB5 cDNA 的细胞具有较强的转移能力,而转染miR-30d-5p 的细胞则表现出较低的转移能力。共转染 ABCB5和miR-30d-5p模拟物对PC细胞的转移无明显影响(图9B)。
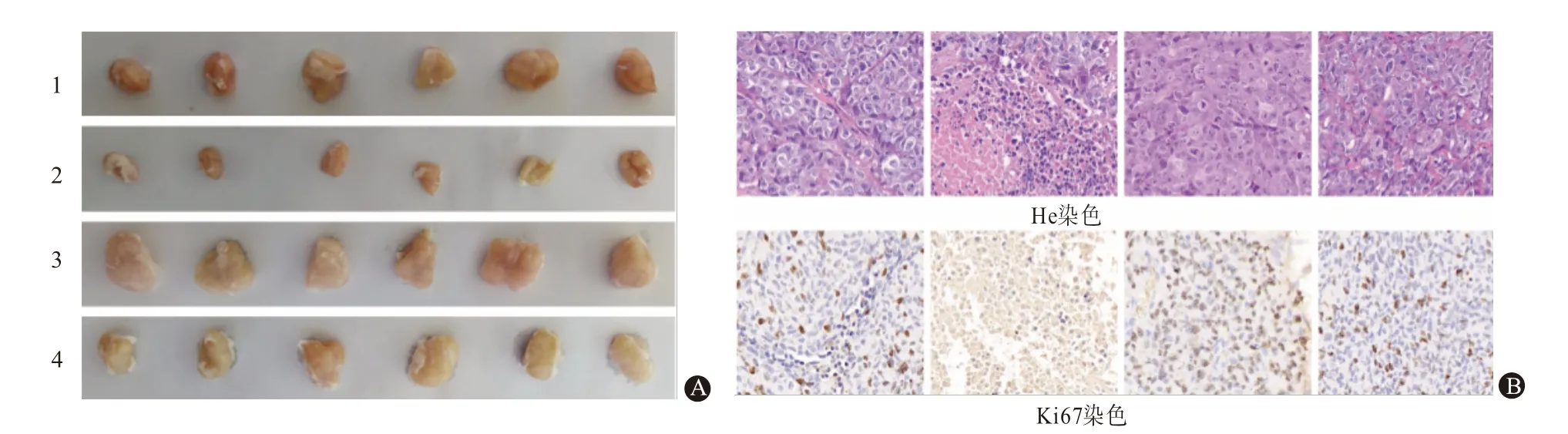
图9 微RNA-30d-5p通过阻断ABCB5抑制PC肿瘤生长和转移:A为从小鼠身上切除的肿瘤;B为小鼠肿瘤组织
3 讨论
MiRNA是小的非编码RNA分子,参与调节癌症进展中的细胞增殖、凋亡、分化、侵袭和迁移[16-19]。有研究表明miRNA 在胰腺癌中充当癌基因或肿瘤抑制基因[20-21]。研究表明,miR-30d-5p 过表达可能会抑制胰腺癌的生长[22]。在本研究中,我们的结果显示miR-30d-5p 在胰腺癌肿瘤组织中下调。此外,miR-30d-5p 过表达被证明可抑制胰腺癌细胞增殖并促进细胞凋亡,表明miR-30d-5p 在胰腺癌中起抑癌基因的作用。
众所周知,miRNA 通过降解靶mRNA 或抑制其翻译来调节基因表达。本研究假设miR-30d-5p 通过调节相应基因来调节胰腺癌细胞的生物学能力。迄今为止,已鉴定出几个miR-30d-5p 的靶基因,如CAVI 和GSTPI。基于我们之前的生物信息学分析,我们证明ABCB5是miR-30d-5p的靶基因之一,并且在胰腺癌组织中显著上调。为了进一步证实 miR-30d-5p 是否通过调节ABCB5 表达发挥关键的肿瘤抑制作用,我们分别用miR-30d-5p 和ABCB5 转染Capan-1 和PANC-1 细胞。结果表明,转染si-ABCB5或miR-30d-5p 的Capan-1 细胞活力明显受到抑制,而转染ABCB5 cDNA 的细胞活力增强;用ABCB5 cDNA 和miR-30d-5p模拟物转染的细胞的细胞活力改变被逆转。最近有研究结果显示miR-30d-5p 在人恶性胸膜间皮瘤中能够显著抑制肿瘤的细胞增殖和迁移[23]。本研究中我们首次发现了miR-30d-5p 在胰腺癌中存在同样的作用。然而目前关于ABCB5 在肿瘤中的研究较少,郑天亮等[24]关注到ABCB5 在食管瘤放疗敏感性的作用;吴星也曾报道其在黑色素瘤中的作用[25]。本研究首次发现ABCB5 能够充当miR-30d-5p 的下游基因在胰腺癌治疗中同样扮演重要角色。这一猜想在进一步细胞凋亡试验中得到进一步佐证。随后,本研究通过Transwell 侵袭试验和伤口愈合试验测量miR-30d-5p/ABCB5 对Capan-1 和PANC-1 细胞体外侵袭和迁移能力的影响。结果表明,ABCB5 促进了细胞的迁移和侵袭,而miR-30d-5p 则显著抑制了他们的转移。我们的双萤光素酶报告基因检测验证了miR-30d-5p 能够靶向调控ABCB5 的表达。这些数据证实了miR-30d-5p 能够通过靶向调控ABCB5 的表达影响胰腺癌进展。
综上所述,本研究发现miR-30d-5p 通过调控ABCB5 的表达抑制PC 细胞的增殖、迁移和侵袭。这些结果为预测PC 的预后和治疗靶点提供了新的生物标志物。

