基于U937-NF-κB-Luc细胞系的阿达木单抗生物学活性快速检测方法的建立及验证
郭莎,贾哲,龙彩凤,黄璟,贺鹏飞,高洁,于传飞,徐刚领,刘万卉,王兰
1.中国食品药品检定研究院国家卫生健康委员会生物技术产品检定方法及标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室,北京 102629;2.烟台大学药学院,山东 烟台 264005
自身免疫性疾病是一类以局部或全身性异常炎性免疫反应为特征的炎性免疫性疾病,如类风湿关节炎(rheumatic arthritis,RA)、强直性脊柱炎(ankylosing spondylitis,AS)、银屑病(psoriasis,PS)。近年,自身免疫性疾病患病人数呈上升趋势,全球发病率在0.1%~0.3%之间[1-2]。用于治疗自身免疫性疾病的分子靶向药物中,以肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)为靶点的TNF-α抑制剂应用最广[3-4],其中美国艾伯维公司生产的阿达木单抗(adalimumab)是全球首个获批上市的靶细胞TNF-α 全人源单抗,适应证包括RA、AS、PS 等10 种疾病[5-6]。目前,国内已有6 款阿达木单抗类似药获批上市,且数量还在不断增多,给该制品的质量监管带来较大压力。
目前,阿达木单抗生物学活性的检测方法大多采用以L929 细胞为基础的TNF-α 中和活性法[7-11],该方法虽然可评估产品的有效性,但检测周期长达3 d;而基于转基因细胞的生物学活性测定方法具有灵敏度高、快速的优点[12-14]。U937-NF-κB-Luc 细胞是采用慢病毒方法建立的低背景、稳定表达NF-κB-Luc报告基因的细胞系[15-19],TNF-α可结合靶细胞表面的肿瘤坏死因子受体(tumornecrosisfactorreceptor,TNFR),刺激NF-κB 下游通路,通过激活荧光素酶的表达而产生荧光信号,阿达木单抗与TNF-α 结合后可拮抗上述过程。基于上述原理建立的阿达木单抗生物学活性检测方法无需细胞贴壁培养及进行细胞增殖凋亡等表型判定,可大幅缩短检测周期。本研究旨在基于U937-NF-κB-Luc 细胞系建立一种用于评价阿达木单抗生物学活性的快速检测方法,并优化方法的TNF-α 浓度、抗体起始浓度、抗体稀释倍数、细胞接种量、孵育时间,验证方法的专属性、准确性及精密性等,同时与基于L929 细胞的TNF-α 中和活性检测方法进行比较,以期为阿达木单抗的生物学活性评价提供新的快速检测方法。
1 材料与方法
1.1 细胞 U937-NF-κB-Luc细胞系由中国食品药品检定研究院单克隆抗体产品室构建。
1.2 单抗 5 批阿达木单抗[包括阿达木单抗原研药(批号:16117XH01)和4种阿达木单抗生物类似药(批号:20201018、M1202007003、02A20201120、P2011009)]、英夫利西单抗、培塞利珠单抗、贝伐珠单抗、帕博利珠单抗和帕妥珠单抗均为中国食品药品检定研究院留样。
1.3 主要试剂 阿达木单抗和TNF-α 国际标准品均购自NIBSC;胎牛血清(fetal bovine serum,FBS)、胰酶、RPMI1640培养基及PBS均购自美国Gibco公司;Bright-Glo 及牛血清白蛋白(bovine serum albumin,BSA)均购自美国Promega 公司。
1.4 方法的建立 于96孔板中用稀释液(含10%FBS的RPMI1640 培养基)将阿达木单抗国际标准品进行2 倍系列稀释(以1 600 ng/mL 为起始浓度,共10 个稀释度),每个稀释度均设2 个复孔;加入终浓度为10 ng/mL 的TNF-α 国际标准品,混匀,即为体系溶液。用稀释液调整U937-NF-κB-Luc 细胞浓度,按等体积分数加入96孔板,细胞终浓度为4×104个/孔,37 ℃培养2 h 后,室温平衡15 min;加入等体积分数的Bright-Glo,室温避光反应5 min,用酶标仪读取相对光单位(relative light unit,RLU)数值。以阿达木单抗浓度对数为横坐标,对应的RLU 为纵坐标,选用四参数方程回归模型,拟合单抗的剂量-效应曲线,该曲线所得数据应符合四参数方程式:y=(A-D)/[1+(x/C)B]+ D,式中D 为最大浓度下的响应值,A 为最小浓度下的响应值,C 为半数有效浓度(median effective concentration,EC50),B为斜率。
1.5 方法的优化
1.5.1 TNF-α 浓度的确定 不加入阿达木单抗国际标准品,仅加入不同浓度的TNF-α 国际标准品(以160 ng/mL 为初始浓度进行2 倍系列稀释,共10 个稀释度),再加入U937-NF-κB-Luc 细胞,其他步骤同1.4 项。根据剂量-效应曲线确定线性部分靠近上平台区域的浓度,进行进一步优化。加入阿达木单抗国际标准品及确定浓度的TNF-α 国际标准品,再加入U937-NF-κB-Luc 细胞,混合孵育2 h 后检测RLU,并拟合四参数曲线,以产生较大激活作用的TNF-α浓度为最适浓度。
1.5.2 抗体起始浓度的确定 将阿达木单抗国际标准品起始浓度设为2 000 ng/mL,进行2倍系列稀释,共20个稀释度,其他步骤同1.4项。得到较宽范围的剂量-效应曲线,根据曲线的上、下平台及线性,部分浓度点的分布情况,选择可使曲线呈S 型,且点分布均匀的10个浓度的最高浓度为最适抗体起始浓度。
1.5.3 抗体稀释倍数的确定 以800 ng/mL 为阿达木单抗国际标准品起始浓度,分别进行1.5、2、3、4倍系列稀释,均设10 个稀释度,其他步骤同1.4 项。拟合以上4 条四参数曲线,选择剂量-效应曲线各点在上、下平台及线性段分布均匀的倍数为最适稀释倍数。
1.5.4 细胞接种量的确定 将U937-NF-κB-Luc细胞分别以8×103、2×104、4×104、6×104个/孔的终浓度加入96 孔板,其他步骤同1.4 项。拟合四参数曲线,并按D/A计算信噪比(S/N),S/N应≥10。选择各点在曲线上分布均匀,且S/N 最小时的细胞接种量为最适接种量。
1.5.5 孵育时间的确定 TNF-α 国际标准品与阿达木单抗国际标准品混合后,分别孵育0.5、1、2、3 h,其他步骤同1.4项。拟合四参数曲线,并计算S/N,S/N 应≥10。选择四参数曲线形态较好,且S/N最小的孵育时间为最适时间。
1.6 方法的验证
1.6.1 专属性 采用优化方法检测以TNF-α为靶点的阿达木单抗国际标准品、英夫利西单抗和培塞利珠单抗3 种治疗性单抗及非TNF-α 靶点的贝伐珠单抗(VEGF靶点)、帕博利珠单抗(PD1靶点)和帕妥珠单抗(HER2靶点)3种治疗性单抗,建立四参数拟合曲线。
1.6.2 准确性 将阿达木单抗国际标准品起始浓度点分别设为512、640、800、1 000 和12 500 ng/mL,以800 ng/mL 浓度为100%效价,即起始效价分别为64%、80%、100%、125%和156%。以100%效价样品作为参比品,采用优化方法检测效价,重复检测3 次。样品效价测定值的相对偏倚应在参比品的±12%范围内;以效价理论值对数为横坐标,其相应效价测定值对数为纵坐标进行直线回归,回归方程的斜率应在0.80~1.25范围内。
1.6.3 精密性 按1.6.2项方法制备64%、80%、100%、125%和156%效价的阿达木单抗样品,采用优化方法检测效价,重复检测3 次。以100%样品作为参比品,按下式计算相对效价,并统计分析几何标准偏差(geometric standard deviation,GSD)及其置信上限、几何变异系数(geometric coefficient of variation,GCV)及其置信上限,GCV应≤20%。
相对效价(%)=参比品EC50/样品EC50×100%
1.6.4 线性范围 按1.6.2 项方法制备64%、80%、100%、125%和156%效价的阿达木单抗样品,采用优化方法检测效价。以效价理论值对数为横坐标,其相应效价测定值对数为纵坐标,采用最小二乘法进行线性回归,直线回归方程的相关系数(R2)应≥0.98。
1.7 与其他检测方法的比较 采用优化方法及基于L929 细胞的TNF-α 中和活性法分别检测5 批阿达木单抗样品的相对效价,并进行比较。
1.8 统计学分析 应用SPSS 22.0软件进行统计学分析,组间比较采用t检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1 阿达木单抗国际标准品的剂量-效应曲线 阿达木单抗国际标准品的剂量-效应曲线呈典型的S 型,且所得数据符合四参数方程式,R2>0.99,见图1。
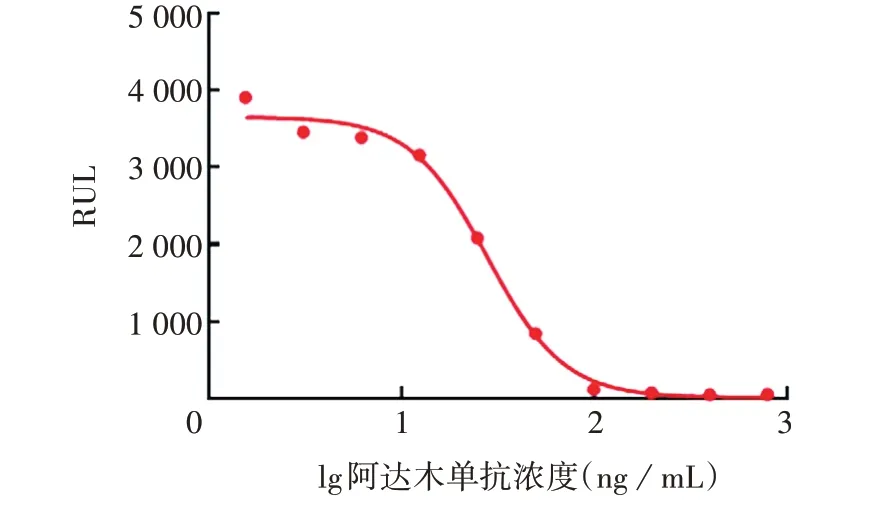
图1 阿达木单抗国际标准品的剂量-效应曲线Fig.1 Dose-response curve of adalimumab international standard
2.2 方法的优化
2.2.1 最适TNF-α浓度 不加阿达木单抗的情况下,根据TNF-α 诱导细胞凋亡的剂量-效应曲线,在40、20、10、5 ng/mL TNF-α诱导下,曲线接近上平台,即在这些浓度下能达到较大实验窗口。且在TNF-α 浓度为5 ng/mL 时,即可产生较明显的诱导细胞凋亡作用,见图2。因此选择5 ng/mL 的TNF-α 进行后续试验。
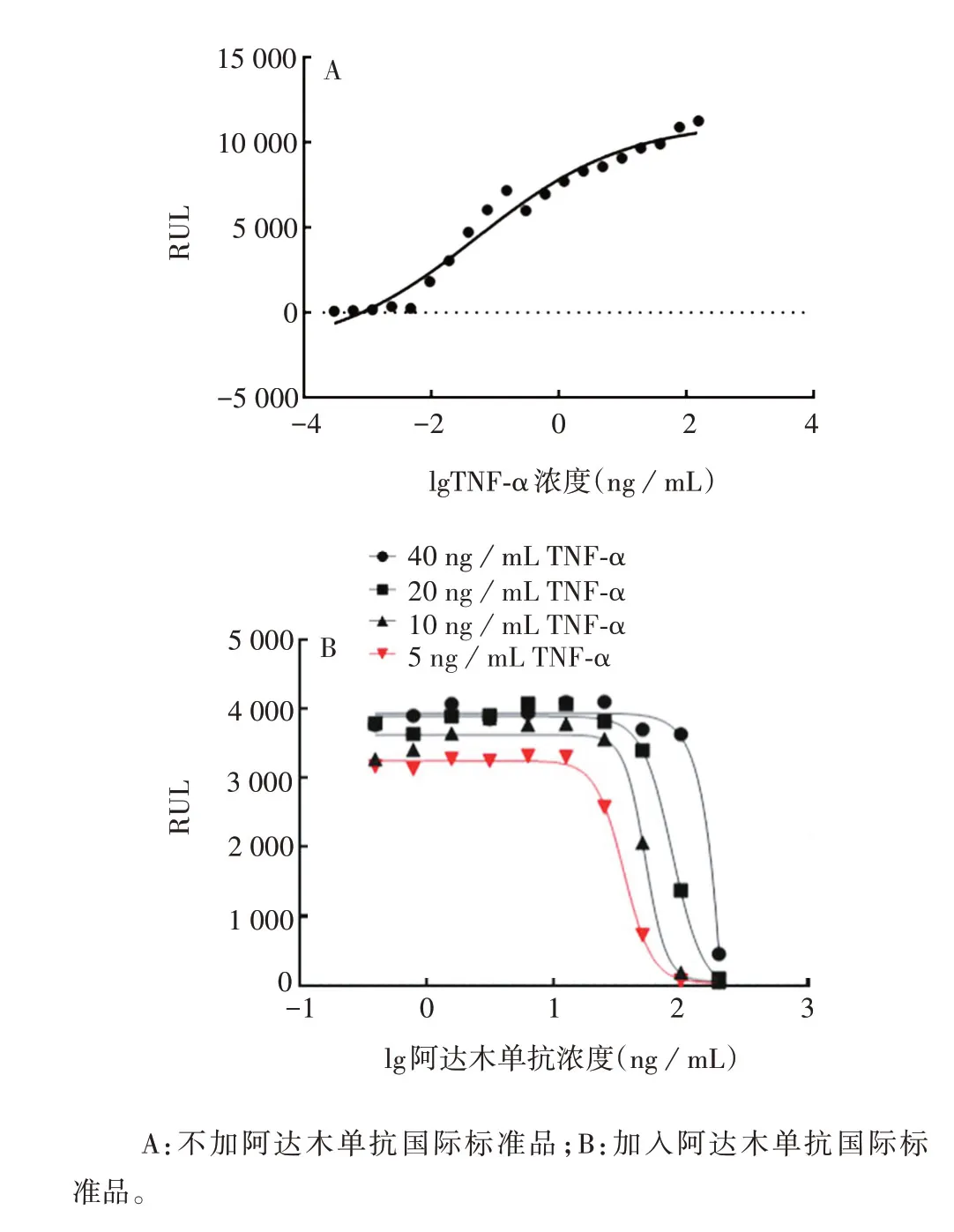
图2 TNF-α浓度的优化Fig.2 Optimization of concentration of TNF-α
2.2.2 最适抗体起始浓度 起始浓度为800 ng/mL时,曲线呈S 型,且各浓度点均匀分布于曲线的上、下平台及线性区域,见图3。因此确定最适抗体起始浓度为800 ng/mL。
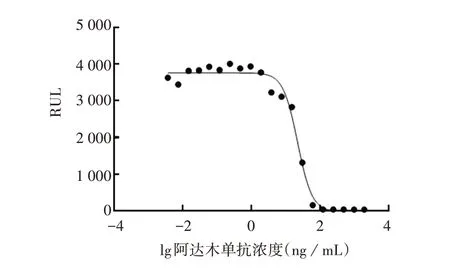
图3 阿达木单抗起始浓度的优化Fig.3 Optimization of initial concentration of adalimumab
2.2.3 最适抗体稀释倍数 1.5倍系列稀释的四参数拟合曲线无上平台,4倍系列稀释的四参数拟合曲线无下平台,二者均无完整四参数曲线形态;3倍系列稀释的四参数拟合曲线上平台过长,下平台过短;2倍系列稀释的四参数拟合曲线10个稀释浓度点均匀分布于曲线上,上下平台各3个浓度点,线性段4个浓度点。见图4。因此确定阿达木单抗最适稀释倍数为2倍。
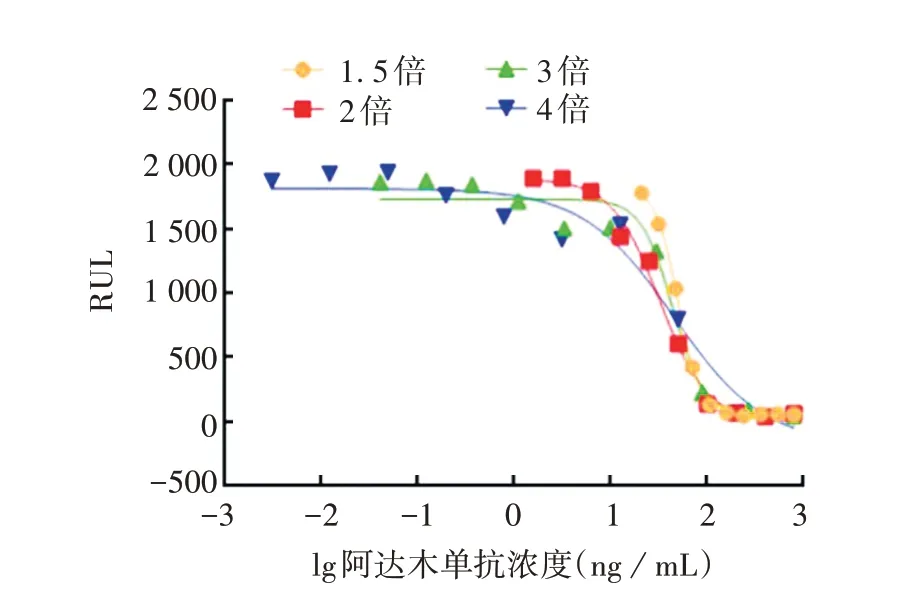
图4 阿达木单抗稀释倍数的优化Fig.4 Optimization of dilution multiple of adalimumab
2.2.4 最适细胞接种量 8×103、2×104、4×104、6×104个/孔细胞接种量的S/N 分别为34、53、114 和100,均>10。8×103个/孔的四参数曲线的S/N最小,且检测值较低,可产生较大变异;2 × 104、4 × 104和6 × 104个/孔的四参数曲线呈经典的S 型,各点在曲线上分布均匀。见图5。考虑到节约细胞用量,确定最适细胞接种量为2×104个/孔。
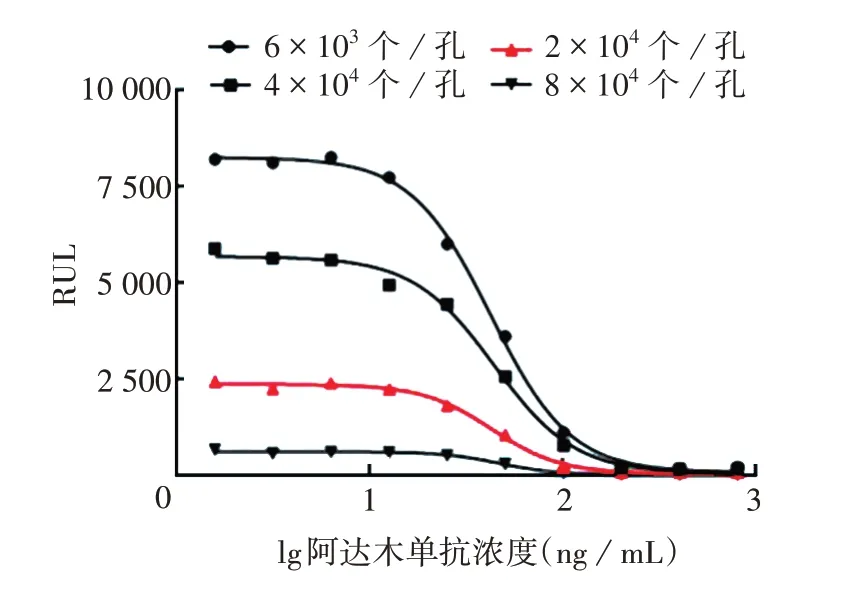
图5 U937-NF-κB-Luc细胞接种量的优化Fig. 5 Optimization of inoculation amount of U937-NF-κBLuc cells
2.2.5 最适孵育时间 孵育0.5、1、2 和3 h 的S/N分别为3、44、405、7 764,1、2 和3 h 的S/N 均>10,虽然1 h 的S/N 最小,但2 h 的四参数曲线形态较好,见图6。因此确定最适孵育时间为2 h。

图6 孵育时间的优化Fig.6 Optimization of incubation time
2.3 方法的验证
2.3.1 专属性 以TNF-α 为靶点的阿达木单抗国际参考品、英夫利西单抗和培塞利珠单抗3 种治疗性单抗均可获得较好的剂量-反应曲线,而其他非TNF-α靶点的治疗性单抗均未呈剂量反应,见图7。表明该方法具有较好的专属性。
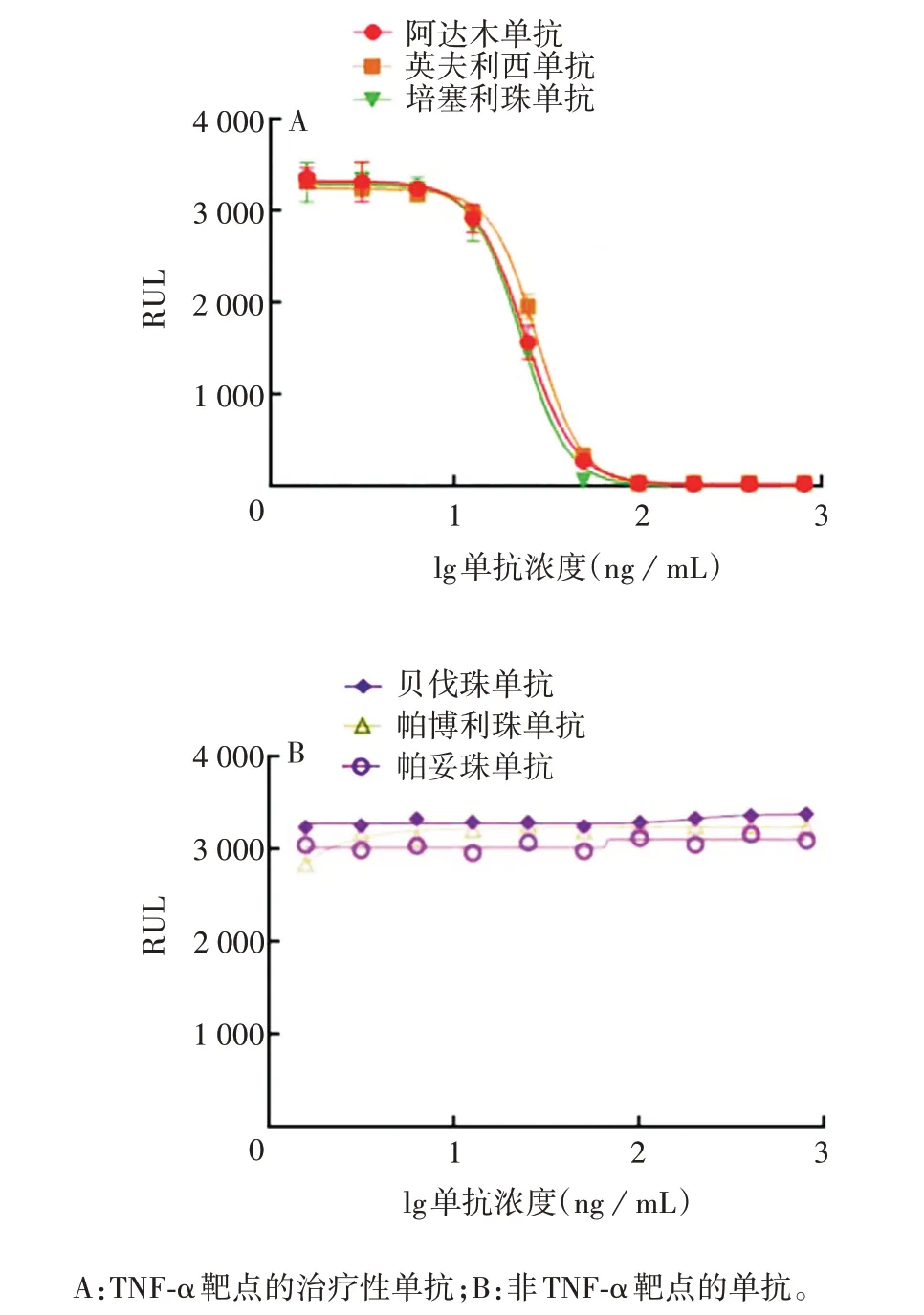
图7 专属性验证结果Fig.7 Verification for specificity
2.3.2 准确性 效价理论值对数与其实测值对数的直线回归方程为y= 1.037 4x- 0.023 7,斜率为1.037,在0.8~1.25 之间,相对偏倚均在± 12%范围内,见表1。表明该方法具有良好的准确性。
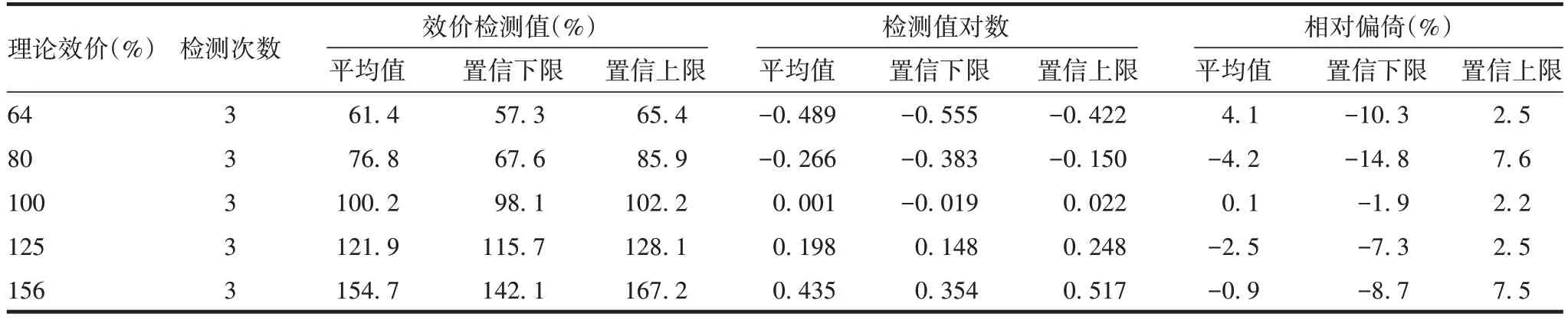
表1 准确性验证结果Tab.1 Verification for accuracy
2.3.3 精密性 各效价水平相对效价测定值的GCV均<20%,见表2。表明该方法具有良好的精密性。
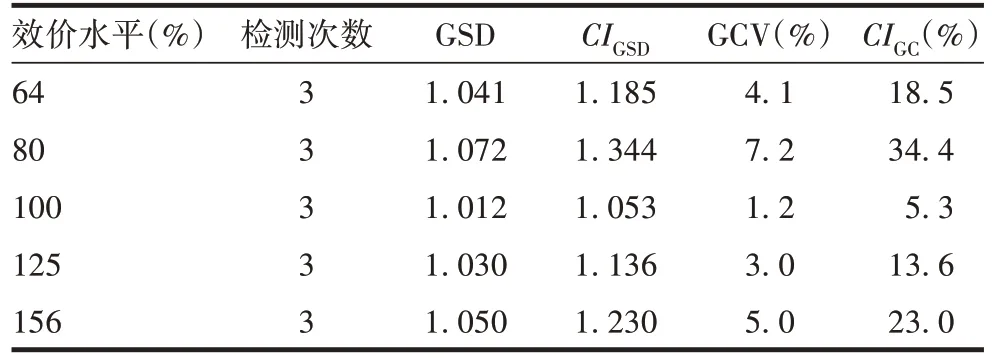
表2 精密性验证结果Tab.2 Verification for precision
2.3.4 线性范围 效价理论值对数与实测值对数的直线回归曲线见图8。理论效价在64%~156%范围内,与实测值呈良好的线性关系,拟合直线回归方程为y=1.037 4x-0.023 7,R2=0.998 4。
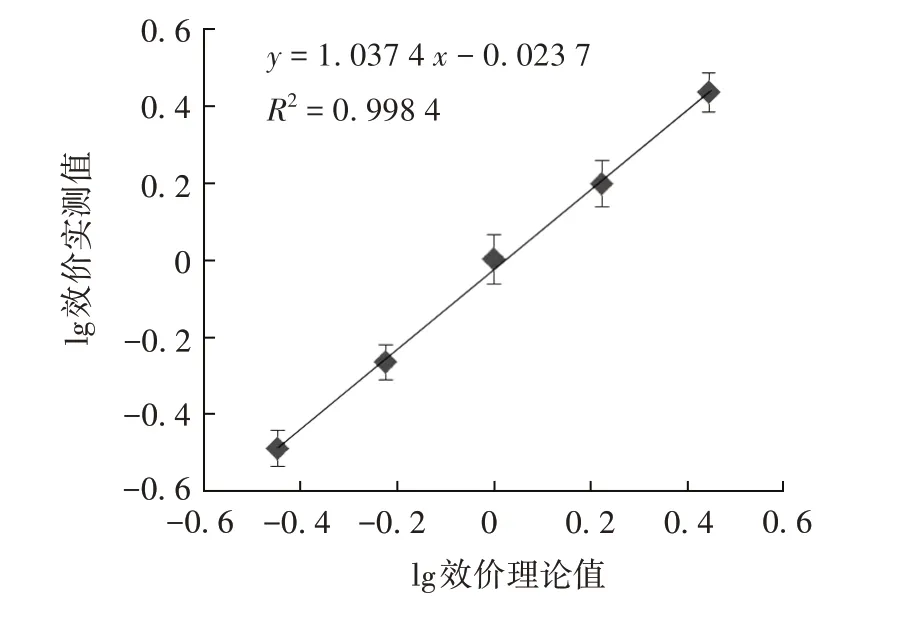
图8 效价理论对数值与实测值对数的直线回归曲线Fig. 8 Linear regression curve between logarithmic value of theoretical potency and logarithmic value of measured potency
2.4 与其他检测方法的比较 两种方法检测5 批阿达木单抗的相对效价检测结果差异无统计学意义(t= 1.198,P= 0.265 1),见图9。表明两种方法具有高度相似性和可替代性,优化方法可作为阿达木单抗生物学活性的快速检测方法。
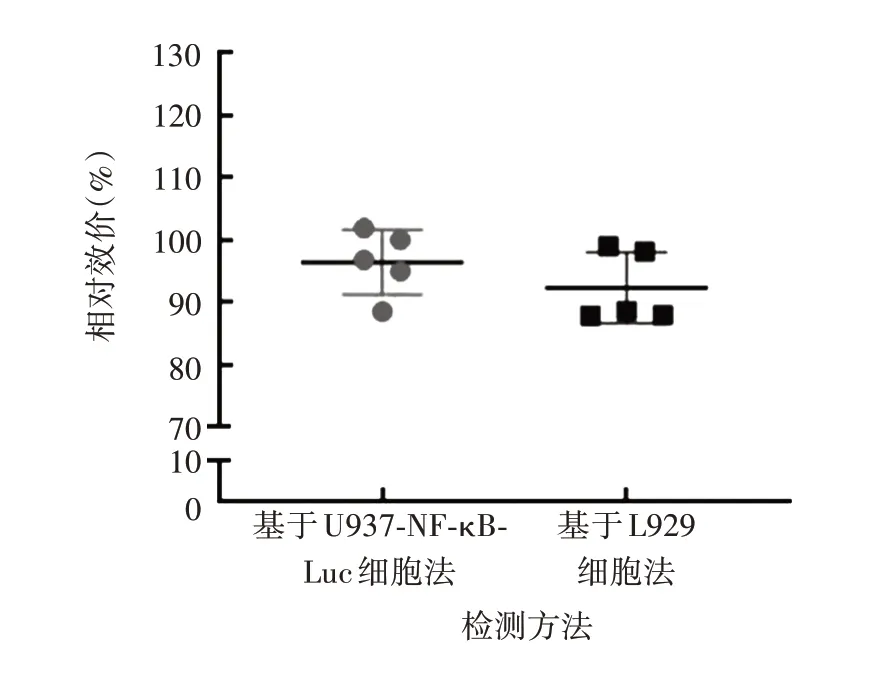
图9 两种方法检测5批阿达木单抗的相对效价Fig. 9 Determination of relative biological potency of five batches of adalimumab by two methods
3 讨论
TNF-α 的拮抗剂或其下游信号NF-κB 的抑制剂是治疗由于TNF-α 表达不受调控而引起免疫性疾病的一线治疗药物,药效良好[20-22]。目前,阿达木单抗原研药专利已到期,因此其生物类似药已成为制药行业的研发热点。生物学活性测定是对药物的有效成分、含量及药物效价的测定,是确保抗体类药物有效性的重要质控指标,也是最具特征的鉴别项目,能准确鉴别药物真伪及精确测定药物效价。TNF-α 中和活性检测法耗时较长,无法满足快速检测和即时甄别的需求[23-24],亟需建立一种快速和标准化的检测方法,以高效推进抽检工作,强化风险管理,提高药品监管效能。
在TNF-α 的作用下,U937-NF-κB-Luc 效应细胞随着NF-κB 信号的激活,荧光素酶的表达增加,因此,本研究在不加入阿达木单抗的前提下对TNF-α浓度进行优化,以达到其对NF-κB 信号的最大激活程度,结果表明,TNF-α 国际标准品浓度为5 ng/mL时可产生较大的激活细胞凋亡作用,因此本研究采用该浓度进行后续试验。
目前,以TNF-α 为靶标的抗体药物多采用基于L929 细胞的药物体外生物学活性检测方法,但该细胞模型的实验条件在不同实验室中差异较大,可能与关键试剂TNF-α的来源有关,不同来源的TNF-α本身活性不同,可引起剂量-反应曲线和EC50值产生较大差异,因此建立方法需要标准化关键试剂。另外,虽然生物类似药已完成相似性研究,但不同企业生产的阿达木单抗可能也不完全一致,为使建立的方法具有更广泛的通用性,本研究也采用NIBSC的阿达木国际标准品进行方法建立、优化及验证,不仅更易于对方法进行标准化,还提升了方法的可溯源性。
基于U937-NF-κB-Luc细胞的快速检测方法经优化后,确定最适检测条件:抗体起始浓度为800 ng/mL,抗体稀释倍数为2倍,孵育时间为2 h。参考《中国药典》三部(2020版)通则9401的要求进行方法验证[25],结果显示,3种TNF-α 靶点的治疗性单抗均可获得较好的剂量-反应曲线,而其他非TNF-α靶点的治疗性单抗均未呈现剂量反应,相对偏倚均在± 12%范围内;效价理论值对数与其实测值对数的直线回归方程为y=1.037 4x-0.023 7,R2=0.998 4;各效价水平相对效价测定值的GCV 均<20%。表明该方法具有良好的专属性、准确性、精密性、线性。采用优化方法及基于L929 细胞的TNF-α 中和活性方法分别检测5 批阿达木单抗的生物学活性,结果表明,两种活性方法检测结果差异无统计学意义(P>0.05),表明两种方法具有高度相似性和可替代性,且该方法耗时较短,仅需3 h,远短于基于L929 细胞的TNF-α 中和活性法(3 d),可作为补充方法以满足市场监管中即时性的需求。今后,将对该方法进行即用型方向的研究并建库,减少由于细胞代次不同导致的结果差异,使该方法充分发挥在药品检验及监管中的技术支撑作用。

