百日咳黏附素等电点全柱成像毛细管等电聚焦电泳检测方法的建立及验证
何鹏,王玲,张娜,张霖阳,吕溪琳,李世慧
北京生物制品研究所有限责任公司细菌类疫苗研究室,北京 100176
百日咳(pertussis,whooping cough)是一种由百日咳杆菌(Bordetella pertussis)引起的严重危害婴幼儿健康的烈性呼吸系统传染病。百日咳在发病早期不易诊断,但极具感染性,具有难以控制传染源及传播途径的特点,疫苗接种是最理想的防治手段。百日咳杆菌为革兰阴性菌,不仅产生内毒素和外毒素,还产生具有不同生物学活性的致病物质,包括百日咳毒素(pertussis toxin,PT)、丝状血凝素(filamentous haemagglutinin,FHA)、百日咳黏附素(pertactin,PRN)、百日咳菌毛蛋白(fimbriae,FIM)、腺苷酸环化酶(adenylate cyclase toxin,ACT)、气管毒素(tracheal cytotoxin,TCT)、皮肤坏死毒素(dermonecrotic toxin,DNT)和脂多糖(lipopolysaccharide,LPS)等。其中PT、FHA、PRN作为保护性抗原成分,已成为组分无细胞百日咳疫苗(acelluar pertussis vaccine,APV)及相关联合疫苗研发和生产中的主要成分[1-3]。
PRN 是百日咳杆菌的一种外膜表面相关蛋白,属于自转运蛋白家族,PRN 蛋白是由PRN基因编码的相对分子质量为93 000 的前体多肽,经水解酶切除信号肽后,成为相对分子质量为69 000 的成熟分子,具有Arg-Gly-Asp(RGD)三联肽结构,可促进百日咳杆菌对宿主细胞的黏附作用,使其侵入呼吸道黏膜纤毛上皮细胞和肺泡巨噬细胞,从而增强百日咳杆菌的侵袭力[4-7]。研究表明,含有PRN 抗原的APV能诱导更强的免疫保护力,因此,越来越多的疫苗研究机构与生产企业将PRN 抗原作为制备组分APV的重要抗原组分[8]。
蛋白类药物在生产、储存及运输过程中可能会产生蛋白分子的翻译后修饰、聚体或碎片,导致具有不同等电点(isoelectric point,pI)的蛋白变异体产生,因此,pI能够反映蛋白类药物电荷异质性,可体现蛋白质药物电荷与空间构象的均一性,同时可利用不同异构体pI 的差异对其进行分离和定量分析[9-12]。毛细管电泳作为表征生物大分子的重要实验技术,已广泛应用于生物制品的研发及质量控制[13-16],如蛋白药物的pI 测定、病毒颗粒的电荷异质性分析及mRNA 疫苗的表征[17-22]。全柱成像毛细管等电聚焦电泳(whole column imaging detection-capillary isoelectric focusing,WCID-CIEF)相较于平板等电聚焦电泳(isoelectric focusing electrophoresis,IEF)及毛细管等电聚焦电泳(capillary isoelectric focusing,CIEF),具有可实时观察样品在电泳过程中的聚焦分离情况、可及时调整聚焦时间和样品浓度等参数以及可提高前期建立及验证方法的效率等优点。本研究利用WCID-CIEF 建立测定PRN 抗原pI 的方法,并进行验证,以期为PRN抗原的pI测定及表征提供依据。
1 材料与方法
1.1 样品 3 批PRN 抗原由北京生物制品研究所有限责任公司菌苗室制备(批号:ACP20220431S01、ACP20220431S02、ACP20220431S03);PRN参考品购自中国食品药品检定研究院(批号:201606004)。
1.2 主要试剂及仪器 两性电解质Pharmalyte(pH:3-10)购自美国Cytiva 公司;尿素购自国药集团化学试剂有限公司;亚氨基二乙酸购自美国Sigma 公司;0.5%甲基纤维素、1%甲基纤维素、500 mmol/L 精氨酸、iCE 电极液(阳极液为含0.1%甲基纤维素的80 mmol/L 磷酸,阴极液为含0.1%甲基纤维素的100 mmol/L 氢氧化钠)、Maurice cIEF Fluorescence Calibration Standard、pI marker(4.05、5.85、7.05、9.50)和Maurice 系统适用性检测试剂盒(Letter:C)均购自美国Protein simple公司;Maurice毛细管电泳仪和Maurice CIEF 毛细管卡盒购自美国Protein simple 公司;台式微量高速冷冻离心机购自日本Hitachi公司。
1.3 WCID-CIEF
采用预制Maurice CIEF毛细管卡盒,卡盒内的毛细管内壁为氟碳涂层,内径100µm,有效长度5 cm,待测样品采用真空进样,进样时间55 s,预聚焦1 500 V,1 min;聚焦电压设置为3 000 V,聚焦时间依据样品分离效果进行调整,依据聚焦过程的全柱成像,可实时检测聚焦图谱。
1.3.1 系统适用性检测 取系统适用性检测试剂盒,运行系统适用性方法进行WCID-CIEF。
1.3.2 最佳聚焦时间的确定 取PRN抗原进行WCIDCIEF,运行通用方法,预聚焦电压1 500 V,时间1 min;聚焦电压设置为3 000 V,设置不同聚焦时间(1、2、3、4 min),依据样品聚焦过程及分离程度选择PRN抗原的最佳聚焦时间。
1.3.3 样品终浓度的选择 取PRN 抗原进行WCIDCIEF,设置150、225、300、375 µg/mL 共4 个体系样品终浓度梯度,依据峰高、分离度等条件选择上样终体系中最佳样品浓度。
1.4 方法的验证
1.4.1 专属性 将PRN 抗原背景缓冲液作为空白对照,以PRN 抗原及PRN 参考品作为待测样品,进行WCID-CIEF,验证方法的专属性。
1.4.2 准确性 将pI marker 5.85和pI marker 7.05作为待测样品,分别进行WCID-CIEF,每个pI marker重复测定6 次,计算6 次结果的平均值(mean)、相对标准偏差(relative standard deviation,RSD)及6 次结果平均值与理论值的相对偏差。
RSD(%)= 测定结果的标准偏差/测定结果的算术平均值×100%;
平均值与理论值的相对偏差=(测定结果的算术平均值-理论值)/理论值×100%
1.4.3 重复性 将PRN抗原作为待测样品,进行WCIDCIEF,测定其pI,以pI 值、出峰位置、峰面积(dropline)及各峰占比(面积百分比法)作为验证要素,重复测定6次,计算各要素测定结果的RSD。
1.4.4 中间精密度 将PRN 抗原作为待测样品,由不同实验人员于不同日期进行WCID-CIEF,重复测定6次pI,计算测定结果的RSD。
1.4.5 耐用性
1.4.5.1 不同物料批号 将PRN 抗原作为待测样品,使用不同批次毛细管卡盒、不同批次两性电解质进行WCID-CIEF,重复测定6 次pI,计算测定结果的RSD。
1.4.5.2 样品稳定性 将PRN 抗原于室温(25 ℃)条件下分别放置0、6、12、18、24 h 后进行WCID-CIEF,重复测定6次pI,计算测定结果的RSD。
1.4.6 批间一致性 分别将3 批PRN 抗原作为待测样品进行WCID-CIEF,重复测定6 次pI,计算测定结果的RSD。
1.5 数据采集及分析 使用Microsoft Excel 365软件进行数据统计分析,Compass for iCE 和Adobe Photoshop CS6软件绘图。
2 结果
2.1 WCID-CIEF
2.1.1 系统适用性 系统适用性检测得到5 个峰,pI分别为:3.380、6.062、6.355、9.992、10.170,依据Maurice cIEF COA(Letter:C,pI 5.85 Range:5.89 ~6.09;pI 6.14 Range:6.18 ~6.38)文件判定标准,结果符合测定标准。
2.1.2 最佳聚焦时间 PRN 抗原聚焦1和2 min 时未完全完成聚焦,3 min 完成聚焦,以后峰形保持不变。依据全柱实时成像及峰型分离效果,选择1 500 V 预聚焦1 min,3 000 V 聚焦3 min 为最佳聚焦时间。见图2。
2.1.3 样品终浓度 通过实时观察分析聚焦过程的电流及电压值、紫外吸收及自发荧光信号强度、紫外吸收及自发荧光信号强度下峰面积百分比等参数,确定体系中PRN 抗原终浓度为300µg/mL 时,峰形高度最佳(300 ~400 mAU),重复性及分离度较好。见图3。
2.2 方法的验证
2.2.1 专属性 PRN 抗原背景缓冲液无紫外吸收峰,PRN 抗原及参考品在pI marker 4.05 及pI marker 7.05间有4个峰出现,其主峰值即其pI分别为6.033和6.014,表明方法专属性良好。见图4。
2.2.2 准确性 pI marker 5.85 测定6 次结果的平均值为5.780,RSD为0.076%,平均值与理论值的相对偏差为1.197%;pI marker 7.05 测定6 次结果的平均值为7.194,RSD为0.020%,平均值与理论值的相对偏差为1.986%。见图5、图6 和表1。表明方法准确性良好。

表1 方法的准确性验证结果(pI)Tab.1 Verification for accuracy of method(pI)
2.2.3 重复性 PRN 抗原进行WCID-CIEF,聚焦完成共有4个峰,重复测定6次峰型叠图显示重现性良好,见图7;各峰pI 的RSD均小于0.05%,见表2。表明方法重复性良好。
表2 方法的重复性验证结果(pI)Tab.2 Verification for repeatability of method(pI)
2.2.4 中间精密度 不同实试验人员于不同日期测得PRN 抗原4 个峰pI 的RSD分别为0.033%、0.035%、0.038%和0.054%,见图8 和表3。表明方法中间精密度良好。
表3 不同实验人员于不同日期测定PRN 抗原的pI(±s,n=6)Tab.3 pI values of PRN determined by different experimenters on different days(±s,n=6)
时间第1天第2天RSD(%)峰1 5.584±0.001 5.586±0.002 0.033峰2 5.767±0.001 5.770±0.001 0.035峰3 6.035±0.002 6.031±0.001 0.038峰4 6.292±0.002 6.287±0.001 0.054
2.2.5 耐用性
2.2.5.1 不同批次毛细管卡盒 不同批次毛细管卡盒测得PRN 抗原4 个峰pI 的RSD分别为0.126%、0.087%、0.047%和0.071%,见图9 和表4。表明使用不同批次毛细管卡盒,方法耐用性良好。
表4 不同批次毛细管卡盒测得PRN抗原的pI(±s,n=6)Tab.4 pI values of PRN determined by capillary cartridges in different batches(±s,n=6)
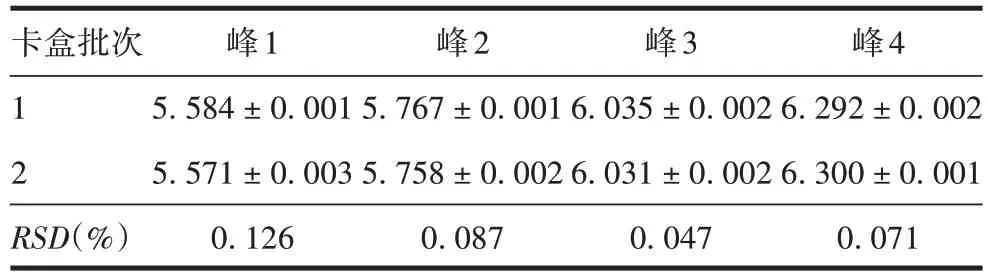
表4 不同批次毛细管卡盒测得PRN抗原的pI(±s,n=6)Tab.4 pI values of PRN determined by capillary cartridges in different batches(±s,n=6)
卡盒批次1 2 RSD(%)峰1 5.584±0.001 5.571±0.003 0.126峰2 5.767±0.001 5.758±0.002 0.087峰3 6.035±0.002 6.031±0.002 0.047峰4 6.292±0.002 6.300±0.001 0.071
2.2.5.2 不同批次两性电解质 不同批次两性电解质测得PRN 抗原4 个峰pI 的RSD分别为0.041%、0.017%、0.029%和0.034%,见图10和表5。表明使用不同批次两性电解质,方法耐用性良好。
表5 不同批次两性电解质测得PRN抗原的pI(±s,n=6)Tab.5 pI values of PRN determined by pharmalyte in different batches(±s,n=6)
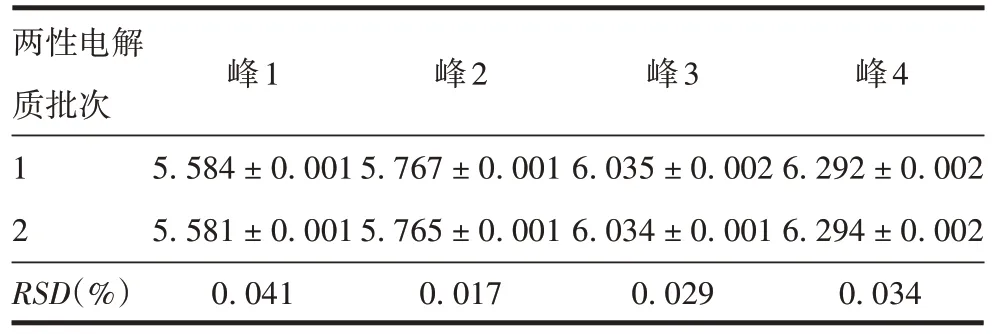
表5 不同批次两性电解质测得PRN抗原的pI(±s,n=6)Tab.5 pI values of PRN determined by pharmalyte in different batches(±s,n=6)
两性电解质批次1 2 RSD(%)峰1 5.584±0.001 5.581±0.001 0.041峰2 5.767±0.001 5.765±0.001 0.017峰3 6.035±0.002 6.034±0.001 0.029峰4 6.292±0.002 6.294±0.002 0.034
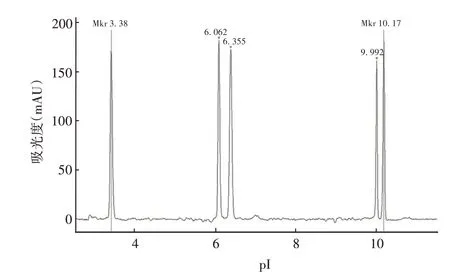
图1 系统适用性检测Fig.1 System suitability test
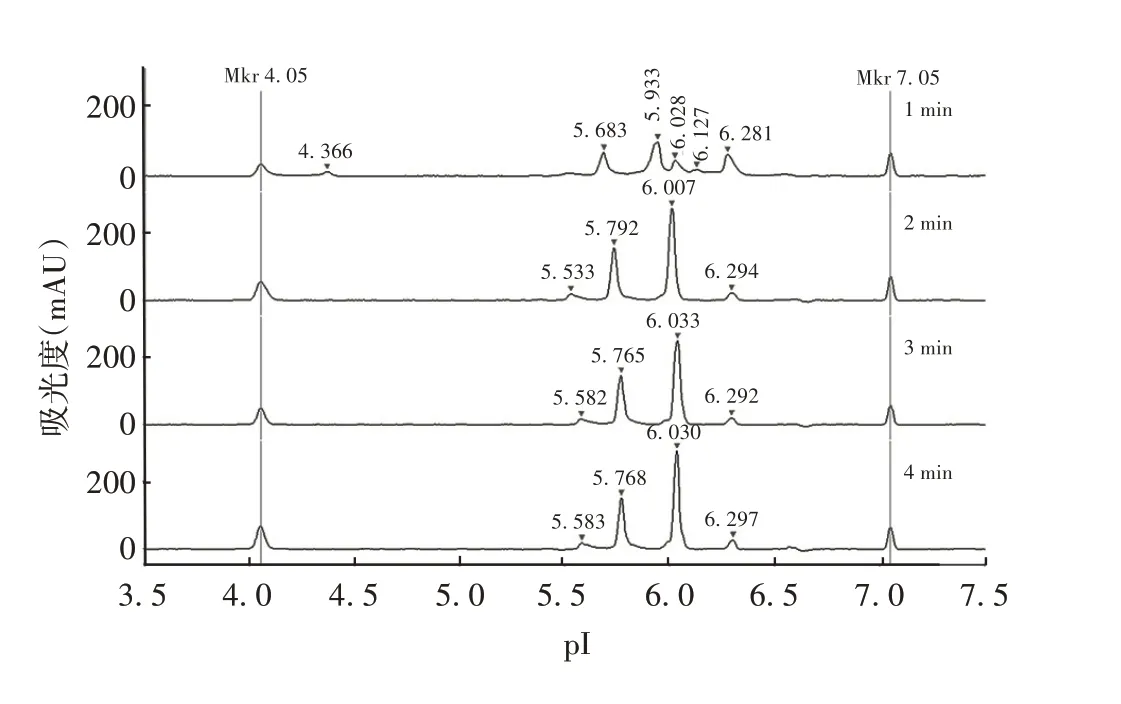
图2 不同聚焦时间对PRN抗原分离效果的影响Fig.2 Effect of focusing time on separation of PRN
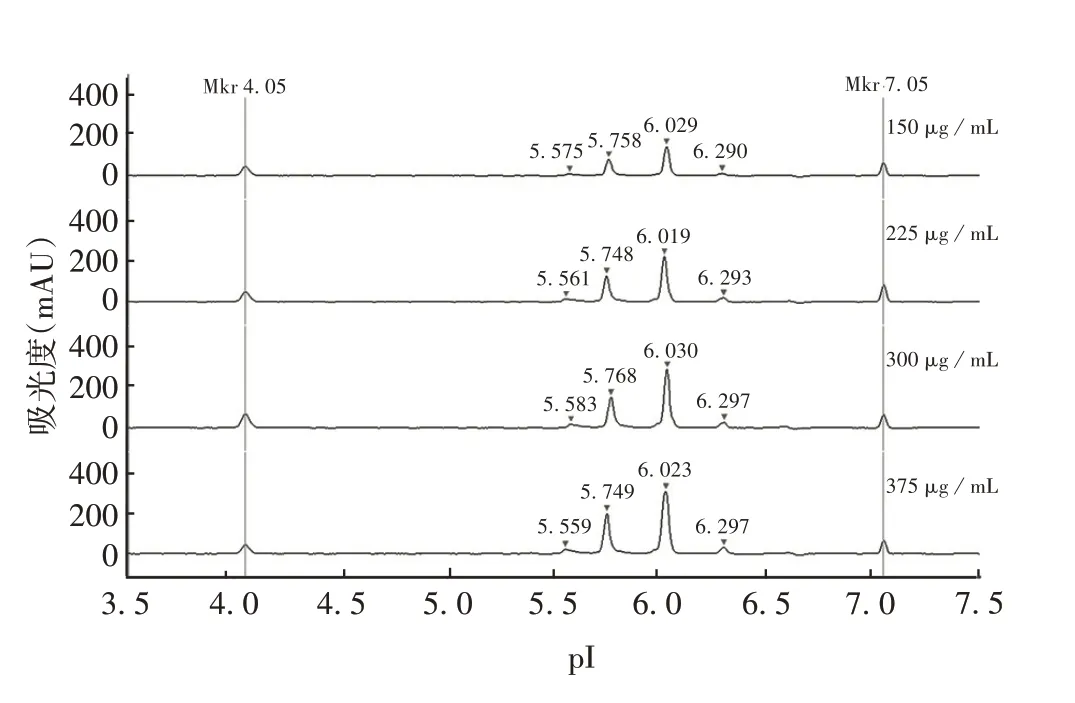
图3 不同样品终浓度对PRN抗原分离效果的影响Fig.3 Effect of sample final concentration on separation of PRN
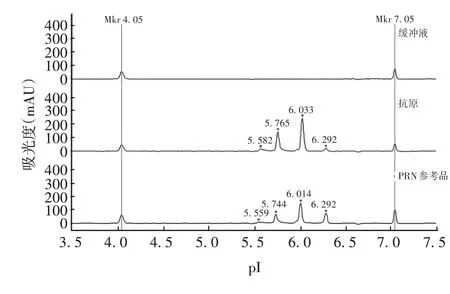
图4 WCID-CIEF的专属性验证Fig.4 Verification for specificity of WCID-CIEF
图5 pI marker 5.85测定叠图Fig.5 pI marker stacking diagrams of 5.85
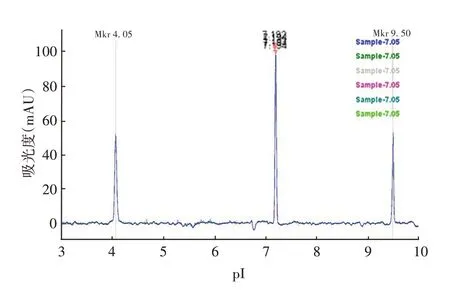
图6 pI marker 7.05测定叠图Fig.6 pI marker stacking diagrams of 7.05

图7 PRN抗原重复性验证叠图Fig.7 pI stacking diagrams of repeatability verification of PRN
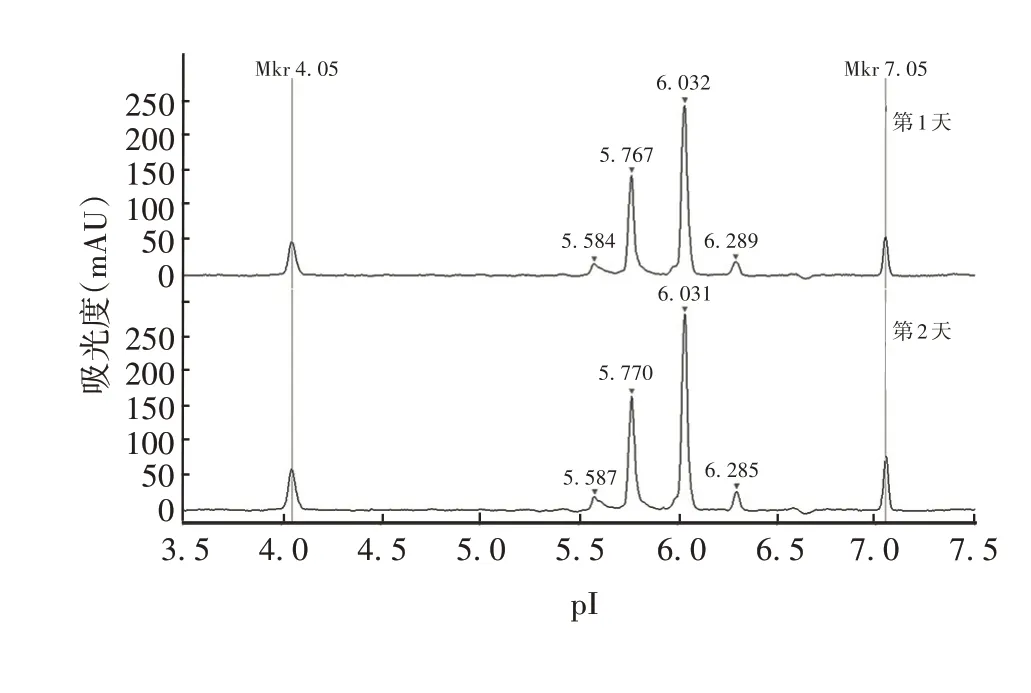
图8 PRN抗原中间精密度验证Fig.8 Verification for intermediate precision of PRN
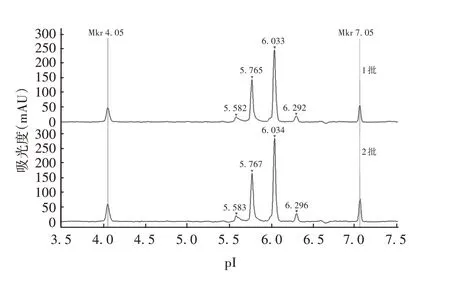
图10 不同批次两性电解质测定PRN抗原pI图谱Fig.10 pI map of PRN determined by pharmalyte in different batches
2.2.5.3 PRN 抗原稳定性 PRN 抗原于25 ℃放置不同时间测得4个峰pI的RSD分别为0.109%、0.079%、0.029%和0.039%,见表6。表明PRN 抗原于25 ℃放置0 ~24 h,抗原稳定性良好。
表6 PRN抗原于25 ℃放置0 ~24 h的pI(±s,n=6)Tab.6 pI values of PRN after storage at 25 ℃for 0 ~24 h(±s,n=6)
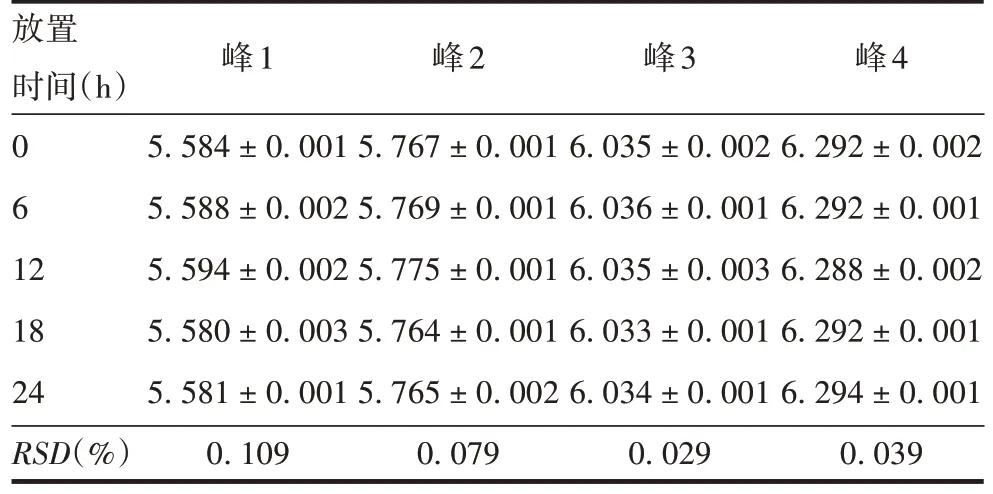
表6 PRN抗原于25 ℃放置0 ~24 h的pI(±s,n=6)Tab.6 pI values of PRN after storage at 25 ℃for 0 ~24 h(±s,n=6)
放置时间(h)0 6 12 18 24 RSD(%)峰1 5.584±0.001 5.588±0.002 5.594±0.002 5.580±0.003 5.581±0.001 0.109峰2 5.767±0.001 5.769±0.001 5.775±0.001 5.764±0.001 5.765±0.002 0.079峰3 6.035±0.002 6.036±0.001 6.035±0.003 6.033±0.001 6.034±0.001 0.029峰4 6.292±0.002 6.292±0.001 6.288±0.002 6.292±0.001 6.294±0.001 0.039
2.2.6 批间一致性 3 批次PRN 抗原均有4 个峰,3批间各峰pI的RSD分别为0.124%、0.073%、0.029%和0.122%,见表7。表明3 批PRN 抗原批间一致性良好。
表7 3批次PRN抗原的pI(±s,n=6)Tab.7 pI values of three batches of different PRN(±s,n=6)
抗原批次ACP2022-0431S01 ACP2022-0431S02 ACP2022-0431S03 RSD(%)峰1 5.584±0.001 5.582±0.006 5.595±0.004 0.124峰2 5.767±0.001 5.767±0.002 5.775±0.001 0.073峰3 6.035±0.002 6.034±0.002 6.036±0.001 0.029峰4 6.292±0.002 6.289±0.008 6.278±0.001 0.122
3 讨论
pI 是蛋白质的重要理化性质,每种蛋白质均有其特定的pI,能反应蛋白质的空间结构、均一性以及功能性结构的变化,准确测定蛋白质的pI 在蛋白质结构及功能等基础研究、蛋白质药物研发及表征等方面具有重要意义。CIEF 是一种根据蛋白质或多肽pI 不同而在毛细管内进行分离的电泳技术,对于两性分子pI 的测定可精确至0.01 个pH 单位,是蛋白质pI 测定、异构体分离及利用其他方法难以分离的蛋白质分析中强有力的工具之一[23]。WCID-CIEF是在CIEF 的基础上,结合全柱成像技术,通过实时记录样品的动态聚焦过程,以确定最佳聚焦时间,使得检测结果更加真实可靠,能够大幅提高样品的检测效率[24]。
不同于已有报道的融合蛋白疫苗、HPV 病毒样颗粒及脂质纳米颗粒包裹的mRNA 疫苗等样品的测定[18-21],本研究WCID-CIEF 过程中未添加尿素、甲酰胺、SimpleSol、烷基脲等样品稳定剂,PRN 抗原在体系中即能实现稳定聚焦。测定结果显示,PRN 抗原共有4个峰,其pI分别为5.584±0.001、5.767±0.001、6.035±0.002、6.292±0.002,主峰pI为6.035±0.002,与文献报道的应用IEF 测定值及其pI 理论值(6.0)接近[25-26]。
本研究建立了测定PRN 抗原pI 的WCID-CIEF方法,专属性验证结果显示,样品背景缓冲液无吸收峰出现;准确性验证结果显示,测定的平均值与理论值相对偏差均小于2%;方法的重复性、中间精密度及耐用性良好,PRN抗原pI的RSD均小于0.5%;3批PRN 抗原测定结果批间一致性良好。综上所述,本研究建立的方法适用于PRN 抗原pI 测定及表征,可为PRN抗原的分离纯化及质量控制提供参考。

