原油催化氧化脱硫用催化剂的制备及性能评价*
梁晓彤,李 博,屈世存
(1.杨凌职业技术学院,陕西 杨凌 712100;2.榆林碳氢研究院股份有限公司,陕西 榆林 719000)
燃料(如原油、柴油或汽油)废气排放浓度要求限值为10×10-6~15×10-6。然而,实现如此低的浓度被认为是炼油行业燃料脱硫和净化技术所面临的一个巨大挑战[1-4]。目前,有许多技术应用于燃料中硫的去除,例如选择性吸附、萃取分离、生物降解、加氢脱硫(HDS)和氧化脱硫(ODS)等技术可以帮助减少硫化合物在燃烧后转化为SOx的过程,从而减少黑色尾气中的颗粒物,保护环境,防止酸雨和全球变暖[5]。
HDS 通过氢解反应来减少脂肪族硫化合物,例如硫醇、硫化物和二硫化物,并消耗大量H2。尽管HDS 需要各种特定的工艺条件,但对于一些难以处理的含硫芳香化合物,例如苯并噻吩和噻吩,无法达到超低硫的结果[6,7]。
氧化脱硫(ODS)近年来引起关注,是因为其能够有效地处理芳香族硫化物,并且在温和的条件下运行,不需要H2。在温和的温度和压力下进行氧化脱硫需要使用不同的催化剂,是实现有效和快速ODS 过程的关键。在用于ODS 的金属中,CuO 纳米颗粒具有独特的光学、半导体、磁性和电学性质,而且是无毒材料,成本低且易得[8-11]。
活性金属通过湿法浸渍法加载在特定支撑材料上,以合成具有更高光吸收能力特别是具有SiO2支撑的催化剂,更适合用于ODS 过程的活性催化剂。如使用Cu-TiO2基催化剂进行ODS 反应,但这类催化剂需要支撑材料。考虑将SiO2与TiO2混合作为Cu 氧化物的支撑材料,以获得高效催化剂,已经制备了CuO/TiO2-SiO2催化剂来氧化甲苯,但尚未用于燃料和原油的氧化脱硫过程[12-15]。
本研究的创新之处在于基于实验制备的复合自制纳米催化剂(CuO/SiO2、CuO/TiO2-SiO2)去除原油燃料中的硫化物,并评估使用空气作为氧化剂的硫化物反应。
1 实验部分
1.1 材料及仪器
Cu(NO3)2·3H2O、钛(IV)异丙醇、无水乙醇、Na2SiO3、H2SO4,纯度均为99%,Sigma- Aldric 公司;榆林市生产的原油(总硫含量为1158×10-6)。
ZNCL-G15 型磁力搅拌器(河南爱博特科技发展有限公司);真空泵(浙江飞越机电有限公司);马弗炉(上海识捷电炉有限公司);X 射线衍射仪(耐驰科学仪器商贸(上海)有限公司);FTIR-650 型傅里叶变换红外光谱仪(天津港东科技发展股份有限公司);TG209F3 型热重分析仪(耐驰科学仪器商贸(上海)有限公司)。
1.2 纳米复合催化剂的合成
1.2.1 纳米SiO2载体的合成 通过溶胶-凝胶法制备纳米SiO2。首先,将40g 的Na2SiO3前驱体与100mL蒸馏水混合,并在加热磁力搅拌器下搅拌2h 直到完全溶解。然后,向Na2SiO3溶液中滴加98%的H2SO4,并继续搅拌以降低溶液的pH 值。将凝胶静置24h,在室温下过滤,并使用漏斗和真空泵加速过滤步骤。凝胶经过多次冲洗和清洗,直到其pH 值为7,中和酸并去除SO42-。最终的过滤液中添加BaCl2指示剂,直到出现白色沉淀,然后进行持续清洗直到获得清澈的滤液,并在110℃下干燥过夜。最后,使用马弗炉在500℃下焙烧1h,以去除氧化物并获得所需的材料相。
1.2.2 CuO/SiO2催化剂(CAT-1)的制备 为了制备3g 复合催化剂,将1.4g Cu(NO3)2·3H2O 添加到56mL蒸馏水中,并在超声混合器中混合30min。之后,对2.5g 所制备的纳米SiO2进行称重。然后,通过磁力搅拌器将金属溶液在载体上混合60min。将所获得的凝胶在110℃下干燥12h,然后在500℃下煅烧3h。
1.2.3 复合载体(TiO2-SiO2)的制备 将15g 纳米SiO2溶解在70mL 乙醇溶剂中,然后,将11.9mL 的钛(IV)异丙醇添加到40mL 的乙醇中以制备溶液(A)。加入0.7mL HCl、20mL 乙醇和3mL H2O 以制备溶液(B)。然后,在磁力搅拌器中将溶液(B)加入到溶解的纳米SiO2中1h,直到获得凝胶溶液。一旦发现凝胶,将溶液(A)逐滴加入凝胶中,搅拌2h。在100℃下干燥24h,并在500℃下煅烧3h。
1.2.4 CuO/TiO2-SiO2催化剂(CAT-2)的制备 在制备复合载体之后,将11.46g 的Cu(NO3)2·3H2O 溶解在100mL 的蒸馏水中。将制备的TiO2-SiO2载体装入具有真空泵的烧瓶中。打开真空泵以吸附烧瓶内的所有空气,当确保空气真空时,关闭真空泵。在连续搅拌的情况下,将盐溶液逐滴添加到TiO2-SiO2载体上。继续真空搅拌2h,然后沉淀24h。之后,溶液沉淀在100℃下干燥24h,并在500℃下煅烧3h。
1.3 表征测试
使用Brunauer-Emmett-Teller(BET)技术对合成的SiO2载体和复合催化剂的结构和比表面积进行了测量;使用X 射线衍射仪对所制备的SiO2载体和复合催化剂进行衍射图对比分析;纳米SiO2支撑材料和催化剂的表面化学特性使用傅里叶变换红外光谱仪进行测试;使用热重分析仪器进行热重分析。
1.4 氧化脱硫反应器
为了评估纳米复合催化剂的性能(或硫转化率),采用自制间歇反应器系统催化氧化原油原料中的含硫化合物。该系统由圆底三颈烧瓶组成,用于在内部进行ODS 反应作为分批过程。
1.5 氧化脱硫工艺实验
使用自制设备进行氧化脱硫工艺的实验。氧化脱硫工艺反应条件为:温度为353~413K,时间为40~100min。在实验中,制备了两种不同的纳米催化剂,CAT-1 为15%的CuO 和85%的SiO2,CAT-2 为15%的CuO、10%的TiO2和75%的SiO2。在进行硫氧化反应,温度到到原油所需温度时,将0.5g 纳米催化剂样品加入反应器,并记录时间。当计时器达到设定时间时,关闭系统,过滤和收集反应产物。氧化反应后硫转化为氧化硫的计算公式如下:
式中 Xs:硫转化率,%;Cs:初始硫浓度,g·L-1;CL:反应后硫浓度,g·L-1。
2 结果与讨论
2.1 合成的纳米催化剂的表征
2.1.1 X-射线荧光光谱 用X-射线荧光光谱分析了所合成的纳米SiO2载体以及所制备的纳米催化剂和复合纳米催化剂的确切化学成分百分比。对合成的SiO2载体和复合催化剂的结构和比表面积进行了测量,结果见表1。

表1 载体和合成催化剂的比表面积、化学成分和孔体积Tab.1 Specific surface area, chemical composition and pore volume of the carrier and synthetic catalysts
由表1 可见,两种复合催化剂均具有较高的比表面积。但由于活性金属的负载和浸渍步骤,催化剂的比表面积比载体的要小。浸渍后孔容增大的原因是活性成分占据了样品中的一些空隙。
2.1.2 X 射线衍射 所制备的纳米SiO2载体的X射线衍射图见图1。
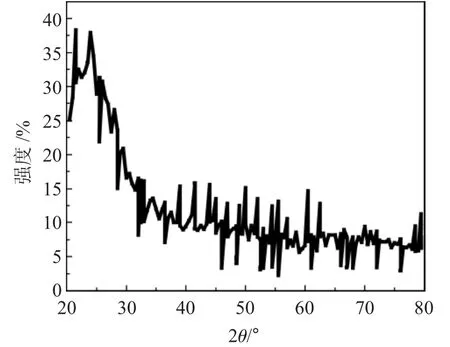
图1 纳米SiO2 的XRDFig.1 XRD of nanosilica
在纳米SiO2载体的衍射图中能够明确区分其特征的最大峰,并且发现了无定形的纳米SiO2存在于2θ 为21°的峰位。
CAT-1 和CAT-2 的X 射线衍射图见图2。

图2 CAT-1 和CAT-2 的XRDFig.2 XRD of CAT-1 and CAT-2
由图2 可见,CAT-1 催化剂呈现出CuO/SiO2的无定形形态,在散射峰2θ 为23°~25°处具有一个非常宽的峰和极低存在度的CuO 峰。此外,CAT-1 中的CuO 颗粒要么是微小晶粒,要么是半晶体。而CAT-2 的XRD 图中发现为无定形,在25°的一个宽峰处注意到了TiO2的锐钛矿相峰位,但没有金红石相的存在。经过500°C 焙烧后,催化剂中的TiO2结晶相得以观察,而无定形SiO2的存在抑制了TiO2的晶相。这证实了SiO2载体对CuO 和TiO2相的分散趋势,其3 个峰位分别为2θ 为25°、35°和38°。因此,可以确定CuO 负载在纳米SiO2上(CAT-1),TiO2负载在CuO/SiO2上(CAT-2),成功制备了负载型催化剂CAT-1 和CAT-2。
2.1.3 傅里叶变换红外光谱 纳米SiO2的FTIR 结果见图3。

图3 纳米SiO2 的FTIR 分析Fig.3 FTIR analysis of nano-silica
由图3 可见,峰值代表Si-O-Si 四面体桥氧的不对称伸展在1060.7cm-1处,而四面体之间桥氧的对称伸展在798.4cm-1处。另外,在956.5cm-1处检测到硅醇(Si-OH)基团的峰值。
CAT-1 和CAT-2 的FTIR 结果见图4。

图4 CAT-1 和CAT-2 的FTIR 光谱Fig.4 FTIR spectra of CAT-1 and CAT-2
由图4 可见,出现在3397~3500cm-1之间的区域的特征峰为纳米SiO2支撑表面吸附水或硅醇的-OH 伸展振动。1640cm-1处检测到的特征峰代表水粒子弯曲振动。代表Si-O-Si 四面体桥氧的不对称伸展峰值在1060.7cm-1处,而四面体之间桥氧的对称伸展峰值在802.2~794.5cm-1之间。在990~1000cm-1之间存在一个特征峰值,表示硅醇基团的Si-O 伸展振动频率,并发现了Si-O-Si 的频率。从FTIR 结果来看,已经成功合成催化剂。
2.1.4 热重分析 图5 为纳米SiO2和复合催化剂样品的热重分析(TGA)曲线。
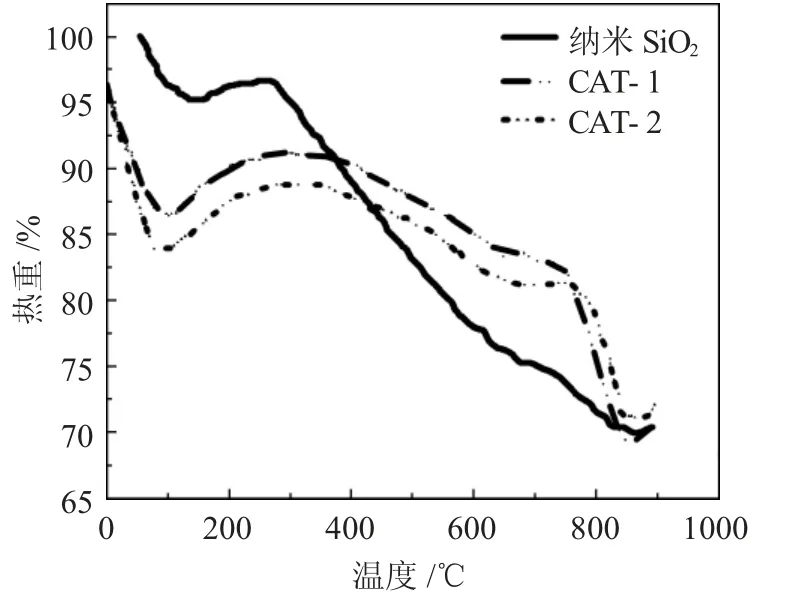
图5 纳米SiO2、CAT-1 和CAT-2 的TGA 曲线Fig5 TGA curves of nanosilica, CAT-1 and CAT-2
由图5 可见,在活性金属的负载过程前后,催化剂样品的质量损失存在差异。随着温度从20℃升高到240℃,曲线表明样品周围存在质量损失,这是由于固体表面物理吸附水的脱水和蒸发所致。具体而言,CAT-1 的TGA 曲线在20~140℃之间表现出质量损失,而CAT-2 在20~160℃之间表现出质量损失。当温度超过380℃时,与制备载体相比,制备的催化剂具有较好的热稳定性,这归因于活性成分的相稳定性、高纯度和良好的结晶性。
2.2 催化剂类型对催化裂化工艺的影响
研究CuO 在两种不同类型的纳米SiO2载体和TiO2-SiO2载体上对原油的ODS 反应的影响,结果见图6。
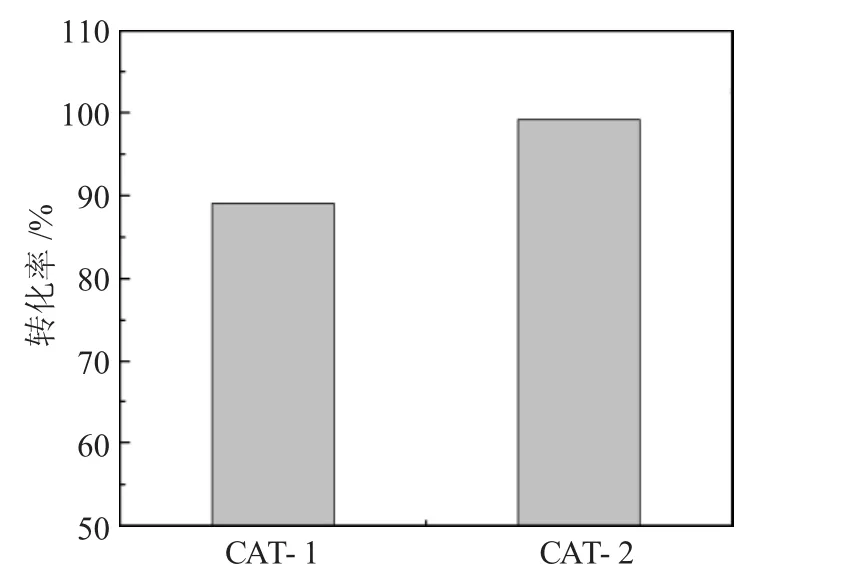
图6 使用CAT-1 和CAT-2 进行硫转化的ODS 效率Fig.6 ODS efficiency of sulfur conversion using CAT-1 and CAT-2
由图6 可见,CAT-1 和CAT-2 分别实现了高达89%和99.2%的高转化率。CAT-1 的高转化率结果可归因于其高比表面积和分散的CuO 支撑点。在制备高光学吸收率和高稳定性的CuO/SiO2复合材料方面,CuO 发挥了关键作用。催化剂表面吸附含硫化物和砜类的氧化物,从而去除了硫化物。促进了混合物之间的接触和暴露更多的活性物质,从而提高了最终的催化效率。在纳米SiO2载体上添加TiO2比纳米SiO2载体单独使用更为有效。这表明TiO2的加入提高了催化剂的性能,如孔隙体积和比表面积的增加,以及可接受的活性金属分散,避免了它们的聚集状态,提高了热稳定性。根据Lewis 酸碱理论,原油中含量最高的噻吩类硫化合物被认为是Lewis 碱,而且只被Lewis 酸位点吸附,而SiO2对TiO2的修饰增加了Lewis 碱的总量,从而提高了氧化脱硫的性能。
2.3 反应温度与时间的影响
探究了在不同反应时间下,反应温度(353、373、393 和413 K)对ODS 反应的影响。结果见图7。

图7 在不同反应时间下反应温度对转化率的影响Fig.7 Effect of reaction temperature on conversion at different reaction times
由图7 可见,使用CAT-1 催化剂,当反应时间为100min 时,硫化合物的转化率从353K 到413K显著提高,从61%增加到87%。而相同反应时间内使用CAT-2 催化剂,硫的转化率从353K 到413K由71%增加到99.2%。分析认为,由于催化剂表面具有高活性金属化合物和功能基团,并且催化剂比表面积大,分子吸附速率增加。这个原因可以用阿伦尼乌斯方程(k=Aexp(-Ea/ RT))来解释。反应速率和活化能是反应温度的函数,因此,提高温度会增加硫化合物的转化率。此外,液体中空气分子被吸附、散射和溶解在催化剂孔中的速率也随温度升高而增加。根据反应时间对ODS 工艺硫转化的有利影响的实验测试,可以通过应用所制备的CuO/SiO2和CuO/TiO2-SiO2催化剂来提高原油在空气氧化剂中的脱硫效率。随着反应时间的延长,硫化合物的转化率增加。而延长反应时间增加了反应物接触、反应和建立氧化剂最终到达氧化脱硫。当反应时间从40min 增加到100min 时,在413 K 时,CAT-1 的硫化物转化率从74%提高到87%,CAT-2 的转化率从88%提高到99%。因此,在413K 和100min 下,CAT-1 和CAT-2 的脱硫效率分别达到了87%和99.2%。
3 结论
本研究考察了复合纳米SiO2催化剂对原油催化氧化脱硫工艺性能的影响,主要结论如下:
(1)合成复合纳米催化剂CAT-1(15%CuO/85%SiO2)和CAT-2(15%CuO/10%TiO2-75%SiO2),通过氧化脱硫法脱除硫化物,生产清洁燃料。
(2)SiO2载体的比表面积为652.3m2·g-1,CAT-1和CAT-2 催化剂的比表面积分别为386.5m2·g-1和336.7m2·g-1。纳米SiO2、CAT-1 和CAT-2 的孔容分别为0.55cm3·g-1、0.36cm3·g-1和0.37cm3·g-1。
(3)由于活性金属高度分布以及巨大的比表面积和孔容,浸渍法制备的新型纳米活性金属催化剂在原油脱硫中表现出较高的脱硫率。
(4)当使用CAT-2 催化剂时,反应温度为413K,反应时间为100min,原油中硫化物的最大转化率可达99.2%,因此,可用于燃料和原油的氧化脱硫过程。

