纳米羧化壳聚糖在污水无机阴离子去除中的研究*
解晓敏,解秀祥
(临沂市生态环境局沂水县分局 环境监控中心,山东 临沂 276400)
饮用水的质量对公共健康起着重要的作用,因此,地下水和地表水的化学成分,如硝酸盐、氟化物和磷酸盐等阴离子,是供水来源成为饮用水的决定性参数之一[1,2]。NO3-作为氮化合物氧化的最后阶段产生的分子,其浓度是污水和固体废物污染的最重要指标之一;农业氮肥是硝酸盐污染的最重要来源之一[2]。氟化物及其化合物通常来源于半导体生产、燃煤发电厂、玻璃和陶瓷、金属加工、橡胶制造和化肥等行业[3-5]。根据世界卫生组织的标准,饮用水中氟的最佳浓度为1.5mg·L-1。磷是城市污水中的重要组成部分。该元素在污水中以各种形式存在。由于富营养化和受纳水域的破坏,城市污水排入受纳水域的趋势越来越大。从水中去除这些阴离子的常规方法有生物法(包括硝化和反硝化(硝酸盐去除)[6-8])及化学方法(包括氯化、吸附、电渗析、选择性离子交换、混凝和沉积以及膜的应用[9-12])。
壳聚糖是由甲壳素脱乙酰基合成的一种天然多胺类糖类吸附剂,其原始形态的吸收能力较低,因此,需要进行修饰以增加其吸收能力。磁性铁,因其良好的稳定性和高的吸附能力,可以作为这一目的的有效改性剂[13-15]。壳聚糖铁与壳聚糖高聚物链通过氨基(-NH2)和羟基(-OH)形成壳聚糖铁络合物,提高了吸附能力,使其易于通过外加磁场收集。本研究旨在利用磁性铁纳米粒子对壳聚糖进行改性,并将其用于去除污水中的硝酸盐、氟化物和磷酸阴离子。
1 实验部分
1.1 材料与仪器
FeCl3、FeCl2、KNO3、KF、K2PO4,均为分析纯,上海阿拉丁生化科技股份有限公司;NH3·H2O(28%滕州祥润化工有限公司);壳聚糖(99% 山东奥康生物科技有限公司)。
1.5L16 -A4 型超声换能器(成系统有限公司);BRUKER TENSOR 27 型傅里叶红外光谱(德国布鲁克);Mastersizer 3000 型粒度分析仪(山东耐克特分析仪器有限公司);Zeta 电位分析仪(美国Nanobrook Omni);Metrohm 882 紧凑型IC plus 离子色谱分析仪(瑞士万通(Metrohm)公司)。
1.2 吸附剂制备
吸附剂制备分为两个阶段:
(1)磁性铁纳米颗粒的合成 将4.1g FeCl3和2.5g FeCl2分别置于超声换能器中,直到均质过程完成。将两种化合物混合,加入20mL NH3·H2O 溶液在80℃下搅拌反应1h。制备的纳米颗粒用蒸馏水和乙醇洗涤,用钕磁铁分离,70℃烘干。
(2)吸附剂的制备 将5g 壳聚糖加入100mL 0.5N 的羧酸中,然后滴加NH3·H2O 将溶液的pH 值提高到8,并将所制备的溶液置于搅拌器中于室温下搅拌24h。加入0.3g 磁性铁纳米颗粒,向溶液中注入N2,将溶液置于搅拌器中搅拌60min。将25mL NH3·H2O 加入吸附剂中,60min 后,溶液经过多次洗涤并在室温下干燥,得到磁性铁纳米羧化壳聚糖。
1.3 吸附剂表征
使用傅里叶红外光谱(FTIR)对吸附剂进行光谱分析。使用粒度分析仪和Zeta 电位分析仪测量纳米颗粒表面的电位和纳米颗粒的尺寸分布。
1.4 吸附实验
制备KNO3、KF、K3PO4的标准溶液(1000 mg·L-1)。在100mL 烧瓶中加入不同浓度的硝酸盐、氟化物和磷酸盐样品。在不同的吸附剂量、pH 值和接触时间条件下进行。使用配备阴离子柱离子色谱分析仪测定阴离子浓度。每次测试后,样品以4000r·min-1的速度离心,用注射器过滤后注入设备中。阴离子在吸附剂表面的吸附量(Qe)用式(1)计算。
式中 C0和Ce:吸附后阴离子的初始浓度和平衡浓度,mg·L-1;W:溶剂体积中的吸附剂质量,g·L-1。
2 结果与讨论
2.1 吸附剂表征
图1 为磁性铁纳米颗粒以及原始、羧化和纳米羧化壳聚糖的FTIR 结果。

图1 傅立叶变换红外光谱Fig.1 FTIR spectra of(a)iron nanoparticles;(b)chitosan;(c)carboxylated chitosan;(d)iron nanoparticles carboxylated chitosan
由图1 可见,未改性壳聚糖、磁性铁纳米颗粒、羧化壳聚糖和纳米羧化壳聚糖吸附剂在3413~3440cm-1范围内有O-H 和N-H 的拉伸谱带。所有的壳聚糖样品在2900cm-1处都观察到-CH 键谱带。在NH=C=O 的C=O 拉伸键作用下,纳米羧化壳聚糖在1657cm-1处的峰强度更大,在1366cm-1处的峰是C-N 振动拉伸键。磁性铁纳米粒子以及羧化壳聚糖和纳米羧化壳聚糖吸附剂在578.6cm-1处的谱带是由于Fe3O4的Fe-O 拉伸键所致。FTIR 光谱证实了磁性铁纳米颗粒和改性壳聚糖的合成。
磁性铁纳米颗粒和铁纳米羧化壳聚糖颗粒的动态光散射(DLS)结果见图2。

图2 磁性铁纳米颗粒和铁纳米羧化壳聚糖颗粒的DLSFig.2 Dynamic light scattering of magnetic iron nanoparticles and iron nanocarboxylated chitosan particles
由图2 可见,铁纳米羧化壳聚糖颗粒与铁纳米颗粒的尺寸相当,且均匀分布,颗粒大小也在120~200nm 之间。
在最佳pH 值条件下,对磁性铁纳米颗粒和铁纳米羧化壳聚糖颗粒进行了Zeta 电位测量。在5mL蒸馏水中加入0.01g 的吸附剂,在超声波下放置15min,测定Zeta 电位。测得磁性铁纳米粒和铁纳米羧化壳聚糖的Zeta 电位和电泳迁移率分别为-8.45mV和6.46mV,-0.66cm2·(v·s)-1和0.50cm2·(v·s)-1。图3 为通过初始pH 值和最终pH 值的交集计算的吸附剂表面零电荷点的pH 值(pHpzc)。经计算pHpzc为6.15。换而言之,在该pH 值下,吸附剂的电荷为零,当pH 值大于6.15 时,电荷为负,在较低的pH值时,吸附剂电荷为正,呈阳性。这种微小的差异可以归因于壳聚糖缺乏特定的组成。当pH 值小于pHpzc 时,该吸附剂带正电荷。因此,吸附剂的正电荷与硝酸盐、氟化物和磷酸阴离子的负电荷发生静电吸引,从而提高了吸附效率。

图3 铁纳米羧化壳聚糖的pHpzcFig.3 pHpzc of iron nanocarboxylated chitosan
2.2 pH 值影响
为研究pH 值对阴离子吸附效率的影响,将样品经过离心后,进行离子色谱仪分析,结果见图4。
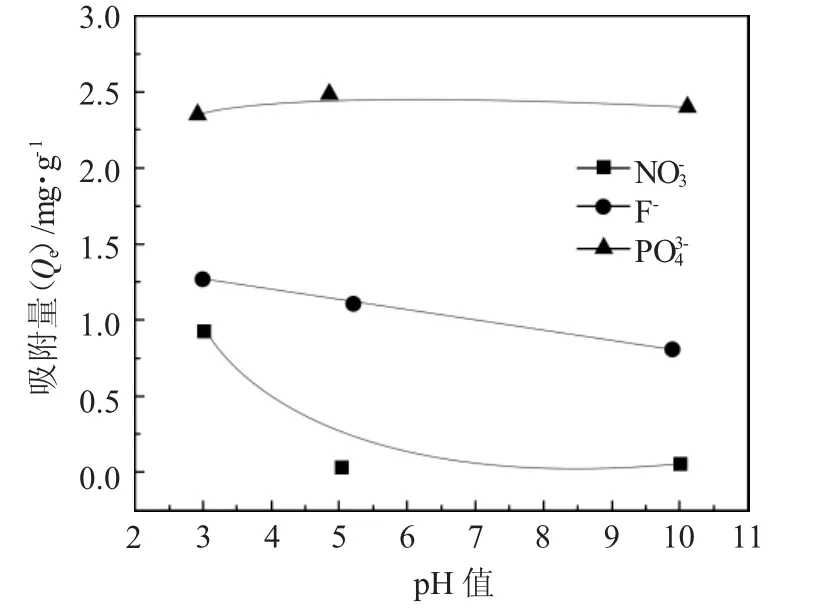
图4 pH 值对铁纳米羧化壳聚糖吸附阴离子的影响Fig.4 Effect of pH on the adsorption of anions by iron nanocarboxylated chitosan
由图4 可见,pH 值由酸性变为碱性(由3 变为10),吸附的F-和NO3-呈下降趋势。结果表明,在pH 值为3 的条件下铁纳米羧化壳聚糖颗粒对F-和NO3-的吸附以及在pH 为5 的条件下对PO43-的吸附均表现出最大的吸附能力。由于在pH 值为3 和5时,吸附的磷酸盐阴离子的量大致相等,因此,从水溶液中同时去除氟化物、硝酸盐和PO43-的最佳pH值为3。
随着pH 值的降低,H+增加,质子在吸附剂表面产生正电荷。由于硝酸盐、氟化物和磷酸盐的电荷是负电荷,在吸附剂和阴离子之间产生静电吸引力,导致在酸性环境中吸附剂对阴离子的吸附更多。另一方面,在碱性环境中,吸附剂表面附近的负电荷(OH-)会导致阴离子之间的静电斥力,从而降低吸附效率。最高的吸附效率与酸性环境有关。
2.3 吸附剂用量的影响
分别制备不同浓度(0.5、1、2、4、10、20g·L-1)的硝酸盐、氟化物和磷酸盐阴离子样品,考察铁纳米羧化壳聚糖剂量对阴离子吸附量的影响,结果见图5。

图5 铁纳米羧化壳聚糖剂量对阴离子吸附量的影响Fig5 Effect of iron nanocarboxylated chitosan dosage on anion adsorption
由图5 可见,当吸附剂量从0.5g·L-1增加到1g·L-1时,吸附的阴离子数量增加,但当吸附剂量从2g·L-1增加到20g·L-1时,所有阴离子的吸附总量逐渐减少,因此,最佳吸附剂量为2g·L-1。阴离子吸附量的增加是由于随着吸附剂量的增加,吸附表面上的自由位(或表面积)增加,同时还增加了阴离子对吸附剂表面活性中心的利用率。然而,进一步增加吸附剂用量(从2 到20g·L-1)并没有产生明显的阴离子吸附量,这主要是由于在较高的吸附剂用量时达到吸附平衡。总之,吸附剂的用量是提高吸附效率的有效参数之一,因为随着吸附剂用量的增加,可用吸附交换吸附材料的面积增加。F-浓度随着吸附剂量的增加而降低,随着吸附剂量从1g·L-1增加到20g·L-1,吸附效率从45%提高到95%,离子浓度从4.5mg·L-1降到0.5mg·L-1以下。
2.4 接触时间的影响
为评价接触时间对阴离子吸附量的影响,研究了吸附时间分别为10、30、60、90、120 和150min 的NO-3、F-、PO34-的吸附情况,结果见图6。

图6 吸附接触时间对吸附量的影响Fig.6 Effect of adsorption contact time on the amount of adsorption
由图6 可见,在10~60min 之间,吸附阴离子的量随接触时间的增加而增加。如在10 和60min 时,吸附NO-3的量(Q)e分别为0.8475 和1.082mg·g-1,而在150min 时则为1.025g·L-1。可以得出结论,进一步增加接触时间,吸附速率没有明显变化。结果表明,壳聚糖和磁性铁纳米粒子的吸附速度较快,大部分NO-3、F-、PO34-在接触后1h 内被去除,不到150min 就达到吸附平衡。由于阴离子在吸附部位的积累,吸附速率随着接触时间的延长而降低。
2.5 阴离子浓度的影响
为确定吸附剂对NO-3、F-、PO34-的最佳吸附浓度,在吸附剂量为1g·L-1时,对各阴离子进行单独的实验。结果见图7。

图7 吸附剂量为1g·L-1 时阴离子浓度对吸附量的影响Fig.7 Effect of each anion concentration on adsorption at adsorbent amount of 1g·L-1
图7(a)在F-浓度为3、5、10 和15mg·L-1的条件下,根据其吸附效率确定了最大F-浓度。当F-浓度为5mg·L-1时,吸附F-的量为1.218mg·g-1,吸附效率随F-浓度的增加而降低。图7(b)在NO-3浓度为5、10、50、100、250和500mg·L-1的条件下评价了最佳硝酸盐浓度对吸附效率的影响。由图7(b)可见,随硝酸盐浓度的增加,吸附效率降低。当硝酸盐浓度为5mg·L-1时,吸附NO-3的量为1.108mg·g-1,吸附效率为92%;当浓度为50mg·L-1时,NO-3吸附效率为39.6%。由图7(c)也可以看出,磷酸盐浓度分别为0.2、2、5 和10mg·L-1,随着磷酸盐浓度的增加,吸附效率降低。在磷酸盐浓度为0.029mg·L-1和10mg·L-1时,吸附的PO34-(Q)e分别为0.029 和1.867mg·g-1。
在对3 种阴离子的研究中,随着污染物浓度的增加,由于缺乏足够的有效表面,3 种阴离子的吸附效率降低。观察到在恒定的接触时间和pH 值为6的条件下,随着初始硝酸盐浓度从5mg·L-1增加到120mg·L-1,由于有效表面减少,在较高浓度下的吸附效率从91%下降到78%;而吸附容量从0.46 增加到9.9mg·g-1。吸附量随着初始浓度的增加而增加。
2.6 吸附剂类型的影响
为评价吸附剂类型对硝酸盐、氟化物和磷酸盐的去除效率,在最佳条件下考察了不同类型的吸附剂(壳聚糖、羧化壳聚糖、磁性铁纳米颗粒和磁性铁羧化壳聚糖)在硝酸盐浓度为100mg·L-1、氟化物浓度为15mg·L-1和磷酸盐浓度为10mg·L-1时的吸附效果,结果见表1。

表1 不同类型的吸附剂对阴离子吸附量的影响(mg·L-1)Tab.1 Effect of different types of adsorbents on the adsorption of anions
由表1 可见,改性后的吸附剂的吸附量和效率远高于其他吸附剂,这归因于利用羧酸和铁纳米颗粒来修饰壳聚糖的吸附容量。观察到的协同效应可以用低密度和高孔隙率的壳聚糖吸附剂的组合来解释,吸附剂具有高度的三维程度,赋予了客体纳米颗粒高吸附量特征,从而使有效表面积增加。此外,壳聚糖-磁性铁纳米颗粒优异效率的最重要的因素是Zeta 电位,其中带正电的吸附剂可以通过静电吸引有效吸附阴离子,这种结合使官能团更多地位于吸附剂上,进而产生更高的效率。
3 结论
本文对纳米羧化壳聚糖的合成、制备及其对废水中氟化物、硝酸盐和磷酸盐的同时去除效果进行了评价。对所使用的吸附剂规格进行了分析,主要结论如下:
(1)红外光谱显示纳米羧化壳聚糖复合材料在578.6cm-1处存在Fe-O 张力键,表明壳聚糖改性成功,生成了磁性壳聚糖,表明壳聚糖-磁性铁纳米粒子中铁纳米粒子的存在。
(2)利用纳米羧化壳聚糖吸附剂的表面电荷可以去除污水中带负电荷的污染物,并通过磁铁将吸附剂与水溶液完全分离。
(3)在酸性条件下(pH 值为3),纳米羧化壳聚糖颗粒对所有阴离子的吸附量最大。最佳吸附剂量为2g·L-1时,可同时去除水溶液中的F-、NO3-和PO43-。此外,接触时间从10min 增加到60min,阴离子的吸附量增加,但在接触时间超过60min 后,阴离子的吸附量保持不变。
(4)纳米羧化壳聚糖吸附剂可以有效的吸附去除污水溶液中硝酸盐、氟化物和磷酸盐。

