钛白副产硫酸亚铁中镁离子的含量分析
赵业军,钱 欣,王桂兵,周朗坤,王莹莹
(1.武汉东湖学院 生命科学与化学学院,湖北,武汉 430212;2.湖北中医药大学 药学院,湖北 武汉 430065)
钛白粉(TiO2)是目前工业生产中极为重要的一种无机化工颜料,硫酸法生产钛白粉会产生大量副产FeSO4,大约每生产1t 的钛白粉就会产生2.5~3.5t的副产物FeSO4粗品[1]。FeSO4的综合利用通常从精制开始,但FeSO4粗品中存在大量的金属阳离子杂质,尤其是Mg2+杂质很难检测并去除,因此,找出一种简便快捷、经济、准确的测定钛白副产FeSO4中Mg2+含量的方法就显得尤为重要和迫切。离子选择性电极法所用的电极使用寿命短且性能不稳定;火焰原子吸收法和等离子发射光谱法(ICP—AES)测定结果虽可靠准确,但仪器价格较高,很难在工厂中得到普及[2,3]。EDTA 络合滴定法和紫外分光光度法的操作相对简便,并且成本低廉,适用于工厂普及[4]。本文对EDTA 络合滴定法和紫外分光光度法进行研究,以期寻找出适合工业生产应用的快速准确的分析方法。
1 实验部分
1.1 试剂与仪器
FeSO4(工业级 武汉方圆钛白);FeSO4、MgSO4、NH4Cl、草酸铵、盐酸羟胺、NH4OH,天津登峰;酸性铬蓝K(天津福晨);抗坏血酸、乙二胺四乙酸二纳,西陇科学;无水乙醇、25% NH3·H2O,天津天力;三乙醇胺(国药集团化学);钙羧酸指示剂、铬黑T,天津致远;以上试剂均为分析纯。
i3 型紫外可见分光光度计(济南淘能);TDL-80-2B 型离心机(上海安亭)。
1.2 EDTA 络合滴定法
样品溶液以铬黑T 为指标剂,EDTA 标准溶液对其进行滴定,计算Mg2+的浓度。
1.3 测定方法
用NH3-NH4Cl 缓冲液调节样品溶液pH 值,加入草酸铵溶液使Fe2+沉淀,定容静置取上清液离心,再吸取离心管中上清液至容量瓶中,依次加入抗坏血酸溶液、酸性铬蓝K-乙醇溶液、NH3-NH4Cl 缓冲液,定容显色后,在室温环境下用紫外分光光度法测定其吸光度。
2 结果与讨论
2.1 EDTA 络合滴定法分析
样品溶液加入NH3-NH4Cl 缓冲溶液后形成了大量灰绿色胶体分散在溶液中,以致无法判断滴定终点。经分析,出现的灰绿色胶体为Fe(OH)2,产生原因是FeSO4粗品溶液中含有大量Fe2+,目前方法中的三乙醇胺的用量远远不足以屏蔽Fe2+干扰,在加入NH3-NH4Cl 缓冲溶液后,溶液变为碱性,生成的Fe(OH)2进一步氧化为Fe(OH)3胶体,从而导致无法观测到滴定终点。考虑EDTA 络合滴定法的灵敏度较低,准确度不高,因此,EDTA 络合滴定法不适用FeSO4中Mg2+含量分析。
2.2 紫外分光光度法分析
2.2.1 用草酸铵排除Fe2+干扰 草酸根离子可以和Fe2+反应,生成难溶于水的草酸亚铁沉淀,反应式如下:
2.2.2 测定波长的选择 取10mL 配好的1mg·mL-1Mg2+标液,稀释10 倍,得到100μg·mL-1的Mg2+标液,取5mL 100μg·mL-1的Mg2+标液于比色管中,用NH3-NH4Cl 缓冲液调节pH 值为8~10,再加入10mL草酸铵溶液,用去离子水稀释到25mL 刻度线,再取1.0mL 至比色管中,依次加入0.6mL 抗坏血酸溶液,1.6mL 酸性铬蓝K 乙醇溶液,2mL pH 值为9.5 的NH3-NH4Cl 缓冲液,用去离子水稀释至10mL 刻度线,在室温环境下显色后测定其吸光度,结果见图1。
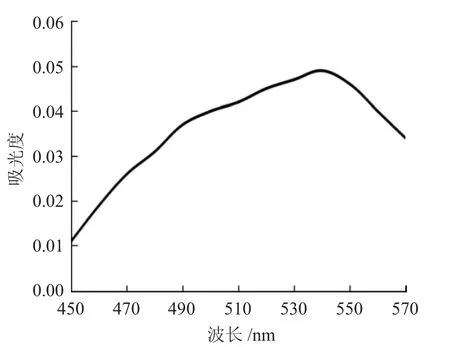
图1 最大吸收波长曲线Fig.1 Maximum absorption wavelength curve
由图1 可见,Mg2+与酸性铬蓝K 形成的红色络合物的最大吸收波长是540nm。
2.2.3 草酸铵用量的影响 在FeSO4溶液中加入NH3-NH4Cl 缓冲溶液调节pH 值,分别加入5、10、15、20mL 草酸铵,静置沉淀后发现,加入5mL 草酸铵中的沉淀量明显少于其他样品,判断加入5mL 草酸铵用量不足,Fe2+没有完全沉淀。取另外3 个样品离心,再分别吸取离心管中上清液显色,测定其吸光度,结果见图2。

图2 草酸铵溶液用量对吸光度的影响Fig.2 Effect of the dosage of ammonium oxalate solution on absorbance
由图2 可见,草酸铵用量在10mL 以上时,Fe2+已经可以完全沉淀,且草酸铵的用量不会干扰吸光度的大小,故使用10mL 的草酸铵最合适。
2.2.4 缓冲液pH 值的影响 取上述配好的混合液,分别加入pH 值为9、9.5、10、10.5、11 的NH3-NH4Cl 缓冲溶液中进行显色实验,10min 内和20min内进行检测,结果见表1。

表1 缓冲液pH 值对吸光度的影响Tab.1 Effect of the buffer pH on absorbance
由表1 可见,在20min 内pH 值为10、10.5、11的样品颜色不稳定,容易褪去,使数据失效,其原因可能是当缓冲液pH 值达到10 以上时,形成的Mg-铬蓝K 的红色络合物不稳定,易于分解;而缓冲液pH 值为9~9.5 时,Mg-铬蓝K 红色络合物相对稳定,显色后溶液吸光度也基本保持稳定,综合考虑,选用pH 值为9.5 的NH3-NH4Cl 缓冲溶液。
2.2.5 标准曲线 配制Mg2+浓度为0.4、0.8、1.2、1.6、2.0、2.4μg·mL-1的溶液,按实验方法分别显色,在室温环境下测吸光度,绘制标准曲线见图3。

图3 Mg2+标准曲线Fig.3 Mg2+standard curve
由图3 可见,标准曲线线性方程y=0.0402x+0.0015,R=0.9992,线性相关良好,可用于样品检测。
2.3 加标回收实验
取2mL Mg2+标液,转移至100mL 容量瓶中,用2mg·mL-1的FeSO4溶液定容。取2mg·mL-1的FeSO4溶液于1 号容量瓶中、取加标溶液5mL 于2 号容量瓶中,按实验方法分别显色,在室温下测得吸光度及计算结果见表2,带入工作曲线,计算得加标回收率为98.5%。

表2 加标回收实验结果Tab.2 Spiking and recovery experiment results
2.4 测定钛白副产物FeSO4 中Mg2+含量
取1g 钛白副产物FeSO4粗品于加去离子水搅拌溶解过滤,转移至100mL 容量瓶中定容。样品溶液按照研究方法进行分析,实验结果见表3。

表3 样品吸光值及含量Tab.3 Absorbance value and content of samples
由表3 可见,1g FeSO4粗品中含10.70mg 的Mg2+,含量约为1.07%。
3 结 论
本文研究钛白副产物FeSO4粗品中Mg2+含量的紫外分光光度检测方法,经加标回收的方法验证了方法的可行性。该方法不需要大型昂贵的设备,且操作简便、成本低廉、准确性高,适合工厂普及使用。

