高孕激素状态下促排卵方案中不同孕激素对卵巢储备功能减退患者的应用效果比较
张露云,孙亚婷,刘维凯,高茹,朱爱珍
(山西省运城市中心医院生殖医学科,运城 044000)
据估计,全世界有8%~12%的育龄夫妇受到不育症的困扰[1]。在不孕症患者中,卵巢储备功能减退(diminished ovarian reserve,DOR)的人群越来越多,数据统计,约10%的不孕妇女患DOR[2]。DOR患者存在窦卵泡数目减少、质量下降,对促性腺激素(Gn)的反应低下,促排卵过程中易出现黄体生成素(LH)峰激增及卵泡早排,促排卵周期取消率高、获卵少、可用胚胎率低、妊娠率低等特点[3],是临床医生促排卵过程中面临的重大难题。近年来,Kuang等[4]提出了卵泡期高孕激素促排卵(PPOS)方案。PPOS方案是在早卵泡期雌激素升高前添加外源性的孕激素,可以阻断雌激素的正反馈作用,有效抑制早发LH峰,预防早发排卵,减少周期取消率。大量数据表明PPOS方案所营造的高孕激素状态下促排卵可使DOR患者获得良好的促排卵结局[5-7],但因其高孕激素的使用会使子宫内膜提前出现分泌期改变,子宫内膜和胚胎发育不同步,无法进行鲜胚移植,只能将胚胎冷冻保存,择期行冻融胚胎解冻移植(FET)。尽管目前玻璃化冷冻解冻技术已相当成熟,解冻复苏周期的妊娠率也不亚于新鲜移植周期[8],但全胚冷冻会增加患者冷冻胚胎保存的费用及等待移植的时间,因此PPOS方案的使用范围受限。目前,我中心PPOS方案主要适用于既往采用其他方案出现早发LH峰、获卵差、胚胎质量差等不良结局的患者,需要多周期攒胚胎的患者,以及DOR合并子宫腺肌病、输卵管积液、薄型子宫内膜等患者。
醋酸甲羟孕酮(MPA)是最早提出的外源性孕激素,应用于PPOS方案中可有效抑制早发LH峰,减少周期取消率。除MPA外,也有文献报道在PPOS 方案中使用其它的孕激素制剂如地屈孕酮(DYG)、安琪坦等也有良好的促排卵效果[9-10]。现有少量文献和数据对比分析了PPOS方案中不同孕激素制剂对卵巢功能正常人群、多囊卵巢综合征(PCOS)人群、卵巢低反应人群促排卵结局的影响,但对于DOR这一特定人群在PPOS方案中使用MPA还是DYG更能获得良好的促排卵效果或实验室结局尚不清楚。本研究旨在比较PPOS方案中使用MPA和DYG对DOR患者促排卵效果和实验室结局的影响。
资料与方法
一、研究对象
本研究为回顾性队列分析。选择2022年1月至2023年5月在山西省运城市中心医院生殖医学科接受常规体外受精(IVF)/卵胞浆内单精子注射(ICSI)助孕治疗的DOR患者为研究对象。本研究符合《赫尔辛基宣言》的基本原则。
纳入标准:(1)临床诊断为不孕症;(2)在本中心采用PPOS方案促排卵 IVF/ICSI 助孕治疗;(3)符合临床DOR诊断标准[11]:经阴道B超提示双侧卵巢基础窦卵泡数(AFC)<5~7个,或抗苗勒管激素(AMH)<1.1 ng/ml,或连续两个月经周期的基础卵泡刺激素(FSH)≥10 U/L。
排除标准:(1)补救ICSI;(2)经皮睾丸穿刺活检(TESA);(3)夫妻双方任意一方染色体核型异常;(4)部分统计数据缺失。
共纳入299个助孕周期,根据 PPOS方案中应用孕激素制剂的类型将纳入的研究对象分成MPA组(177个周期)和DYG组(122个周期)。
二、诊疗回顾
1.性激素水平测定:于月经来潮第2天上午8:00~9:00留取静脉血样本进行基础性激素[卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)、孕酮(P)、泌乳素(PRL)、睾酮(T)]水平测定。使用西门子医学诊断产品(上海)有限公司提供的直接化学发光法免疫试剂盒操作,采用西门子全自动化学发光免疫分析仪(ADVIA Centaur CP;西门子,德国)进行检测。
2.PPOS方案及取卵:月经来潮第2天,患者基础FSH≤15 U/L、窦卵泡直径<10 mm时,给予口服醋酸甲羟孕酮(MPA;浙江仙琚制药)10 mg/d或地屈孕酮(DYG;达芙通,雅培,荷兰) 20 mg/d,同时联合人绝经期促性腺激素(HMG;珠海丽珠制药)150~225 U/d促排卵。经阴道超声结合血激素水平分析监测卵泡生长情况,根据卵泡发育情况调整HMG用量。当1个主导卵泡直径≥18 mm,或 2~3 个卵泡直径≥16 mm,或直径>14 mm卵泡数比例超过2/3,且血清E2水平与成熟卵泡数符合(每成熟卵泡E2734~1 101 pmol/L)时肌肉注射10 000 U人绒毛膜促性腺激素(HCG;珠海丽珠制药)进行扳机。HCG注射后36 h经阴道超声引导穿刺取卵抽吸14 mm以上卵泡,将获取的卵冠丘-卵母细胞复合物放入培养箱中培养2~4 h。
3.体外受精及胚胎观察:取卵当日男方以手淫法将全部精液留置在取精杯中。待精液液化后,观察并记录精子浓度和活力。根据男方精液处理后的前向运动(PR)精子总数选择常规IVF授精(PR精子总数≥5×106)或ICSI授精(PR精子总数<5×106)。(1)常规IVF操作:采用密度梯度离心法(Spermient;COOK,澳大利亚)和上游法(fertilization medium;COOK,澳大利亚)相结合的方法来处理精液。采用四孔板授精,授精时加精浓度为5万条精子/卵。将含有精卵的四孔板放置在培养箱中孵育4~5 h后,脱颗粒观察卵母细胞第二极体排出情况,若有一半及以上成熟卵子均可看到明显的2个极体,则将卵母细胞放回培养箱继续培养。(2)ICSI操作:采用密度梯度离心法(精子浓度≥2×106/ml且活力正常)或洗涤法(精子浓度<2×106/ml)处理精液,于取卵后2~4 h剥离卵冠丘-卵母细胞复合物的颗粒细胞,剥离颗粒细胞的卵子在培养箱中至少培养30 min,将处理后的适量精子悬液置于ICSI操作皿的GB(Gamete buffer;COOK,澳大利亚)液滴,安装好持卵针(Sunlight,美国)和注射针(Sunlight,美国)后,将GB滴中的精子吸入注射针行卵胞浆内注射。只对形态正常的成熟卵母细胞进行注射。
常规IVF授精20 h后或ICSI授精17 h后观察受精情况,观察到2个原核(2PN)的受精卵判定为正常受精。取卵后第3天对胚胎进行形态学评分[12],一级和二级胚胎为优质胚胎。根据患者病史和第3天胚胎情况选择将胚胎冷冻或者继续囊胚培养。如进行囊胚培养,取卵后第5天、第6天根据Gardner囊胚评分系统[13]对囊胚进行评分。
三、观察指标
两组患者的基础资料包括女方年龄、不孕年限、体质量指数(BMI)、AFC,基础性激素(FSH、LH、E2、P、PRL和T)水平;纳入的临床促排卵指标有HMG总剂量、HMG天数、孕激素费用、扳机日E2、LH和P水平、优势卵泡数(直径≥14 mm)、早发LH峰发生率;实验室结局指标有周期次数、获卵数、授精方式、ICSI成熟卵率、正常受精率、优质胚胎数、可用胚胎数、可用卵裂胚数、可用囊胚数,以及优质胚胎周期占比、可用胚胎周期占比。
早发LH峰发生率=出现早发LH峰周期数(HCG注射前LH≥10 U/L)/总周期数;ICSI成熟卵率=注射MⅡ卵子总数/获卵数;正常受精率=2PN受精卵数/获卵数;优质胚胎周期占比=有优质胚胎的周期数/总周期数;可用胚胎周期占比=有可用胚胎的周期数/总周期数。
四、统计学分析
采用SPSS 26.0 统计软件进行数据分析处理。计量数据经Kolmogorov-Smirnov方法分析后,所有计量数据均不符合正态分布,以中位数(第25百分位数,第75百分位数)[M(P25,P75)]表示,组间比较使用Mann-Whitney U检验。计数数据用构成比或率(%)表示,组间比较使用皮尔逊χ2检验或连续校正χ2检验。双侧P<0.05为差异有统计学意义。
结 果
一、纳入患者的整体情况及基本资料比较
本研究共纳入299个周期,未获卵4个周期、获卵295个周期。其中醋酸甲羟孕酮组(MPA组) 177个周期,未获卵1个周期;地屈孕酮组(DYG组)122个周期,未获卵3个周期。两组患者在女方年龄、不孕年限、BMI、AFC、基础FSH、LH、E2、PRL和T水平方面均无显著性差异(P>0.05);DYG组基础P水平显著低于MPA组(P<0.05)(表1)。
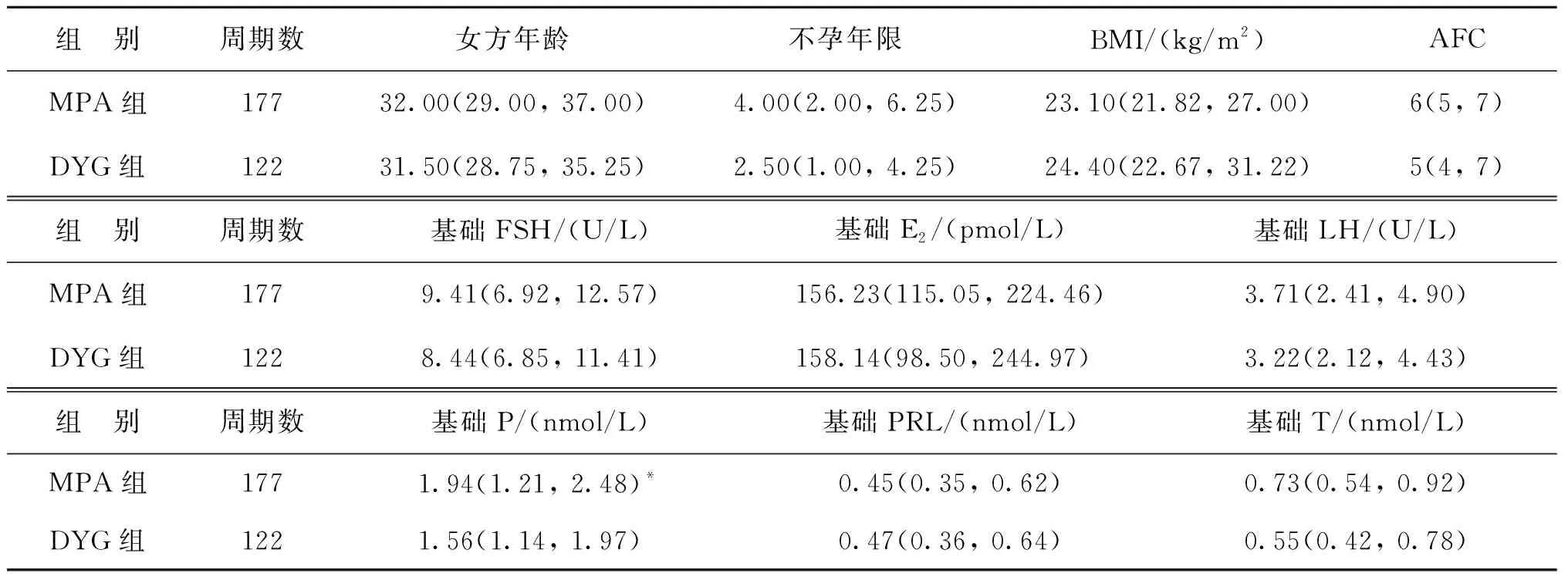
表1 两组患者基础资料比较[M(P25,P75)]
二、两组患者临床促排卵情况比较
两组患者间HMG天数、HMG总量、HCG日LH水平、优势卵泡数比较均无显著性差异(P>0.05);DYG组的孕激素费用、HCG日E2和P水平、早发LH峰发生率显著高于MPA组(P<0.05)(表2)。
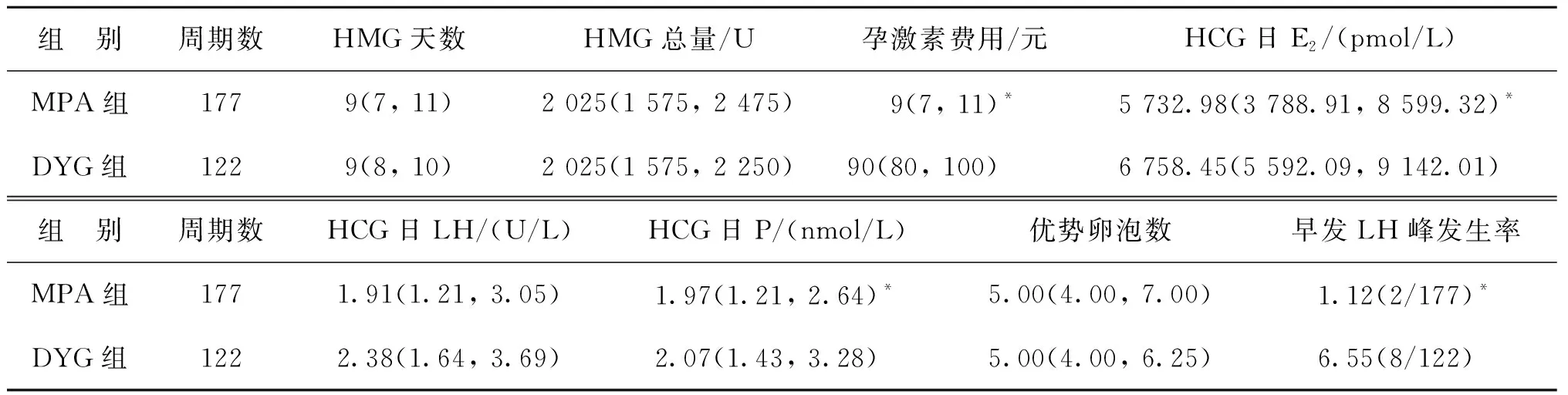
表2 两组患者促排卵结局比较[M(P25,P75),%]
三、两组患者实验室结局比较
共295个获卵周期纳入实验室结局分析,其中MPA组176个获卵周期、DYG组119个获卵周期。两组患者间获卵数、ICSI成熟卵率、正常受精率、优质胚胎数、可用胚胎数、可用卵裂胚数、可用囊胚数、优质胚胎周期占比、可用胚胎周期占比、ICSI周期占比、周期次数等比较均无显著性差异(P>0.05)(表3)。

表3 两组患者实验室结局比较[M(P25,P75),%]

续表
讨 论
卵巢储备功能减退(DOR)是以卵子数量和质量下降为特征的病理状态,发病机制不明确,可能与年龄、自身免疫、遗传、生活环境等因素都有关系[14]。DOR是导致很多女性不孕的重要因素,行辅助生殖助孕的DOR患者助孕结局往往不理想,反复的助孕失败对患者的身心健康造成很大的伤害。对于DOR患者,临床上倡导更加灵活、温和的个体化促排卵方案。目前DOR患者较多采用的促排卵方案有拮抗剂方案、微刺激方案、PPOS方案、自然周期方案等。PPOS方案虽然可有效抑制早发LH峰、减少周期取消率、获得较好的胚胎结局,但因其导致患者无法新鲜周期移植,增加了患者的时间成本以及冷冻解冻的花销,因此临床医生需根据患者的具体情况慎重选择PPOS方案。
外源性孕激素的添加是PPOS方案中重要的促排卵环节。MPA和DYG都是人工合成的孕激素,口服吸收好,易于被患者所接受,这两种孕激素均不会干扰患者体内血清孕激素水平的测定[15]。在本研究中,我们主要分析PPOS方案中使用MPA和DYG对DOR患者促排卵结局和实验室结局的影响。
本研究显示在PPOS方案促排卵过程中,两组患者间HMG天数、HMG总量比较均无显著差异(P>0.05)。一项回顾性队列研究纳入了236名符合卵巢低反应(POR)入组标准者,研究结果也显示PPOS方案促排卵中MPA和DYG两组患者间HMG总剂量、促排卵持续时间比较均无显著差异(P>0.05)[16];另一项随机对照研究试验以516名卵巢储备功能正常的患者为研究对象进行分组比较,得出PPOS方案促排卵中MPA组HMG总剂量略高于DYG组,但差异无统计学意义(P>0.05)[17]。有趣的是,Huang等[18]对420名PCOS患者的PPOS促排卵方案进行了回顾性队列研究,他们认为由于MPA对垂体的抑制作用更深,发现MPA组HMG剂量显著高于DYG组(P<0.05)。我们分析,不同的研究结论可能是由于卵巢储备功能不同的人群对促性腺激素的卵巢反应性不同导致的。
血清LH值是DOR患者促排卵过程中的重点关注指标。在本研究中,MPA组早发LH峰的发生率显著低于DYG组(P<0.05)。其中,MPA组早发LH峰的发生率为1.12%,177例患者中有2例出现了早发LH峰,1例患者因卵泡早排而周期取消;DYG组早发LH峰的发生率为6.55%,122例患者中出现了8例早发LH峰,3例患者因卵泡早排而周期取消。由此可见,MPA相对于DYG,能更有效抑制早发LH峰。Kuang等[4]的研究中最早提出了在PPOS促排卵过程中使用MPA对垂体有较深的抑制。一项随机对照试验以卵巢储备功能正常的患者为研究对象分组比较,MPA组和DYG组均未出现LH过早增高,但MPA组平均LH水平始终低于DYG组,差异显著(P<0.05)[17]。Huang等[18]对PCOS患者的研究结果显示MPA+HMG组在促排卵周期第9~11天及扳机日LH水平均显著低于DYG+HMG组(P<0.001),两组均未出现LH过早增高。在朱玲玲[19]对DOR不孕患者的促排卵方案的研究中,发现使用MPA的PPOS方案中出现了1.5%的早发LH峰发生率,但对比其他方案仍能够有效降低早发LH峰发生率,实现高效能促排卵。这些结果均表明MPA较DYG对垂体有更深的抑制作用,能够降低早发LH峰发生率。本研究中HCG日血清激素检测显示MPA组LH水平低于DYG组,虽差异不显著(P>0.05),但趋势和已有的报道相符,可能和我们的样本量少有关。有研究发现DOR患者促性腺激素平抑因子(Gonadotropin surge attenuating factor,Gn-SAF)生物活性低,对垂体的抑制作用弱,较卵巢功能正常或PCOS人群更易出现早发LH峰[20]。众多研究虽表示MPA和DYG都能有效抑制早发LH峰,但MPA较DYG对垂体较深的抑制作用以及更低的早发LH峰发生率,对于更易出现LH峰激增、卵泡早排的DOR人群,是临床上更想要获得的促排卵效果和治疗结局。
本研究中两种孕激素的使用在实验室各项结局指标之间并未产生显著差异。多项研究报道也指出PPOS方案中使用MPA和DYG的实验室结局相当。Yu等[17]的一项前瞻性随机对照试验结果显示,卵巢储备正常患者使用MPA与DYG的获卵数、成熟卵率、受精率、卵裂率比较均无显著差异(P>0.05)。罗玉萍等[21]的研究结果显示两种孕激素组间获卵数、正常受精率、优胚率等比较均无显著差异(P>0.05)。本研究还观察到,MPA组的HCG日血清E2水平显著低于DYG组(P<0.05),而且在MPA组的基础P水平显著高于DYG组的情况下HCG日血清P水平仍显著低于DYG组(P<0.05),这可能与MPA对垂体有较深的抑制有关。而在Huang等[18]对PCOS患者和Zhang等[16]对POR患者的研究中,动态血清激素谱均显示 MPA组和DYG组HCG日E2水平无显著性差异(P>0.05);在Yu等[17]对卵巢功能正常患者的研究中,动态血清激素谱显示HCG日MPA组和DYG组P水平无显著性差异(P>0.05)。出现这种结果不一致的现象可能与促排卵剂量、纳入人群等不同有关,其具体的生物学机制目前尚不清楚,有待进行更深层次的研究。
在一些研究报道中,MPA的安全性被反复提及。有研究指出MPA在动物试验中存在剂量相关的致畸性和毒性,但在安全治疗剂量下并无毒性,MPA的使用不增加子代先天畸形率[4,22]。在Kuang等[4]最初的研究中使用的MPA剂量为10 mg/d,并没有观察到MPA对卵母细胞的质量、受精能力或胚胎的发育潜力的影响;在Zhang等[23]的研究中,通过对1 931名活产婴儿的随访发现,使用HMG+MPA(10 mg/d)促排卵治疗方案既不会影响IVF新生儿出生结局,也不会增加先天性畸形的患病率;张冕等[24]的研究也表明促排卵过程使用DYG(20 mg/d)所营造的高孕激素状态并没有影响卵泡的发育和胚胎的质量及潜能,对助孕结局可能无负面影响。本研究未发现不同孕激素的安全性问题,可能是因为我们采用的均是安全剂量。
综上所述,我们的研究得出,对于需要采用PPOS方案促排卵的DOR患者,使用MPA和DYG均可获得相似的胚胎结局,但相对DYG,MPA早发LH峰发生率更低,是DOR患者PPOS促排卵方案的一个理想的孕激素选择。本研究也存在不足之处:(1)为了避免解冻周期子宫内膜等其他因素对临床结局的影响,本研究只讨论两种孕激素对实验室胚胎质量结局的影响,没有进一步分析对临床结局以及子代安全性的影响;(2)本中心外源性孕激素只使用了MPA和DYG两种,我们的研究只分析了这两种孕激素的差异,其他种类孕激素并未涉及;(3)系回顾性研究,样本量少,分析结果可能存在偏差,需扩大样本量进行前瞻性随机对照研究。

