术前应用Philips CT成像特征预测胃肠道间质瘤高ki-67增殖指数的研究*
贾 浩 范志刚 朱 彬 崔创撑
1.三二〇一医院影像科(陕西 汉中 723000)
2.三二〇一医院肿瘤内科(陕西 汉中 723000)
3.西安市第九医院放射医学科(陕西 西安 710051)
胃肠道间质瘤(GIST)为胃肠道常见软组织肉瘤,发生率约占胃肠肿瘤的1~2%,可于胃肠道任何部位发病,多见于胃部(55~60%)及小肠(30%),少见于十二指肠(4~5%)、直肠(2~4%)等[1]。因GIST属侵袭性肿瘤,且具有多向分化潜能,在生物学上有向恶性发展的倾向,被视为潜在恶性肿瘤,相关研究指出GIST患者中10~30%具有恶性临床表现,且恶性临床表现与高有丝分裂指数密切相关[2]。作为仅存于增殖细胞核中的核蛋白—Ki-67,于细胞增殖的G1、S、G2和M期均有表达,其增殖指数高低可较为准确反映肿瘤恶性潜能的发展及复发风险[3]。已有充足证据证实Ki-67可作为GIST患者可靠预后指标,用于患者术后复发及生存率评估价值较高[4]。但该指标需收集患者病灶组织应用免疫组化法进行测定,难以于早期及时评估GIST生物学行为。而CT作为GIST术前常用检查方法,既往研究已证实术前CT特征与GIST患者危险分级具有较强相关性,但是通过术前CT特征预测GIST患者术后复发风险所涉研究鲜少[5]。兹本文旨在探讨术前CT特征在预测GIST患者高Ki-67增殖指数中的应用价值,以期为GIST患者后续个体化治疗提供关键参考。作如下报道。
1 资料与方法
1.1 一般资料纳入2019年1月至2022年12月经本院收治GIST患者112例。纳入标准:符合《中国胃肠间质瘤内镜下诊治专家共识》[6]中相关标准,均接受外科手术切除病灶,且术后病理证实为原发性GIST;术前未进行放化疗治疗;患者及家属知情同意。排除标准:伴发其他恶性肿瘤;切缘阳性;对比剂过敏;临床资料缺失。本研究获经医院伦理委员会审查。
1.2 分组依据采集术后病灶组织用浓度分数10%福尔马林固定后送至本院病理科,经常规HE染色后应用免疫组化法测定Ki-67增殖指数的表达,参考文献标准[7],以5%为临界值,>5%归入高Ki-67组(n=40例),≤5%归入低Ki-67组(n=72例)。
1.3 方法
1.3.1 CT平扫及3期动态增强检查 检查前禁食8h,扫描前口服500~1000mL温开水。取患者仰卧位,头先进,听从医师指示规范屏气、呼吸。采用 Philips Brilliance 64排CT(荷兰Philips公司)自膈顶向耻骨联合上缘,先行CT平扫,参数设置:管电压120kV,管电流145~200mA,层距5mm,层厚2~5mm,视野30~50cm,矩阵512×512。后行动态增强扫描:于患者肘部正中静脉应用高压注射器团注100mL欧乃派克[国药准字:H20160023,厂商:GE Healthcare Ireland],控制速率2.5~3ml/s,于动脉期(25~30s)、门静脉期(65~70s)及延迟期(180~300s)采集图像。
1.3.2 图像评估 采集图像均传输至影像归档和通信系统(PCAS),由两名具有丰富经验影像医师(工作年限分别为12年、15年)经盲法分析图像,记录CT特征。若意见不一致,则会同第3方讨论统一意见。
1.4 观察指标收集两组人口学信息,包括性别(男/女)、年龄(≥60岁、<60岁)等,并记录CT特征,包括肿瘤位置(胃部、肠部、胃肠外)、肿瘤大小[8](>5cm、≤5cm)、肿瘤边界(清晰、不清晰)、肿瘤轮廓(规则、不规则)、生长方式(腔内型、腔外型、混合型)、钙化(以骨窗为准判定,分有/无)、囊变或坏死(对比肿瘤实质呈低密度,且增强扫描未见明显强化,分有/无)、肿瘤增粗血管(有/无)、病灶表面溃疡(有/无)、强化方式(均匀、不均匀)、强化程度(基于文献[9],选择同一层面实质,以强化后最高CT值与平扫期CT差值评定,轻度(≤20HU)、中/高度(>20HU))、转移(即有无腹膜、脏器或淋巴结转移,分有/无)。
1.5 统计学处理采用SPSS 22.0软件作统计处理,计量资料以“±s”表示,行t检验,计数资料以“%”表示,行χ2检验,行单因素及Logistic回归模型多因素明确影响GIST患者高Ki-67增殖指数独立性危险术前CT特征,且经受试者工作曲线(ROC)评估单一及联合术前CT特征预测GIST患者高Ki-67增殖指数诊断价值,若P<0.05,差异具有统计学意义。
2 结 果
2.1 两组人口学信息、术前CT特征单因素分析除性别、年龄、肿瘤位置、肿瘤轮廓、生长方式、钙化、病灶表面溃疡、转移外,两组肿瘤大小、肿瘤边界、囊变或坏死、肿瘤增粗血管、强化方式及强化程度比较,差异有统计学意义(P<0.05),具体见表1。
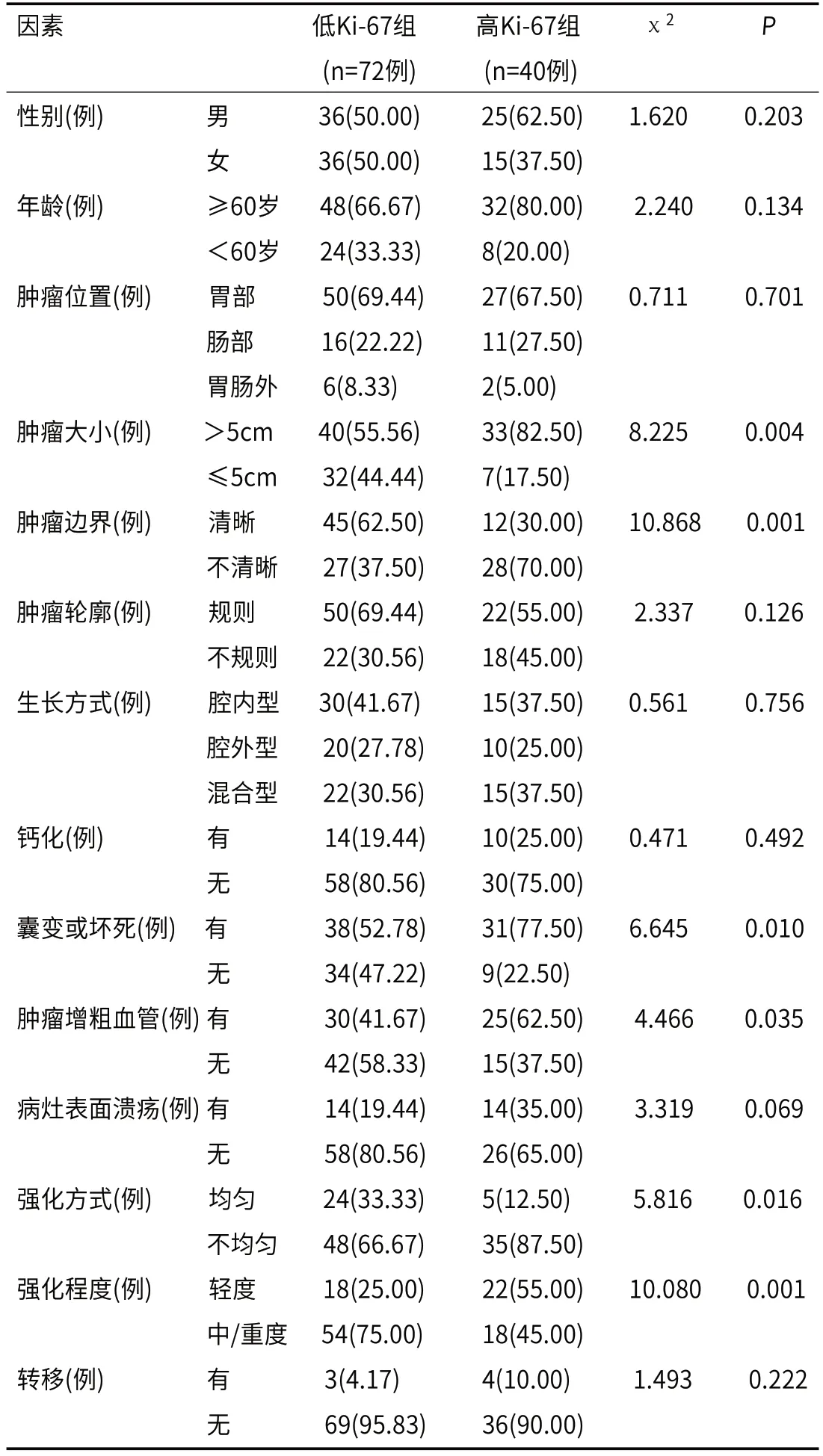
表1 两组人口学信息、术前CT特征单因素分析
2.2 两组术前CT特征Logistic回归模型多因素分析经Logistic回归模型多因素分析结果显示:影响GIST患者高Ki-67增殖指数独立性危险术前CT特征包括肿瘤大小(>5cm)、肿瘤边界(不清晰)及强化程度(轻度),见表2。
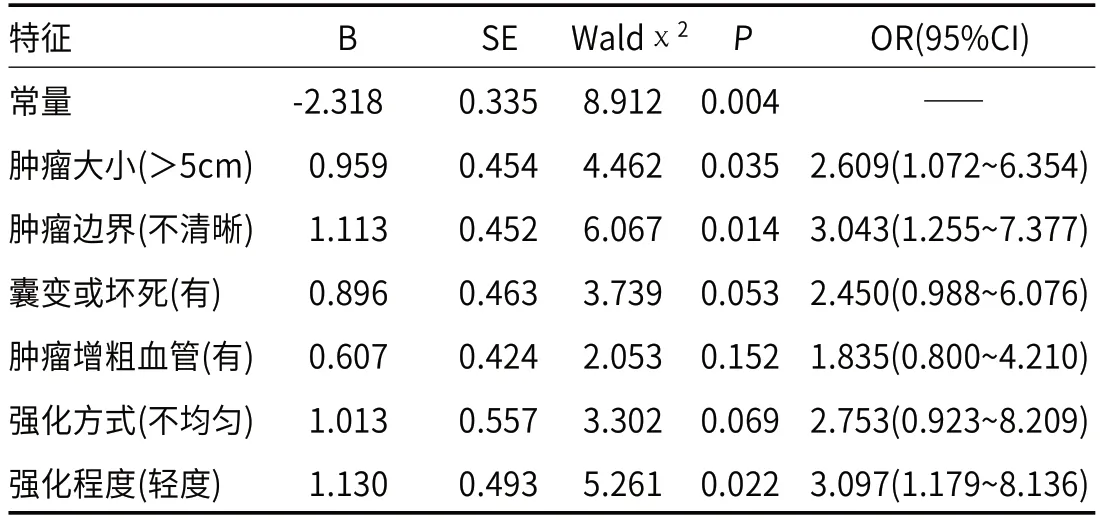
表2 两组术前CT特征Logistic回归模型多因素分析
2.3 术前CT特征单一及联合预测GIST患者高Ki-67增殖指数ROC结果经公式Logit(P1)≈-2.318+0.959×肿瘤大小+1.113×肿瘤边界+1.130×强化程度构建联合模型,经ROC结果显示:联合模型预测GIST患者高Ki-67增殖指数诊断价值最高,AUC值为0.874,灵敏度、特异度依次为85.00%、79.17%,见表3、图1。
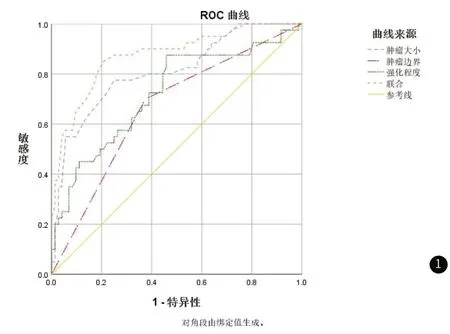
图1 术前CT特征单一及联合预测GIST患者高Ki-67增殖指数ROC结果

表3 术前CT特征单一及联合预测GIST患者高Ki-67增殖指数ROC结果
3 讨 论
GIST主要起源于胃肠道Caial间质细胞,以酪氨酸激酶受体(C-kit)过表达为主要发病特征[10]。病理组织学为GIST诊断金标准,但该方法属有创检查,且存在出血、破溃情形增加肿瘤播散风险;创伤相对较小的细针穿刺活检因采集病灶组织小,正确诊断难度系数较高,部分患者需反复进行穿刺,可增加患者痛楚,故临床应用均有所限制。随近些年来影像技术发展,凭借扫描范围广、用时短且图像质量高等优势的CT技术已逐步用于GIST检查中,由美国国立卫生研究院亦推荐CT作为GIST诊断、疗效及复发/转移评估的常规检查方法[11]。且有研究证实肿瘤形态学特征可一定程度反映肿瘤生物学特性,故通过术前CT特征与GIST生物学特性联系起来,进而对GIST术后复发风险(或恶性潜能)进行早期识别,更有助于改善患者预后,研究意义巨大。
因GIST术后复发风险(或恶性潜能)与肿瘤组织增殖关系密切[12],Ki-67作为近几十年来应用广泛的肿瘤细胞增殖标志物,由Wang 等[13]一项回顾性研究证实Ki-67增殖指数(以5%为临界值)用于术前有丝分裂率预测及GIST风险分层切实可行。但关于GIST术后复发风险Ki-67增殖指数临界值尚未统一口径,2.50%~10.0%均有应用[14-15],本文基于《中国胃肠道间质瘤诊断治疗专家共识病理解读》[16]意见确定Ki-67增殖指数临界值为5%。而具体哪些术前CT特征可影响Ki-67增殖指数表达尚不明确,Guller等[17]研究认为GIST发生部位恶性程度存在差异,因肠部GIST生物学特性倾向于向腔外跨壁生长,较胃部GIST更易出现形态不规则或分叶状改变,故肠道GIST恶性程度可能更高。由王剑屏等[18]研究证实肿瘤位置、肿瘤大小、合并溃疡、囊变或坏死及转移等可影响Ki-67增殖指数表达,但该文未作多因素分析用以明确各术前CT特征对GIST患者Ki-67增殖指数的独立性影响。此外,陈允志等[19]研究指出强化方式不均匀、强化程度轻度GIST患者Ki-67增殖指数表达呈高水平。由本文结果显示:术前CT特征中肿瘤大小(>5cm)、肿瘤边界(不清晰)及强化程度(轻度)均为GIST患者高Ki-67增殖指数高表达独立性风险因素。具体分析:(1)肿瘤大小:因肿瘤直径是GIST患者术后复发公认独立性风险因素,若肿瘤直径越大,提示肿瘤组织细胞分裂、增殖速度加快,恶性风险越高,故Ki-67增殖指数呈表达[20];(2)肿瘤边界(不清晰):通常来说,GIST患者多呈腔内生长(60.6%),随肿瘤组织过度分裂、增殖,可逐步浸润周围组织,并向腔外生长表现为腔外型或混合型,由此可导致肿瘤边界越不清晰[21-22];(3)强化程度(轻度):受较大肿瘤组织、合并囊变或坏死等术前CT特征综合影响,可导致强化后平均微小血管密度较低,进而多形成轻度强化。这与Li等[23-24]研究证实肿瘤大小、溃疡存在是GIST患者Ki-67增殖指数高表达(>5%)独立性风险因素类似,但在溃疡存在这一术前CT特征有一定出入,该文解释溃疡形成原因是因GIST恶性程度高,可增加周围侵袭能力,进而浸润周围黏膜层、脂肪间隙引发溃疡。而本文认为溃疡、囊变或坏死等术前CT特征均可在后续强化上有综合体现,进而发挥主要影响。由杨采薇等[25]可支持本文观点。此外,存在转移通常预示GIST患者预后不佳,但因GIST患者较少出现转移,例数较少,本文虽证实高Ki-67组GIST患者转移发生率稍高于低Ki-67组,但例数较少,故分析均未体现统计学差异,有待扩大样本量作进一步分析。此外,本文还根据Logistic回归模型多因素分析结果构建联合模型,由结果显示:联合模型预测GIST患者Ki-67增殖指数高表达具有较高诊断效能(AUC值为0.874),提示结合关键性术前CT特征综合评估可及早识别GIST术后复发高风险患者。但本文有以下局限:(1)术前CT特征判定具有一定主观性偏倚,可能造成研究结论有一定偏倚;(2)纳入对象例数较少,仅112例,亦可造成结论有失偏颇。
综上所述,术前CT特征中肿瘤大小(>5cm)、肿瘤边界(不清晰)及强化程度(轻度)与GIST患者Ki-67增殖指数高表达有密切关联,通过构建联合模型有助于早期识别Ki-67增殖指数高表达GIST患者,可为后续临床治疗方案制定提供关键信息。

