联合ADC组学标签和激素受体预测乳腺癌新辅助化疗病理完全化解*
李小苑 杨志企 陈湘光 陈寿让 温伟华 杨宇扬 戴卓智 陈小凤,*
1.梅州市人民医院乳腺外科(广东 梅州 514031)
2.广东省临床分子诊断与抗体药物工程技术研究中心 (广东 梅州 514031)
3.梅州市人民医院影像科 (广东 梅州 514031)
4.汕头市中心医院影像科 (广东 汕头 515031)
乳腺癌是女性罹患率最高的恶性肿瘤之一[1-5]。目前,进展期乳腺癌的标准治疗方案是术前新辅助化疗(neoadjuvant chemotherapy, NC)[2,6]。先前的研究表明NC疗效与预后相关[7],但仍有少部分患者对NC反应不佳,因此,准确预测NC疗效有助于筛选合适患者进行NC治疗,并可为NC不敏感患者提供及时、准确治疗。近年来,影像组学在乳腺癌的诊断、鉴别诊断、疗效预判和预后预测方面发挥着重要的临床作用[8-9],并在为 临床筛选合适患者进行化疗及个体化治疗方案制定提供了参考依据[10]。因此,本研究探讨 联合ADC图组学标签和激素受体模型预测乳腺癌NC病理完全缓解的价值。
1 资料与方法
1.1 一般资料本研究回顾分析了2016年1月至2019年12月间接受乳腺癌NC治疗的女性患者资料,并仅选取经术后病理疗效评估者。
入组标准包含:行乳腺癌NC治疗并进行病理疗效评估;接受NC治疗前进行DWI检查。排除标准包括:乳腺癌复发;影像质量不佳;数据不齐。共有165例乳腺乳腺癌患者入选,年龄范围在28至70岁之间,平均(49.0±10.0)岁。按照3:1比例将上述患者随机划分为训练集123例和测试集42例。
临床病理资料包括患者年龄、激素受体、人表皮生长因子受体2(h u m a n epidermal growth factor receptor-2,HER-2)、肿瘤增殖细胞核抗原-67(Ki-67)、乳腺癌分 型、临床分期及NC疗效病理Miller-Payne分级评估结果。V级标志着病理完 全缓解(pathological complete response,pCR),而Ⅰ~Ⅳ被定义为病理部分缓解(pathological partial response,pPR)[2]。按照上述标准,在训练集中有36例患者获得pCR,87例患者获得pPR。在测试集中有11例患者获得pCR,31例患者获得pPR。Ki-67水平低于20%被定义为低表达,20%及以上则被定义为高表达[2]。 HER-2阳性通过免疫组织化学检测(+++)或荧光原位杂交法检测确认[2]。雌/孕激素受体阴性标准为核染色阳性细胞数小于1%。乳腺癌分型和临床分期采用2021年版中国抗癌协会乳腺癌诊治指南与规范作为标准。
1.2 检查方法本研究使用了德国西门子Magnetom Skyra 3.0 T磁共振扫描仪及其专用乳腺线圈。患者在俯卧位下接受扫描,双乳房自然悬垂于乳腺线圈凹槽内。DWI序列使用了以下参数:TR 420ms,TE 62ms, b=0s/mm2、50s/mm2和800s/mm2,FOV 149mm×340mm,矩阵86×220,层厚4.0mm,层间距0.8mm。
1.3 影像组学分析将ADC原始图像以DICOM格式从医院图像存档及通讯系统下载并导入ITK-SNAP软件,由一名副主任医师使用鼠标 勾画肿瘤感兴趣区,同时由另外一名主任医师对上述感兴趣区进行 核对, 意见不同时通过协商达成一致。然后采用人工智能Analysis Kinetic软件对肿瘤原始图像和感兴趣区提取直方图形态学、纹理学、灰度共生矩阵、灰度大小区域矩阵和游程矩阵共396个组学特征。
1.4 数据分析采用R语言软件进行统计分析,基于P<0.05的显著性水平筛选差异具有统计学意义的变量。采用t检验比较两组间年龄的差异,采用卡方检验比较两组间激素受体、Ki-67、HER2、乳腺癌分型、临床分期的差异,并将有意义的特征纳入logistic回归。(1)最优组学特征筛选:采用单因素方差分析满足正态分布且满足方差齐性)、非参数检验(不满足正态分布或不满足方差齐性)、Spearman分析、最小绝对收缩和选择算法进行特征筛选和降维。(2)采用logistic回归建立两个模型,分别为基于ADC图组学标签影像组学模型和基于联合ADC图组学标签和有 意义临床指标构建的联合模型最终,基于ROC曲线和决策曲线评估模型效能。
2 结 果
2.1 病理完全缓解和病理部分缓解组间临床病理特征比较在训练集和测试集中,雌激素受体、孕激素受体表达状态在pCR和pPR组间的差异均具有统计学意义(表1,P<0.05)。在训练集中乳腺癌分子分型在pCR和pPR组间的差异具有统计学意义(P<0.05),但在测试集中未得到验证(P=0.05)。在训练集和测试集中,年龄、HER-2、Ki-67和临 床分期在pCR和pPR组间的差异均无统计学意义 (均P>0.05)。

表1 病理完全缓解和病理部分缓解组间临床特征比较
2.2 ADC组学特征筛选396个基于ADC图的影像组学特征采用单因素方差分析及非参数检验筛剔除335个特征筛选出61个特征,通过Spearman相关性分析(阈值0.9)减少55个重复变量筛选出6个特征,最后使用最小绝对收缩和选择算法除去系数为0的变量3个最终筛选出3个剩余特征包括一阶统计特征峰度(kurtosis),两个高阶统计特征包括长游程低灰度补偿特征(Long Run High Grey Level Emphasis_All Direction_offset7)和高密度短域补偿特征(High Intensity Small Area Emphasis), 和一个截距(Intercept)。上述特征和截距在模型中的系数分别为2.64×10-6、6.75×10-7、0.990和-2.07,其中以高密度短域补偿特征系数最高。
2.3 模型诊断效能分析在训练集中,联合ADC组学标签和雌/孕激素受体的联合模型预测NC病理完全缓解的曲线下面积高于基于ADC组学模型(AUC:0.904 vs.0.785,Delong testP=0.04),其准确率高亦于基于ADC图组学模型(0.841 vs.0.794)。在测试集中, 联合ADC图组学标签和雌/孕激素受体的联合模型预测NC病理完全 缓解的曲线下面积高于基于ADC图组学模型(AUC:0.789 vs.0.639,P=0.06),其准确率亦高于基于ADC图组学模 型。详见表2。联合模型临床获益优于基于ADC图组学模型(图1)。
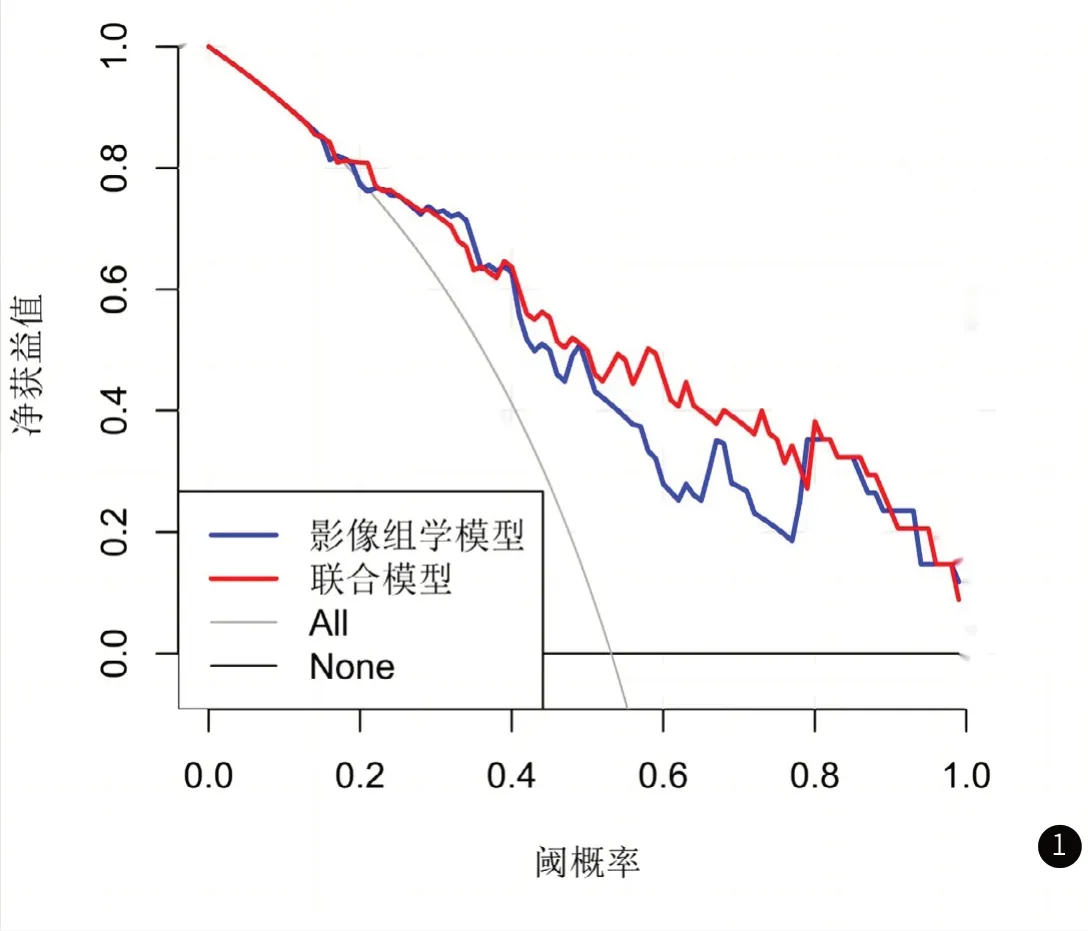
图1 模型决策曲线
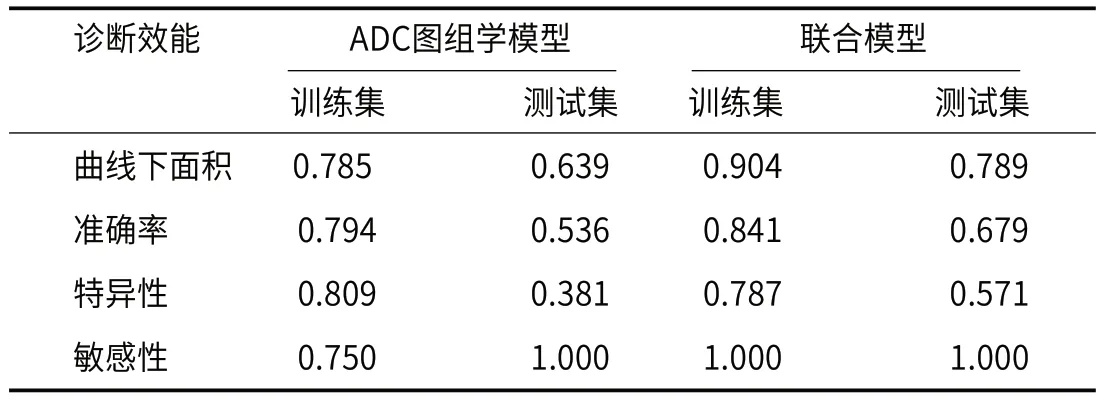
表2 模型诊断效能
3 讨 论
乳腺MR已经被广泛应用于乳腺癌诊断、鉴别诊断及NC疗效评价[8-9,11],其中以ADC和DCE-MRI价值为著。本研究基于术前ADC图组学标签构建预测乳腺癌NC病理完全缓解模型,结果显示该模型具有较好的预测
效能(AUC=0.785),且稍高于Liu zhenyu等[8]基于ADC图组学模型预测乳腺癌NC病理完全缓解的诊断效能(AUC=0.690)。由于临床生物学标记物具有反映乳腺癌某一特征的性能,而联合生物学标记物、组学标签能够更好反映肿瘤全部特征。因此将有统计学意义的临床特征雌/孕激素受体纳入后,模型预测pCR的AUC值较前约提高了15%,这与Liu zhenyu等[8]研究结果相符。决策分析曲线结果显示应用联合模型预测NC病理完全缓解的临床获益稍高于基于ADC图组学模型,这也再次表明联合多种潜在预测因子建立联合诊断模型将提高模型的预测效能及临床获益。
目前传统影像学评价NC疗效主要依据肿瘤大小、强化程度或ADC值变化[12]。然而研究表明瘤内异质性与肿瘤疗效相关[2],因此了解瘤内异质性将能提供传统影像学疗效评价所无法提供的额外信息。以前的研究表明峰度是乳腺癌异质性的预测因子之一,峰度低值与乳腺癌NC疗效敏感相关,而峰度高值与NC疗效不敏感有关[13]。长游程低灰度补偿和高密度短域补偿反映了图像纹理特征,其值越大,瘤内的异质性就越明显。本研究中基于ADC图最终筛选的影像组学特征包括了两个纹理特征,即长游程低灰度补偿和高密度短域补偿,以及一个峰度直方图特征,而上述这些特征参数均反映了瘤内异质性,这进一步证实肿瘤异质性与其NC的疗效密切相关[2]。
本研究存在以下不足:首先,样本量偏少,特别是pCR组的病人,需要扩大样本量研究。其次,本研究未考虑乳腺癌的具体病理类型、分化程度、治疗方案、疗程等因素,需要进一步细化研究。最后,本研究是单中心研究,缺乏多中心研究的进一步验证。
综上所述,通过联合ADC图组学标签和激素受体建立的联合模型对预测乳腺癌NC病理完全缓解具有较好的价值。

